Радиационная биология. Радиоэкология, 2020, T. 60, № 4, стр. 404-410
ЭКСПЕРИМЕНТАЛЬНАЯ ОЦЕНКА ПРОТИВОЛУЧЕВОЙ ЭФФЕКТИВНОСТИ β-ЭСТРАДИОЛА, ИНДОМЕТОФЕНА И ПРЕПАРАТА BP-C2
В. Н. Быков 1, 3, И. С. Драчёв 2, А. В. Панченко 3, *, Е. И. Федорос 3, 4, С. Е. Пигарев 4
1 Московский физико-технический институт (государственный университет)
Долгопрудный, Россия
2 Государственный научно-исследовательский испытательный институт военной медицины
Министерства обороны РФ
Санкт-Петербург, Россия
3 Национальный медицинский исследовательский центр онкологии им. Н.Н. Петрова
Санкт-Петербург, Россия
4 ООО “Меабко”
Копенгаген, Дания
* E-mail: ando.pan@gmail.com
Поступила в редакцию 16.08.2018
После доработки 14.05.2019
Принята к публикации 12.02.2020
Аннотация
В опытах на мышах проведена оценка защитного действия β-эстрадиола, индометофена, препарата BP-C2 при остром общем воздействии γ-излучения в различных поглощенных дозах. Изучали 30-суточную выживаемость, динамику массы тела, состояние кроветворения облученных животных. Установлено, что изученные вещества защищают животных от лучевой гибели в диапазоне доз 4–7 Гр (мощность дозы 1,1 Гр/мин). Значение величин фактора изменения дозы составили: для β-эстрадиола – 1,19, для индометофена – 1,22 и для BP-C2 – 1,22. Выявленный защитный эффект может быть связан с восстановлением костномозгового и внекостномозгового кроветворения, а для BP-C2 – еще и с антиоксидантной активностью.
В настоящее время эффекты противолучевых средств, проявляющих защитное действие при применении до воздействия ионизирующих излучений и в ранний постлучевой период, связывают с ускорением пострадиационной репарации нелетальных повреждений пораженных клеток (прежде всего, гемопоэтических), обусловленной активацией провоспалительных сигнальных путей и усилением секреции ростовых факторов [1, 2]. Такими свойствам обладают вакцины, полисахариды, антиоксиданты, гормоны и другие препараты [3, 4]. Однако сравнительной оценке их противолучевой активности не уделяется достаточного внимания.
В настоящей работе проведено сравнительное изучение защитного действия β-эстрадиола, индометофена и препарата BP-C2 при остром лучевом воздействии. β-эстрадиол относится к группе женских половых гормонов, препараты на основе которых обладают выраженным противолучевым действием при введении до и после облучения [5–7]. Индометофен – синтетический нестероидный антиэстроген из группы тамоксифена, разработанный в ГНЦ ФМБЦ им. А.И. Бурназяна, обладающий радиомитигирующим действием [8, 9]. Как для β-эстрадиола, так и для индометофена была доказана противолучевая активность при однократном введении [8, 10]. Препарат BP-C2 принадлежит к металлсодержащим комплексам и представляет собой полифенольное полимерное производное лигнина с молибдатом аммония [11], его противолучевое действие при многократном введении было показано в ряде работ [12, 13]. Препарат обладает антиоксидантными свойствами, а его полифенольный компонент демонстрирует слабую аффинность к эстрогеновым рецепторам клетки [14].
Интерес представляет эффективность указанных средств при многократном введении до и после острого облучения, поскольку продолжительность лечения может определять не только исходы острого радиационного поражения, но и снижать риск развития отсроченных эффектов острого радиационного воздействия (лучевые дерматиты, фиброз легких, пневмонит и др.) [15].
Цель настоящего исследования состояла в сравнительной оценке противолучевой активности β-эстрадиола, индометофена и BP-C2 при многократном введении и изучении их влияния на гемопоэтическую систему облученных животных.
МАТЕРИАЛЫ И МЕТОДИКА
Экспериментальные исследования выполнены на беспородных мышах-самцах (питомник лабораторных животных “Рапполово”). Перед началом экспериментов животные проходили двухнедельный карантин. Исследования проведены согласно существующим правилам работ с использованием экспериментальных животных и Европейской конвенции по их защите. В работе применяли радиобиологические и гематологические методы исследования, а также приемы оценки объективного состояния.
Животных подвергали общему, относительно равномерному воздействию γ-излучения в различных дозах на установке ИГУР-1, снаряженной радионуклидом 137Cs (мощность дозы 1,1 Гр/мин).
Определение 30-суточной выживаемости выполнено на 432 животных, разделенных на 20 групп (15 – опытных и 5 – контрольных, табл. 1), которых облучали в дозах 3, 4, 5, 6 и 7 Гр. В течение 30 сут после радиационного воздействия ежедневно учитывали количество павших и оставшихся в живых животных. Рассчитывали 30-суточную выживаемость, ЛД50/30, ЛД16/30 и ЛД84/30 методом пробит-анализа по Финни, определяли величину фактора изменения дозы (ФИД).
Таблица 1.
Влияние β-эстрадиола, индометофена и BP-C2 на выживаемость мышей после острого облучения (срок наблюдения 30 сут) Table 1. The effect of β-estradiol, indometophen and BP-C2 on the survival of mice after acute radiation exposure (30 days observation period)
| Доза облучения, Гр | Группа | Число выживших/общее число животных в группе | Вероятность ошибки различий с группой контроля по 2-стороннему критерию Фишера |
|---|---|---|---|
| 3 | Контроль | 12/12 | – |
| β-эстрадиол | 12/12 | >0.9999 | |
| Индометофен | 12/12 | >0.9999 | |
| BP-C2 | 12/12 | >0.9999 | |
| 4 | Контроль | 18/24 | – |
| β-эстрадиол | 22/24 | 0.2448 | |
| Индометофен | 24/24 | 0.0219 | |
| BP-C2 | 23/24 | 0.0971 | |
| 5 | Контроль | 13/24 | – |
| β-эстрадиол | 20/24 | 0.0599 | |
| Индометофен | 22/24 | 0.0078 | |
| BP-C2 | 21/24 | 0.0243 | |
| 6 | Контроль | 6/24 | – |
| β-эстрадиол | 14/24 | 0.0392 | |
| Индометофен | 12/24 | 0.1351 | |
| BP-C2 | 16/24 | 0.0084 | |
| 7 | Контроль | 0/24 | – |
| β-эстрадиол | 2/24 | 0.4894 | |
| Индометофен | 0/24 | >0.9999 | |
| BP-C2 | 2/24 | 0.4894 |
Оценку влияния изучаемых соединений на гемопоэз проводили на 48 мышах, облученных в дозе ЛД50/30. На 9-е сутки после облучения определяли общую клеточность костного мозга в бедренной кости и подсчитывали количество эндогенных колониеобразующих единиц (КОЕс) в селезенке.
β-эстрадиол (“Sigma”, США) вводили внутримышечно в дозе 40 мг/кг за 5 сут, 1 сут, сразу после облучения и через 1 сут после облучения в виде суспензии с Твин-80. Индометофен (ЦХЛС – ВНИХФИ, Россия) вводили перорально в дозе 30 мг/кг за 5 сут и 1 сут до облучения. ВР-С2 (ООО “Нобель”, Россия) вводили перорально в дозе 60 мг/кг 10-кратно с интервалом 48 ч (пять введений до облучения и пять введений после облучения). Выбранные дозы препаратов тестировали ранее при однократном введении животным, подвергнутым острому лучевому воздействию [7, 8, 10].
Для исследования относительной антиоксидантной емкости BP-C2 применяли железо-восстанавливающий тест [16]. Антиоксидантную емкость рассчитывали как отношение количества окрашенного комплекса Fe2+ с 2,2-дипиридилом в пробе с добавлением BP-C2 к его содержанию в пробах со стандартными веществами: аскорбиновой кислотой и дигидрокверцетином.
Полученные данные подвергали статистической обработке. Для графического отображения функций выживаемости применяли кривые Каплана–Майера, сравнение проводили по Лог-ранг тесту, а для низшей дозы – по тесту Кокса–Мантела. Для анализа различий 30-суточной выживаемости между группами применяли точный двухсторонний критерий Фишера. В остальных случаях для сравнения различий с группой контроля применяли критерий Манна–Уитни. Вероятность p < 0.05 считали достаточной для вывода о статистической значимости различий полученных данных.
РЕЗУЛЬТАТЫ
Сравнительную оценку радиозащитной эффективности веществ проводили по критерию 30-суточной выживаемости (табл. 1) и на основании анализа кривых дожития (рис. 1).
Рис. 1.
Изменение графиков функции выживания мышей после острого облучения в дозах 4 Гр (а), 5 Гр (б), 6 Гр (в) и 7 Гр (г) под влиянием β-эстрадиола, индометофена и BP-C2 (срок наблюдения 30 сут, n = 24). В скобках указана статистическая значимость различий с группой Контроль по Лог-ранг тесту.
Fig. 1. The survival graphs of mice after total body irradiation at dose of 4 Gy (a), 5 Gy (b), 6 Gy (c) and 7 Gy (d) and exposure to β-estradiol, indometophen and BP-C2 (30 days observation period, n = 24 in each group). In parentheses are given values of the statistical significance for the differences with the control group by the log-rank test.
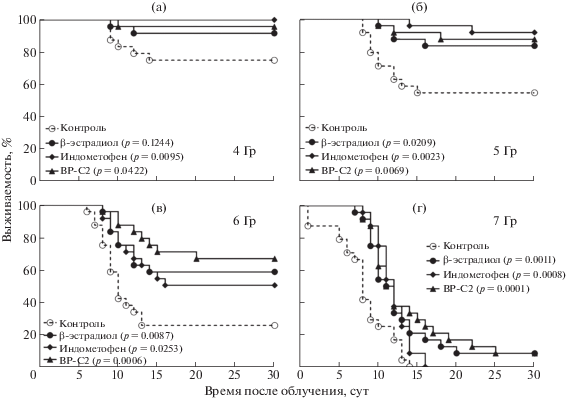
Количество животных, выживших через 30 сут после острого облучения в дозе 5 Гр, было статистически значимо выше после введения всех исследуемых соединений по сравнению с контролем. Для BP-C2 и для β-эстрадиола показатель 30-суточной выживаемости был достоверно выше, чем в контроле и после острого облучения животных в дозе 6 Гр (табл. 1). Кривые дожития (рис. 1) статистически значимо отличались от контрольной группы после облучения животных в дозе 4 Гр для индометофена и ВР-С2, в дозе 5 Гр – для β-эстрадиола и индометофена, а после облучения в дозах 6 и 7 Гр – для всех групп животных, получавших противолучевые препараты.
Расчетное значение ЛД50/30 (табл. 2) для мышей контрольной группы составило 4,91 ± 0,18 Гр, расчетные значения ЛД50/30 при введении β-эстрадиола, индометофена и BP-C2 – 5,82 ± 0,19 Гр, 5,99 ± 0,26 Гр и 6,00 ± 0,17 Гр соответственно. Показатель ФИД составил для β-эстрадиола – 1,19, для индометофена – 1,22, для BP-C2 – 1,22.
Таблица 2.
Величины ФИД и ЛД50/30, ЛД16/30 и ЛД84/30 у мышей после острого облучения при введении β-эстрадиола, индометофена и BP-C2 (срок наблюдения 30 сут) Table 2. The values of DRF (dose reduction factor) and LD50/30, LD16/30 and LD84/30 in mice after acute total body irradiation with the administration of β-estradiol, indometophen and BP-C2 (30 days observation period)
| Группа | ЛД50/30 | Стандартная ошибка ЛД50/30 | Нижняя граница ЛД50/30 | Верхняя граница ЛД50/30 | ЛД16/30 | ЛД84/30 |
|---|---|---|---|---|---|---|
| Контроль | 4.91 | 0.18 | 4.56 | 5.25 | 3.93 | 6.14 |
| β-эстрадиол (40 мг/кг ×4) | 5.82 | 0.19 | 5.48 | 6.21 | 4.78 | 7.10 |
| ФИД = 1.19 | ФИД = 1.22 | ФИД = 1.16 | ||||
| Индометофен (30 мг/кг ×2) | 5.99 | 0.26 | 5.68 | 6.73 | 5.27 | 6.82 |
| ФИД = 1.22 | ФИД = 1.34 | ФИД = 1.11 | ||||
| BP-C2 (60 мг/кг ×10) | 6.00 | 0.17 | 5.68 | 6.36 | 5.07 | 7.10 |
| ФИД = 1.22 | ФИД = 1.29 | ФИД = 1.16 | ||||
Масса тела мышей в раннем постлучевом периоде существенно снижалась в зависимости от дозы облучения и практически не зависела от применяемого противолучевого средства (табл. 3). Показатель средней массы тела был больше при сравнении с группой контроля у всех животных, которым проводили противолучевую терапию исследуемыми соединениями, хотя статистически значимые различия наблюдали только в единичных случаях.
Таблица 3.
Влияние β-эстрадиола, индометофена и BP-C2 на динамику массы тела мышей, облученных в различных дозах (среднее значение ± стандартное отклонение, n = 12) Table 3. The effect of β-estradiol, indometophen and BP-C2 on the dynamics of body weight of mice after acute total body irradiation at various doses (mean ± standard deviation, n = 12 in each group)
| Доза облучения, Гр | Группа | Масса животных (г) на срок наблюдения (сут) | ||||
|---|---|---|---|---|---|---|
| до облучения | 2 | 4 | 6 | 8 | ||
| 4 | Контроль | 20.9 ± 1.04 | 20.2 ± 1.04 | 19.7 ± 1.39 | 19.3 ± 1.39 | 18.3 ± 2.08 |
| β-эстрадиол | 21.5 ± 1.04 | 19.5 ± 1.39 | 19.5 ± 1.39 | 19.5 ± 1.04 | 18.1 ± 2.08 | |
| Индометофен | 21.4 ± 0.69 | 20.0 ± 1.39 | 18.9 ± 0.69 | 19.7 ± 1.04 | 19.1 ± 2.08 | |
| BP-C2 | 20.6 ± 1.04 | 20.1±1.39 | 20.0 ± 1.04 | 19.6 ± 1.04 | 18.4 ± 2.08 | |
| 5 | Контроль | 21.0 ± 1.04 | 19.5 ± 2.42 | 18.0 ± 1.04 | 16.8 ± 0.69 | 16.8 ± 1.73 |
| β-эстрадиол | 20.9 ± 1.04 | 19.9 ± 2.42 | 18.7 ± 1.04 | 17.6 ± 0.69 | 17.4 ± 1.39 | |
| Индометофен | 20.9 ± 0.69 | 21.3 ± 1.39 | 19.0 ± 1.04 | 17.9 ± 1.04 | 17.8 ± 1.39 | |
| BP-C2 | 20.9 ± 1.04 | 19.8 ± 1.73 | 19.2 ± 0.69 | 17.8 ± 0.69 | 17.2 ± 1.39 | |
| 6 | Контроль | 21.1 ± 0.69 | 18.0 ± 1.04 | 16.0 ± 1.04 | 15.0 ± 0.69 | 13.8 ± 1.73 |
| β-эстрадиол | 21.1 ± 0.69 | 17.7 ± 1.04 | 15.9 ± 1.04 | 15.7 ± 0.69 | 15.0 ± 1.73 | |
| Индометофен | 21.2 ± 1.04 | 18.3 ± 0.69 | 17.4 ± 1.04 | 15.2 ± 1.04 | 15.1 ± 1.39* | |
| BP-C2 | 21.0 ± 1.04 | 18.1 ± 0.69 | 16.7 ± 1.39 | 15.3 ± 1.04 | 14.4 ± 1.04 | |
| 7 | Контроль | 20.4 ± 0.69 | 17.3 ± 1.04 | 14.1 ± 1.73 | 12.7 ± 1.04 | 11.8±2.08 |
| β-эстрадиол | 21.0 ± 0.69 | 17.2 ± 1.39 | 14.3 ± 1.73 | 12.7 ± 0.69 | 12.2 ± 1.73 | |
| Индометофен | 20.9 ± 1.04 | 17.4 ± 1.04 | 14.2 ± 1.73 | 13.5 ± 1.04 | 11.5 ± 2.08 | |
| ВР-С2 | 20.7 ± 1.04 | 17.7 ± 1.39 | 14.6 ± 1.73 | 13.1 ± 0.69 | 12.4 ± 2.42 | |
При изучении влияния препаратов на гемопоэз у облученных мышей выявлен ряд особенностей (табл. 4). На 9-е сутки после облучения контрольных животных в дозе 6 Гр количество миелокариоцитов костного мозга снижалось в 7,4 раза и составляло 3,3 × 106/бедро. У облученных мышей, которым вводили изучаемые вещества, количество миелокариоцитов костного мозга уменьшалось в меньшей степени – в 4,6, 5,4 и 5,7 раза для β-эстрадиола, индометофена и ВР-С2 соответственно. Следует отметить, что количество миелокариоцитов у мышей, которым вводили β-эстрадиол, было выше, чем после применения BP-C2 и индометофена.
Таблица 4.
Влияние β-эстрадиола, индометофена и BP-C2 на показатели кроветворения у мышей на 9-е сутки после воздействия γ-излучения в дозе 6 Гр (среднее значение ± стандартное отклонение, n = 12 в каждой группе) Table 4. The effect of β-estradiol, indometophen and BP-C2 on hematopoiesis in mice by the ninth day after exposure to γ-radiation at a dose of 6 Gy (mean ± standard deviation, n = 12 in each group)
| Группа | Количество миелокариоцитов, ×106/бедро | Количество КОЕс, абс. ед./селезенку |
|---|---|---|
| Контроль | 3.3 ± 0.8 | 5.0 ± 3.46 |
| β-эстрадиол | 5.3 ± 0.7* | 11.0 ± 6.93* |
| Индометофен | 4.5 ± 0.6* | 10.0 ± 6.93* |
| BP-C2 | 4.3 ± 0.6* | 9.0 ± 6.93 |
В группе контроля среднее количество эндогенных КОЕс на 9-е сутки после облучения животных в дозе 6 Гр составило 5,0 ± 3,46 единиц. После введения изучаемых препаратов этот показатель увеличился в 1,8–2,2 раза. Индометофен и β-эстрадиол способствовали росту эндогенных колоний на селезенке в большей степени, чем BP-C2.
При изучении антиоксидантной активности BP-C2 было показано, что относительная антиокислительная емкость BP-C2 сравнима с аскорбиновой кислотой и дигидрокверцетином при эквимолярных концентрациях растворов и составляет 0,99 и 0,91 соответственно, но уступает им при пересчете на массовую концентрацию. Так, 1 г BP-C2 по антиоксидантной активности в использованном тесте был эквивалентен 124 мг аскорбиновой кислоты или 199 мг дигидрокверцитина.
ОБСУЖДЕНИЕ
Известно, что профилактическое введение эстрогенов и их синтетических аналогов повышает радиорезистентность организма на срок 1–3 нед, причем ФИД препаратов у мышей может достигать 1,15–1,3 [5, 18]. Введение индометофена в дозах 15 и 30 мг/кг через 30 мин – 3 сут после воздействия γ-излучения в дозах ЛД90/30 и ЛД60/30 способствовало увеличению выживаемости мышей на 40–60% [8]. Считается, что механизм радиозащитного действия эстрогенов связан с перестройкой гемопоэза и более полным восстановлением системы кроветворения после воздействия радиации [8, 9, 18].
Вопрос о влиянии полифенольных соединений на гемопоэз в облученном организме изучен в меньшей степени. В качестве одного из возможных механизмов защитного действия называется антирадикальная активность [19]. Введение металлокомплексов способствует репарации повреждений, вызванных ионизирующими излучениями, и активирует синтез ДНК и РНК, в том числе в гемопоэтических клетках [20–22].
Проведенные исследования показали, что величина ФИД для всех изученных веществ близка к 1,2. При облучении в дозе 6 Гр выявлено более выраженное влияние BP-C2 на показатели 30-суточной выживаемости, что проявилось в статистически значимом увеличении количества выживших животных и смещением кривой дожития вправо по сравнению с группой контроля и другими экспериментальными группами.
Влияние препаратов на кроветворение различается. β-эстрадиол и индометофен в большей степени способствовали увеличению количества миелокариоцитов в костном мозге, а также статистически значимо усиливали эндогенное колониеобразование на селезенке.
Установлено, что BP-C2 обладает антиоксидантными свойствами. По результатам определения относительной антиоксидантной емкости его активность несколько уступает аскорбиновой кислоте и дигидрокверцетину. Выявленный защитный эффект ВР-С2 может быть связан также с его антиоксидантной активностью.
В целом необходимо дальнейшее изучение препаратов для выявления новых механизмов их противолучевого действия.
ВЫВОДЫ
1. ФИД составляет для β-эстрадиола – 1,19, для индометофена – 1,22 и для BP-C2 – 1,22.
2. При облучении в дозе 5 Гр все изученные препараты способствовали статистически значимому увеличению выживаемости по сравнению с группой контроля, при облучении в дозе 6 Гр статистически значимое увеличение выживаемости по сравнению с группой контроля отмечали только после введения индометофена и ВР-С2.
3. Относительная антиоксидантная емкость BP-C2 выражена в меньшей степени, чем у аскорбиновой кислоты и дигидрокверцетина.
Список литературы
Васин М.В. Классификация противолучевых средств как отражение современного состояния и перспективы развития радиационной фармакологии // Радиац. биология. Радиоэкология. 2013. Т. 53. № 5. С. 459–467. [Vasin M.V. Klassifikatsiya protivoluchevykh sredstv kak otrazhenie sovremennogo sostoyaniya i perspektivy razvitiya radiatsionnoi farmakologii // Radiats. biologiya. Radioekologiya. 2013. V. 53. № 5. Р. 459–467. (In Russian)]
Гребенюк А.Н., Зацепин В.В., Назаров В.Б., Власенко Т.Н. Современные возможности медикаментозной профилактики и ранней терапии радиационных поражений // Воен.-мед. журн. 2011. Т. 332. № 2. С. 13–17. [Grebenyuk A.N., Zatsepin V.V., Nazarov V.B., Vlasenko T.N. Sovremennye vozmozhnosti medikamentoznoi profilaktiki i rannei terapii radia-tsionnykh porazhenii // Voenno-meditsinskii zhurnal. 2011. V. 332. № . P. 13–17. (In Russian)]
Гребенюк А.Н., Легеза В.И., Тарумов Р.А. Радиомитигаторы: перспективы использования в системе медицинской противорадиационной защиты // Воен.-мед. журнал. 2014. Т. 335. № 6. С. 39–43. [Grebenyuk A.N., Legeza V.I., Tarumov R.A. Radiomitigatory: perspektivy ispol’zovaniya v sisteme medi-tsinskoi protivoradiatsionnoi zashchity // Voenno-meditsinskii zhurnal. 2014. V. 335. № 6. P. 39–43. (In Russian)]
Singha V.K., Romaine P.L.P., Newman V.L., Seed T.M. Medical countermeasures for unwanted CBRN exposures: part II radiological and nuclear threats with review of recent countermeasure patents // Expert. Opin. Therap. Patents. 2016. V. 26. № 12. P. 1399–1408.
Шапиро Н.И., Нуждин Н.И., Кузин А.М. Действие эстрогенных веществ на лучевую реакцию мышей. М.: Изд-во АН СССР, 1955. С. 16–32. [Shapiro N.I., Nuzhdin N.I., Kuzin A.M. Deistvie ehstrogennykh ve-shchestv na luchevuyu reaktsiyu mysheI. M.: Izdatel`stvo AN SSSR, 1955. P. 16–32. (In Russian)]
Сусликов В.Н. О защитном действии диэтилстильбэстрола // Радиобиология. 1963. Т. 3. № 6. С. 880–890. [Suslikov V.N. O zashchitnom deistvii diehtilstil’behstrola // Radiobiologiya. 1963. V. 3. № 6. P. 880–890. (In Russian)]
Быков В.Н., Гребенюк А.Н., Мясников В.А., Чепур С.В. Влияние профилактического применения β-эстрадиола на выживаемость и костномозговое кроветворение облученных мышей // Воен.-мед. журн. 2017. Т. 338. № 11. С. 26–33. [Bykov V.N., Grebenyuk A.N., Myasnikov V.A., Chepur S.V. Vliyanie profilakticheskogo primeneniya β-ehstradiola na vyzhi-vaemost' i kostnomozgovoe krovetvorenie obluchennykh myshei // Voenno-meditsinskii zhurnal. 2017. V. 338. № 11. P. 26–33. (In Russian)]
Шлякова Т.Г., Михайлов П.П. Индометофен как средство лечения острой лучевой болезни // Радиац. биология. Радиоэкология. 2009. Т. 49. № 4. С. 438–443. [Shlyakova T.G., Mikhailov P.P. Indometofen kak sredstvo lecheniya ostroi luchevoi bolezni // Radiats. biologiya. Radioehkologiya. 2009. V. 49. № 4. P. 438–443. (In Russian)]
Лебедев В.Г., Мороз Б.Б., Воротникова Т.В., Дешевой Ю.Б. Изучение механизмов радиозащитного действия индометофена на кроветворные клетки-предшественники в длительных культурах костного мозга мышей // Радиац. биология. Радиоэкология. 1999. Т. 39. № 5. С. 528–533 [Lebedev V.G., Moroz B.B., Vorotnikova T.V., Deshevoi Yu.B. Izuchenie mekhanizmov radiozashchitnogo deistviya indometofena na krovetvornye kletki-predshestvenniki v dlitel’nykh kul’turakh kostnogo mozga myshei // Radiatsionnaya biologiya. Radioehkologiya. 1999. V. 39.№ 5. P. 528–533. (In Russian)]
Мясников В.А., Тарумов Р.А. Изучение эффективности в-эстрадиола, индометафена и генистеина в качестве радиопротекторов при остром облучении // Вестн. новых мед. технологий. 2012. Т. 19. № 2. С. 244–246. [Myasnikov V.A., Tarumov R.A. Izuchenie ehffektivnosti в-ehstradiola, indo-metafena i genisteina v kachestve radioprotektorov pri ostrom obluchenii // Vestnik novykh meditsinskikh tekhnologiI. 2012. V. 19. № 2. P. 244–246. (In Russian)]
Shipov V.P., Pigarev E.S., Fedoros E.I. Benzene polycarboxylic acid compounds and their use as drug: Patent WO2013143549 (A1), 03 October, 2013.
Bykov V.N., Drachev I.S., Kraev S.Y. et al. Radioprotective and radiomitigative effects of BP-C2, a novel lignin-derived polyphenolic composition with ammonium molybdate, in two mouse strains exposed to total body irradiation // Int. J. Radiat. Biol. 2018. V. 94. № 2. P. 114–123.
Панченко А.В., Федорос Е.И., Пигарев С.Е. и др. Экспериментальное изучение радиозащитной эффективности комплекса полифенольного полимерного производного лигнина с молибдатом аммония – препарата BP-C2 // Радиац. биология. Радиоэкология. 2017. Т. 57. № 5. С. 505–511. [Panchenko A.V., Fedoros E.I., Pigarev S.E. i dr. Ehksperimental’noe izuchenie radiozashchitnoi ehffektivnosti kompleksa polifenol’nogo polimernogo proizvodnogo lignina s molibdatom ammoniya – preparata BP-C2 // Radiats. biologiya. Radioehkologiya. 2017. Т. 57. № 5. P. 505–511. (In Russian)]
Fedoros E.I., Orlov A.A., Zherebker A. et al. Novel water-soluble lignin derivative BP-Cx-1: identification of components and screening of potential targets in silico and in vitro // Oncotarget. 2018. V. 9. № 26. P. 18578–18593.
Jackson I.L., Zodda A., Gurung G. et al. BIO 300, a nanosuspension of genistein, mitigates pneumonitis/fibrosis following high-dose radiation exposure in the C57L/J murine model // Br. J. Pharmacol. 2017. V. 174. № 24. P. 4738–4750.
Анисимович И.П., Дейнека В.И., Дейнека Л.А. и др. Параметры антиоксидантной активности соединений: относительная антиоксидантная активность чая // Науч. вед. БелГУ. Сер. Естественные науки. 2010. Т 9. № 11. С. 104–110. [Anisimovich I.P., Deineka V.I., Deineka L.A. i dr. Parametry antioksidantnoi aktivnosti soedineniI: otnositel’naya antioksidantnaya aktivnost' chaya // Nauchnye vedomosti Belgorodskogo gosudarstvennogo universiteta. Seriya: Estestvennye nauki. 2010. V. 9. № 11. P. 104–110. (In Russian)]
Шапиро Н.И., Нуждин Н.И., Кузин А.М. Действие эстрогенных веществ на лучевую реакцию мышей. М.: Изд-во АН СССР, 1955. С. 16–32. [Shapiro N.I., Nuzhdin N.I., Kuzin A.M. Deistvie ehstrogennykh ve-shchestv na luchevuyu reaktsiyu mysheI. M.: Izdatel`stvo AN SSSR, 1955. P. 16–32. (In Russian)]
Гребенюк А.Н., Мясников В.А., Зацепин В.В. и др. Сравнительное изучение эффективности гепарина, интерлейкина-1β, β-эстрадиола и индометофена в качестве радиопротекторов при остром облучении // Вестн. Рос. Воен.-мед. акад. 2011. Т. 4. № 36. С. 101–104. [Grebenyuk A.N., Myasnikov V.A., Zatsepin V.V. i dr. Sravnitel’noe izuchenie ehffektivnosti geparina, interleikina-1β, β-estradiola i indometofena v kachestve radioprotektorov pri ostrom obluchenii // Vestnik Rossiiskoi voenno-meditsinskoi akademii. 2011. V. 4. № 36. P. 101–104. (In Russian)]
Kuntić V.S., Stanković M.B., Vujić Z.B. et al. Radioprotectors – the evergreen topic // Chem. Biodivers. 2013. № 10. P. 1791–1803.
Garofalo M.C., Ward A.A., Farese A.M. et al. A pilot study in rhesus macaques to assess the treatment efficacy of a small molecular weight catalytic metalloporphyrin antioxidant (AEOL 10150) in mitigating radiation induced lung damage // Health Phys. 2014. V. 106. № 1. P. 73–83.
Kirkin A., Dzhandzhugazya K., Fang J. et al. A novel anticancer agent, benzene-poly-carboxylic acids complex with cis-diammineplatinum (II) dichloride, activates multiple immunologic mechanisms of an antitumor response // J. Clin. Oncol. 2013. № 31. P. 12024.
Sevgi K., Tepe B., Sarikurkcu C. Antioxidant and DNA damage protection potentials of selected phenolic acids // Food Chem. Toxicol. 2015. № 77. P. 12–21.
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология


