Радиационная биология. Радиоэкология, 2020, T. 60, № 4, стр. 411-417
ИЗУЧЕНИЕ ПРОЦЕССОВ УФ-МОДИФИКАЦИИ ФИЦИНА, СВОБОДНОГО И ИММОБИЛИЗОВАННОГО НА МАТРИЦЕ ХИТОЗАНА
С. М. Панкова 1, М. Г. Холявка 1, *, М. С. Кондратьев 3, Ю. М. Вышкворкина 2, А. Н. Лукин 1, В. Г. Артюхов 1
1 Воронежский государственный университет
Воронеж, Россия
2 Московский физико-технический институт
Москва, Россия
3 Институт биофизики клетки РАН
Пущино, Россия
* E-mail: holyavka@rambler.ru
Поступила в редакцию 27.05.2019
После доработки 30.11.2019
Принята к публикации 12.02.2020
Аннотация
Установлено, что при действии УФ-излучения в дозах 151–1510 Дж/м2 активность свободного фицина (КФ 3.4.22.3) и диаметр его молекул оставались на постоянном (первоначальном) уровне. При использовании доз 3020, 4530, 6040 Дж/м2 зарегистрированы снижение каталитической способности фермента и увеличение диаметра его глобулы, что, вероятно, связано с разворачиванием молекулы энзима. После адсорбции фицина на матрице среднемолекулярного (200 кДа) и высокомолекулярного (350 кДа) хитозанов каталитическая способность ферментного препарата не снижалась во всем диапазоне используемых нами доз УФ-излучения. Можно предположить, что матрица хитозана выступает в качестве фотопротектора для иммобилизованного на ней фицина, так как изменения в ИК-спектрах адсорбированной на ней цистеиновой протеазы практически не затрагивают полосы, обусловленные белковым компонентом системы: амид I, амид II, амид III.
Изучение механизмов действия УФ-излучения на белки-ферменты – одна из важнейших фундаментальных проблем молекулярной фотобиологии. Трансформация энергии света в различных фотобиологических процессах включает последовательные стадии: поглощение света и образование электронно-возбужденных состояний хромофора, фотофизическую реализацию энергии возбуждения, проявление фотохимических реакций с образованием первичных фотопродуктов и развитие вызванных ими фотобиологических ответов. За счет энергии электронного возбуждения молекула хромофора (в белках ими являются ароматические аминокислоты: триптофан, тирозин, фенилаланин, а также цистин) изменяет состояние своего ближайшего микроокружения в биоструктурах, и это дает начало структурно-функциональным перестройкам, что может отражаться на свойствах биологических молекул, в частности, ферментов. Ведущие направления современной фотобиологии связаны с изучением первичных механизмов регуляторных, деструктивных и фотопротекторных процессов, вызываемых УФ-излучением в биосистемах [1–5].
Исследование структуры протеолитических ферментов способствует пониманию процессов жизнедеятельности на молекулярном уровне и приобретает практическую значимость при создании медицинских препаратов пролонгированного действия на основе иммобилизованных энзимов. Лекарственные средства, обладающие протеолитической активностью, в том числе фицин, широко применяются в клинической практике для лечения повреждений кожных покровов, воспалительных заболеваний, гельминтозов [6, 7].
Фицин (КФ 3.4.22.3) – протеолитический фермент, выделенный из латекса фиговых деревьев (Ficus species) [8, 9]. Он принадлежит к семейству папаинов, в активном центре находится триада аминокислот Cys, His и Asp. Данный фермент содержит одну полипептидную цепь массой ∼25 кДа, которая свернута с образованием глобулярного белка и включает два домена [10–13]. Для молекулы фицина оптимум рН составляет 6.7, оптимальная температура – от 45 до 55°С [10–16]. Энзим обладает антимикробной активностью против грамположительных и грамотрицательных бактерий [17, 18].
Современные методы модификации ферментов (стабилизация субстратом или другими соединениями, ковалентная модификация, например, гликозилирование, конструирование энзимов с заданными свойствами с помощью сайт-направленного мутагенеза) позволяют увеличивать стабильность энзимов к действию различных химических реагентов, физических факторов, регулировать каталитические свойства молекул. Однако именно иммобилизация фермента на нерастворимом носителе, кроме перечисленных выше преимуществ, предоставляет ученым возможность многократного использования биокатализатора, упрощает процедуру его отделения от реагентов и продуктов реакции, повышает вероятность однозначного прогнозирования поведения энзима и кинетики реакции в промышленных ферментерах.
Иммобилизация – это процесс фиксации белка-фермента на полимерном носителе с помощью физических взаимодействий и/или химических связей. В научной литературе большое внимание уделяется вопросам изучения путей связывания молекул энзимов с различными носителями, повышающих их устойчивость к высоким температурам, экстремальным значениям рН, ингибиторам, при этом воздействие УФ-излучения на каталитическую активность и физико-химические свойства иммобилизованных ферментов изучено недостаточно [19–21]. В этой связи целью нашей работы стало выявление особенностей и закономерностей воздействия УФ-излучения на процессы фотомодуляции свободного и иммобилизованного на матрице хитозана фицина.
МАТЕРИАЛЫ И МЕТОДИКА
В качестве объекта исследования был выбран фицин фирмы “Sigma-Aldrich”, субстратом для гидролиза служил бычий сывороточный альбумин (БСА) фирмы “Sigma-Aldrich”, носителями для иммобилизации – два вида хитозана, синтезированных ЗАО “Биопрогресс”: хитозан пищевой кислоторастворимый среднемолекулярный (Мr = 200 кДа, степень деацетилирования (СД) 82%, хитозан кислоторастворимый высокомолекулярный (Мr = 350 кДа, СД = 94.85%).
Иммобилизацию фицина на матрице хитозанов осуществляли адсорбционным методом [22, 23]. Определение количества белка в препаратах и каталитической активности фермента проводили модифицированным методом Лоури [24].
Процесс УФ-облучения происходил при непрерывном перемешивании соответственно раствора и суспензии в объеме 4 мл (толщина слоя в середине кюветы – 7 мм) магнитной мешалкой в круглодонной термостатируемой кювете (20 ± 1°С) с помощью ртутно-кварцевой лампы типа ДРТ-400 через светофильтр УФС-1 с полосой пропускания 240–390 нм в течение 1, 3, 5, 10, 20, 30 или 40 мин. Доза облучения составила соответственно 151, 453, 755, 1510, 3020, 4530 и 6040 Дж/м2.
Регистрацию ИК-спектров анализируемых образцов осуществляли в Центре коллективного пользования научным оборудованием Воронежского государственного университета с помощью ИК-Фурье спектрометра Bruker Vertex-70 (Германия). Спектры снимали с неориентированных порошковых образцов.
Визуализацию аминокислотных остатков – хромофоров для УФ-света – осуществляли в программе Maestro.
Подготовка структуры фермента для докинга выполнялась по стандартной для Autodock Vina схеме, описанной авторами пакета на сайте: из входного файла PDB были удалены координаты атомов (и сами атомы) молекул растворителя, буфера и лигандов. Перед проведением численных расчетов была выполнена расстановка зарядов на поверхности белков c помощью MGLTools. Центр молекулы и параметры бокса («ячейки») мы задавали вручную, добиваясь того, чтобы молекула протеазы полностью была внутри расчетной области пространства.
Модель структуры хитозана была нарисована в молекулярном конструкторе HyperChem, последовательно оптимизирована сначала в силовом поле AMBER, а потом квантово-химически в PM3. Лиганд в расчетах докинга имел максимальную конформационную свободу: допускалось вращение функциональных групп вокруг всех одинарных связей. Расстановка зарядов на молекуле хитозана и ее протонирование/депротонирование осуществлялись автоматически в пакете MGLTools 1.5.6.
Статистическую обработку полученных результатов проводили с использованием t-критерия Стьюдента при уровне значимости различий 5%.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При УФ-облучении раствора фицина в дозах от 151 до 1510 Дж/м2 наблюдалась тенденция к снижению его активности. Начиная с 3020 Дж/м2 и при повышении дозы до 4530 и 6040 Дж/м2, зарегистрировано статистически значимое уменьшение каталитической способности свободного фицина на 11, 12 и 17% соответственно.
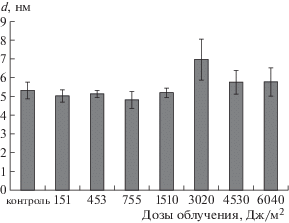
После иммобилизации фицина на матрице среднемолекулярного хитозана при УФ-облучении в дозе 151 Дж/м2 наблюдалась тенденция к снижению активности препарата, однако при дальнейшем облучении в диапазоне доз 453–6040 Дж/м2 фермент сохранял свою каталитическую способность на относительно постоянном уровне. После иммобилизации фицина на матрице высокомолекулярного хитозана при УФ-облучении фермент сохранял свою активность на первоначальном (до облучения) уровне, снижение каталитической способности энзима не зарегистрировано во всем диапазоне исследуемых нами доз (рис. 1). При УФ-облучении свободного фицина изменение размера глобулы выявлено при использовании дозы 3020 Дж/м2, возможно, это связано с разворачиванием молекулы фермента (рис. 2).
Рис. 1.
Влияние УФ-света на удельную каталитическую активность (А, ед./мг) свободного и иммобилизованного на матрице хитозана фицина: 1 – свободный фицин, 2 – фермент, иммобилизованный на среднемолекулярном хитозане, 3 – фермент, иммобилизованный на высокомолекулярном хитозане.
Fig. 1. Effect of UV light on the specific catalytic activity (A, U/mg) of free and immobilized on the chitosan matrix ficin: 1 – free ficin, 2 – enzyme immobilized on medium molecular weight chitosan, 3 – enzyme immobilized on high molecular weight chitosan.
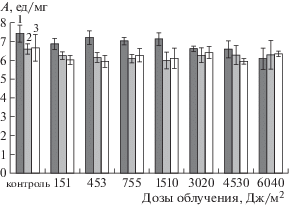
Рис. 2.
Влияние УФ-света на диаметр молекул фицина.
Fig. 2. The effect of UV light on the diameter of ficin mo-lecules.
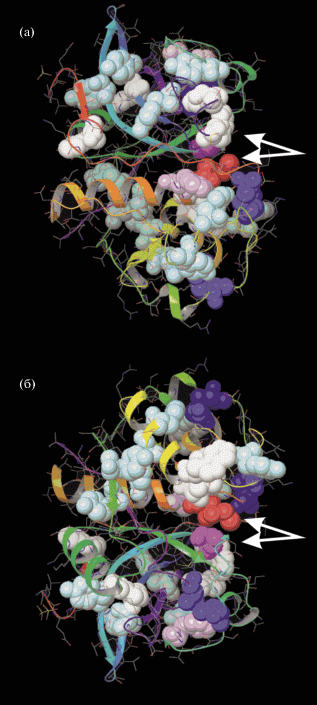
Для более детального анализа полученных результатов была осуществлена визуализация хромофоров УФ-света для молекул фицина (PDB ID: 4YYW), по отношению к активному центру фермента (рис. 3). В активном центре фицина находится His 162, в непосредственной близости к нему располагаются сразу два хромофора – Tyr 177 и Trp 178.
Рис. 3.
Хромофоры для УФ-света в молекуле фицина (PDB ID: 4YYW): атомы аминокислотных остатков, входящих в их состав, обозначены шарами, активный центр фермента указан стрелкой. б – повернутая на 180° вокруг горизонтальной оси форма а.
Fig. 3. Chromophores for UV light in ficin molecule (PDB ID: 4YYW): atoms of amino acid residues in their composition are indicated by balls, the active center of the enzyme is indicated by the arrow. b – shape a rotated 180 degrees around the horizontal axis.
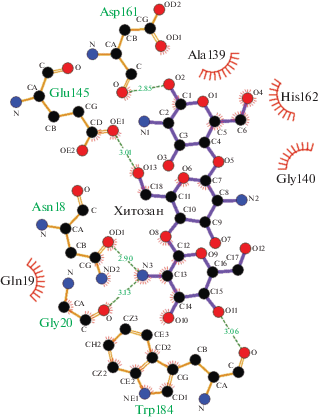
На рис. 4 отражены связи и взаимодействия между молекулами фицина (PDB ID: 4YYW) и матрицей хитозана, возникающие в ходе иммобилизации фермента. У фицина в процессах адсорбции на носителе из хромофоров задействован Trp 184, что, вероятно, способствует сохранению его каталитической активности при облучении УФ-светом.
Рис. 4.
Связи и взаимодействия между молекулой фицина (PDB ID: 4YYW) и матрицей хитозана (пунктирными линиями обозначены водородные связи).
Fig. 4. Bonds and interactions between ficin molecule (PDB ID: 4YYW) and chitosan matrix (hydrogen bonds are indicated by dashed lines).
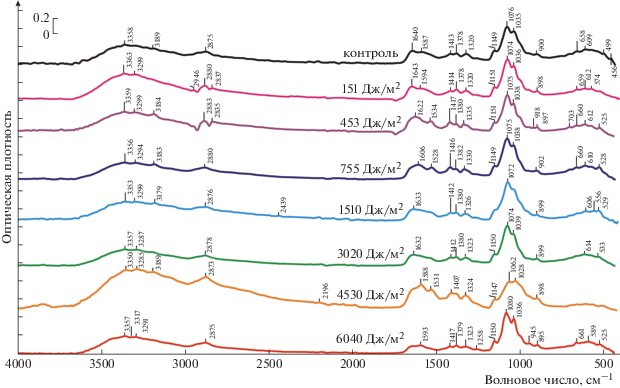
В целях более полного анализа наблюдаемых эффектов были зарегистрированы ИК-спектры фицина, иммобилизованного на матрице среднемолекулярного и высокомолекулярного хитозанов, до и после облучения образцов УФ-светом в дозах 151, 453, 755, 1510, 3020, 4530 и 6040 Дж/м2.
На ИК-спектрах фицина, иммобилизованного на матрице высокомолекулярного хитозана, наблюдается сдвиг максимума в области 1062–1080 см–1 при увеличении дозы облучения, что, вероятно, связано с участием гидроксильных групп в первичных фотобиологических реакциях. Зарегистрированы колебания С–О–Н групп, на что указывает наличие пика в области 1149–1150 см–1. В полосе 1413–1417 см–1 наблюдается смещение максимума в сторону уменьшения значений волновых чисел, следовательно, в системе могут проходить реакции с участием ароматического кольца. Наблюдаются симметричные деформационные колебания NН$_{3}^{ + }$-группы и N–Н связи – полосы в ИК-спектре 1587– и 1528–1534 см–1 соответственно. Полосы 2875–2883 и 3356–3363 см–1 свидетельствуют о наличии карбонильных групп и валентной =NH–С связи в препаратах иммобилизованной цистеиновой протеазы (рис. 5).
Рис. 5.
ИК-спектры фицина, иммобилизованного на матрице высокомолекулярного хитозана, до и после УФ-облучения в диапазоне доз 151–6040 Дж/м2.
Fig. 5. IR spectra of ficin immobilized on a high-molecular chitosan matrix before and after UV irradiation in the dose range 151–6040 J/m2.
При иммобилизации на среднемолекулярном хитозане в ИК-спектре белкового препарата присутствуют пики ∼1084, 1151 см–1, что соответствует валентному колебанию С–О(Н) групп. В полосе 1380–1391 см–1, которая ответственна за деформационное колебание С–Н связи, зарегистрировано смещение пика в сторону увеличения значений волновых чисел. Изменение интенсивности полосы 1499–1515 см–1 указывает на характеристическое колебание с участием ароматического кольца (рис. 6).
Рис. 6.
ИК-спектры фицина, иммобилизованного на матрице среднемолекулярного хитозана, до и после УФ-облучения в диапазоне доз 151–6040 Дж/м2.
Fig. 6. IR spectra of ficin immobilized on a matrix of medium molecular chitosan, before and after UV irradiation in the dose range of 151–6040 J/m2.
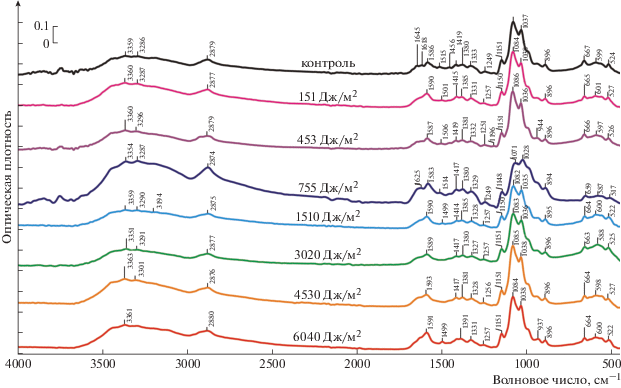
Как видно из рис. 5, 6, изменения в ИК-спектрах иммобилизованной цистеиновой протеазы практически не затрагивают полосы, обусловленные белковым компонентом системы: амид I, амид II, амид III, поэтому можно констатировать, что матрица хитозана выступает в качестве фотопротектора для адсорбированного на ней фицина.
ЗАКЛЮЧЕНИЕ
Наши экспериментальные данные показывают, что при УФ-облучении свободного фицина в дозе 3020 Дж/м2 и выше происходит снижение активности ферментного препарата и увеличение размеров белковой глобулы. При иммобилизации фицина на матрице среднемолекулярного и высокомолекулярного хитозанов после облучения во всем диапазоне используемых нами доз (151–6040 Дж/м2) энзим сохранял свою каталитическую способность на относительно постоянном уровне по сравнению с контрольным образцом. Таким образом, ферментативная активность молекул свободного фицина при воздействии УФ-света подвержена изменению в большей степени, чем в иммобилизованном состоянии, так как образование проанализированных нами связей и взаимодействий между молекулами фермента и матрицей хитозана оказывает значительное влияние на устойчивость иммобилизованного препарата к УФ-излучению.
Приведенные в статье материалы могут быть использованы при комплексном применении протеолитических ферментов (в частности фицина), хитозана и его производных и УФ-излучения при терапии повреждений кожных покровов различной этиологии.
Список литературы
Рощупкин Д.И., Артюхов В.Г. Основы фотобиофизики. Воронеж: ВГУ, 1997. 116 с. [Roshchupkin D.I., Artyuhov V.G. Osnovy fotobiofiziki: ucheb. posobie. Voronezh: VGU; 1997. 116 р. (In Russian)]
Ahmad S. Ultraviolet light in human health, diseases and environment // Adv. Experim. Med. Bio. 2017. V. 996. P. 365. https://doi.org/10.1007/978-3-319-56017-5
Артюхов В.Г., Ковалева Т.А., Наквасина М.А. и др. Биофизика. М.: Академический Проект, 2009. 294 с. [Artyuhov V.G., Kovaleva T.A., Nakvasina M.A. et al. Biofizika. M.: Akademicheskij Proekt, 2009. 294 р. (In Russian)]
Фрайкин Г.Я. Актуальные направления фотобиологических исследований // Альманах мировой науки. 2018. № 3 (23). С. 36–39. [Frajkin G.Ya. Aktual’nye napravleniya fotobiologicheskih issledovanij // Al’manah mirovoj nauki. 2018. № 3 (23). P. 36–39. (In Russian)]
Алипов Н.В. О клинической эффективности дальней длинноволновой УФ-терапии // Саратовский науч.-мед. жур. 2015. Т. 11. № 3. С. 431–434. [Alipov N.V. O klinicheskoj effektivnosti dal’nej dlinnovolnovoj UF-terapii // Saratovskij nauchno-medicinskij zhurnal. 2015. V. 11. № 3. P. 431–434. (In Russian)]
Мосолов В.В. Протеолитические ферменты. М.: Наука, 1971. 404 с. [Mosolov V.V. Proteoliticheskie fermenty. M.: Nauka, 1971. 404 р. (In Russian)]
Пенджиев А.М., Абдуллаев А. Лекарственные особенности дынного дерева // Мед. науки. 2017. № 1. С. 21–35. [Pendzhiev A.M., Abdullaev A. Lekarstvennye osobennosti dynnogo dereva // Med. Nauki. 2017. № 1. P. 21–35. (In Russian)]
Devaraj K.B., Kumar P.R., Prakash V. Purification, characterization, and solvent-induced thermal stabilization of ficin from Ficus carica // J. Agric. Food Chem. 2008. V. 56 P. 11417–11423. https://doi.org/10.1021/jf802205a
Devaraj K.B., Kumar P.R., Prakash V. Characterization of acid-induced molten globule like state of ficin // Int. J. Biol. Macromol. 2009. V. 45. P. 248–254. https://doi.org/10.1016/j.ijbiomac.2009.05.008
Feijoo-Siota L., Villa T.G. Native and biotechnologically engineered plant proteases with industrial applications // J. Food Bioproc.Technol. 2011. V. 4. P. 1066–1088. https://doi.org/10.1007/s11947-010-0431-4
Homaei A., Stevanato R., Etemadipour R., Hemmati R. Purification, catalytic, kinetic and thermodynamic characteristics of a novel ficin from Ficus johannis // J. Biocatalys. Agricult. Biotechno. 2017. V. 10. P. 360–366. https://doi.org/10.1016/j.bcab.2017.04.008
González-Rábade N., Badillo-Corona J.A., Aranda-Barradas J.S., Oliver-Salvador M.C. Production of plant proteases in vivo and in vitro – A review // J. Biotechno. Adv. 2011. V. 29. P. 983–996. https://doi.org/10.1016/j.biotechadv.2011.08.017
Zare H., Moosavi-Movahedi A.A., Salami M. et al. Purification and autolysis of the ficin isoforms from fig (Ficus carica cv. Sabz) latex // J. Phytochem. 2013. V. 87. P. 16–22. https://doi.org/10.1016/j.phytochem.2012.12.006
Haesaerts S., Buitrago J.A.R., Loris R. et al. Crystallization and preliminary X-ray analysis of four cysteine proteases from Ficus carica latex // J. Acta Cryst. 2015. V. 71. P. 459–465. https://doi.org/10.1107/S2053230X15005014
Baeyens-Volant D., Matagne A., Mahyaoui R.E. et al. A novel form of ficin from Ficus carica latex: purification and characterization // J. Phytochem. 2015. V. 117. P. 154–167. https://doi.org/10.1016/j.phytochem.2015.05.019
Raskovica B., Lazica J., Polovic N. Characterization of general proteolytic, milk clotting and antifungal activity of Ficus carica latex during fruit ripening // J. Sci. Food Agriculte. 2016. V. 96. P. 576–582. https://doi.org/10.1002/jsfa.7126
Zarea H., Moosavi-Movahedi A.A., Salami M. et al. Autolysis control and structural changes of purified ficin from Iranian fig latex with synthetic inhibitors // Int. J. Biol. Macromolec. 2016. V. 84. P. 464–471. https://doi.org/10.1016/j.ijbiomac.2015.12.009
Baidamshina D.R., Trizna E.Y., Holyavka M.G. et al. Targeting microbial bioflms using Ficin, a nonspecifc plant protease roof // Scientif. Rep. 2017. V. 7. P. 46068. https://doi.org/10.1038/srep46068
Абелян В.А. Получение и применение иммобилизованных ферментов и клеток микроорганизмов. Ереван: Изд-во АН Арм. ССР, 1988. 390 с. [Abelyan V.A. Poluchenie i primenenie immobilizovannyh fermentov i kletok mikroorganizmov. Еrevan: Izdatel’stvo AN Arm. SSR, 1988. 390 p. (In Russian)]
Березин И.В. Биотехнология: учеб. пособие для вузов. В 8 кн. / Под ред. Н.С. Егорова, В.Д. Самуилова. Кн. 7: Иммобилизованные ферменты. М.: Высш. шк., 1987. 159 с. [Berezin I.V. Biotekhnologiya: ucheb. posobie dlya vuzov. V 8 kn. / Pod red. N.S. Еgorova, V.D. Samuilova. Kn. 7: Immobilizovannye fermenty. M.: Vyssh. Shk, 1987. 159 p. (In Russian)]
Егорова Т.А., Клунова С.М., Живухина Е.А. Основы биотехнологии. М.: Изд. центр “Академия”, 2003. 208 с. [Еgorova T.A., Klunova S.M., Zhivuhina Е.A. Osnovy biotekhnologii. Moskva: Izdat. centr “Akademiya”, 2003. 208 p. (In Russian)]
Логинова О.О., Холявка М.Г., Артюхов В.Г. Физико-химические и кинетические свойства гетерогенного биокатализатора на основе трипсина, иммобилизованного на матрице хитозана // Биофарм. журн. 2015. № 2. С. 13–16. [Loginova O.O., Holyavka M.G., Artyuhov V.G. Fiziko-himicheskie i kineticheskie svojstva geterogennogo biokatalizatora na osnove tripsina, immobilizovannogo na matrice hitozana // Biofarmacevticheskij zhurnal. 2015. № 2. P. 13–16. (In Russian)]
Логинова О.О., Холявка М.Г., Артюхов В.Г., Беленова А.С. Разработка методики получения гетерогенного биокатализатора на основе трипсина, иммобилизованного на матрице хитозана // Фунд. исслед. 2013. № 11 (3). С. 484–487. [Loginova O.O., Holyavka M.G., Artyuhov V.G., Belenova A.S. Razrabotka metodiki polucheniya geterogennogo biokatalizatora na osnove tripsina, immobilizovannogo na matrice hitozana // Fundamental’nye issledovaniya. 2013. № 11 (3). P. 484–487. (In Russian)]
Логинова О.О., Холявка М.Г., Артюхов В.Г., Беленова А.С. Подбор методики количественного определения трипсина, иммобилизованного на матрице хитозана, и его каталитической активности // Вестн. ВГУ. Серия: “Химия. Биология. Фармация”. 2013. № 2. С. 116–119. [Loginova O.O., Holyavka M.G., Artyuhov V.G., Belenova A.S. Podbor metodiki kolichestvennogo opredeleniya tripsina, immobilizovannogo na matrice hitozana, i ego kataliticheskoj aktivnosti // Vestnik VGU. Seriya: “Himiya. Biologiya. Farmaciya”. 2013. № 2. P. 116–119. (In Russian)]
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология


