Радиационная биология. Радиоэкология, 2020, T. 60, № 4, стр. 362-370
РАДИАЦИОННО-ИНДУЦИРОВАННЫЕ ИЗМЕНЕНИЯ ЯДЕРНОЙ ДНК В НЕЙРОНАХ ГОЛОВНОГО МОЗГА
И. Б. Ушаков 1, *, В. П. Федоров 2
1 Государственный научный центр – Федеральный медицинский биофизический центр им. А.И. Бурназяна ФМБА России
Москва, Россия
2 Всероссийский центр экстренной и радиационной медицины им. А.М. Никифорова МЧС России
Санкт-Петербург, Россия
* E-mail: iushakov@fmbcfmba.ru
Поступила в редакцию 17.06.2019
После доработки 17.12.2019
Принята к публикации 12.02.2020
Аннотация
В экспериментах на крысах, подвергшихся общему воздействию γ-излучения в дозах от 0.1 до 1.0 Гр, с помощью гистохимических методик исследованы радиационно-индуцированные изменения ядерной ДНК в нейронах головного мозга. Установлено, что как у контрольных, так и облученных животных на протяжении всей жизни происходят волнообразные изменения содержания ядерной ДНК в нейронах с постепенным снижением показателей к окончанию срока наблюдения. При этом изменения ДНК в нейронах, как правило, связаны с изменениями размеров ядер. Регрессионный анализ показал, что однократное общее облучение в малых дозах оказывает на динамику ядерной ДНК нелинейное стохастическое влияние, характеризующееся отсутствием дозо-временной зависимости, и не вызывает значимых органических изменений содержания и топохимии продуктов гистохимических реакций в нейронах головного мозга по сравнению с возрастным контролем.
Важнейшей радиационной мишенью клеток являются нуклеиновые кислоты. Уже в первых обзорах проблемы [1, 2] показано, что под действием ионизирующего излучения нарушаются синтез ДНК, структура ДНК-матрицы, затем синтез РНК. Отмечено стимулирующее действие облучения в дозах до 1.0 Гр на активность ДНКаз и РНКаз головного мозга [1]. По этим показателям даже предпринимались попытки оценить зависимости “доза–эффект”, скорость восстановления и сравнительную радиоустойчивость мозговых структур. Установлено снижение содержания ДНК и РНК как в спинном, так и в головном мозге в первые сутки после облучения кроликов в дозе 6 Гр. Также показано полное восстановление разрывов нитей ДНК нейронов мозжечка крыс в течение 38 ч после локального воздействия γ-излучения на область головы в дозе 50 Гр [2]. Сразу после облучения головы в дозах от 4 до 17 Гр в нейронах мозжечка наблюдалось снижение количества ДНК с коэффициентом седиментации ЗООS. В серии последующих исследований показана линейная зависимость между поглощенной дозой и числом разрывов нитей ДНК для нейронов, глиальных и эндотелиальных клеток головного мозга при облучении в дозах до 18 Гр. Однако большинство этих повреждений были репарируемы уже в течение 30 мин после радиационного воздействия. Более выраженные ранние эффекты, проявляющиеся разрывами ДНК и снижением скорости ее синтеза, наблюдались после облучения развивающегося мозга. Так, подавление синтеза ДНК в мозжечке крысят зарегистрировано уже через 10 ч после облучения в дозе 1.5 Гр, а у 10-дневных животных лишь через 18 ч. Заслуживает внимания факт, что влияние облучения на синтез ДНК в мозжечке было более выражено, чем в остальных отделах мозга. Однако практически все исследователи считают, что для интерпретации вклада изменений ДНК в развитие радиоцеребральных эффектов данных пока недостаточно [2].
В настоящее время считается, что ответ клеток на различные воздействия, в том числе и облучение, определяется изменением экспрессии генов, модулирующих внутриклеточные программы функционирования [3]. Основными повреждениями генома клетки под действием радиации в малых дозах считаются одно- и двунитевые разрывы ДНК, модификация оснований (окислительное повреждение или отщепление), кластерные повреждения нитей ДНК, ее конформационные модификации, инверсии генов. Функциональные последствия этих повреждений (изменения активности генов, индукция репаративных процессов или апоптоза, адаптивный ответ) отличаются от результатов действия радиации в больших дозах [4, 5]. В то же время радиобиологический подход, регламентирующий диапазон малых доз, рекомендуемый НКДАР, базируется в основном на экспериментальных исследованиях полноты репарации ДНК и на индукции опухолей у лабораторных животных [6–11]. Большинство исследований данного эффекта выполнено in vitro, в то время как на уровне целого организма он изучен слабо. Важность такого рода исследований обусловлена необходимостью оценки риска последствий радиационного воздействия и разработки более эффективных методов радиотерапии [11–13]. Однако исследования на людях не дали прямых доказательств, обусловленных облучением наследуемых патологий. Эксперименты свидетельствуют о неоднозначности прямого переноса радиобиологических закономерностей модельных опытов на эпидемиологические ситуации, что связано со сложностью интерпретаций результатов опытов на клеточных культурах для возможной ситуации in vivo [14–16]. К настоящему времени для облученных популяций человека не установлены наследуемые генетические патологии. Эпидемиологические исследования не способны продемонстрировать доказательства основных эффектов облучения родителей до зачатия как среди потомков, выживших после атомных бомбардировок в Японии, так и среди работников, подвергавшихся воздействию радиации [6–8].
Научная литература о радиационно-индуцированном изменении нуклеиновых кислот, в том числе и в нейронах головного мозга, постоянно пополняется [17–22]. Однако принципиально новых данных не получено, а морфологическое исследование распределения нуклеиновых кислот в нейронах головного мозга облученных животных практически не проводится [23, 24]. В связи с этим целью исследования являлось изучение динамики (на протяжении жизни) состояния ядерной ДНК в нейронах головного мозга крыс, подвергшихся общему воздействию γ-излучения в дозах от 0.1 до 1 Гр.
МАТЕРИАЛЫ И МЕТОДИКА
В основу эксперимента положены данные о лучевой нагрузке у военнослужащих-ликвидаторов аварии на ЧАЭС и состоянии их здоровья в ранние и отдаленные сроки пострадиационного периода [24]. Исследование с соблюдением правил биоэтики выполнено на 320 половозрелых беспородных крысах-самцах в возрасте 4 мес. к началу эксперимента (что соответствует 27–28 годам возраста ликвидаторов-вертолетчиков), подвергшихся общему однократному воздействию γ-квантов 60Со в дозах 0.1, 0.2, 0.5 и 1.0 Гр (энергия 1.2 МэВ; мощность дозы 0.5, 1.0, 2.5 и 6.6 Гр/ч). Участки головного мозга (лобная кора – поле FPa; теменная кора поле – РАs; кора мозжечка – culmen) забирали в первые часы и сутки (время, соответствующее возможной первичной реакции на облучение), 6 мес. (возраст профессионального долголетия летного состава, участвующего в ликвидации последствий Чернобыльской радиационной аварии – 40 лет), 12 мес. (предельный возраст пребывания на военной службе – 50 лет), 18 и 24 мес. (пожилой и старческий возраст) постр-адиационного периода. Каждой группе соответствовал адекватный возрастной контроль. После стандартных гистологических процедур на парафиновых срезах, окрашенных по методу Ниссля, оценивали динамику морфометрических и тинкториальных показателей нейронов. Выявление ДНК проводили на криостатных и парафиновых срезах, окрашенных по методу S. Shea с соответствующим контролем ДНКазой. При этом детально выявляются цитоплазма и ядрышко нейронов благодаря содержанию большого количества рибонуклеопротеидов, а нуклеоплазма, содержащая ДНК, окрашивается в другой цвет. Как правило, структуры, содержащие РНК, окрашиваются в интенсивно сиреневый цвет, а структуры, содержащие ДНК, – в сине-зеленый, что позволяет легко их дифференцировать. При этом надо учитывать, что варианты окраски нуклеиновых кислот могут варьировать в зависимости от методик гистохимических процедур, но всегда они окрашиваются в различные цвета.
Кариометрические показатели ядер нейронов и содержание в них ДНК оценивали с помощью компьютерной программы Image J. 36 b Wayne Rasband National Institutes of Health, USA. Количество нейронов у каждого животного, необходимых для определения нейроморфологических показателей, определяемое методом аккумулированных средних, составляло от 300 до 400. При этом рассматриваемые показатели имеют распределение, близкое к нормальному (среднее арифметическое, геометрическое и гармоническое значения незначительно отличаются друг от друга, это же касается моды и медианы; минимальные и максимальные значения примерно равноудалены от среднего значения и стандартизированные коэффициенты асимметрии и эксцесса по абсолютной величине < 2). При незначительном коэффициенте вариации показателей в данном случае возможно использование параметрических методов обработки результатов. Описательную статистику с вычислением средних и доверительные интервалы осуществляли с помощью пакетов программ Statistica 6.1, MSExcel 2007 и MathCad 14 с последующим математическим моделированием нейроморфологических показателей. Алгоритм проведения эксперимента, обработки, исследования и статистического анализа материала достаточно подробно представлен нами ранее [23].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Проведенные нами ранее исследования животных, подвергшихся внешнему воздействию ионизирующего излучения в дозах до 1.0 Гр, не выявили значимых органических изменений в нейронах головного мозга на протяжении всей жизни. Выявленные изменения являются неспецифическими, как правило, обратимы и имеют стохастический характер, не зависящий от доза-временных параметров. В исследуемом диапазоне доз изменения статистически значимых различий не имеют. Радиационные воздействия в малых дозах вызывают, как правило, функциональные изменения в нейронах, нарушающие баланс между процессами возбуждения и торможения. Характер этих изменений показывает, что ионизирующее излучение в малых дозах может вызывать разнонаправленные эффекты, снижая одни нейроморфологические показатели и повышая другие, что свидетельствует об определенной нестабильности структурно-функциональной организации нейронов. Эти изменения в большинстве случаев обратимы, но при увеличении дозы облучения или действии сопутствующих вредных и опасных факторов среды могут предрасполагать к развитию расстройств функционирования нервной системы [23, 24].
Настоящее исследование показало, что через сутки после радиационного воздействия размер ядер грушевидных нейронов мозжечка имел тенденцию к снижению, а при дозе 1.0 Гр снижение было статистически значимым. Через 6 мес. во всех экспериментальных группах размер ядер был меньше возрастного контроля и оставался на этом уровне и через 12 мес. наблюдения, после чего имел тенденцию к нормализации. Исключение составила группа животных, облученных в дозе 0.1 Гр, где показатель нормализовался уже через 12 мес., через 18 мес. снижался и вновь повышался через 24 мес. пострадиационного периода (рис. 1).
Рис. 1.
График зависимости содержания ДНК в ядрах нейронов ганглионарного слоя коры мозжечка от дозы облучения и времени пострадиационного периода. * Различия с контролем статистически значимы (р < 0.05).
Fig. 1. Graph of content Dnkw the nuclei of neurons of ganglionic layer of cerebellar cortex from radiation dose and time post radiation period. * Differences in the statistical control are reliable (p < 0.05).
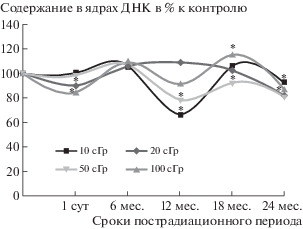
Содержание ДНК в ядрах нейронов через сутки после облучения в дозе 1.0 Гр снижалось, а при других дозах оставалось на уровне возрастного контроля. Через 6 мес. количество ядерной ДНК при всех дозах радиационного воздействия соответствовало возрастному контролю. Через 12 мес. при дозах облучения 0.1 и 0.5 Гр рассматриваемый показатель снижался, а при дозах 0.2 и 1.0 Гр практически соответствовало контролю. Через 18 мес. содержание ДНК в ядрах нейронов при всех дозах облучения не имело значимых различий с возрастным контролем, а к концу пострадиационного периода снижалось (рис. 1).
Установив, что между параметрами воздействующих факторов – дозой облучения, временем после воздействия и динамикой изучаемых показателей морфофункционального состояния нейронов существуют неоднонаправленные связи, был проведен сравнительный анализ зависимостей выявленных изменений от воздействия изучаемых факторов. Основной целью исследования являлось установление приоритета каждого из них для построения математической модели. Математическую модель динамики изучаемых нейроморфологических показателей в коре мозжечка в зависимости от дозы облучения и времени пострадиационного периода представляли в виде уравнения регрессии
где П – исследуемый показатель, х – доза облучения; у – время пострадиационного периода; ху, х2, у2, х3, у3 – взаимные влияния параметров х, у и нелинейное влияние каждого из этих параметров. При построении регрессионных моделей учитывались только параметры для коэффициентов с уравнением значимости p < 0.05. Алгоритм расчетов подробно приведен нами в работах [19, 23]. Показано, что размер ядер клеток Пуркинье при малых радиационных воздействиях зависит от дозы облучения и времени пострадиационного периода. При этом доза облучения оказывает большее влияние на динамику показателя, чем время, прошедшее после облучения. Уравнение регрессии выглядит следующим образом:
Коэффициент диагностической значимости модели R2 = 0.59, но связь аргументов слабая (r = 0.35).
Содержание ядерной ДНК зависит как от дозы облучения, так и от времени пострадиационного периода. При этом время имеет большее влияние на динамику состояния ядерной ДНК, чем доза облучения, так как абсолютные значения коэффициентов при аргументе времени выше таковых при дозе облучения. Уравнение регрессии выглядит следующим образом:
Диагностическая значимость модели высокая (R2= 0.74), а связь аргументов средняя (r = 0.55). Визуальная оценка функции модели представлена на рис. 2.
Рис. 2.
График зависимости содержания ДНК в ядрах нейронов ганглионарного слоя коры мозжечка от дозы облучения и времени пострадиационного периода.
Fig. 2. Graph of the dependence of the DNA content in the nuclei of neurons of the ganglion layer of the cerebellar cortex on the radiation dose and the time of the irradiation period.
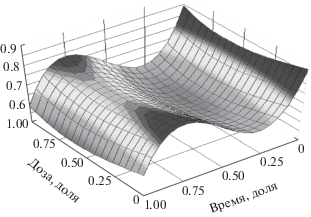
Из графика следует, что показатель содержания ядерной ДНК имеет два экстремума (минимум и максимум), на образование которых влияет время пострадиационного периода, а доза облучения сопряжена с существованием одного минимума.
Кариометрические исследования показали, что через одни сутки после радиационного воздействия в теменной коре размер ядер нейронов нелинейно зависел от дозы облучения. При дозе облучения 0.1 Гр этот показатель увеличивался на 53.8%, при 0.2 Гр уменьшался на 27.8%, а при 1.0 Гр не изменялся вплоть до 12 мес. наблюдения. При дозе облучения 0.1 Гр размер ядер через 6 мес. был увеличен на 24.5%, а через 12 мес. на 50.1% по сравнению с контролем. В группе животных, облученных в дозе 0.2 Гр, рассматриваемый показатель увеличивался на 14.6% через 6 мес. наблюдения, а в остальные сроки соответствовал возрастному контролю. К концу пострадиационного периода размеры ядер при дозах облучения 0.1 и 0.2 Гр соответствовали возрастному контролю, а при 1.0 Гр составляли от него 82.8% (рис. 3).
Рис. 3.
График зависимости размера ядер (а) и содержания в ядрах ДНК (б) в нейронах теменной коры от дозы облучения и времени пострадиационного периода. * Различия с контролем статистически достоверны (p < 0.05).
Fig. 3. Graph of the dependence of the size of nuclei (a) and the content in the nuclei of DNA (b) neurons of the parietal cortex on the dose and time of the postradiation period. * Differences with control were statistically significant (p < 0.05).
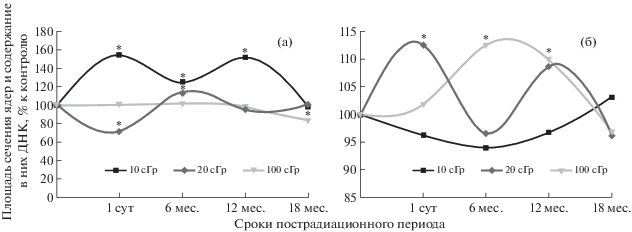
Содержание ядерной ДНК при облучении в дозе 0.1 Гр во все сроки наблюдения практически не изменялось. При 0.2 Гр через сутки рассматриваемый показатель повысился на 12.6%, а в последующие сроки наблюдения соответствовал возрастному контролю. Через сутки после облучения в дозе 1.0 Гр содержание ядерной ДНК не изменялось, через 6 и 12 мес. было повышено на 12.5 и 10% соответственно, а через 18 мес. соответствовало контрольному уровню (рис. 3).
Модель изменений кариометрических показателей и содержания ядерной ДНК в нейронах теменной коры (регрессионный анализ) представляли аналогичной для нейронов мозжечка. Уравнение регрессии, описывающее динамику кариометрических показателей нейронов теменной коры при однократном радиационном воздействии, выглядит следующим образом:
Коэффициент диагностической значимости модели R2 = 0.61, связь между эффектом и исследуемыми аргументами умеренная – коэффициент корреляции r = 0.37. Из уравнения регрессии следует, что размер ядер нейронов нелинейно зависел от дозы облучения, а время после облучения оказывало на рассматриваемый показатель меньшее влияние. Для оценки содержания ядерной ДНК в нейронах теменной коры при однократном облучении математическая модель оказалась неадекватной (при ее построении коэффициенты регрессии были незначимыми, p > 0.05). На эти показатели оказывал влияние только один аргумент (х), что хорошо видно из соответствующего уравнения:
Содержание ядерной ДНК в нейронах зависит лишь от нелинейных составляющих дозы облучения. Коэффициент диагностической значимости модели R2 = 0.31, а связь между эффектом и дозой облучения отсутствует (r = 0.09).
Согласно данным, представленным на рис. 4, в лобной коре размер ядер нейронов V слоя (большие пирамидные нейроны) сразу после облучения в дозе 0.5 Гр (мощность дозы облучения 0.5 Гр/ч) снижается по отношению к контролю на 19% (р < 0.05), но в последующие сроки наблюдения (5 ч и 1 сут) статистически значимо превышает данный показатель у контрольных животных. Через 3 сут размер ядер значимо уменьшается и составляет 70.2% от уровня контроля (р < 0.05). После 14 сут наблюдения размер ядер нейронов увеличивается и через 30 сут соответствует контролю, а через 6, 12 и 18 мес. статистически значимо превышает его. Содержание ядерной ДНК в нейронах облученных животных до 3 сут статистически значимо снижается по сравнению с контролем. Через 7 сут содержания ядерной ДНК в нейронах сравниваемых групп не имеет различий, а через 14 сут показатель облученных животных превышает контроль на 43.8% (р < 0.05). Через 6 мес. содержание ДНК в ядрах нейронов статистически значимо снижается и через 12 и 18 мес. составляет от уровня контроля 71.5 и 74.3% соответственно (рис. 4).
Рис. 4.
График зависимости размера ядер (а) и содержания в них ДНК (б) в нейронах V слоя лобной коры от времени пострадиационного периода при облучении (0.5 Гр) с мощностью дозы 0.5 Гр/ч (а) и 6.6 Гр/ч (б). * Различия с контролем статистически значимы (p < 0.05).
Fig. 4. Graph of the size of nuclei (a) and the content of DNA (b) neurons in the nuclei of the V layer of the frontal cortex from radiation at a dose of 0.5 Gy with a dose rate of 0.5 et 6.6 Gy/h and the time of the postradiation period. * Differences with control were statistically significant (p < 0.05).
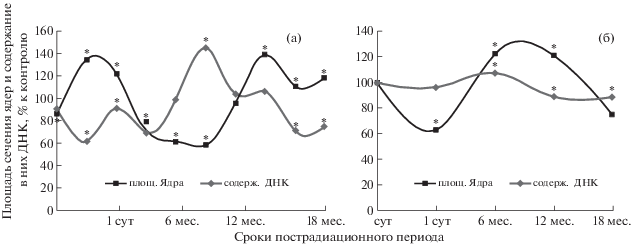
При увеличении мощности дозы облучения до 6.6 Гр размер ядер нейронов в лобной коре через 1 сут после воздействия уменьшался и составлял 63.5% от уровня контроля, а содержание ядерной ДНК соответствовало контролю – 96.7%. Через 6 мес. размер ядер увеличился на 22.7%, а содержание ядерной ДНК – на 7.5%. Через 12 мес. размер ядер превышал возрастной контроль на 22.1%, через 18 мес. уменьшился до 74.4%, а содержание ядерной ДНК снизилось до 89.1% от уровня контроля (рис. 4).
При радиационном воздействии в дозе 0.5 Гр (различная мощность дозы облучения) математическую модель зависимости динамики кариометрических показателей и содержания в ядрах нейронов ДНК от мощности дозы облучения и времени пострадиационного периода представляли уравнением регрессии:
Таблица 1.
Оценка зависимости размера ядер нейронов от контролируемых показателей Table 1. Evaluation of the dependence of the size of neuronal nuclei on the effects of controlled factors
| Показатель | Коэффициент оценки | Стандартная ошибка | Т-статистика | Уровень значимости |
|---|---|---|---|---|
| Константа | 0.2812 | 0.0206 | 13.601 | <1 × 10–19 |
| ${{а}_{2}}$ | 0.5707 | 0.1447 | 3.943 | 0.000141 |
| ${{а}_{4}}$ | –0.0811 | 0.0360 | –2.249 | 0.026475 |
| ${{а}_{5}}$ | –0.5787 | 0.1490 | –3.884 | 0.000176 |
Анализ данных таблицы показывает, что изменение размера ядер нейронов зависит от всех рассматриваемых факторов, но большее влияние на показатель оказывает время, прошедшее после облучения.
Эффект влияния рассматриваемых факторов на размер ядер приемлемый: уровень значимости модели составляет менее 1 × 10–19 при коэффициенте диагностической значимости 0.38. Эти параметры и ряд других, характеризующих модель, показаны в табл. 2. Уравнение регрессии, описывающее зависимость размера ядер от рассматриваемых показателей, выглядит следующим образом:
Таблица 2.
Оценка адекватности математической модели, описывающей влияние рассмотренных факторов на размер ядер Table 2. Evaluation of the adequacy of the mathematical model of the influence of parameters on the dynamics of the size of the nuclei
| Параметр | Сумма квадратов отклонений | Степени свободы | Средний квадрат | F-статистика | Уровень значимости |
|---|---|---|---|---|---|
| Модель | 11.132 | 4.0 | 2.783 | 122.68 | <1 × 10–19 |
| Остаток | 2.495 | 110.0 | 0.022 | ||
| Модель с приведенной суммой | 11.132 | 4.00 | 2.7831 | 107.89 | <1 × 10–19 |
Визуальная оценка динамики размера ядер нейронов лобной коры показана на графике (рис. 5,а). Из графика видно, что максимальные значения показателя соответствуют средним диапазонам значений прошедшего после облучения времени и начальному диапазону мощности дозы облучения. При этом время пострадиационного периода имеет большее влияние на динамику рассматриваемого показателя.
Рис. 5.
График зависимости размера ядер (а) нейронов и содержания в них (б) ДНК от мощности дозы облучения и времени пострадиационного периода.
Fig. 5. Graph of the size of nuclei (a) of neurons and their (b) DNA content on the dose rate and time of the postradiation period.
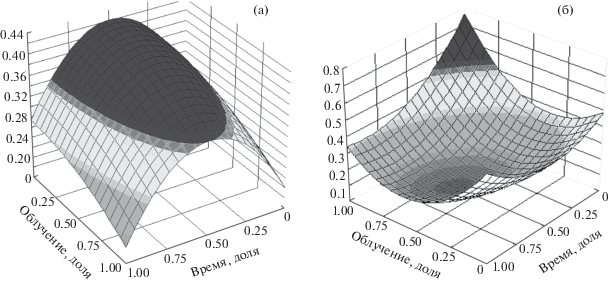
Как следует из табл. 3, показатель содержания ДНК в ядрах значимо зависит от всех рассматриваемых факторов, в том числе и от сочетанного влияния мощности дозы облучения и времени пострадиационного периода. Эффект влияния факторов на содержание ДНК в ядрах нейронов приемлемый: уровень значимости модели составляет менее 1 × 10–19 при коэффициенте диагностической значимости R2= 0.701. Параметры, характеризующие модель, представлены в табл. 4.
Таблица 3.
Оценка зависимости содержания ДНК в ядрах нейронов от контролируемых показателей Table 3. Assessment of the relationship of DNA content in the nuclei of neurons from the effects of controllable factors
| Показатель | Коэффициент оценки | Стандартная ошибка | Т-статистика | Уровень значимости |
|---|---|---|---|---|
| Константа | 0.486 | 0.024 | 20.377 | <1 × 10–19 |
| ${{а}_{1}}$ | –0.725 | 0.341 | –2.125 | 0.0358 |
| ${{а}_{2}}$ | –0.551 | 0.100 | –5.504 | <1 × 10–19 |
| ${{а}_{3}}$ | –0.474 | 0.066 | –7.084 | <1 × 10–19 |
| ${{а}_{4}}$ | 1.006 | 0.324 | 3.098 | 0.0024 |
| ${{а}_{5}}$ | 0.601 | 0.102 | 5.881 | <1 × 10–19 |
Таблица 4.
Оценка адекватности математической модели, описывающей влияние рассматриваемых факторов на содержание ДНК в ядрах нейронов Table 4. Assessment of the adequacy of the mathematical model of the influence of factors on the dynamics of DNA content in the nuclei of neurons
| Параметр | Сумма квадратов отклонений | Степени свободы | Средний квадрат | F-статистика | Уровень значимости |
|---|---|---|---|---|---|
| Модель | 22.692 | 6.00 | 365.75 | <1 × 10–19 | |
| Остаток | 1.116 | 108.00 | 0.0103 | ||
| Модель с приведенной суммой | 22.692 | 6.00 | 3.7821 | 194.69 | <1 × 10–19 |
Уравнение регрессии, описывающее влияние изучаемых факторов на содержание ядерной ДНК нейронов лобной коры, выглядит следующим образом:
Визуальная оценка зависимости содержания ядерной ДНК от мощности дозы облучения и времени пострадиационного периода представлена на графике (рис. 5,б). Из графика видно, что максимальному значению функции соответствуют максимальное значение мощности дозы облучения и минимальное значение времени после облучения, т.е. содержание ДНК в ядрах достигает своего максимума при высоких значениях мощности дозы облучения и начальных значениях времени пострадиационного периода.
ЗАКЛЮЧЕНИЕ
Анализ литературы показал, что, несмотря на значительное количество работ по исследованию влияния ионизирующего излучения на состояние нуклеиновых кислот [4, 6, 12, 14, 17–22], эксперименты, прослеживающие изменения ДНК в ядрах нейронов головного мозга на всем пострадиационном периоде, достаточно редки [19, 23, 24]. Проведенные нами нейроморфологические и гистохимические исследования показали, что как у контрольных, так и облученных животных на протяжении всей последующей жизни в нейронах головного мозга происходят волнообразные изменения содержания ядерной ДНК с постепенным снижением рассматриваемых показателей к окончанию пострадиационного периода. При этом динамика содержания ДНК в ядрах нейронов на отдельных этапах пострадиационного периода больше связана с изменениями кариметрических показателей, чем с изменением ее синтеза и внутриклеточного транспорта. Регрессионный анализ показал, что облучение в изученных дозах оказывает на динамику ядерной ДНК нелинейное стохастическое влияние, характеризующееся отсутствием дозо-временной зависимости, и не вызывает значимых изменений топохимии продукта гистохимической реакции при выявлении ДНК в нейронах головного мозга. Однако при увеличении мощности дозы облучения изменения содержания ДНК в ядрах нейронов головного мозга имеют более выраженный характер. В конце пострадиационного периода, когда наблюдается гибель как облученных, так и контрольных животных, содержание ДНК в нейронах головного мозга статистически значимо снижается во всех экспериментальных группах, но в большей степени у облученных животных.
Список литературы
Рева А.Д. Ионизирующие излучения и нейрохимия. М.: Атомиздат, 1974. 240 с. [Reva A.D. Ioniziruyushchie izlucheniya i nejrokhimiya. Moscow: Atomizdat, 1974. 240 p. (in Russian)]
Давыдов Б.И., Ушаков И.Б. Ионизирующие излучения и мозг: поведенческие и структурно-функциональные паттерны // Итоги науки и техники. Радиационная биология. М.: ВИНИТИ, 1987. Т. 8. 336 с. [Davydov B.I., Ushakov I.B. Ioniziruyushchie izlucheniya i mozg: povedencheskie i strukturno-funkcional’nye pattern // Itogi nauki i tekhniki. Radiatsionnaya biologiya. M.: VINITI, 1987. Т. 8. 336 p. (in Russian)]
Шуленина Л.В., Михайлов В.Ф., Рева Н.Ф. Содержание микроРНК и мРНК генов в периферической крови больных раком предстательной железы при формировании осложнений органов малого таза после лучевой терапии // Актуальные проблемы радиобиологии и астробиологии. Генетические и эпигенетические эффекты ионизирующих излучений. Дубна, 2016. С. 76–78 [Shulenina L.V., Mikhajlov V.F., Reva N.F. Soderzhanie mikroRNK i mRNK genov v perifericheskoj krovi bol’nykh rakom predstatel’noj zhelezy pri formirovanii oslozhnenij organov malogo taza posle luchevoj terapii // Aktual’nye problemy radiobiologii i astrobiologii. Geneticheskie i epigeneti-cheskie effekty ioniziruyushchikh izluchenij. Dubna, 2016. P. 76–78. (in Russian)].
Газиев А.И. Фрагменты ДНК из гибнувших клеток можно рассматривать как мобильные генетические элементы, индуцирующие мутагенез // Актуальные проблемы радиобиологии и астробиологии. Генетические и эпигенетические эффекты ионизирующих излучений. Дубна, 2016. С. 13–14. [Gaziev A.I. Fragmenty DNK iz gibnuvshikh kletok mozhno rassmatrivat' kak mobil’nye geneticheskie elementy, indutsiruyushchie mutagenez //Aktual'nye problemy radiobiologii i astrobiologii. Geneticheskie i epigeneticheskie effekty ioniziruyushchikh izluchenij. Dubna, 2016. P. 13–14. (in Russian)]
Жижина Г.П., Заварыкина Т.М., Фаткуллина Л.Д. Действие малых доз ионизирующей радиации и фенозана на структуру ДНК и мембран клеток мышей // Актуальные проблемы радиобиологии и астробиологии. Генетические и эпигенетические эффекты ионизирующих излучений. Дубна, 2016. С. 20–23. [Zhizhina G.P., Zavarykina T.M., Fatkullina L.D. Dejstvie malykh doz ioniziruyushchej radiatsii i fenozana na strukturu DNK i membran kletok myshej // Aktual’nye problemy radiobiologii i astrobiologii. Geneticheskie i epigeneticheskie effekty ioniziruyushchikh izluchenij. Dubna, 2016. P. 20–23. (in Russian)]
Бирюков А.П., Котеров А.Н. Роль радиобиологии при оценке радиационного риска // Медико-биологические проблемы жизнедеятельности. 2010. № 1. С. 25–30. [Biryukov A.P., Koterov A.N. Rol radiobiologii pri otsenke radiatsionnogo riska // Mediko-biologicheskiye problemy zhiznedeyatelnosti. 2010. № 1. P. 25–30. (in Russian)]
Котеров А.Н. Малые дозы и малые мощности доз ионизирующей радиации: регламентация диапазонов, критерии их формирования и реалии XXI века // Мед. радиология и радиац. безопасность. 2009. Т. 54. № 3. С. 5–26. [Koterov A.N. Malyye dozy i malyye moshchnosti doz ioniziruyushchey radiatsii: reglamentatsiya diapazonov, kriterii ikh formirovaniya i realii XXI veka // Med. radiologiya i radiats. bezopasnost. 2009. Т. 54. № 3. P. 5–26. (in Russian)]
United Nations. UNSCEAR 2000. Report to the General Assembly, with Scientific Annex. Annex F. DNA repair and mutagenesis. New York: United Nations, 2000. P. 1–72.
United Nations. UNSCEAR 2006. Report to the General Assembly, with Scientific Annexes. Annex A. Epidemiological studies of radiation and cancer. New York: United Nations, 2008. P. 17–322.
Jacob N.K., Cooley J.V., Yee T.N. et al. Identification of sensitive serum microRNA biomarkers for radiation biodosimetry // PLoS One. 2013. V. 8. № 2. 603 p.
Sahu A., Sighal U., Chinnaiyan A. Long non-coding RNAs in cancer: from function to translation // Trends Cancer. 2015. V. l. P. 93–109.
Евдокимовский Э.В., Абдуллаев С.А., Митрошина И.Ю., Губина Н.Е. Облучение головного мозга влияет на число копий мтДНК и ее транскриптов в необлученных тканях мышей // Актуальные проблемы радиобиологии и астробиологии. Генетические и эпигенетические эффекты ионизирующих излучений. Дубна, 2016. С. 19–20. [Еvdokimovskij E.V., Abdullaev S.A., Mitroshina I.Yu., Gubina N.Е. Obluchenie golovnogo mozga vliyaet na chislo kopij mtDNK i ee transkriptov v neobluchennykh tkanyakh myshej // Aktual’nye problemy radiobiologii i astrobiologii. Geneticheskie i epigeneticheskie effekty ioniziruyushchikh izluchenij. Dubna, 2016. P. 19–20. (in Russian)]
United Nations. UNSCEAR 2006. Report to the Gene-ral Assembly, with Scientific Annexes. Annex C. Non-targeted and delayed effects of exposure to ionizing radiation. New York: United Nations, 2009. P. 1–79.
Котеров А.Н. Ограничения при распространении закономерностей для клеток in vitro на область радиационной медицины // Мед. радиология и радиац. безопасность. 2009. Т. 54. № 5. С. 5–14. [Koterov A.N. Ogranicheniya pri rasprostranenii zakonomernostey dlya kletok in vitro na oblast radiatsionnoy meditsiny // Med. radiologiya i radiats. bezopasnost. 2009. Т. 54. № 5. P. 5–14. (in Russian)]
Guidaa M.S., Abd El-Aalb A., Kafafyc Y. et al. Thymoquinone Rescues T. Lymphocytes from Gamma Irradiation-Induced Apoptosis and Exhaustion by Modulating Pro-Inflammatory Cytokine Levels and PD-1, Bax, and Bcl-2 Signaling // Cell Physiol. Biochem. 2016. V. 38. P. 786–800.
Trott K.R., Rosemann M. Molecular mechanisms of radiation carcinogenesis and the linear, nonthreshold dose response model of radiation risk estimation // The Effects of Low and Very Low Doses of Ionizing Radiation on Human Health / Ed. WONUC. Amsterdam–New-York: Elsevier Sоences B.V., 2000. P. 65–77.
Абдуллаев С.А., Буланова Т.С., Тимошенко Г.Н., Газиев А.И. Исследование количества копий и гетероплазмии митохондриальной ДНК в различных областях мозга крыс после облучения их голов протонами 150 МэВ // Современные вопросы радиационной генетики: Мат. Рос. конф. с междунар. участием. Дубна: ОИЯИ, 2019. С. 7–104. [Abdullaev S.A., Bulanova T.S., Timoshenko G.N., Gaziev A.I. Issledovanie kolichestva kopij i geteroplazmii mitohondrial’noj DNK v razlichnyh oblastyah mozga krys posle oblucheniya ih golov protonami 150 MeV // Sovremennye voprosy radiacionnoj genetiki: Materialy Rossijskoj konferencii s mezhdunarodnym uchastiem. Dubna: OIYAI, 2019. P. 7–104. (in Russian)]
Батмунх М., Баярчимэг Л., Бугай А.Н. и др. Моделирование индукции и репарации повреждений ДНК в клетках гиппокампа при действии тяжелых заряженных частиц // Современные вопросы радиационной генетики: Мат. Рос. конф. с междунар. участием. Дубна: ОИЯИ, 2019. С. 20–21. [Batmunh M., Bayarchimeg L., Bugaj A.N. et al. Modelirovanie indukcii i reparacii povrezhdenij DNK v kletkah gippokampa pri dejstvii tyazhelyh zaryazhennyh chastic // Sovremennye voprosy radiacionnoj genetiki: Materialy Rossijskoj konferencii s mezhdunarodnym uchastiem. Dubna: OIYAI, 2019. P. 20–21. (in Russian)]
Ушаков И.Б., Федоров В.П. Моделирование радиационно-индуцированных изменений ядерной ДНК нейронов головного мозга // Современные вопросы радиационной генетики: Мат. Рос. конф. с междунар. участием. Дубна: ОИЯИ, 2019. С. 102–104. [Ushakov I.B., Fedorov V.P. Modelirovanie radiacionno-inducirovannyh izmenenij yadernoj DNK nejronov golovnogo mozga // Sovremennye voprosy radiacionnoj genetiki: Materialy Rossijskoj konferencii s mezhdunarodnym uchastiem. Dubna: OIYAI, 2019. P. 102–104. (in Russian)]
Sankaranarayanan K., Chakraborty R. Ionizing radiation and genetic risks. XIII. Summary and synthesis of papers VI to XII and estimates of genetic risks in the year 2000 // Mutat. Res. 2000. V. 453. № 2. P. 183–197.
Schettino G. Low dose binary behavior of bystander cell killing after microbeam irradiation of a single cell with focused Ck X ray // Radiat. Res. 2005. V. 163. № 3. P. 332–336.
Goodhead D.T. Fifth Warren K. Singlaire keynote address: issues in quantifying the effects of low-level radiation // Health Phys. 2009. V. 97. № 5. P. 394–406.
Ушаков И.Б., Федоров В.П. Малые радиационные воздействия и мозг. Воронеж: Науч. книга, 2015. 536 с. [Ushakov I.B., Fedorov V.P. Malyye radiatsionnyye vozdeystviya i mozg. Voronezh: Nauch. Kniga, 2015. 536 p. (in Russian)]
Федоров В.П., Ушаков И.Б., Федоров Н.В. Церебральные эффекты у ликвидаторов Чернобыльской аварии. Саарбрюккен: LAP LAMBERT Academic Publishing, 2016. 390 с. [Fedorov V.P., Ushakov I.B., Fedorov N.V. Tserebralnyye effekty u likvidatorov Chernobylskoy avarii. Saarbryukken: LAP LAMBERT Academic Publishing, 2016. 390 p. (in Russian)]
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология


