Радиационная биология. Радиоэкология, 2020, T. 60, № 4, стр. 371-377
ИЗМЕНЕНИЕ КОНФОРМАЦИИ КАРОТИНОИДОВ СЕМЯН ГИБРИДОВ КУКУРУЗЫ ПРИ ДЕЙСТВИИ УЛЬТРАФИОЛЕТА И α-ЧАСТИЦ
О. В. Слатинская 1, Ч. Н. Раденович 2, В. В. Шутова 3, Г. В. Максимов 1, 4, *
1 Биологический факультет, Московский государственный университет им. М.В. Ломоносова
Москва, Россия
2 Maize Research Institute, Zemun Polje – Институт кукурузы “Земун Поле”
Белград, Сербия
3 Национальный исследовательский Мордовский государственный университет им. Н.П. Огарёва
Саранск, Россия
4 Национальный исследовательский технологический университет “МИСиС”
Москва, Россия
* E-mail: gmaksimov@mail.ru
Поступила в редакцию 31.05.2018
После доработки 30.10.2019
Принята к публикации 12.02.2020
Аннотация
С помощью спектроскопии комбинационного рассеяния (КР) исследована роль каротиноидов при облучении (УФВ и α-частицами) семян инбредной линии (zppl 225) и гибрида (zp 341) кукурузы (Zea mays L.). Установлено, что облучение семян в области основания зерна (воздействие α-частиц высоких энергий, но не УФВ) меняет функциональное состояние растения за счет изменения конформации молекулы каротиноидов семян при переходе из 15-cis в all-trans состояние, а не колебаний С=С и С–С-связей полиеновой цепи молекулы каротиноидов.
Одним из способов повышения посевных качеств семян и увеличения скорости прорастания является их предобработка радиацией (от 1 Гр до 10 кГр, мощность дозы 10–900 Гр/ч) или ультрафиолетом (УФ-излучение, в диапазоне 315–380 нм) [1, 2]. Предполагают, что в результате данной технологии в клетках семян синтезируются фенолы и образуются активные формы кислорода (АФК) [3, 4]. Очевидно, что уровень АФК регулируется некоторыми антиоксидантами семян и, в первую очередь, каротиноидами. В связи с этим выявление различий состояния каротиноидов семян при действии физических факторов (свет, температура, радиация и т.д.) важно не только для диагностики функционального состояния семян, но и для разработки технологии формирования новых гибридов. С помощью спектроскопии комбинационного рассеяния света (КР) было проведено систематическое исследование, свидетельствующее о связи между содержанием и молекулярными свойствами каротиноидов в хлоропластах листа кукурузы при действии на растение радиации и УФ [5]. Показано, что метод КР можно эффективно использовать для исследования конформации молекул каротиноидов семян, оценивая вклад колебаний отдельных связей молекулы (колебаний С=С и С–С-связей полиеновой цепи молекулы; переход атомов молекулы из плоской конфигурации в изогнутую (искривление молекулы вне плоскости полиеновой цепи); изменение cis-trans конформации молекулы) [6].
В данной работе исследовали изменения конформации молекулы каротиноидов семян кукурузы (Zea mays L.) чистой линии и гибрида с повышенной всхожестью после локального воздействия ультрафиолетом зоны В (далее – УФВ) и α-частицами высоких энергий (далее – α-частицы).
МАТЕРИАЛЫ И МЕТОДИКА
Объектом исследования служили высокоурожайный гибрид кукурузы с улучшенной всхожестью (Zea mays L.) zp341 и чистая линия zppl225 (линия и гибрид являются собственностью Maize Research Institute, Zemun Polje – Института кукурузы “Земун Поле”, г. Белград, Сербия). Вес семян составлял 281 ± 6 мг и 382 ± 17 мг соответственно. Отметим, что гибрид zp341 обладает высокими показателями качества, урожайности и пригодности к возделыванию [7, 8].
В качестве источника УФВ-излучения использовали ультрафиолетовый облучатель (λmax = = 312 нм), собранный на основе трех люминесцентных эритемных ламп ЛЭ-30 (мощность 5.2 Вт/м2, вклад УФB-излучения 47.69%) [8–10]. Семена кукурузы фиксировали в пластиковой чашке Петри и подвергали воздействию УФВ в течение 30, 60 и 90 мин (дозы – 4.46, 8.93 и 13.39 кДж/м2 соответственно). В экспериментах с облучением УФВ и α-частицами облучению подвергалось основание зерна кукурузы.
Облучение семян с помощью пучка α-частиц высоких энергий (30 МэВ/нукл) с высоким значением линейной передачи энергии (ЛПЭ) осуществлялось на 120-см циклотроне НИИЯФ МГУ (Р7). Величина ЛПЭ частиц на поверхности объекта после прохождения частиц через 50 мкм алюминиевую фольгу составляла около 26.2 МэВ/нуклон, потери в воздухе (7 см) – около 3 МэВ/нуклон, глубина пробега α-частиц в крахмале – около 1620 мкм (средняя толщина семян 5000–7000 мкм). Так как толщина семени значительно больше длины пробега, будем для упрощения считать, что величина ЛПЭ α-частиц в толщине семян постоянна. Оценка величины поглощенной дозы D в семенах при облучении семян массой М α-частицами с энергией Е: D (Гр) = E (Дж)/M (кг). В соответствии с данными калибровки один отсчет интегратора тока соответствует заряду Q = 2 × × 10–10 К, а заряд дейтрона q = 1.6 × 10–19 К. Энергия α-частиц, оставленная в слое семян, составила E = N × Eo, где N – число α-частиц, прошедших через кювету, а Eo = 26.2 МэВ – энергия, оставленная в семенах одной α-частицей. Таким образом, N = ?, Eo = 1.25 × 109 дейтронов/отсчет интегратора, а E = 1.25 × 109 × 26.2 МэВ/дейтрон = = 32.75 × 109 МэВ/отсчет интегратора, или 52.4 Дж/отсчет интегратора.
Масса слоя семян толщиной 1620 мкм, облучаемая пучком диаметром 3 см (диаметр “окна”), при плотности крахмала 1.5 г/см3 составила 5.72 × × 10–3 кг. Тогда D для одного отсчета интегратора составит 9.16 Гр/отсчет интегратора.
Облучение семян проводили в специально изготовленной кольцеобразной кювете с внешним и внутренним диаметром из фигурных колец 60 и 20 мм соответственно. Кювета состояла из двух одинаковых фигурных колец толщиной по 15 мм, соединенных болтами, и уплотняющим тефлоновым кольцом между ними. В центральной части кюветы помещали семена практически вплотную друг к другу в один слой. Кювету помещали на расстоянии 7 см за “окном” ионопровода. Интенсивность пучка частиц поддерживалась постоянной: около 10 отсчетов/с. Расчет энергии α-частиц и поглощенной дозы проводили, считая, что семена полностью состоят из крахмала и заполняют кювету ровным слоем. Облучение семян в кювете было выполнено для 160, 320 и 1600 импульсов интегратора тока, зарегистрированных пересчетным прибором ПС-100. Эти величины импульсов интегратора переводили в поглощенную дозу D. Семена подверглись облучению в дозах 1.5, 3 и 15 кГр [10, 12].
В опыт случайным образом отбирали семена (30 шт.), которые после облучения промывали проточной водой и размещали на фильтровальной бумаге при бесконтактном смачивании водой (при 22°С) до прорастания корешков (длина не менее 5 мм). Далее проростки выращивали в грунте до фазы третьего настоящего листа в условиях 16-часового светового дня при поддержании постоянной температуры 25°С. В качестве контроля использовали необлученные семена, находившиеся в аналогичных условиях. Качество семян оценивали (ГОСТ 13056.6-75) по параметрам всхожести (количество одновременно проросших семян на первый день прорастания – “первичная лабораторная всхожесть семян” и “лабораторная всхожесть” – количество нормально проросших семян на 7-е сутки (ГОСТ 12038-84)) и энергии прорастания (количество семян, проросших и давших корешки, равные половине длины семени) на 3-й день.
Изменения в морфологии корневой системы определяли на 5-й день проращивания семян. Для этого случайным образом отбирали 10 облученных семян и продолжали их выращивать в чашке Петри при бесконтактном смачивании водой на фильтровальной бумаге. В качестве критериев изменения морфологии облученных семян относительно контроля были выбраны такие параметры, как длина главного корня, разветвленность корневой системы, наличие корневых волосков и длина стебля. Изменения в морфологии проростков кукурузы, высаженных в грунт, измеряли на 14-й день после облучения семян по изменению длины и ширины листовой пластинки третьего листа.
Спектры КР регистрировали с помощью КР-спектрометра ДФС 24 с лазером 473 нм (Ciel, Eurolase, Россия), системой регистрации МОРС 1/3648 (Троицк, РФ) на базе линейной ПЗС-матрицы TCD1304DG (Toshiba, Япония) с фильтром LPO2-473RS-50 (Shemrock, США) в течение 10 с; мощность лазера на образце – 3 мВт [4]. Семена кукурузы измельчали и очищали от кукурузного крахмала, гомогенат помещали в кварцевую кювету (толщина поглощающего слоя 10 мм), которую юстировали в держателе КР-спектрометра. Регистрация спектров КР семян проводилась в течение 2 ч после начала эксперимента (облучение семян).
Статистическую обработку данных проводили с применением пакета программ Microsoft Excel 2016 (Microsoft Corporation, США), а спектров КР – с помощью пакета Origin Pro 2017 (OriginLab Corporation, США). Число повторов опытных и контрольных групп (n) было не менее шести.
РЕЗУЛЬТАТЫ
В ходе проведенного исследования установлено, что при дозе 15 кГр функциональные параметры семян (первичная лабораторная всхожесть, энергия прорастания и лабораторная всхожесть) достоверно снижаются при дозе 15 кГр для гибрида с улучшенной всхожестью zp341 и при дозе 3 кГр для чистой линии zppl225. Динамика изменений зависит от генотипа (табл. 1). В первые дни после воздействия на семена УФВ обнаружено снижение скорости роста корешков и стебля (прирост составлял 0.5–1.0 мм), но в дальнейшем скорость роста увеличивалась и зависела от дозы: при 13.39 кДж/м2 – до 3.0 ± 0.4 мм в день, при 8.93 кДж/м2 – до 4.0 ± 0.5 мм в день и при 4.46 кДж/м2 – до 7.0 ± 1.5 мм в день. На 5-й день после воздействия на семена α-частицами и УФВ, при дозах 1.5, 3 кГр и 4.46 кДж/м2 корневая система семян имела разветвленную корневую систему из главного корня и придаточных корешков. Отметим, что у образца zp341 после облучения формируются корневые волоски, которые отсутствуют у zppl225 и семян контрольной группы (табл. 2).
Таблица 1.
Параметры всхожести семян кукурузы после облучения Table 1. Parameters of germination of corn seeds after irradiation
| Доза облучения | Генотип кукурузы | Первичная лабораторная всхожесть, % | Энергия прорастания, % | Лабораторная всхожесть, % | |
|---|---|---|---|---|---|
| Контроль | zppl225 | 30 ± 6 | 50 ± 5 | 100 ± 1 | |
| zp341 | 50 ± 4 | 87 ± 3 | 100 ± 0.5 | ||
| Неионизирующее излучение, кДж/м2 | 4.46 | zppl225 | 80 ± 6 | 100 ± 0.5 | 100 ± 0.5 |
| zp341 | 80 ± 4 | 100 ± 0.5 | 100 ± 0.2 | ||
| 8.93 | zppl225 | 40 ± 8 | 50 ± 6 | 60 ± 3* | |
| zp341 | 50 ± 3 | 80 ± 4* | 100 ± 0.5 | ||
| 13.39 | zppl225 | 30 ± 6 | 90 ± 3* | 100 ± 0.2 | |
| zp341 | 90 ± 2* | 100 ± 0.2* | 100 ± 0.2 | ||
| Ионизирующее излучение, кГр | 1.5 | zppl225 | 38 ± 6 | 75 ± 2 | 100 ± 3.6 |
| zp341 | 100 ± 0.2 | 100 ± 0.5 | 100 ± 2 | ||
| 3 | zppl225 | 14 ± 3* | 71 ± 4* | 71 ± 15* | |
| zp341 | 100 ± 0.5 | 100 ± 2 | 96 ± 8 | ||
| 15 | zppl225 | 0* | 17 ± 6* | 33 ± 10* | |
| zp341 | 43 ± 5* | 57 ± 8* | 57 ± 16* | ||
Таблица 2.
Морфологические показатели проростков семян кукурузы и третьего листа растения кукурузы Table 2. Morphology of corn seeds and the third leaf of corn plant
| Доза облучения | Генотип | Морфология проростков семян1 | Морфология третьего листа2 | |||||
|---|---|---|---|---|---|---|---|---|
| длина главного корня, мм | разветвлен-ность корневой системы | наличие корневых волосков | длина стебля, мм | длина листа, мм | ширина листа, мм | |||
| Контроль | zppl225 | 23 ± 5 | + | − | 5 | 120 ± 25 | 15 ± 3 | |
| zp341 | 31 ± 7 | + | − | 6 | 123 ± 22 | 17 ± 4 | ||
| Неионизирующее излучение, кДж/м2 | 4.46 | zppl225 | 45 ± 9 | + | − | 8 | 160 ± 20* | 12 ± 3* |
| zp341 | 51 ± 11 | + | + | 20 | 165 ± 23* | 13 ± 3* | ||
| 8.93 | zppl225 | 15 ± 4 | − | − | 4 | 96 ± 15* | 11 ± 3* | |
| zp341 | 8 ± 3 | − | − | 2 | 100 ± 18 | 12 ± 4 | ||
| 13.39 | zppl225 | 34 ± 8 | + | − | 7 | 166 ± 15 | 14 ± 3 | |
| zp341 | 42 ± 12 | + | + | 15 | 154 ± 18 | 15 ± 2 | ||
| Ионизирующее излучение, кГр | 1.5 | zppl225 | 41 ± 8 | + | − | 5 | 151 ± 12 | 15 ± 3 |
| zp341 | 54 ± 12 | + | + | 18 | 156 ± 18 | 12 ± 3 | ||
| 3 | zppl225 | 42 ± 9 | + | − | 5 | 176 ± 21* | 14 ± 3 | |
| zp341 | 55 ± 13 | + | + | 15 | 180 ± 23* | 14 ± 3 | ||
| 15 | zppl225 | 2 ± 1.5 | − | − | − | 30 ± 12* | 7 ± 2* | |
| zp341 | 8 ± 2 | - | - | 5 | 60 ± 25* | 8 ± 2* | ||
На 14-й день после воздействия на семена УФВ и α-частиц длина третьего настоящего листа растений, высаженных в грунт, имела максимальное значение после облучения в дозах 4.46 кДж/м2 и 3 кГр (16.5 ± 1.5 см и 18.0 ± 2.3 см соответственно, в контроле – 12.0 ± 2.5 см). Отметим, что ширина листовой пластинки третьего настоящего листа в среднем на 5 мм уже контроля (табл. 2). При воздействии в дозе 15 кГр всхожесть снижается на 80–90%. Так, растения zppl225 после облучения семян α-частицами в дозе 15 кГр имели слабую скорость роста (максимальная высота растения кукурузы – 5.0 ± 0.5 см, высота растения кукурузы zppl225 контрольной группы 15.0 ± 2.5 см), либо не развивались после посадки семян в грунт.
Полученные результаты свидетельствуют о зависимости прорастания семян и изменения морфологии корневой системы (табл. 2) проростка от типа излучения: при облучении α-частицами наблюдается интенсивный рост боковых корней (при дозе менее 15 кГр), а при облучении семян УФВ увеличивается интенсивность роста корневой системы. Отметим, что при облучении семян УФВ в дозе 8.93 кДж/м2 семена и растения кукурузы развивались хуже относительно контроля.
В связи с поставленной задачей исследования изменений конформации молекулы природного антиоксиданта – каротиноида при прорастании облученных семян нами были зарегистрированы КР-спектры семян и выявлены характерные полосы КР-спектра каротиноидов: v1 (960 см–1), v2 (1006 см–1), v3 (1156 см–1), v4 (1190 см–1), v5 (1520 см–1) (рис. 1) [3, 5, 6]. Максимальные изменения спектра КР выявлены для соотношений интенсивностей полос I1520/I1006 (характеризует вклад валентных колебаний –С=С–связей полиеновой цепи каротиноида), I1520/I1160 (характеризует изменение вклада –С=С–связей по отношению к –С–С–связям полиеновой цепи), I1006/I960 (характеризует расположение полиеновой цепи каротиноида относительно пиррольных колец). Наличие в спектрах КР пиков на 1190 и 1200 см–1 указывает на состояние каротиноидов, характерное для 15-cis конформации. Мы руководствовались известным фактом – интенсивность полос спектра КР пропорциональна количеству каротиноидов в исследуемом образце (при соблюдении одинаковых условий регистрации сигнала в разных точках гомогената семян) [3, 6] и считаем важным указать на наличие изменения количества молекул каротиноидов после облучения семян. Например, значение максимума и интенсивности образца zppl225 в контроле при положении полосы при 1520 см–1 составляет 1850 отн. ед. После воздействия в дозе в 15 кГр интенсивность полосы составляет 640 отн. ед., что свидетельствует о снижении количества молекул каротиноида, но не является количественной оценкой их содержания в образце.
Рис. 1.
Спектр комбинационного рассеяния каротиноидов семян кукурузы (нормировано на максимум).
Fig. 1. Raman spectrum of corn seed carotenoids (normalized by maximum).

После воздействия на семена УФВ КР-спектр каротиноидов меняется: наблюдаются рост интенсивности полосы 1190 см–1 и снижение интенсивности полосы 1200 см–1, что свидетельствует о переходе конформации молекулы (и/или состава каротиноидов) из 15-cis в all-trans состояние [6]. Данный факт согласуется с ростом величины соотношения интенсивностей полос I1156/I1190 КР спектра семян после облучения (рис. 2). Отметим, что при УФ-воздействии на семена (от 4.46 до 13.39 кДж/м2) не происходит изменений отношения интенсивности полос 1520 и 1156 см–1 (I1520/I1156) КР-спектра, что свидетельствует об отсутствии изменений конформации полиеновой цепи молекулы каротиноида.
Рис. 2.
Соотношение амплитуд полос КР-спектра каротиноидов при облучении семян кукурузы УФВ (а, в) и α-частицами (б, г).* Статистически достоверные отличия от контроля (p < 0.05).
Fig. 2. The change in the parameters of the Raman spectrum of carotenoids of maize leaves under UVB irradiation (a, c) and α-irradiation (b, d). * Significant changes relative to control (p < 0.05).
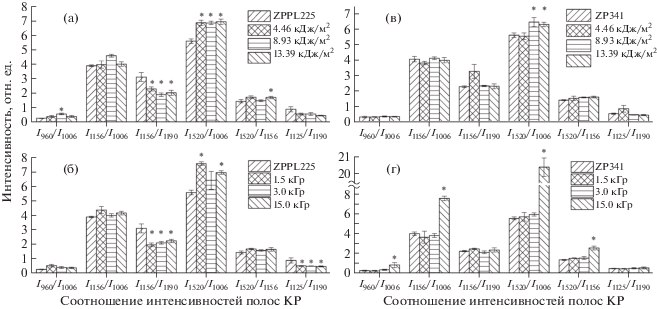
Облучение семян α-частицами приводит к изменению конформации (или состава) молекулы каротиноида у семян инбредной линии zppl225 – увеличению доли молекул в 15-cis конформации, но у гибрида zp341 отсутствуют переход молекулы в cis-состояние и изменение поворота и длины полиеновой цепи. Установлено, что при облучении семян zp341 с дозой 15 кГр интенсивность полос КР-спектра снижается, но возрастает соотношение полос I960/I1006 (рис. 2). Вероятно, изменение величины соотношений I1520/I1006 и I1156/I1006 спектра КР каротиноидов семян при облучении связано с трехкратным уменьшением вклада колебания метильных групп полиеновой цепи каротиноидов (полоса 1006 см–1 спектра КР, данные не представлены).
Важно, что соотношение I1125/I1190 КР спектра каротиноидов характеризует валентные колебания молекул, связанных с хлорофиллом зародыша в семени [12]. Вероятно, ухудшение функционального состояния семян zppl225 при облучении α-частицами обусловлено снижением содержания каротиноидов, связанных с хлорофиллом и переходом молекулы из all-trans состоянии в 15-cis состояние (соотношения I1156/I1190 КР-каротиноидов семян возрастает в 2 раза).
ОБСУЖДЕНИЕ
В ходе проведенного исследования показано, что увеличение дозы локального облучения семян УФВ и α-частицами приводит не только к изменению параметров, характеризующих прорастание растения (первичная лабораторная всхожесть, энергия прорастания и лабораторная всхожесть (табл. 1)), но и к различным изменениям конформации молекул каротиноидов семян гибрида и инбредной линии кукурузы (рис. 2).
При локальном облучении семян zp341 (15 кГр, пучок α-частиц фокусировали в области семявхода) были выявлены изменения структуры молекулы каротиноидов, о чем свидетельствуют увеличение интенсивности полосы 1006 см–1 и рост величины соотношения I960/I1006. Важно, что после облучения α-частицами и УФВ в семенах снижается количество молекул каротиноидов, связанных с хлорофиллом, с чем, вероятно, и связаны изменения в развитии растения. При этом конформация молекулы каротиноида меняется по-разному: облучение α-частицами не оказывает значительное влияние на конформацию (соотношение I1156/I1190), а воздействие УФВ вызывает увеличение доли молекул каротиноида в all-trans конформации.
Полученные результаты свидетельствуют о том, что при локальном воздействии УФВ изменения конформации молекул каротиноидов семян могут быть обусловлены накоплением продуктов АФК [12]. Вероятно, семена гибрида, обладающие повышенной всхожестью, обладают большей устойчивостью к действию ионизирующего излучения, чем семена инбредной линии.
ВЫВОДЫ
1. При локальном воздействии на основание семян УФВ (в диапазоне от 5 до 13.39 кДж/м2) и α-частицами (от 1.5 до 3 кГр) возрастают всхожесть и энергия прорастания семян. Семена гибрида с улучшенной всхожестью zp341 обладают большей стимуляцией к прорастанию при воздействии УФВ по сравнению с семенами чистой линии zppl225.
2. Показано, что воздействие α-частиц вызывает изменение конформации молекулы каротиноидов семян за счет перехода из 15-cis в all-trans состояние и внеплоскостного поворота полиеновой цепи молекулы каротиноидов, а воздействие УФВ – изменение длины полиеновой цепи молекулы.
Список литературы
Корепанов Д.А., Романов В.Ю., Лощенов П.Ю., Богатырёв М.Д. Влияние длинноволнового УФ облучения на повышение посевных качеств семян Pinus silvestris L. // Лесотехн. журн. 2014. Т. 1. № 13. С. 27–29. [Korepanov D.A., Romanov V.Yu., Loschenov P.Yu., Bogatyrev M.V. Vliyaniye dlinnovolnovogo UV oblucheniya na povysheniye posevnyh kachestv semyan // Leso-tеhnicheskiy zhournal. 2014. V. 1. № 6. P. 27–29. (In Russian)]
Мусина О.Н., Коновалов К.Н. Радиационная обработка ионизирующим излучением продовольственного сырья и пищевых продуктов // Пищевая пром-сть. 2016. № 8. С. 46–49. [Musina O.N., Konovalov K.N. Radiocionnaya obrabitka ioniziruyuschim izlucheniem prodovolstvennogo syrya i pischevyh productov // Pischevaya promyshlennost. 2016. № 8. P. 46–49. (In Russian)].
Тютяев Е.В., Шутова В.В., Максимов Г.В. и др. Состояние фотосинтетических пигментов в листьях инбредных линий и гибридов кукурузы // Физиология растений и генетика. 2015. Т. 47. № 2. С. 147–159. [Tyutyaev E.V., Shutova V.V., Maksimov G.V. et al. State of photosynthetical pigments in leaves of inbred lines and hybrids of maize // Fisiologia rasteniy i gene-tica. 2015. V. 47. № 2. P. 147–159 (In Russian)]
Maksimov G.V., Tyutyaev E.V., Kolmykova T.S., Revin V.V. Investigation of fluorescence intensity and distribution of wheat leaf on exposure to temperature // Moscow University Biol. Sci. Bull. 2014. V. 69. № 1. P. 6–9.
Slatinskaya O.V., Protopopov F.F., Seifullina N.Kh. et al. A study of the state of photosynthetic pigments of hybrid maize seeds exposed to ultraviolet and radiation // Biophysics. 2018. V. 63. № 4. P. 611–620.
Кэри П. Применение спектроскопии КР и РКР в биохимии: Пер. с англ. В. Локшин. М.: Мир, 1985. 272 с. [Carey P.R. Biochemical appliсations of Raman and resonance-Raman spectroscopies. New York, 1982. 272 p.]
Раденович Ч.Н., Максимов Г.В., Тютяев Е.В. Диагностицирование конформационных и функциональных свойств зерна элитных инбредных линий кукурузы с помощью инфракрасных спектров // Селекция и семеноводство. 2014. Т. 20. С. 13–33. [Radenovich Ch.N., Maksimov G.V., Tyutyaev E.V. et al. Diagnosing сonformational and functional characteristics of prestigious maize inbred lines grain using infrared spectra // Selekcija i semenarstvo. 2014. V. 20. P. 13–33. (In Russian)]
Раденович Ч., Филипович М., Бабич М., Анджелкович В. и др. Селекционные и физико-химические характеристики у инбредных линий и высокопродуктивных гибридов кукурузы с эффективными фотосинтетическими функциями // Сельскохоз. биол. 2013. № 1. С. 78–86. [Radenović Č., Filipović M., Babić M., Anđelković V., et al. Breeding, physical and chemical features of maize inbred lines and hybrids with significant breedingtraits and efficient photosynthetic functions // Agricultural Biol. 2013. № 1. P. 78–86. (In Russian)]
Akhalaya M.Ya., Goncharenko E.N., Baizhumanov A.A. Effect of ultraviolet B irradiation on immobilization stress-induced changes in the protective systems of C57Bl/6 mice // Bull. Experim. Biol. Med. 2006. V. 141. № 2. P. 219–222.
Лебедев В.М., Максимов Г.В., Максимов Е.Г. и др. Использование 120-м циклотрона для исследования одновременного воздействия ионизирующего излучения и гипомагнитных условий на простейшие биологические объекты // Изв. РАН. Сер. физ. 2014. Т. 78. № 7. С. 842–845. [Lebedev V.M., Maksimov G.V., Maksimov E.G. et al. Ispolzovanie 120-m ciclotrona dlya issledovaniya odnovremennogo vozdeystviya ioniziruyushego izlucheniya I gipomagnitnyh polyey na prosteyshie biologicheskie obekty // Bull. Rus. Acad. Sci. The series is physical. 2014. V. 78. № 7. P. 842–845. (In Russian)]
Дубров А.П. Действие ультрафиолетовой радиации на растения. М.: АН СССР, 1963. 124 с. [Dubrov A.P. The effect of ultraviolet radiation on plants. M.: АN USSR, 1963. 124 p. (In Russian)]
Klementiev K.E., Maksimov E.G., Gvozdev D.A. et al. Radioprotective role of cyanobacterial phycobilisomes // Biochim. Biophys. Acta. Bioenergetics. 2019. V. 1860. № 2. P. 121–128.
Hashimoto H., Koyama Y. The 21A-g state of a carotenoid bound to spinach chloroplast as revealed by picosecond transient Raman spectroscopy // Biochim. Biophys. Acta. Bioenergetics. 1990. V. 1017. № 2. P. 181–186.
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология


