Радиационная биология. Радиоэкология, 2020, T. 60, № 4, стр. 378-395
ПРЕПАРАТ Б-190 (ИНДРАЛИН) В СВЕТЕ ИСТОРИИ ФОРМИРОВАНИЯ ПРЕДСТАВЛЕНИЙ О МЕХАНИЗМЕ ДЕЙСТВИЯ РАДИОПРОТЕКТОРОВ
1 Научно-исследовательский испытательный центр (авиационно-космической медицины и военной эргономики) ЦНИИ ВВС МО РФ
Москва, Россия
2 Российская медицинская академия непрерывного профессионального образования Минздрава РФ
Москва, Россия
* E-mail: mikhail-v-vasin@yandex.ru
Поступила в редакцию 18.09.2019
После доработки 20.11.2019
Принята к публикации 20.11.2019
Аннотация
Представлена история открытия радиопротекторов из группы аминотиолов и биогенных аминов и формирования представления о механизме их действия. Проведен анализ достижений отечественных ученых, радиационных фармакологов и химиков. Отмечена роль Института авиационной и космической медицины, Института биофизики Минздрава и Московского химико-технологического института им. Д.И. Менделеева в синтезе и разработке радиопротектора экстренного действия препарата Б-190 (индралина). Представлен механизм фармакологического, противолучевого и радиомитигирующего действия индралина, его преимущества перед известными радиопротекторами. Обсуждается критическая роль тканевой гипоксии за счет повышения потребления кислорода на фоне циркуляторной гипоксии под действием радиопротектора α1-адреномиметика индралина в реализации противолучевых его свойств на крупных животных (собаках и обезьянах). В основе радиомитигирующего действия индралина выделяется роль стимуляции 5Н2-серотониновых рецепторов.
В настоящее время к противолучевым лекарственным средствам, применяемым как средства защиты от поражающего действия ионизирующего излучения в отечественной и мировой медицинской практике, относятся радиопротектор препарат Б-190 (индралин), амифостин (WR-2721), средства, препятствующие инкорпорации в организм радиоизотопов йода, цезия, стронция, плутония, урана и полония, соответственно стабильный йодид калия, ферроцин, пентацин, средства ранней терапии (радиомитигаторы) беталейкин и дезоксинат, средства биологической защиты при низкоинтенсивном излучении (радиомодуляторы) рибоксин и аминотетравит, средство патогенетической терапии острой лучевой болезни нейпомакс (филграстим) и средство профилактики и купирования первичной лучевой реакции противорвотный препарат латран (ондансетрон) [1–5]. Ранее применявшиеся противолучевые средства цистамин и мексамин, уступающие по ряду характеристик современным радиопротекторам, прежде всего, по переносимости и противолучевым свойствам, находят новое медицинское применение. Цистамин изучается как средство лечения нейродегенеративных заболеваний из-за его свойств блокировать трансглутаминазу [6, 7]. Кроме того, он рассматривается как пищевая добавка в животноводстве для увеличения прибавки массы тела [8]. Мексамин клинически испытан как стимулятор кроветворения в практике химиотерапии онкологических больных [9].
Отечественный радиопротектор экстренного действия препарат Б-190 (индралин) является лекарственным средством для профилактического применения за короткий срок до возможного воздействия больших доз ионизирующего излучения, вызывающих развитие острой лучевой болезни и местных лучевых поражений, для зашиты персонала при радиационных катастрофах. Препарат применяется персоналом внутрь при разжевывании трех таблеток в дозе 0.45 г перед началом работ в опасных зонах радиоактивного загрязнения. Продолжительность действия радиопротектора до 1 ч, при необходимости возможен повторный прием препарата через 1 ч [3, 10].
История открытия и современные представления о механизме действия противолучевых средств представлены в ряде обзоров последних лет [11–15]. В настоящем обзоре внимание сосредоточено на истории открытия и трактовке механизма противолучевого эффекта отечественного радиопротектора экстренного действия индралина в свете современных представлений о реализации действия противолучевых средств.
ИСТОРИЯ ОТКРЫТИЯ РАДИОПРОТЕКТОРОВ И ФОРМИРОВАНИЯ ПРЕДСТАВЛЕНИЙ О МЕХАНИЗМЕ ИХ ДЕЙСТВИЯ
Современные знания о механизме противолучевого действия радиопротекторов складывались исторически как накопление гипотетических представлений по весьма важным научным фактам, имеющим отношение к действию данных соединений на различных уровнях реализации радиобиологического эффекта. Однако ни одна из гипотез радиозащитного действия фармакологических соединений не позволяет подойти, к сожалению, к единому теоретическому обобщению всей проблемы механизма действия радиопротекторов. Сложность данной проблемы связана с возможностью одновременной реализации нескольких механизмов противолучевого действия. Тем не менее с научно-практической точки зрения важно то, что уровень современных теоретических разработок позволяет достаточно корректно подойти к оценке роли отдельных возможных звеньев, последовательности этапов в реализации противолучевых свойств различных групп радиозащитных соединений.
Известие о наличии противолучевых свойств у биогенных аминов появилось в начале 50-х годов прошлого века практически одновременно с обнаружением тех же свойств у природных серосодержащих соединений (цистеин, глутатион) [16, 17] и открытием радиопротектора из ряда аминотиолов цистамина [18, 19]. Джон Грей в 1952 г. в опытах на крысах впервые выявил высокий противолучевой эффект у серотонина, сопоставимый с действием радиопротектора цистамина [20]. Зенон Бак это подтвердил в опытах на мышах в 1954 г. [19]. 10 лет спустя П.Г. Жеребченко и соавт. впервые те же свойства выявили у производного серотонина радиопротектора мексамина [21, 22]. Знаменательно, что в те же 50-е годы был выявлен небольшой противолучевой эффект у фармакологических соединений, вызывающих при определенных дозах гипоксическое состояние организма: у цианида, п-аминопропиофенона, морфина, этилового спирта и нитрита натрия [3], а также у таких биогенных аминов, как гистамин и адреналин [19, 23].
История открытия противолучевых соединений была тесно связана с достижениями радиационной химии своего времени и явилась следствием обнаружения двух важных фактов: это радиобиологический феномен “кислородный эффект”, когда наличие в среде кислорода вызывает усиление радиационного поражения биообъектов [24, 25], а присутствие в среде низкомолекулярных серосодержащих соединений со свободной тиольной группой (цистеин, глутатион), наоборот, его снижает [26].
Прямые доказательства образования гидроксильного радикала при действии ионизирующего излучения на воду были получены J. Weiss в 1944 г. [27], а в 1947 г. D. Lea [28] дал первое объяснение механизма образования радикалов из ионов при их рекомбинации в процессе радиолиза. По гипотезе Z. Bacq и P. Alexander [29], серосодержащие противолучевые препараты могут вступать в конкурентные отношения с продуктами радиолиза воды, перехватывая их и таким образом предотвращая повреждающее действие перекисных соединений на макромолекулы клеток. Ими впервые было высказано предположение о возможности участия радиопротекторов в химических процессах восстановления радикалов макромолекул путем донорства водорода тиольной группы молекулы препарата [30].
Значение низкомолекулярных тиолов для реализации “кислородного эффекта” впервые было показано в опытах in vitro на ДНК и ферментах, а также на бактериофаге [31, 32]. Способность тиолов вызывать химическую репарацию радикалов типа R• путем донорства водорода из SH-группы могла обеспечивать участие серосодержащих соединений в конкурентном процессе между фиксацией потенциальных лучевых повреждений кислородом с образованием перекисей вида ROO• и их коррекции восстановительными эквивалентами клетки. Образование скрытых потенциальных повреждений макромолекул после облучения ранее было обосновано Л.Х. Эйдусом [33].
Однако взаимодействие аминотиолов с молекулой ДНК может носить более специфический характер, чем простая адсорбция на макромолекуле. Впервые возможность образования химического комплекса между цистамином и ДНК с помощью диаминовой связи показал Jellum [34]. По его данным, данный комплекс обладал большей термостабильностью, чем незащищенные молекулы ДНК. Рассматривалась гипотеза [34, 35] о роли стабилизации непокрытых гистонами участков спиралей ДНК с помощью радиопротекторов через диаминовую связь в повышении ее устойчивости к пострадиационной деградации и проявлении таким путем противолучевой эффективности цистамина.
У адреналина и норадреналина противолучевой эффект в первых исследованиях составил 10–40% [3]. В дальнейшем с учетом весьма кратковременного фармакологического эффекта катехоламинов при большой мощности дозы облучения и соответственно при сокращении времени воздействия радиации до нескольких минут у данных биогенных аминов была также выявлена высокая противолучевая эффективность [36–39].
Радиозащитное действие биогенных аминов с самого начала связывали с гипоксией из-за их высокой вазоактивности. В 1959 г. C. Van der Meer и соавт. зарегистрировали гипоксический эффект биогенных аминов в кроветворной ткани полярографическим методом [36]. Выявлена тесная зависимость между проявлением противолучевых свойств серотонина, мексамина и других их производных от выраженности нарушения кровотока и развития гипоксии в кроветворных тканях [36, 40–45]. Ранее было установлено, что гипоксическая гипоксия, вызываемая снижением содержания кислорода во вдыхаемом воздухе более чем в 2 раза, уже оказывает радиозащитное действие [46, 47]. В работах H. van den Brenk и соавт. [48, 49] впервые была показана возможность под действием повышенного давления кислорода устранять или существенного ослаблять противолучевой эффект адреналина, гистамина, серотонина и аминотиолов. Кроме того, обнаружено, что фармакологические антагонисты биогенных аминов, блокируя их фармакологическое действие на кровеносные сосуды, способны устранять противолучевые свойства биогенных аминов [50, 51].
В последующие годы изыскание новых радиопротекторов из различных классов химических соединений велось весьма интенсивно как у нас в стране, так и за рубежом. Первичному отбору, или скринингу радиозащитных средств за это время подверглись десятки тысяч соединений как природного, так и синтетического происхождения, принадлежащих к различным химическим классам. Со временем накопленный массив экспериментальных данных позволил систематизировать полученные сведения, выделить основные классы химических соединений и проследить зависимость между химической структурой и радио-защитными свойствами внутри отдельных классов серосодержащих соединений, индолил- и арилалкиламинов.
Наряду с этим широко изучались механизмы реализации радиозащитного действия эффективных радиопротекторов на молекулярном, клеточном и организменном уровнях. Противолучевые свойства радиопротекторов наиболее изучены и находят свое полное проявление при остром воздействии ионизирующего излучения в дозах, вызывающих развитие костномозгового синдрома острой лучевой болезни. Прямые данные об эффективности радиопротекторов на кроветворной ткани были получены по изменению уровня хромосомных аберраций в миелокариоцитах [52] и по тесту экзогенных КОЕс. [53, 54].
В дальнейшем прошли первые испытания наиболее активных радиопротекторов (цистамина, цистеамина, АЭТ, серотонина и мексамина) на крупных животных (cобаках и обезьянах) [55–62]. Они показали, что эти соединения обладают противолучевыми свойствами на крупных животных, однако выявленная активность препаратов была более скромной по сравнению с результатами, наблюдаемыми на мелких лабораторных животных и, как правило, не превышала 50% для серoсодержащих соединений и 20–30% при испытании серотонина и мексамина.
В 1970-е годы поиск новых эффективных радиопротекторов завершился открытием наиболее активных к настоящему времени противолучевых соединений, которые в опытах на крупных животных (собаки, обезьяны) обладали 100%-ным радиозащитным действием при облучении в дозах, близких к ЛД100. Это относится, прежде всего, к препаратам амифостин (WR-2721) и индралин (препарат Б-190).
Препарат WR-2721 был разработан в Научно-исследовательском институте им. Уолтера Рида (Walter Reed Army Institute of Research, Washington, США) и представляет собой 3-аминопропил-2-аминоэтилтиофосфат (ethyol, amiphostin, гаммафос) [63–65]. Фармакологическая оценка его противолучевых свойств наиболее полно была дана J. Yuhas [66–69]. В настоящее время амифостин проходит клинические испытания как средство защиты здоровых тканей при радиохимиотерапии онкологических больных [70, 71].
Индралин был впервые синтезирован проф. Н.Н. Суворовым с возглавляемым им коллективом химиков Московского химико-технологического института им. Д.И. Менделеева (МХТИ им. Д.И. Менделеева). Его высокие противолучевые свойства, в том числе на крупных животных (собаках), впервые выявлены в Государственном научно-исследовательском испытательном институте авиационной и космической медицины МО СССР [38] и подвержены широкомасштабным исследованиям с участием Института биофизики Минздрава СССР [2].
Как непосредственный участник данных событий, могу отметить, что препарат индралин, помеченный первоначально мною как препарат П-9, был одним из более 300 вновь синтезированных проф. Н.Н. Суворовым и сотр. на кафедре органической химии МХТИ им. Д.И. Менделеева производных биогенных аминов, проходивших скрининг на радиозащитную активность в Институте авиационной и космической медицины МО СССР (72). В коллективе отдела Института, возглавляемом проф. В.В. Антиповым, была благоприятная атмосфера для реализации любых творческих начинаний. Мною оценивалась связь между изменением химической структуры и фармакологической и противолучевой активностью данных соединений [43–45, 73–83]. Было установлено, что адреналин, норадреналин и серотонин при краткосрочном облучении (в течение нескольких минут) обладают выраженными противолучевыми свойствами, сопоставимыми с радиозащитным эффектом наиболее активных аминотиолов, но обладают значительно большей широтой терапевтического действия [3]. Все изученные химические модификации биогенных аминов в ряде случаев при сохранении высокой их активности не увеличивали, а как правило, снижали терапевтический индекс исходных соединений [45]. Тем не менее это позволяло существенно увеличивать продолжительность действия препарата до 1–2 ч [78], что имеет большое практическое значение.
Мое внимание привлек препарат П-9 из-за его способности вызывать адренергическую реакцию у животных, отмеченной в виде пилоэрекции, которая характерна для α1-адреномиметиков. В дальнейшем Н.Н. Суворов предложил назвать его индралином. При первой возможности мной было проведено испытание данного препарата в опытах на собаках, причем на животных, выживших после облучения в смертельной дозе 4 Гр при экранировании области живота. Через 2 мес. после облучения они были подвергнуты вновь γ-облучению (60Со) в дозе 4 Гр при профилактическом внутрибрюшинном введении индралина в дозах 20–40 мг/кг, близких к дозам, ранее применявшимся с мексамином в опытах на крупных животных. Результаты были неожиданными: все подопытные животные с индралином выжили при 100%-ной смертности животных из контрольной группы облучения. Эти результаты я доложил моему руководителю проф. В.В. Антипову и проф. Н.Н. Суворову, возглавлявшему проект по разработке новых потенциально эффективных радиопротекторов из ряда производных биогенных аминов. Николай Николаевич в тот же день связался с директором Института биофизики Минздрава СССР академиком Л.А. Ильиным, чтобы сообщить о данном открытии, о чем Леонид Андреевич вспоминает в своей книге “Мифы и реалии Чернобыля” [84].
В дальнейшем в опытах на 50 собаках был подтвержден 100%-ный противолучевой эффект индралина в сравнительных исследованиях с мексамином и цистамином, радиозащитное действие которых не превышало 30–60% по выживаемости животных после γ-облучения в абсолютно смертельной дозе 4 Гр [85]. Высокий радиозащитный эффект индралина в дальнейшем был подтвержден в опытах на обезьянах Макака-резус, подвергнутых воздействию γ-облучения от источника 60Со в абсолютно смертельной дозе [86]. Первая серия исследований на обезьянах состоялась по инициативе проф. Н.Н. Суворова, который связался с проф. Б.А. Лапиным, директором Института экспериментальной патологии и терапии АМН СССР (г. Сухуми), с просьбой выделить для исследования обезьян и содействовать проведению на них изучения противолучевых свойств индралина. При его согласии я выехал в командировку в г. Сухуми на 2 мес., где были проведены исследования индралина с сотрудниками лаборатории, возглавляемой проф. Л.Ф. Семеновым, который оказал большую помощь в работе с обезьянами.
Полученные результаты послужили основанием для дальнейших широкомасштабных исследований индралина при различных способах применения (внутривенный, внутримышечный, подкожный и пероральный пути введения) не только при γ-облучении, но и при γ-нейтронном и протонном (высоких энергий) облучении в совместных исследованиях Института авиационной и космической медицины МО СССР и Института биофизики Минздрава СССР при участии Института медико-биологических проблем (в те годы МЗ СССР). Разработанная лекарственная форма индралина для применения внутрь для человека в виде таблеток по 0.15 г получила название препарат Б-190 [2].
МЕХАНИЗМ ФАРМАКОЛОГИЧЕСКОГО ДЕЙСТВИЯ ИНДРАЛИНА
Индралин в опытах на крысах, кошках, кроликах и собаках повышает артериальное давление [2, 86, 87]; α-адреноблокаторы тропафен и фентоламин полностью снимают гипертензивную реакцию индралина. Вазопресcорное действие препарата сохранялось при предварительном применении резерпина, т.е. препарат обладает прямым адренергическим эффектом. При повторном применении индралина выраженность гипертензивной реакции сохраняется. В отличие от адреналина, когда после его гипертензивной фазы действия может быть гипотензивная реакция, при применении индралина подобного эффекта не отмечается [87].
На функцию сердца препарат не оказывает существенного влияния. Отмечаемая при применении индралина брадикардия является рефлекторной реакцией на гипертензию под действием α1-адреномиметика (рис. 1) [88]. На магистральных артериальных сосудах по данным ангиографии в опытах на собаках индралин вызывал небольшое сокращение ряда сосудов конечностей (в пределах 9–11%) и оказывал слабое влияние на диаметр брыжеечной и селезеночной артерий (до 8–9%) при отсутствии влияния на печеночную и почечную артерии, несопоставимое с выраженным сокращением (на 20–40%) крупных артериальных сосудов под действием производного серотонина мексамина в той же дозе 10 мг/кг (табл. 1) [89, 90]. Тем не менее отмечено резкое снижение скорости прохождения контрастной массы через сосуды конечностей и внутренних органов брюшной полости под действием индралина за счет резкого сокращения прекапилляров [89]. Как α-адреномиметик индралин вызывает подобно адреналину сокращение гладких мышц селезенки, резко сокращая в ней кровоток [89] (табл. 2), не влияя на гладкую мускулатуру бронхов [87]. Помимо всего прочего, индралин обладает серотонинергическим действием, сокращая мышцы рога матки крысы, которое устраняется блокатором D-серотониновых рецепторов LSD [87].
Рис. 1.
Влияние препарата Б-190 (0.45 г) при пероральном применении натощак на диастолическое артериальное давление (АД) и частоту сердечных сокращений (ЧСС) у человека [2].
Fig. 1. Effect of Б-190 (0.45 g) in fasting oral administration on diastolic blood pressure (AD) and heart rate (HR) in humans [2].
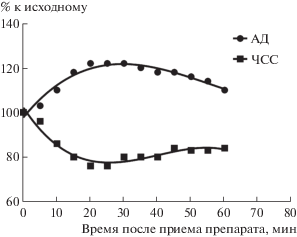
Таблица 1.
Влияние индралина и мексамина на диаметр артериальных сосудов собак через 5–7 мин после их внутримышечного введения в дозе 10 мг/кг (изменения в % к исходному уровню) [89, 90] Table 1. Effect of indralin and mexamine on dog arterial vessel diameter 5–7 min after their intramuscular administration at a dose of 10 mg/kg (% to baseline) [89, 90]
| Сосуды | Индралин | Мексамин |
|---|---|---|
| Бедренная артерия | –1.6 | –18* |
| Краниальная бедренная артерия | –4.7 | –28* |
| Окружная латеральная бедренная артерия | +1.7 | –25* |
| Проксимальная артерия | –11.5 | –40* |
| Средняя артерия | –8.6 | –32* |
| Дистальная артерия | –2.7 | –25* |
| Сафена | –15 | –21* |
| Внутренняя подвздошная артерия | –1.0 | –20* |
| Средняя крестцовая артерия | –1.7 | –17* |
| Хвостовая непарная артерия | –13 | –20* |
| Межреберные артерии | –2.0 | –1.0 |
| Краниальная брыжеечная артерия | –9 | –30* |
| Селезеночная артерия | –7.7 | –32* |
| Печеночная артерия | +0.1 | –32* |
Таблица 2.
Влияние индралина и мексамина в дозе 10 мг/кг в/м на изменение кровотока в селезенке и костном мозге собак (% к группе биологического контроля) [89] Table 2. Effect of indralin and mexamine at a dose of 10 mg/kg on blood flow change in spleen and bone marrow of dogs (% to biological control group) [89]
| Группы | n | Селезенка | Костный мозг |
|---|---|---|---|
| Индралин | 6 | 18.3* | 57.8* |
| Мексамин | 18 | 26.3* | 49.1* |
Фармакодинамика индралина предопределяется его фармакокинетикой, она во многом сходна с фармакодинамикой биогенных аминов, в частности, производного серотонина мексамина. После внутримышечного введения максимальное содержание препарата в крови и тканях устанавливается через 5–10 мин и поддерживается на данном уровне в течение 30 мин; в дальнейшем отмечается быстрое снижение концентрации препарата в крови, через 1 ч его содержание уменьшается в 2 раза. В кроветворных тканях (костный мозг, селезенка) на оптимальный срок противолучевого действия (15–20 мин) содержание препарата в 1.5–2.0 раза превышает его уровень в крови. Прохождение индралина через гематоэнцефалический барьер достаточно ограничено. Препарат практически полностью выводится из организма через почки, в основном в течение 6 ч. В течение 30 мин индралин выводится через почки в основном в неизменном виде, через 6 ч в моче 70–75% активности связано с метаболитами препарата [2].
Препарат Б-190 в дозе 0.45 г у человека вызывает повышение артериального давления, урежение частоты сердечных сокращений и изменение периферического кровотока (рис. 1) [2, 3]. С учетом фармакокинетики препарата при пероральном применении основные фармакологические эффекты имеют продолжительность до 60 мин. При приеме препарата Б-190 внутрь нет нарушения ритма сердца.
Результаты клинических исследований позволяют отнести препарат Б-190 к мощным прессорным средствам вазотонического механизма действия. Первичным действием препарата является α1В-адреномиметический вазопрессорный эффект с ростом периферического сопротивления и ограничением регионального кровотока [2].
Индралин связан с прямым α1-адренергическим эффектом, реализующим действие на клетки через Gαq/11-протеин cцепленные рецепторы [91, 92], через которые осуществляется стимуляция 1Р3-киназы, вызывающей фосфорилирование специфического мембранного фосфоинозитол-4,5-дифосфата до инозитол-1,4,5-трифосфата (1Р3) [93]. Образовавшийся IP3 через фосфолипазу С вызывает высвобождение внутриклеточного Са2+ из сакроплазматического ретикулума клетки с последующей активацией кальций-зависимой протеинкиназы С и реализацией α(В)1-адренергического эффекта [94].
Сокращение гладких мышц сосудов под действием высвобождаемого в цитозоль Са2+ при стимуляции α1(В)-адренорецепторов ограничивается компенсаторным механизмом ограничения входа Са2+ в клетку через открытие Са2+-активируемых К+-каналов под действием нитроксида (NO) [95].
Вазоконстрикция под действием α1(В)-адреномиметиков неизбежно связана с освобождением в сосудах NO, который противодействует чрезмерному их сокращению и тем самым позволяет поддерживать минимально необходимое кровоснабжение ткани. Этот механизм обратной связи заложен природой. Запуск активации эндотелиальной NO-синтазы в этих условиях осуществляется за счет поступления Са2+ в эндотелий через его диффузию из гладких мышц сосудов [96]. При предварительном применении нитратов (монизола) фармакодинамика гипертензивной реакции на индралин сохраняется, но интенсивность реакции резко снижается [88].
Вазодилятация под действием NO может происходить по цГМФ-зависимому или цГМФ-независимому механизму. При реализации эффекта NO через цГМФ-зависимую протеинкиназу происходит фосфорилирование небольшого G-белка RhoA, что приводит к блокаде его активности. Известно, что RhoA через RhoA-киназу вовлекается в сенситизацию гладких мышц сосудов к Са2+ и усиливает вазоконстрикторный эффект α1-агонистов. Таким образом, эндотелиальная NO подавляет RhoA/RhoA-киназа-зависимое сокращение сосудов [97]. Релаксация сосудов под действием NO по цГМФ-независимому механизму связана с активацией K+-каналов [98].
Вазоконстрикторный эффект, реализуемый через α1-адренорецепторы, неизбежно связан с повышением потребления кислорода в ткани [99–101]. Во время гипоксии снижается вазоконстрикторный эффект норадреналина и фенилэфрина [102].
МЕХАНИЗМ ПРОТИВОЛУЧЕВОГО ДЕЙСТВИЯ ИНДРАЛИНА
Высокая степень противолучевой защиты при применении индралина была подтверждена на многих видах животных: мыши, крысы, сирийские хомячки, морские свинки, кролики, собаки и обезьяны [2, 85, 86]. Начало проявления специфического эффекта радиопротектора вызвано его взаимодействием с α1-адренорецепторами клеток и отмечается с первых минут после его парентерального введения. Максимальный противолучевой эффект индралина отмечается через 5–10 мин после его парентерального или через 10–15 мин после перорального введения, т.е. в сроки его наибольшей концентрации в крови и тканях при различных путях его поступления, продолжается 1 ч, после чего начинает снижаться. Применение ингибитора моноаминооксидазы ипразида, затрудняющего метаболизм вещества, увеличивает время действия препарата в 2–3 раза [91]. Дозовая зависимость противолучевого эффекта индралина, как и для биогенных аминов, реализующих свой эффект через специфические рецепторы, удовлетворительно описывается логарифмической функцией.
Установлена тесная связь противолучевой эффективности биогенных аминов с их вазоконстрикторской активностью, которая приводит к региональному нарушению кровоснабжения, в том числе в радиочувствительных тканях. Радиозащитная активность биогенных аминов объясняется частичной нейтрализацией известного радиобиологического феномена “кислородного эффекта” вследствие развития острой гипоксии, прежде всего, в костном мозге и селезенке. При ослаблении гипоксического эффекта биогенных аминов в условиях облучения животных под повышенным давлением кислорода их радиозащитные свойства устранялись [48, 49].
Применение фармакологических антагонистов устраняло противолучевое действие биогенных аминов [50, 51]. По данным В.И. Кулинского, противолучевая эффективность адреналина и норадреналина реализуется через α1-адренорецепторы [103]. Противолучевые свойства индралина также связаны с α1-адренорецепторами [92]. Неселективные α-адренолитики тропафен и аминазин, селективный α1-адреноблокатор празозин снижали или полностью устраняли противолучевое действие индралина (табл. 3) [91, 92]. Применение блокаторов β-адренорецепторов, серотонинергических и М-холинергических рецепторов не влияет на противолучевые свойства индралина. Резерпин и кокаин также не влияли на противолучевой эффект индралина, что свидетельствует о реализации его действия непосредственно через прямое воздействие на α1-адренорецепторы [91]. Кроме того, отсутствие влияния нифедипина (блокатора Са-каналов) на эффект индралина косвенно указывает на чувствительность именно α1В-адренорецепторов к радиопротектору [97]. Подавление противолучевых свойств индралина под действием блокатора фосфодиэстеразы теофиллина обусловлено противодействием вазоконстрикторному эффекту радиопротектора NO-зависимой и NO-независимой вазодилятацией за счет экспрессии блокатором NOS белков, стимуляции NO/сGMP и AC/cAMP путей и открытия K+-каналов [93, 104].
Таблица 3.
Фармакологический анализ противолучевых свойств индралина [91, 92] Table 3. Pharmacological analysis of radioprotective properties of indralin [91, 92]
| Группа | Доза, мг/кг | Время введения до облучения, мин | n | Выживаемость, % |
|---|---|---|---|---|
| Белые беспородные мыши | ||||
| Контроль на облучение | – | – | 57 | 5.3 |
| Индралин | 100 | 5 | 60 | 78.4 |
| Тропафен + индралин | 10 + 100 | 15 + 5 | 37 | 5.4* |
| Контроль на облучение | – | – | 46 | 0 |
| Индралин | 100 | 5 | 50 | 74.0 |
| Аминазин + индралин | 1 + 100 | 10 + 5 | 20 | 90.0 |
| 2 + 100 | 30 + 5 | 39 | 25.6* | |
| 5 + 100 | 10 + 5 | 18 | 0* | |
| Контроль на облучение | – | – | 29 | 0 |
| Индралин | 100 | 5 | 38 | 65.8 |
| Теофиллин + индралин | 50 + 100 | 20 + 5 | 48 | 14.6* |
| Мыши (CBA×C57Bl/6)F1 | ||||
| Контроль на облучение | – | – | 39 | 2.5 |
| Индралин | 100 | 5 | 29 | 79.3 |
| Тропафен + индралин | 10 + 100 | 25 + 5 | 20 | 25.0* |
| Аминазин + индралин | 2 + 100 | 30 + 5 | 30 | 30.0* |
| Контроль на облучение | – | – | 20 | 5.0 |
| Индралин | 100 | 5 | 20 | 60.0 |
| Празозин + индралин | 6 +100 | 60 + 5 | 20 | 10.0* |
| Крысы белые беспородные | ||||
| Контроль на облучение | – | – | 20 | 0 |
| Индралин | 100 | 5 | 29 | 69.0 |
| Тропафен + индралин | 10 + 100 | 15 + 5 | 30 | 30.0* |
| Индралин + тропафен | 100 + 10 | 5 + после облучения | 30 | 86.7 |
| Собаки беспородные | ||||
| Контроль на облучение | – | – | 11 | 0 |
| Индралин | 10 | 5 | 7 | 100.0 |
| Тропафен + индралин | 2 + 10 | 20 + 5 | 5 | 0* |
| Спленоэктомия + индралин | 10 | 5 | 7 | 71.4 |
Между проявлением противолучевых свойств индралина и его фармакологическим вазоконстрикторным эффектом, регистрируемым по гипертензивной реакции, снижением напряжения кислорода в подкожной клетчатке и костном мозге существует коррелятивная связь [2]. Циркуляторная гипоксия в радиочувствительных тканях при росте периферического сопротивления сосудов во время гипертензивной реакции на индралин вносит определенный вклад в механизм реализации противолучевых свойств радиопротектора.
Важно подчеркнуть, что индралин оказывает противолучевое действие при сверхсмертельных дозах облучения. Потенциальные возможности препарата Б-190 по радиозащитной эффективности на крупных животных достигают теоретически возможного предела по показателю ФУД, равного 2–2.5. (табл. 4) [2]. Такого результата пока по настоящее время никто не смог достигнуть в мире в исследованиях на крупных животных. Возникает наиболее важный вопрос, который требует своего решения: почему существует принципиальное различие в реализации эффекта индралина на крупных животных (собаках и обезьянах), сопровождающегося высокими недостижимыми для серотонина и его производных противолучевыми свойствами, связанными с гипоксическим действием радиопротекторов [2]. Для меня стало ясно, что равные с эффектами мексамина циркуляторные нарушения кровоснабжения радиочувствительных органов под действием индралина (табл. 2), ведущие к развитию в них гипоксии, не являются определяющими в реализации его действия [89]. Наблюдаемый уровень гипоксии в костном мозге и подкожной клетчатке собак (снижение рО2 на 50%) после применения радиопротектора не может в полной мере обеспечить отмечаемый 90–100%-ный эффект препарата, что видно на примере мексамина, обладающего слабыми противолучевыми свойствами при тех гемодинамических сдвигах в кровоснабжении костного мозга [89]. Удаление селезенки у собак, где кровоток снижался под действием индралина в 5 раз, существенно не влияло на его противолучевой эффект (табл. 2 и 3) [89]. Поскольку противолучевой эффект индралина так или иначе связан с гипоксическим эффектом препарата, устраняемого в условиях гипероксии [89], нами было высказано предположение, что его действие объясняется во многом развитием тканевой гипоксии за счет активации тканевого дыхания через α1-адренорецепторы [38, 89, 105, 106]. Подобную точку зрения ранее высказывал В.И. Кулинский в отношении реализации противолучевого действия норадреналина [107].
Таблица 4.
Противолучевая эффективность индралина в опытах на собаках при сверхсмертельных дозах γ-облучения [2] Table 4. Radioprotective effectiveness of indralin in dog experiments at superlethal doses of γ-radiation [2]
| Группа | Доза облучения, Гр | Доза, мг/кг | n | Выжива-емость % |
|---|---|---|---|---|
| Контроль | 4.0 | – | 10 | 0 |
| Индралин | 4.0 | 10 | 62 | 90.3 |
| 6.0 | 10 | 10 | 60.0 | |
| 6.0 | 30 | 10 | 100.0 | |
| 7.0 | 30 | 10 | 100.0 | |
| 8.0 | 30 | 20 | 55.0 |
Впервые стимуляцию дыхания митохондрий под действием Са2+ выявил Сhаnсе [108]. Образовавшийся при стимуляции α1(В)-адренорецептора инозитол-1,4,5-трифосфат (1Р3) вызывает через 1Р3-рецепторы высвобождение внутриклеточного Са2+ из эндоплазматического ретикулума (ЭР) клетки в микродоминантах на специфических контактах ЭР с митохондриями. Высокие концентрации Са2+ на контактах ЭР с митохондриями позволяют реализовать быстрое поглощение Са2+ митохондриями через низкоаффинный митохондриальный унипортер с последующим подъемом концентрации Са2+ в матриксе митохондрий. Рост содержания Са2+ в митохондриях стимулирует их метаболизм и усиливает потребление кислорода тканями [109].
Существует принципиальное различие по механизму вазоконстрикторного эффекта между серотонином и норадреналином. Для норадреналина сокращение гладких мышц сосудистого русла требует повышенного потребления кислорода, в то время как для серотонина этого не требуется [92]. α-Адреномиметики способны повышать потребление кислорода в тканях (например, в мышцах, печени и почках) [99, 100, 110, 111]. Нами установлено, что индралин при снижении напряжения кислорода в костном мозге в условиях гипоксии ниже 10 мкмоль/л может увеличить повышение его потребления в 1.5 раза [112]. Характер влияния индралина на потребление кислорода клетками, возможно, связан с реализацией трофической функции адренергической системы, открытой Л.А. Орбели. Повышение потребления кислорода в костном мозге на фоне циркуляторной гипоксии под действием индралина при выраженной гетерогенности его кровоснабжения может в определенной популяции клеток создать условия, близкие к аноксии с резким повышением их радиорезистентности, что в дальнейшем обеспечивает пострадиационную репопуляцию кроветворной ткани. Известно, что интенсификация потребления кислорода за счет расщепления окислительного фосфорилирования под действием 2,4-динитрофенола без проявления циркуляторной гипоксии способна обеспечить 100%-ную выживаемость мышей при смертельной дозе облучения [113, 114].
Здесь возникает вопрос, который обескуражил исследователей по испытанию мексамина в опытах на собаках и обезьянах – почему данный радиопротектор, имея высокие противолучевые свойства на мелких лабораторных животных, обладает существенно меньшей эффективностью при защите крупных животных от действия радиации [114–116].
Проведенное нами сравнительное исследование по противолучевым свойствам гипоксической гипоксии в опытах на мышах, крысах и собаках позволило установить, что снижение эффективности гипоксии в данном ряду от мышей к собакам связано со снижением интенсивности потребления кислорода при увеличении массы животного, связанного со снижением отношения площади поверхности животного как главного источника теплоотдачи организма в окружающую среду к его массе [117, 118]. Исходный уровень потребления кислорода животным и человеком предопределяет степень развития тканевой гипоксии при проявлении в организме гипоксической или циркуляторной гипоксии. Более низкий исходный уровень потребления кислорода, например, при гипотермии, предоставляет большие возможности для адаптивных процессов в клетке к воздействию острой гипоксии [119]. Этим объясняется снижение противолучевых свойств гипоксической гипоксии и мексамина на крупных животных и потенциально низкая их эффективность как средств защиты у человека [89, 116, 120]. α-Адреномиметики могут нарушить отмеченный выше адаптационный процесс, интенсифицируя тканевое дыхание в условиях гипоксии. По этой причине возможно достижение острой тканевой гипоксии под действием индралина в радиочувствительных тканях до радиобиологически значимых значений.
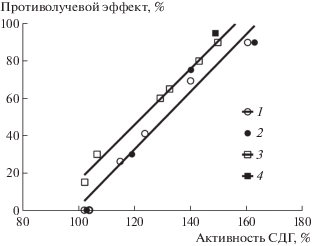
Существует четкая взаимосвязь между уровнем воздействия острой гипоксии и выраженностью стресс-адренергической реакции в виде активации тканевого дыхания, регистрируемой по одному из ферментов цикла Кребса СДГ. Выброс катехоламинов при стресс-реакции вносит определенный вклад в повышение радиорезистентности организма, в том числе при применении радиопротекторов [121]. Реакция со стороны СДГ лимфоцитов крови может служить индикатором переносимости острой гипоксии и в то же время обусловленной ею противолучевых свойств у радиопротекторов (рис. 2) [105, 118, 122, 123]. Обнаруженная реакция СДГ лимфоцитов крови у человека на прием индралина в рекомендуемой дозе предполагает вероятность проявления у него оптимального радиозащитного эффекта [105].
Рис. 2.
Взаимосвязь между активацией СДГ лимфоцитов крови под действием радиопротекторов и проявлением их противолучевых свойств при различных дозах препаратов [99]: 1 – индралин (мыши). 2 – индралин (собаки). 3 – цистамин (мыши). 4 – мексамин (мыши).
Fig. 2. Relationship between activation of blood lymphocyte succinate dehydrogenase by radioprotectors and their radioprotective properties at different doses of preparations [99]: 1 – indralin (mice). 2 – indralin (dogs). 3 – cystamine (mice). 4 – mexamine (mice).
В процессе реоксигенации при завершении гипоксии происходит генерация активных форм кислорода, которые способствуют радиационному поражению и замедляют ранние пострадиационные репаративные процессы. Эти побочные последствия имеют место и при фармакологической гипоксии, индуцированной индралином. Сочетанное применение индралина до облучения и нитратов (монизола) после облучения, которые химически нейтрализуют активные формы кислорода с образованием нитропероксида, способствует стабилизации противолучевого действия радиопротектора [124, 125]. Подобный эффект наблюдали при сочетанном применении серотонина до облучения и нитропрусcида после облучения [126].
МЕХАНИЗМ ТЕРАПЕВТИЧЕСКОГО (РАДИОМИТИГИРУЮЩЕГО) ДЕЙСТВИЯ ИНДРАЛИНА
Известно, что серотонин и его производные, а также аминотиолы (цистамин и АЭТ) способны снижать смертность животных от смертельных доз радиации при их применении в течение часа после облучения и усиливать пролиферацию стволовых кроветворных клеток в облученном костном мозге и селезенке [127–129]. В исследованиях, проведенных Г.А. Черновым, было впервые показано на примере индралина, что радиомитигирующий эффект радиопротектора имеет место и в опытах на крупных животных (собаках) [2]. При применении индралина после облучения терапевтическое действие радиопротектора возрастало до 50% при последующей антибиотикотерапии на модели острой лучевой болезни в опытах на собаках [130]. Подобным же действием в сходных условиях в опытах на собаках обладает беталейкин (человеческий рекомбинантный ИЛ-1) – средство экстренной терапии [131].
Г.А. Черновым было установлено в опытах на мышах по тесту эндогенных колоний, что данный эффект индралина не устраняется α-адреноблокатором тропафеном [2]. Нами было подтвержден радиомитигирующий эффект индралина [132], в том числе при сверхсмертельных дозах радиации в условиях применения средств локальной защиты в области живота [133]. Данный эффект не изменялся под действием селективного α1-адреноблокатора, но устранялся 5НТ2А-серотониновым блокатором [134]. Ранее установлено, что в опытах in vitro норадреналин обладает противолучевым действием только при применении его до облучения. В тех же условиях серотонин был активен как до, так и после облучения [135]. Пока нет прямых данных о связи терапевтического действия индралина с его возможной серотонинергической активностью на системе кроветворения. Возможно также, что индралин опосредованно высвобождает серотонин из тканей, в том числе из костного мозга. По такому механизму реализуется радиомитигируюший эффект цистамина [136]. Терапевтический эффект индралина устраняется монизолом, являющимся источником нитроксида, при отсутствии влияния на его противолучевые свойства [124]. Причиной данного эффекта монизола может быть способность нитратов переводить серотонин в неактивную форму [136].
Известно, что серотонин стимулирует пролиферацию гемопоэтических стволовых клеток [137–141], в том числе через активацию мезенхимального окружения в нише костного мозга [141, 142]. Действие серотонина на гемопоэз в основном осуществляется чрез 5НТ2A-серотониновые рецепторы, принадлежащие к семейству Gαq-протеин сцепленных рецепторов [137, 143].
Норадреналин вызывает ускорение дифференциации гемопоэтических стволовых клеток, при этом блокируя их пролиферацию [131, 144]. α1(B)-адреноагонисты, к которым относятся норадреналин и индралин, повышают в клетках активность экстраклеточной сигнальной киназы (ERK 1/2) и связанный с ней синтез белков и р38 киназу, которая блокирует синтез ДНК, что способствует дифференцировке клеток [145]. Стимуляция дифференциации гемопоэтических стволовых клеток под действием α1-адреноагонистов подавляется сиртуинами, которые по механизму обратной связи активируются данными соединениями. Получены экспериментальные данные о стимуляции α1-адреномиметиком фенилэфрином экспрессии сиртуина 1 при его подавлении под действием радиации в облученных слюнных железах [146]. Возможно, что механизм данного эффекта α1-адреномиметиков связан с повышенной продукцией АФК, которые способны стимулировать экспрессию сиртуина 1 после облучения с активацией антиоксидантной системы через ядерный фактор Nrf2 и FOXO3 и ранних пострадиационных репаративных процессов в радиочувствительных тканях [147]. Растительные полифенолы (кверцетин), являющиеся стимуляторами сиртуинов, при сочетанном применении с индралином способствуют усилению его терапевтического противолучевого действия [148, 149].
Практический интерес представляют данные по противолучевой эффективности препарата Б-190 при неравномерном облучении. В условиях экранирования отдельных участков костного мозга животных возможно наблюдать усиление миграции его стволовых клеток, что способствует более быстрым пострадиационным репаративным процессам в кроветворной системе [150]. При экранировании области живота существенно (на 50%) возрастают противолучевые свойства индралина как cредства экстренной терапии при его применении в ближайший час после облучения (табл. 5) [134].
Таблица 5.
Противолучевые свойства индралина при применении после облучения в условиях частичного экранирования области живота крыс [132] Table 5. Radioprotective properties of indralin when applied after irradiation under conditions of partial shielding of rat abdomen [132]
| Группа | Способ и срок введения | Доза, мг/кг | n | Выживаемость, % | СПЖ, сут |
|---|---|---|---|---|---|
| Контроль на облучение | – | – | 34 | 2.9 | 8.5 ± 0.7 |
| Индралин | внутрибрюшинно через 10 мин после облучения | 100.0 | 10 | 10.0 | 5.7 ± 0.9 |
| Экранирование живота (Э) | – | – | 32 | 31.3* | 11.9 ± 1.0** |
| Э + индралин | внутрибрюшинно через 10 мин после облучения | 100.0 | 24 | 87.5* ‡ | 9.3 ± 0.7 |
В целом можно заключить, что радиомитигирующие свойства индралина, сходные по выраженности с терапевтическим действием беталейкина, вносят определенный вклад в повышение радиорезистентности организма, но не сопоставимы с величиной его уникального радиозащитного эффекта, обнаруженного в экспериментах на крупных животных.
ЗАКЛЮЧЕНИЕ
Открытие З. Баком радиозащитного эффекта у цистамина и Дж. Греем тех же свойств у серотонина в начале 50-х годов прошлого века вызвало в мире всплеск исследований по поиску более активных соединений среди практически всех фармакологических к тому времени известных групп с последующей разработкой противолучевых лекарственных средств амифостина (WR-2721) в США и препарата Б-190 (индралина) в СССР с формированием теоретических представлений о механизме реализации действия радиопротекторов как средства по нейтрализации “кислородного эффекта” – универсального радиобиологического феномена, потенцирующего поражающее действие на живые организмы ионизирующего излучения в больших дозах.
Влияние препарата Б-190 (индралина) на сердечно-сосудистую систему и его высокая противолучевая эффективность связаны с прямым взаимодействием с α1-адренорецепторами с последующим развитием гипертензивной реакции и циркуляторной гипоксии в радиочувствительных тканях на фоне фармакологической активации тканевого дыхания. Следствием этого является формирование в клетках биохимического шока по З. Баку или “восстановительного” стресса по современным представлениям.
Терапевтическое действие индралина как радиомитигатора реализуется в основном через 5Н2-серотониновые рецепторы, активация которых способствует усилению пролиферации и миграции стволовых клеток и клеток-предшественников радиочувствительных тканей с репопуляцией их клеточного состава в процессе пострадиационного восстановления. Препарат Б-190 по своим высоким противолучевым свойствам и широте терапевтического (радиозащитного) действия превосходит известные лекарственные противолучевые препараты.
P.S.
В моей жизни был ряд важных событий, критических рубежей, которые во многом предопределили всю мою судьбу на поприще науки. Первое – это то, что я смог заниматься научной работой практически сразу после окончания Первого Московского медицинского института благодаря безграничной любви и помощи моей матушки. Второе, что судьба меня свела с моим научным руководителем, родоначальником отечественной радиационной фармакологии Павлом Петровичем Саксоновым. Третье, что я встретил в своей жизни большого ученого-химика и обаятельного человека Николая Николаевича Суворова. Он был для меня большим другом, с ним я плодотворно сотрудничал по скринингу вновь синтезируемых производных биогенных аминов, а в дальнейшем при изучении противолучевых свойств индралина.
Список литературы
Ильин Л.А., Ушаков И.Б., Васин М.В. Противолучевые средства в системе радиационной защиты персонала и населения при радиационных авариях // Мед. радиол. радиац. безопасность. 2012 Т. 57. № 3. С. 26–31. [Ilyin L.A., Ushakov I.B., Vasin M.V. Radioprotective agents in radiation protection system of personnel and population in case of radiation accidents // Med. Radiol. Radiation Safe. 2012. V. 57. № 3. P. 26–31. (In Russian)]
Ильин Л.А., Рудный Н.Н., Суворов Н.Н. и др. Индралин – радиопротектор экстренного действия. Противолучевые свойства, фармакология, механизм действия, клиника. М.: Минздрав РФ, 1994. 435 с. [Ilyin L.A., Rudny N.N., Suvorov N.N. et al. Indralin – radioprojector of emergency action. Radioprotective properties, pharmacology, mechanism of action, clinic. M.: Ministry of Health of the Russian Fe-deration, 1994. 435 p. (In Russian)]
Васин М.В. Лекарственные противолучевые средства. М.: РМАПО, 2010. 180 с. [Vasin M.V. Medicinal radioprotective agents. Moscow: RMAPO, 2010. 180 p. (In Russian)]
Weiss J.F., Landauer M.R. History and development of radiation-protective agents // Int. J. Radiat. Biol. 2009. V. 85. № 7. P. 539–573.
Гребенюк А.Н., Легеза В.И. Противолучевые свойства интерлейкина-1. СПб.: Фолиант. 2012. 216 с. [Grebenyuk A.N., Legeza V.I. Radioprotective properties of interleukin-1. Sanct-Peterburg: Foliant, 2012. 216 p. (In Russian)]
Gibrat C., Cicchetti F. Potential of cystamine and cysteamine in the treatment of neurodegenerative diseases // Prog. Neuropsychopharmacol. Biol. Psychiatry. 2011. V. 35. № 2. P. 380–389.
Kawabe K., Takano K., Moriyama M., Nakamura Y. Transglutaminases derived from astrocytes Aaccelerate amyloid β aggregation // Neurochem. Res. 2017. V. 42. № 8. P. 2384–2391.
Barnett M., Hegarty R. Cysteamine hydrochloride increases bodyweight and wool fibre length, improves feed conversion ratio and reduces methane yield in sheep // Animal Production Science. 2014. V. 54. № 9. P. 1288–1293.
Lissoni P., Malugani F., Bukovec R. et al. Reduction of cisplatin-induced anemia by the pineal indole 5-methoxytryptamine in metastatic lung cancer patients // Neuro Endocrinol. Lett. 2003. V. 24. № 1–2. P. 83–85.
Васин М.В. Медицинские аспекты радиационных катастроф. М.: РМАПО, 2008. 76 с. [Vasin M.V. Medical aspects of radiation disasters. M.: RMAPO, 2008. 76 p.]
Kamran M.Z., Ranjan A., Kaur N. et al. Radioprotective agents: strategies and translational advances // Med. Res. Rev. 2016. V. 36. № 3. P. 461–493. https://doi.org/10.1002/med.21386
Saaya F.M., Katsube T., Xie Y. et al. Research and deve-lopment of radioprotective agents: a mini-review // Int. J. Radiol. 2017. V. 4. № 2–3. P. 128–138.
Smith T.A., Kirkpatrick D.R., Smith, S. et al. Radioprotective agents to prevent cellular damage due to ionizing radiation // J. Transl. Med. 2017. V. 15. P. 232. https://doi.org/10.1186/s12967-017-1338-x
Singh V.K., Seed T.M. A review of radiation countermeasures focusing on injury-specific medicinals and regulatory approval status: part I. Radiation sub-syndromes, animal models and FDA-approved countermeasures // Int. J. Radiat. Biol. 2017. V. 93. № 9. P. 1–19. https://doi.org/10.1080/09553002.2017.1332438
Гудков С.В., Попова Н.Р., Брусков В.И. История, тренды и перспективы // Биофизика. 2015. Т. 60. № 4. С. 801–811. [Gudkov S.V., Popova N.R., Bruskov V.I. History, trends and prospects // Biophysics. 2015. V. 60. № 4. P. 801–811. (In Russian)]
Patt H.M., Tyree E.B., Straube R.L., Smith D.E. Cysteine protection against X-irradiation // Science. 1949. V. 110. № 2852. P. 213–214.
Chapman W.H., Cronkite E.P. Further studies of beneficial effect of glutathione on X-irradiation mice // Proc. Soc. Exptl. Biol. Med. 1950. V. 75. № 2. P. 318–322.
Bacq Z.M., Herve A., Lecomte J. et al. Protection contre le rayonnement X par la beta-mercaptoethylamine // Arch. Int. Physiol. 1951. V. 59. № 4. P. 442–447.
Bacq Z.M. The amines and particularly cystamine as protectors against roentgen rays // Acta Radiol. 1954. V. 41. № 2. P. 47–55.
Gray J.L., Tew J.T., Jensen H. Protective effect of serotonin and paraaminopropiophenon against lethal doses of X-irradiation // Proc. Soc. Exptl. Biol. Med. 1952. V. 80. № 4. P. 604–607.
Красных И.Г., Жеребченко П.Г., Мурашова В.С. и др. Радиозащитное действие 5-метокситриптамина и других алкокситриптаминов // Радиобиология. 1962. Т. 2. Вып. 1. С. 156–160. [Krasnykh I.G., Zherebchenko P.G., Murashova V.S. et al. Radioprotective effect of 5-methoxytryptamine and other alkoxytryptamines // Radiobiology. 1962. V. 2. № 1. P. 156–160. (In Russian)]
Жеребченко П.Г. Противолучевые свойства индолилалкиламинов. М.: Атомиздат, 1971. 200 с. [Zherebchenko P.G. Radioprotective properties of indolylalkylamines. M.: Atomizdat, 1971. 200 p. (In Russian)]
Gray J.L., Moulden E.J., Tew J.T., Jensen H. Protective effect of pitressin and of epinephrine against total body X-irradiation // Proc. Soc. Exptl. Biol. Med. 1952 V. 79. № 3. P. 384–387.
Gray L.H., Conger A.D., Ebert M. et al. The concentration of oxygen dissolved in tissues at the time of irradiation as a factor in radiotherapy // Brit. J. Radiol. 1953. V. 26. P. 638–648.
Alper T., Howard-Flanders P. The role of oxygen in modifying the radiosensitivity of E. coli B // Nature. 1956. V. 178. № 4540. P. 978–979.
Barron E., Dickman S., Muntz I., Singer T.R. Stuties on the mechanism of action of ionizing radiatuins // J. Gen. Physiol. 1949. V. 32. № 4. P. 537–552.
Weiss J. Radiochemistry of aqueus solutions // Nature. 1944. V. 153. P. 748–750.
Lea D.E. Action of Radiation on Living Cells. 2nd ed. Cambridge: University Press, 1956. (Ли Д.Э. Действие радиации на живые клетки: Пер. с англ. М.: Гос-атомиздат, 1963.)
Bacq Z.M., Alexander P. Fundamentals of radiobiology. 1st ed. Butterworth. London. 1955. 2nd ed. London: Pergamon Press, 1961 (Бак З., Александер П. Основы радиобиологии. М.: ИЛ, 1963. 500 с. (In Russian)]
Alexander P., Charlesby A. Physico-chemical methods of protection against ionizing radiations // Radio-biol. Symp. Liege. 1954. London: Butterworth, 1955. P. 49–59.
Howard-Flanders P. Effect of oxygen on the radiosensiti-vity of bacteriophage in the presence of sulphydryl compounds // Nature. 1960. V. 186. № 4723. P. 485–487.
Howard-Flanders P., Levin J., Theriot L. Reactions of deoxyribonucleic acid radicals with sulphydryl compounds in X-irradiated bacteriophage systems // Radiat. Res. 1963. V. 18. № 4. P. 593–606.
Эйдус Л.Х., Корыстов Ю.Н. Кислород в радиобиологии. М.: Энергоатомиздат, 1984. 177 с. [Aidus L.H., Korystov Yu.N. Oxygen in Radiobiology. M.: Energo-atomizdat, 1984. 177 p. (In Russian)]
Jellum E. Interaction of cysteamine and cystamine derivatives with nucleic acids and nucleoproteins // Int. J. Radiat. Biol. 1965. V. 9. P. 185–200.
Brown P.E. Mechanism of action of aminothiol radioprotectors // Nature. 1967. V. 213. № 5074. P. 363–364.
van der Meer C., van Bekkum D.W. The mechanism of radiation protection by hystamine and other biological amines // Int. J. Radiat. Biol. 1959. V. 1. № 1. P. 5–12.
Овакимов В.Г., Айрапетян Г.М., Иванов В.Н. и др. Защитный эффект биогенных аминов при радиационном кишечном синдроме // Радиобиология. 1970. Т. 10. Вып. 4. С. 551–555. [Ovakimov V.G., Ayrapetyan G.M., Ivanov V.N. et al. Protective effect of biogenic amines in radiation intestinal syndrome // Radiobiology. 1970. V. 10. № 4. P. 551–555. (In Russian)]
Васин М.В. Поиск и исследование новых эффективных средств фармакохимической защиты организма от поражающего действия ионизирующего излучения: Дис. … д-ра мед. наук. М.: ГНИИИ АиКМ МО, 1977. 510 с. [Vasin M.V. Search and research of new effective means of pharmacochemical protection of the body against damaging effect of ioni-zing radiation: Dies. … doc. sci. M.: Institute of aviation and space medicine of Ministry of Defence, 1977. 510 p. (In Russian)]
Кулинский В.И. Радиопротекторы рецепторного действия // Радиац. биология. Радиоэкология. 1993. Т. 33. № 6. С. 831–847. [Kulinskii V.I. Receptor-action radioprotectors // Radiat. Biol. Radiat. Ecol. 1993. V. 33. № 6. P. 831–847. (In Russian)]
Hasegawa A.T., Landahl H.D. Studies on spleen oxygen tension and radioprotection in mice with hypoxia, serotonin and p-aminopropiophenone // Radiat. Res. 1967. V. 31. № 3. P. 389–399.
Ярмоненко С.П., Рампан Ю.И., Карочкин Б.Б. и др. Кинетика напряжения кислорода в критических органах под влиянием мексамина в сопоставлении с его радиозащитным эффектом // Радиобиология. 1970. Т. 10. № 5. С. 700–705. [Yarmonenko S.P., Rampan Yu.I., Karochkin B.B. et al. Kinetics of oxygen consumption in critical organs under the influence of mexamine in comparison with its radioprotective effect // Radiobiology. 1970. V. 10. № 5. P. 700–705. (In Russian)]
Жеребченко П.Г., Суворов Н.Н. О связи между радиозащитным и сосудосуживающим действием индолилалкиламинов // Радиобиология. 1963. Т. 3. № 4. С. 595–599. [Zherebchenko P.G., Suvorov N.N. On the relationship between radioprotective and vasoconstrictive action of Indolylalkylamines // Radiobiology. 1963. V. 3. № 4. P. 595–599. (In Russian)]
Абрамов М.М., Васин М.В. К характеристике связей противолучевых свойств серотонина и его ацил- и алкилпроизводных и их способности изменять местный кровоток в тканях организма // Радиобиология. 1978. Т. 18. № 2. С. 204–209. [Abramov M.M., Vasin M.V. To characteristic of radioprotective properties of serotonin and its acyl and alkyl derivatives and their ability to change local blood flow in body tissues // Radiobiology. 1978. V. 18. № 2. P. 204–209. (In Russian)]
Васин М.В., Антипов В.В., Суворов Н.Н. и др. К характеристике роли гидроксильной группы серотонина в фармакологическом и противолучевом эффекте серотонина // Радиобиология. 1984. Т. 24. № 3. С. 411–414. [Vasin M.V., Antipov V.V., Suvorov N.N. et al. To characteristic of the role of hydroxyl group of serotonin in pharmacological and radioprotective effect of serotonin // Radiobiology. 1984 .V. 24. № 3. P. 411–414. (In Russian)]
Васин М.В., Суворов Н.Н., Абрамов М.М., Гордеев Е.Н. Изменение терапевтической широты действия по фармакологическому и противолучевому эффекту при О-алкилировании серотонина и 5(2-оксиэтокситриптамина) // Радиобиология. 1987. Т. 27. № 5. С. 700–703. [Vasin M.V., Suvorov N.N., Abramov M.M., Gordeev E.N. Change of therapeutic window of action on pharmacological and radioprotective effect in O-alkylation of serotonin and 5 (2-oxyethoxytryptamine) // Radiobiology. 1987. V. 27. № 5. P. 700–703. (In Russian)]
Dowdy A., Bennett L.R., Chastain S.M. Protective action of anoxia against total body roentgen irradiation of mammals // Radiology. 1950. V. 55. № 6. P. 879–885.
Limperos G. Effects of varying oxygen tension on mortality of X-rayed mice // J. Frankl. Inst. 1950. V. 249. P. 513–514.
van den Brenk H., Jamieson D. Studies of mechanisms of chemical radiation protection in vivo. II. Effect of pressure oxygen on radioprotection in vivo and its relation to “Oxygen poisoning” // Int. J. Radiat. Biol. 1962. V. 4. № 4. P. 379–402.
van den Brenk H., Moore R. Effect of high oxygen pressure on the protective action of cystamine and 5-hydroxytryptamine in irradiated rats // Nature. 1959. V. 183. № 4674. P. 1530–1531.
van den Brenk H., Haas M. Studies on the mechanisms of chemical radiation protection in vivo. 1. 5-hydroxytryptamine in relation to effect of antimetabolites, antagonists and releasing agents // Int. J. Radiat. Biol. 1961. V. 3. № 1. P. 73–94.
van der Meer C., Bekkum D. A study on the mechanism of radiation protection by 5-hydroxytryptamine and tryptamine // Int. J. Radiat. Biol. 1961. V. 4. P. 105–110.
Devik F., Lothe F. The effect of cysteamine, cystamine and hypoxia on mortality and bone-marrow chromosome aberrations in mice after total bogy roentgen irradiation // Acta Radiol. 1955. V. 44. P. 243–248.
Duplan J.F., Fuhrer J. Estimation de l’ffect radioprotecteur de l’aminoethylisothiouronium (AET) par le denombrement des nodules spleniques // Compt. Rend. Soc. Biol. 1966. V. 160. № 6. P. 1142–1145.
Feher I., Gidali J., Sztanyik L. Study of the radioprotective effect of 5-methoxytryptamine on heamopoietic stem cells // Int. J. Radiat. Biol. 1968. V. 14. № 3. P. 257–263.
Crouch B.G., Overman R.R. Chemical protection against X-irradiation dearh in primates: a preliminary report // Science. 1957. V. 125. P. 1092–1093.
Jacobus D.P. Preprotection of the dog against ionizing radiation // Fed. Proc. 1959. V. 18. P. 74.
Jacobus D.P., Dacquisto M.D. Anti-radiation drug development // Military Med. 1961. V. 126. P. 698.
Разоренова В.А. Защитное действие меркамина при экспериментальном остром лучевом поражении // Вопросы патогенеза, экспериментальной терапии и профилактики лучевой болезни. М.: Медгиз, 1960. С. 351–359. [Razorenova V.A. Protective action of mercamine in experimental acute radiation damage // The questions of pathogenesis, experimental therapy and prevention of radiation disease. M.: Medgiz, 1960. P. 351–359. (In Russian)]
Разоренова В.А., Щербова Е.Н. О профилактическом применении цистеинамина и цистамина при острой лучевой болезни // Мед. радиол. 1961. Т. 6. № 3. С. 266–269. [Razorenova V.A., Scherbova E.N. On preventive use of cysteinamine and cystamine in acute radiation disease // Med. Radiol. 1961. V. 6. № 3. P. 266–269. (In Russian)]
Benson R.E., Michaelson S.M., Downs W. Toxicological and radioprotection studies on S,beta-aminoethyl isothiouronium bromide (AET) // Radiat. Res. 1961. V. 15. № 5. P. 561–567.
Мозжухин А.С., Рачинский Ф.Ю. Химическая профилактика радиационных поражений. М.: Атомиздат, 1964. 244 с. [Moszhukhin A.S., Rachinsky F.Yu. Chemical prevention of radiation injuries. Moscow: Atomizdat, 1964. 244 p. (In Russian)]
Семенов Л.Ф. Профилактика острой лучевой болезни. Л.: Медицина, 1967. 215 с. [Semenov L.F. Prevention of acute radiation disease. Leningrad: Medicine, 1967. 215 p. (In Russian)]
Akerfeldt S., Ronnback C., Nelson A. Radioprotective agents: results with S-(3-amino-2-hydroxypropyl)phosphorothioate, amidophosphorothioate and some related compounds // Radiat. Res. 1967. V. 31. № 4. P. 850–855
Piper J., Stringfellow C., Elliot R., Johnston T. S,2(omega-aminoalkylamino)-ethyldihydrogen phosphorothioates and related compounds as potential antiradiation agents // J. Med. Chem. 1969. V. 12. № 2. P. 236–243.
Piper J.R., Rose L.M., Johnson T.P. et al. S-2-omega-Diaminoalkyl dihydrogen phosphorothioates as antiradiation agents // J. Med. Chem. 1979. V. 22. № 6. P. 613–639.
Yuhas J.M., Storer J.B. Chemoprotection against three modes of radiation death in the mice // Int. J. Radiat. Biol. 1969. V. 15. № 3. P. 233–237.
Yuhas J.M. Biological factors affecting the radioprotective efficiency of S,2-(3-aminopropylamino) ethylphosphorothioic acid (WR-2721) LD50/30 doses // Radiat. Res. 1970. V. 44. № 3. P. 621–628.
Yuhas J.M. Biological factors affecting the radioprotective efficiency of S,2-(3-aminopropylamino) ethylphosphorothioic acid (WR-2721) LD50/7 doses // Radiat. Res. 1971. V. 47. № 2. P. 226–229.
Yuhas J.M., Proctor J.O., Smith L.H. Some pharmacologic effects of WR-2721: their role in toxicity and radioprotection // Radiat. Res. 1973. V. 54. № 2. P. 222–233.
Gu J., Zhu S., Li X. Effect of amifostine in head and neck cancer patients treated with radiotherapy: a systematic review and meta-analysis based on randomized controlled trials // Plos One. 2014. V. 9. № 5. e95968. https://doi.org/10.1371/journal.pone.0095968
Devine A., Marignol L. Potential of amifostine for chemoradiotherapy and radiotherapy-associated toxicity reduction in advanced NSCLC: a meta-analysis // Anticancer Res. 2016. V. 36. № 1. P. 5–12.
Суворов Н.Н., Шашков В.С. Химия и фармакология средств профилактики радиационных поражений. М.: Атомиздат, 1975. 224 с. [Suvorov N.N., Shashkov V.S. Chemistry and pharmacology of means of prevention of radiation lesions. M.: Atomizdat, 1975. 224 p. (In Russian)]
Горелова Н.В., Шашков В.С., Васин М.В. и др. Радио-защитные свойства О-ацильных производных серотонина // Радиобиология. 1970. Т. 10. № 5. С. 758–762. [Gorelova N.V., Shashkov V.S., Vasin M.V. et al. Radioprotective properties of O-acyl derivatives of serotonin // Radiobiology. 1970. V. 10. № 5. P. 758–762. (In Russian)]
Васин М.В., Антипов В.В., Суворов Н.Н. и др. Противолучевые свойства индолилалкиламиноэтанолов // Радиобиология. 1971. Т. 11. № 5. С. 779–781. [Vasin M.V., Antipov V.V., Suvorov N.N. et al. Radioprotective properties of indolylalkylaminoethanols // Radiobiology. 1971. V. 11. № 5. P. 779–781. (In Russian)]
Старостина З.Г., Суворов Н.Н., Васин М.В. и др. Синтез 3-диалкиламино 3-дезоксианалогов 1-(индолил-3) глицерина // Химико-фармацевтический журнал. 1972. Т. 6. № 11. С. 14–18. [Starastina Z.G., Suvorov N.N., Vasin M.V. et al. Synthesis of 3-dialkylamino 3-deoxyanalogs 1-(indolyl-3) glycerol // Chemico-Pharmaceutical J. 1972. V. 6. № 11. P. 14–18. (In Russian)]
Суворов Н.Н., Гуляев В.А., Костюченко Н.Н и др. Производные индола: Синтез некоторых О(-оксиалкоксипропил)производных серотонина // Химия гетероциклич. соед. 1973. № 11. С. 1515–1518. [Suvorov N.N., Gulyaev V.A., Kostyuchenko N.N. et al. Indole derivatives: Synthesis of some O (-oxyalkoxypropyl) derivatives of serotonin // Chemistry heterocyclic compound. 1973. № 11. P. 1515–1518. (In Russian)]
Суворов Н.Н., Виноград Л.Х., Минаева В.С. и др. Производные индола: Аминотиолы и аминотиосульфаты индольного ряда // Химия гетероциклич. соед. 1973. № 11. С. 1505–1511. [Suvorov N.N., Vinograd L.Kh., Minaeva V.S. et al. Indole derivatives: Aminothiols and aminothiosulfates of indole series // Chemistry heterocyclic compound. 1973. № 11. P. 1505–1511. (In Russian)]
Васин М.В., Антипов В.В., Суворов Н.Н. и др. Противолучевые свойства дисеротониновых эфиров дикарбоновых кислот // Радиобиология. 1974. Т. 14. № 2. С. 242–246. [Vasin M.V., Antipov V.V., Suvorov N.N. et al. Radioprotective properties of diserotonin esters of dicarboxylic acids // Radiobiology. 1974. V. 14. № 2. P. 242–246. (In Russian)]
Васин М.В., Антипов В.В., Суворов Н.Н. и др. Противолучевые свойства -окси и -меркаптотриптaминов и их производных // Радиобиология. 1974. Т. 14. № 4. С. 610–612. [Vasin M.V., Antipov V.V., Suvorov N.N. et al. Radioprotective properties of -oxy and -mercaptotriptamines and their derivatives // Radio-biology. 1974. V. 14. № 4. P. 610–612. (In Russian)]
Русинова В.Н., Суворов Н.Н., Смушкевич Ю.А. и др. Производные индола; Индолил-3-фенилуксусная кислота // Химия гетероциклич. соед. 1974. № 2. С. 211–213. [Rusinova V.N., Suvorov N.N., Smushke-vich Yu.A. et al. Indole derivatives; Indolyl-3-phenylacetic acid // Chemistry heterocyclic compound. 1974. № 2. P. 211–213. (In Russian)]
Суворов Н.Н. Гордеев Е.Н., Васин М.В. Производные индола; Синтез и биологическая активность некоторых триптаминов // Химия гетероцикич. соед. 1974. № 11. С. 1496–1501. [Suvorov N.N. Gordeev E.N., Vasin M.V. Indole derivatives; Synthesis and biological activity of certain tryptamines // Chemistry heterocycic compound. 1974. № 11. P. 1496–1501. (In Russian)]
Балабушевич А.Б., Яросько Н.С., Суворов Н.Н. и др. Синтез и радиозащитные свойства некоторых изотриптаминов // Тр. МХТИ. 1977. Вып. 94. С. 20–22. [Balabushevich A.B., Yarosko N.S., Suvorcoov N.N. et al. Synthesis and radioprotective properties of certain isotriptamines // Works of Moscow Chemical thechnological institute. 1977. Issue 94. P. 20–22. (In Russian)]
Суворов Н.Н., Виноград Л.Х., Лаврищева Л.Н. и др. Серусодержащие производные индолилалкиламинов // Тр. МХТИ. 1977. Вып. 94. С. 9–19. [Suvorov N.N., Vinograd L.H., Lavrischeva L.N. et al. Sulfur-containing indolylalkylamine derivatives // Works of of Moscow Chemical thechnological institute. 1977. Issue 94. P. 9–19. (In Russian)]
Ильин Л.А. Мифы и реалии Чернобыля. М.: ALARA Limited, 1994. 448 с. [Ilyin L.A. Myths and realities of Chernobyl. М.: ALARA Limited, 1994. 448 p. (In Russian)]
Васин М.В., Чернов Г.А., Антипов В.В. Широта радиозащитного действия индралина в сравнительных исследованиях на различных видах животных // Радиац. биология. Радиоэкология. 1997. Т. 37. № 6. С. 896–904. [Vasin M.V., Chernov G.A., Antipov V.V. The window of radioprotective action of indralin in comparative studies on different species of animals // Radiat. biol. Radioekol. 1997. V. 37. № 6. P. 896–904. (In Russian)]
Vasin M.V., Semenov L.F., Suvorov N.N. et al. Protective effect and the therapeutic index of indralin in juvenile rhesus monkeys // J. Radiat. Res. 2014. V. 55. № 6. P. 1048–1055.
Сухинина Г.П. Фармакология 1-(индолил-3)-2-алкиламиноалканолов: Автореф. дис. … канд. мед. наук. М.: ВНИХФИ им. С. Оржоникидзе, 1972. 19 с. [Sukhinina G.P. Pharmacology of 1-(indolyl-3)-2-alkylaminoalkanols: Avtoref. Dis. … Master’s med. sci. M.: Orzhonikidze All-Union Chemical Pharmaceutical insyitute. 1972. 19 p. (In Russian)]
Васин М.В., Ганьшина Т.С., Мирзоян Р.С. и др. Митигирующий эффект нитратов (монизола) на фармакодинамические сдвиги в сердечно-сосудистой системе под действием радиопротектора индралина // Бюл. эксперим. биол. мед. 2018. Т. 165. № 3. С. 340–343. [Vasin M.V., Ganshina T.S., Mirzoyan R.S. et al. The mitigative effect of nitrates (monizol) on pharmacodynamic shifts in cardiovascular system by the action of the indralin // Bul. Experim. Biol. Med. 2018. V. 165. № 3. P. 340–343. (In Russian)]
Васин М.В., Антипов В.В., Чернов Г.А. и др. Роль вазоконстрикторного эффекта в реализации противолучевых свойств индралина в опытах на собаках // Радиац. биология. Радиоэкология. 1997. Т. 37. № 1. С. 46–55. [Vasin M.V., Antipov V.V., Chernov G.A. et al. The role of vasoconstrictor effect in the realization of radioprotectiveproperties of indralin in dog experiments // Radiats. biol. Radioekol. 1997. V. 37. № 1. P. 46–55. (In Russian)]
Васин М.В., Гаврилюк Д.Н. Влияние мексамина на тонус артерий у собак // Фармакол. токсикол. 1979. Т. 42. № 4. С. 376–378. [Vasin M.V., Gavrilyuk D.N. Effect of mexamine on artery tone in dogs // Pharmacol. Toxicol. 1979. V. 42. № 4. P. 376–378. (In Russian)]
Васин М.В., Чернов Г.А., Королева Л.В. и др. К механизму противолучевого действия индралина // Радиац. биология. Радиоэкология. 1996. Т. 36. № 1. С. 36–46. [Vasin M.V., Chernov G.A., Koroleva L.V. et al. To the mechanism of radioprotective action of indraline // Radiats. Biol. Radioekol. 1996. V. 36. № 1. P. 36–46. (In Russian)]
Васин М.В., Ушаков И.Б., Семенова Л.А., Ковтун В.Ю. К фармакологическому анализу противолучевого действия индралина // Радиац. биология. Радиоэкология. 2001. Т. 41. № 3. С. 307–309. [Vasin M.V., Ushakov I.B., Semenova L.A., Kovtun V.Y. To pharmacological analysis of radioprotective action of indralin // Radiats. Biol. Radioekol. 2001. V. 41. № 3. P. 307–309. (In Russian)]
Chen Z.J., Minneman K.P. Recent progress in alpha1-adrenergic receptor research // Acta Pharmacol. Sin. 2005. V. 26. № 11. P. 1281–1287.
Hu Z.W., Shi X.Y., Lin R.Z., Hoffman B.B. Alpha1 adrenergic receptors activate phosphatidylinositol 3-kinase in human vascular smooth muscle cells. Role in mitogenesis // J. Biol. Chem. 1996. V. 271. № 15. P. 8977–8982.
Rameh L.E., Rhee S.G., Spokes K. et al. Phosphoinositi-de 3-kinase regulates phospholipase Cgamma-media-ted calcium signaling // J. Biol. Chem. 1998. V. 273. № 37. P. 23750–23757.
Barrière E., Tazi K.A., Pessione F. et al. Role of small-conductance Ca2+-dependent K+ channels in in vitro nitric oxide-mediated aortic hyporeactivity to alpha-adrenergic vasoconstriction in rats with cirrhosis // J. Hepatol. 2001. V. 35. № 3. P. 350–357.
Tuttle J.L., Falcone J.C. Nitric oxide release during alpha1-adrenoceptor-mediated constriction of arterioles // Am. J. Physiol. 2001. V. 281. № 2. P. H873–H881.
Chitaley K., Webb R.C. Nitric oxide induces dilation of rat aorta via inhibition of rho-kinase signaling // Hypertension. 2002. V. 39. № 2. Pt. 2. P. 438–442.
Sampson L.J., Plane F., Garland C.J. Involvement of cyclic GMP and potassium channels in relaxation evoked by the nitric oxide donor, diethylamine NONOate, in the rat small isolated mesenteric artery // Naunyn Schmiedebergs Arch. Pharmacol. 2001. V. 364. № 3. P. 220–225.
Dora K.A., Richards S.M., Rattigan S. et al. Serotonin and norepinephrine vasoconstriction in rat hindlimb have different oxygen requirements // Am. J. Physiol. 1992. V. 262. № 3. Pt. 2. P. H698–H703.
Hall J.L., Ye J.M., Clark M.G., Colquhoun E.Q. Sympathetic stimulation elicits increased or decreased VO2 in the perfused rat hindlimb via alpha 1-adrenoceptors // Am. J. Physiol. 1997. V. 272. № 2. Pt. 5. P. H2146–H2153.
Bartlett I.S., Marshall J.M. Analysis of the effects of graded levels of hypoxia on noradrenaline-evoked contraction in the rat iliac artery in vitro // Exp. Physiol. 2002. V. 87. № 2. P. 171–184.
Кулинский В.И., Климова А.Д., Яшунский В.Г., Алпатова Т.Г. Механизм противолучевого действия катехоламиновых рецепторных агонистов. Включение в радиозащитный эффект обоих подтипов альфа-адренорецепторов // Радиобиология. 1986. Т. 26. № 1. С. 11–16. [Kulinskii V.I., Klimova A.D., Yashunsky V.G., Alpatova T.G. Mechanism of radioprotective action of catecholamine receptor agonists. Incorporation of both subtypes of alpha adrenoceptors into the radioprotective effect // Radiobiology. 1986. V. 26. № 1. P. 11–16. (In Russian)]
Lo Y.C., Tsou H.H., Lin R.J. et al. Endothelium-dependent and -independent vasorelaxation by a theo-phylline derivative MCPT: roles of cyclic nucleotides, potassium channel opening and phosphodiesterase inhibition // Life Sci. 2005. V. 76. № 8. P. 931–944.
Васин М.В., Ушаков И.Б., Королева Л.В., Антипов В.В. Роль клеточной гипоксии в противолучевом эффекте радиопротекторов // Радиац. биология. Радиоэкология. 1999. Т. 39. № 2–3. С. 238–248. [Vasin M.V., Ushakov I.B., Koroleva L.V., Antipov V.V. The role of cellular hypoxia in radioprotective effect of radioprotectors // Radiats. Biol. Radioekol. 1999. V. 39. № 2–3. P. 238–248. (In Russian)]
Vasin M.V., Ushakov I.B. Comparative efficacy and the window of radioprotection for adrenergic and serotoninergic agents and aminothiols in experiments with small and large animals // J. Radiat. Res. 2015. V. 56. № 1. P. 1–10. https://doi.org/10.1093/jrr/rru087
Кулинский В.И., Золочевская Л.И. Отсутствие корреляции между эффектами симпатомиметиков на кровоток внутренних органов, напряжение кислорода и выживаемостью облученных животных // Радиобиология. 1973. Т. 13. № 3. С. 373–376. Kulinskii V.I., Zolochevskaya L.I. There is no correlation between the effects of sympathomimetics on the blood flow of internal organs, oxygen consumption and survival of irradiated animals // Radiobiology. 1973. V. 13. № 3. P. 373–376. (In Russian)]
Chance B. The energy-linked reaction of calcium with mitochondria // J. Biol. Chem. 1965. V. 240. P. 2729–2748.
Rizzuto R., Pinton P., Brini M. et al. Mitochondria as biosensors of calcium microdomains // Cell Calcium. 1999. V. 26. № 5. P. 193–199.
Breton L., Clot J.P., Bouriannes J., Baudry M. Adrenaline activates oxidative phosphorylation of rat liver mitochondria through alpha 1-receptors // C. R. Seances Soc. Biol. Fil. 1987. V. 181. № 3. P. 242–248. (in French)
Gesek F.A., Strandhoy J.W. Alpha adrenoceptor agonist stimulation of oxygen consumption in rat proximal and distal nephrons // J. Pharmacol. Exp. Ther. 1989. V. 249. № 2. P. 529–534.
Васин М.В., Ушаков И.Б., Коровкина Э.П., Ковтун В.Ю. Модификация потребления кислорода клетками костного мозга in vitro под влиянием α1-адреномиметика индралина // Бюл. эксперим. биол. мед. 2013. Т. 155. № 3. С. 337–339. [Vasin M.V., Ushakov I.B., Korovkina E.P., Kovtun V.Yu. Modification of oxygen consumption by bone marrow cells in vitro under the influence of α-adrenmimetic indralin // Bull. Exp. Biol. Med. 2013. V. 155. № 3. P. 337–339. (In Russian)]
Praslicka M., Hill M., Novak L. Protective action of 2,4-dinitrophenol against X-radiation injury. Radioprotective effect of 2,4-dinitrophenol // Int. J. Radiat. Biol. 1962. V. 4. P. 567–579.
Vacek A., Rotkovska D. On protective effect of 2,4-dinitrophenol // Int. J. Radiat. Biol. 1964. V. 8. № 3. P. 285–289.
Красных И.Г., Жеребченко П.Г., Семенов Л.Ф. и др. Профилактика радиационных поражений на обезьянах с помощью 5-иетокситриптамина // Радиобиология. 1963. Т. 3. № 1. С. 259–261. [Krasnykh I.G., Zherebchenko P.G., Semenov L.F. et al. Prevention of radiation injuries on monkeys with 5-ietoxytryp-tamine // Radiobiology. 1963. V. 3. № 1. P. 259–261. (In Russian)]
Семенов Л.Ф., Лапин Б.А., Стрелков Р.Б. и др. Сравнительное исследование противолучевой эффективности мексамина и газовой гипоксической смеси в опытах на обезьянах-резус // Вестн. АМН СССР. 1978. № 8. С. 83–88. [Semenov L.F., Lapin B.A., Strelkov R.B. et al. Comparative study of radioprotective effectiveness of mexamine and gas hypoxic mixture in experiments on rhesus monkeys // Westт. Acad. Med. Sci. USSR. 1978. № 8. P. 83–88. (In Russian)]
Васин М.В. Сравнительная характеристика модификации радиочувствительности мышей и крыс гипоксической гипоксией // Радиобиология. 1986. Т. 26. № 4. С. 563–565. [Vasin M.V. Comparative characteristic of modification of radiosensitivity of mice and rats by hypoxic hypoxia // Radiobiology. 1986. V. 26. № 4. P. 563–565. (In Russian)]
Антипов В.В., Васин М.В., Гайдамакин А.Н. Видовые особенности реагирования СДГ лимфоцитов у животных на острую гипоксическую гипоксию и ее связь с радиорезистентностью организма // Косм. биол. авиакосм. мед. 1989. Т. 23. № 2. С. 63–66. [Antipov V.V., Vasin M.V., Gaidamakin A.N. Species features of the response of lymphocyte SDG in animals to acute hypoxic hypoxia and its association with body radioresistance // Kosm. Biol. Aviat. Space Med. 1989. V. 23. № 2. P. 63–66. (In Russian)]
Овакимов В.Г., Ярмоненко С.П. Модификация противолучевого эффекта гипоксической гипоксии при искусственной гибернации организма // Радиобиологиия. 1975. Т. 15. № 1. С. 69–73. [Ovakimov V.G., Yarmonenko S.P. Modification of radioprotective effect of hypoxic hypoxia in artificial body hibernation // Radio-biology. 1975. V. 15. № 1. P. 69–73. (In Russian)]
Войткевич Н.Д., Палыга Г.Ф. Противолучевой эффект мексамина // Мед. радиология. 1974. Т. 19. № 1. С. 74–86. [Voitkevich N.D., Palyga G.F. Radioprotective effect of mexamine // Med. Radiol. 1974. V. 19. № 1. P. 74–86. (In Russian)]
Васин М.В., Ушаков И.Б., Антипов В.В. Потенциальная роль реакции катехоламинов на острую гипоксию в модификации противолучевого действия радиопротекторов // Бюл. эксперим. биол. мед. 2015. Т. 159. № 5. С. 549–552. [Vasin M.V., Ushakov I.B., Antipov V.V. Potential role of catecholamines response to acute hypoxia in modification of radioprotective action of radioprotectors // Bull. Exp. Biol. Med. 2015. V. 159. № 5. P. 549–552. (In Russian)]
Васин М.В., Ушаков И.Б. Активация комплекcа II дыxательной цепи во вpемя оcтpой гипокcии как индикатоp ее пеpеноcимоcти // Биофизика. 2018. Т. 63. № 2. С. 329–333. [Vasin M.V., Ushakov I.B. Activation of complex II of the respiration chain during acute hypoxia as an indicator of its tolerance // Biophysics. 2018. V. 63. № 2. P. 329–333. (In Russian)]
Васин М.В., Ушаков И.Б., Бухтияров И.В. Стресс-реакция и состояние биохимического шока как взаимосвязанные и неизбежные компоненты при формировании повышенной радиорезистентности организма в условиях острой гипоксии // Изв. РАН. Серия биол. 2018. № 1. С. 83–92. [Vasin M.V., Ushakov I.B., Bukhtiyarov I.V. Stress reaction and biochemical shock state as interconnected and inevitable components in the formation of increased radioresistance of the bogy in conditions of acute hypoxia // News of Russian Acad. Sci. Series Biol. 2018. № 1. P. 83–92. (In Russian)] https://doi.org/10.7868/S0002332918010113
Vasin M.V., Ushakov I.B., Kovtun V.Yu. et al. The targets for radioprotective and mitigatory action of radioprotector Iindralin // JRR. 2014. V. 2. № 2. P. 3–9.
Васин М.В., Ушаков И.Б., Ковтун В.Ю. и др. Противолучевые свойства индралина при сочетанном применении с монизолом при местных острых и поздних лучевых поражениях в условиях локального гамма-облучения кожи // Бюл. эксперим. биол. мед. 2015. Т. 159. № 6. С. 720–722. [Vasin M.V., Ushakov I.B., Kovtun V.Y. et al. Radioprotective properties of indralin when combined with monizol in local acute and late radiation injuries under local gamma skin irradiation // Bull. Exp. Biol. Med. 2015. V. 159. № 6. P. 720–722. (In Russian)]
Коноплянников А.Г., Коноплянникова О.А., Проскуриков С.Я. Реакция “ишемия/реперфузия” для стволовых клеток двух “критических” систем клеточного обновления организма // Радиац. биология. Радиоэкология. 2005. Т. 45. № 5. С. 605–609. [Konoplyannikov A.G., Konoplyannikova O.A., Proskurikov S.J. The reaction “ischemia/reperfusion” for stem cells of two “critical” systems of cellular renewal of the organism // Radiats. Biol. Radioekol. 2005. V. 45. № 5. P. 605–609. (In Russian)]
Rixon E.H., Baird K.M. The therapeutic effect of serotonin on the survival of X-irradiated rats // Radiat. Res. 1968. V. 33. № 2. P. 395–402.
Шашков В.С., Анашкин О.Д., Суворов Н.Н., Манаева И.А. Эффективность серотонина, мексамина, АЭТ и цистамина при повторном введении после γ-облучения // Радиобиология. 1971. Т. 11. № 4. С. 621–623. [Shashkov V.S., Anashkin O.D., Suvo-rov N.N., Manaeva I.A. Efficiency of serotonin, mexamine, AET and cystamine at repeated administration after γ-irradiation // Radiobiology. 1971. V. 11. № 4. P. 621–623. (In Russian)]
Смирнова И.Б., Донцова Г.В., Константинова М.М., Рахманина О.Н. Радиомодифицирующий эффект серотонина на клетках гематопоэтической системы // Радиобиология. 1984. Т. 24. № 2. С. 236–240. [Smirnova I.B., Dontsova G.V., Konstantinova M.M., Rakhmanina O.N. Radiomodifying effect of serotonin on cells of hematopoietic system // Radiobiology. 1984. V. 24. № 2. P. 236–240. (In Russian).]
Колесниченко И.С., Михайлов Л.С., Бояринов А.С., Гришин А.В. Противолучевые схемы профилактики и лечения служебных собак // Ветеринария. 2005. № 12. С. 52–54. [Kolesnickenko I.S., Mikhailov H.P., Boyarinov A.S., Grishin A.V. Anti-radiation schemes of prevention and treatment of service dogs // Veterina-ria. 2005. № 12. P. 52–54. (In Russian)]
Рождественский Л.М., Коровкина Э.П., Дешевой Ю.Б. Применение рекомбинантного человеческого интерлейкина-1бета (беталейкина) для лечения острой лучевой болезни тяжелой степени у собак // Радиац. биология. Радиоэкология. 2008. Т. 48. № 2. С. 185–184. [Rozhdestvenskii L.M., Korovkina E.P., Deshovoi Yu.B. Use of recombinant human interleukin-1beta (betaleikin) for the treatment of severe acute radiation disease in dogs // Radiats. Biol. Radioekol. 2008. V. 48. № 2. P. 185–194. (In Russian)]
Васин М.В., Ушаков И.Б., Ковтун В.Ю. и др. Характеристика противолучевых свойств радиопротектора Б-190 при его применении после облучения // Радиац. биология. Радиоэкология. 2008. Т. 48. № 6. С. 730–733. [Vasin M.V., Ushakov I.B., Kovtun V.Y. et al. Characteristics of radioprotective properties radioprotector Б-190 at its application after irradiation // Radiats. Biol. Radioekol. 2008. V. 48. № 6. P. 730–733. (In Russian)]
Васин М.В., Ушаков И.Б., Ковтун В.Ю. и др. Противолучевые свойства радиопротектора экстренного действия индралина при его применении после облучения в условиях частичного экранирования живота крыс // Радиац. биология. Радиоэкология. 2008. Т. 48. № 2. С. 199–202. [Vasin M.V., Ushakov I.B., Kovtun V.Yu. et al. Radioprotective properties of indralin emergency action radioprotector in its application after irradiation under conditions of partial schielding of rat abdomen // Radiats. Biol. Radioekol. 2008. V. 48. № 2. P. 199–202. (In Russian)]
Васин М.В., Ушаков И.Б., Ковтун В.Ю. и др. Фармакологический анализ терапевтического действия радиопротекторов цистамина и индралина в качестве радиомитигаторов // Бюл. эксперим. биол. мед. 2016. Т. 168. № 10. С. 460–464. [Vasin M.V., Ushakov I.B., Kovtun V.Y. et al. Pharmacological analysis of therapeutic effect of radioprotectors cystamine and indralin as radiomytigators // Bull. Exp. Biol. Med. 2016. V. 168. № 10. P. 460–464. (In Russian)]
Граевский Э.Я., Янушевская М.И., Буеверова Э.И. и др. Изучение противолучевой активности и некоторых аспектов механизма действия биогенных аминов на клетках млекопитающих, культивируемых in vitro // Радиобиология. 1981. Т. 21. № 5. С. 683–687. [Graevskii E.J., Janushevskii M.I., Bueverova E.I. et al. Study of radioprotective activity and certain aspects of the nechanism of action of biogenic amines on mammalian cells cultured in vitro // Radiobiology. 1981. V. 21. № 5. P. 683–687. (In Russian)]
Fossier P., Blanchard B., Ducrocq C. et al. Nitric oxide transforms serotonin into an inactive form and this affects neuromodulation // Neuroscience. 1999. V. 93. № 2. P. 597–603.
Нефедова В.В., Инжеваткин Е.В., Нефедов В.П. Роль С2 рецепторов в реализации стимулирующего влияния серотонина на стволовые кроветворные клетки костного мозга // Бюл. эксперим. биол. 2002. Т. 133. № 5. С. 484–486. [Nefedova V.V., Inzhevatkin E.V., Nefedov V.P. Role of С2 receptors in realization of stimulating effect of serotonin on hematopoietic stem cells of bone marrow // Bul. Exp. Biol. Med. 2002. V. 133. № 5. P. 484–486. (In Russian)]
Yang M., Li K., Ng P.C. et al. Promoting effects of serotonin on hematopoiesis: ex vivo expansion of cord blood CD34+ stem/progenitor cells, proliferation of bone marrow stromal cells, and antiapoptosis // Stem Cells. 2007. V. 25. № 7. P. 1800–1806.
Spiegel A., Kalinkovich A., Shivtiel S. et al. Stem cell regulation via dynamic interactions of the nervous and immune systems with the microenvironment // Cell Stem. Cell. 2008. V. 3. P. 484–492.
Fouquet G., Coman T., Hermine O., Côté F. Serotonin, hematopoiesis and stem cells // Pharmacol. Res. 2019. V. 140. P. 67–74. https://doi.org/10.1016/j.phrs.2018.08.005
Скурихин Е.Г., Хмелевская Е.С., Першина О.В. и др. Влияние адреномиметиков и серотонина на стромальные и кроветворные полипотентные предшественники при цитостатической миелосупрессии // Бюл. эксперим. биол. мел. 2010. Т. 10. № 3. С. 128–131. [Skurikhin E.G., Khmelevskaya E.S., Pershina O.V. et al. Effects of adrenomimetics and serotonin on stromal and hematopoietic polypotent precursors in cytostatic myelosuppression // Bul. Exp. Biol. Med. 2010. V. 10. № 3. P. 128–131. (In Russian)]
Meuleman N., Tondreau T., Ahmad I. et al. Infusion of mesenchymal stromal cells can aid hematopoietic recovery following allogeneic hematopoietic stem cell myeloablative transplant: a pilot study // Stem Cells Dev. 2009. V. 18. P. 1247–1252.
Mo Y., Li S., Liang E. et al. The expression of functio-nal dopamine and serotonin receptors on megakaryocytes // Blood. 2014. V. 124. № 21. P. 4205.
Cosentino M., Marino F., Maestroni G.J. Sympathoadrenergic modulation of hematopoiesis: a review of available evidence and of therapeutic perspectives // Front. Cell. Neurosci. 2015. V. 9. P. 302.
Waldrop B.A., Mastalerz D., Piascik M.T., Post G.R. alpha(1B)- and alpha(1D)-Adrenergic receptors exhibit different requirements for agonist and mitogen-activated protein kinase activation to regulate growth responses in rat 1 fibroblasts // J. Pharmacol. Exp. Ther. 2002. V. 300. № 1. P. 83–90.
Xiang B., Han L., Wang X. et al. Nicotinamide phosphoribosyltransferase upregulation by phenylephrine reduces radiation injury in submandibular gland // Int. J. Radiat. Oncol. Biol. Phys. 2016. V. 96. № 3. P. 538–546. https://doi.org/10.1016/j.ijrobp.2016.06.2442
Li L., Bhatia R. Role of SIRT1 in the growth and regulation of normal hematopoietic and leukemia stem cells // Curr. Opin. Hematol. 2015. V. 22. № 4. P. 324–329. https://doi.org/10.1097/MOH.0000000000000152
Васин М.В., Ушаков И.Б., Ковтун В.Ю. и др. Влияние сочетанного применения кверцетина и индралина на процессы пострадиационного восстановления // Радиац биол. Радиоэкол. 2011. Т. 51. № 2. С. 247–251. [Vasin M.V., Ushakov I.B., Kovtun V.Yu. et al. Effect of combined application of quercetin and indralin on postradiation recovery // Radiats. biol. Radioekol. 2011. V. 51. № 2. P. 247–251. (In Russian)]
Li P., Liu Y., Burns N. SIRT1 is required for mitochondrial biogenesis reprogramming in hypoxic human pulmonary arteriolar smooth muscle cells // Int. J. Mol. Med. 2017. V. 39. № 5. P. 1127–1136.
Васин М.В. Потенциальная роль фактора неравномерности поглощения энергии ионизирующего излучения в организме в эффективности противолучевых препаратов // Мед. радиология. Радиац. безопасность. 2011. Т. 56. № 4. С. 60–70. [Vasin M.V. Potential role of the non-uniformity of absorption of ionizing radiation energy in the body in the effectiveness of radioprotective preparations // Med. radiol. Radiat. safe. 2011. V. 56. № 4. P. 60–70. (In Russian)]
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология


