Радиационная биология. Радиоэкология, 2020, T. 60, № 5, стр. 516-523
Гипертермия как способ повышения радиочувствительности опухолевых клеток, невосприимчивых к фармакологическим радиосенсибилизаторам
А. В. Хохлова 1, А. О. Якимова 1, В. А. Мосина 1, Е. И. Селиванова 1, А. Е. Кабаков 1, *
1 Медицинский радиологический научный центр им. А.Ф. Цыба –
филиал Национального медицинского исследовательского центра радиологии
Министерства здравоохранения Российской Федерации
Обнинск, Россия
* E-mail: aekabakov@hotmail.com
Поступила в редакцию 20.01.2020
После доработки 10.02.2020
Принята к публикации 12.02.2020
Аннотация
На in vitro модели проверялась возможность применения гипертермии для эффективной радиосенсибилизации опухолевых клеток с радио- и химиорезистентным фенотипом. Работа проводилась на клетках линии MCF-7/MDR1, происходящей из карциномы молочной железы человека и демонстрирующей феномен множественной лекарственной устойчивости из-за гиперэкспрессии гена MDR1. В сравнительных экспериментах использовали опухолевые клетки материнской линии MCF-7. Клеточные культуры подвергали тепловому стрессу (42–44°С, 30–90 мин), затем воздействию γ-излучения в дозах 2–8 Гр. Цитотоксические эффекты оценивали в МТТ-тесте, а также по интенсивности апоптоза и некроза или падению клоногенности. Транскрипционный стресс-ответ прогретых клеток изучали с помощью ПЦР в реальном времени, определяя накопление мРНК, кодирующих индуцибельные белки теплового шока HSP70 и HSP27. Установлено, что радио- и химиорезистентные клетки MCF-7/MDR1 не обладают повышенной терморезистентностью, и их реакции на тепловой стресс сравнимы с таковыми клеток MCF-7. При этом показано, что гипертермическая предобработка позволяет значительно усилить цитотоксическое действие γ-излучения на клетки MCF-7/MDR1, что доказывает возможность эффективного использования гипертермии для повышения чувствительности к облучению радиорезистентных опухолей, которые обладают множественной лекарственной устойчивостью и невосприимчивы к химиотерапевтическим радиосенсибилизаторам. Рассматриваются молекулярные механизмы термо-радиосенсибилизации опухолевых клеток.
Лучевая терапия почти всегда применяется при лечении солидных злокачественных новообразований, что во многих случаях имеет успех. К сожалению, довольно часто опухоли человека оказываются резистентными к воздействию ионизирующего излучения, и поэтому актуальной является проблема радиосенсибилизации – дополнительных обработок, направленных на усиление радиационного ответа в опухолях-мишенях [1–4]. Использование радиотерапии в комбинации с химиотерапией может давать хороший результат, так как многие противоопухолевые лекарства усиливают цитотоксическое действие облучения на раковые клетки. Однако такое комбинирование не всегда эффективно, потому что некоторые злокачественные опухоли обладают так называемой “множественной лекарственной устойчивостью”, когда специальные мембранные транспортеры быстро избавляют раковую клетку от проникающих в нее фармпрепаратов [5, 6]; в таких случаях гипертермия представляется альтернативным способом радиосенсибилизации.
Основной целью данного исследования была проверка возможности применения гипертермической обработки для радиосенсибилизации опухолевых клеток, обладающих радио- и химиорезистентеным фенотипом. Для этого проводились сравнительные эксперименты на клетках MCF-7 – охарактеризованной клеточной линии, происходящей из карциномы молочной железы человека, и клетках сублинии MCF-7/MDR1, которые более радиорезистентны, чем клетки материнской линии MCF-7 [7], а кроме того, обладают выраженным химиорезистентным фенотипом благодаря гиперэкспрессии в них гена MDR1, ответственного за множественную лекарственную устойчивость [6]. Функционально активным продуктом этого гена является трансмембранный гликопротеин gp170, работающий как АТФ-зависимый насос, способный выкачивать из клетки некоторые ксенобиотики, в том числе противоопухолевые агенты [6]. Ранее было показано, что те концентрации доксорубицина и низкомолекулярных ингибиторов активности HSP90, которые оказывали сильное радиосенсибилизирующее действие на клетки MCF-7, практически не влияли на радиочувствительность клеток MCF-7/MDR1 [7]. Таким образом, сравнение этих двух клеточных линий представляется хорошей экспериментальной моделью в рамках заявленной цели.
Кроме того, нас интересовали молекулярные механизмы термо-радиосенсибилизации опухолей. Известно, что на молекулярно-клеточном уровне радиосенсибилизирующие эффекты гипертермического стресса позитивно коррелируют со степенью его протеотоксичности, которая выражается в тепловой денатурации и агрегации многих термолабильных клеточных белков, причем в этот процесс вовлечены белки теплового шока HSP90, HSP70, HSP27 и др. [8]. Также известно, что клетки млекопитающих специфически реагируют на любое протеотоксическое воздействие, запуская транскрипционный стресс-ответ, при котором активируется транскрипционный фактор HSF1 и начинается HSF1-опосредованная транс-крипция генов HSP [9]. Поэтому, чтобы сравнить реакции клеток MCF-7 и MCF-7/MDR1 на протеотоксичность гипертермического стресса, мы оценивали в них динамику теплового (транскрипционного) стресс-ответа и динамику ко-агрегации HSP90, HSP70 и HSP27 с термо-денатурированными клеточными белками.
МАТЕРИАЛЫ И МЕТОДИКА
Основная часть работы проводилась на клетках линейной культуры MCF-7/MDR1. Эта радиорезистентная клеточная линия происходит из злокачественной опухоли молочной железы человека и демонстрирует феномен множественной лекарственной устойчивости из-за гиперэкспрессии MDR1-гена. В сравнительных экспериментах использовали культуры клеток материнской линии MCF-7, которые не обладают химио- и радиорезистентностью.
Выращенные в чашках Петри клетки подвергали воздействию γ-излучения (2–8 Гр, терапевтическая установка с источником 60Со).
Гипертермическую обработку клеток проводили перед облучением, погружая герметично закрытые чашки Петри с клеточными культурами в термостатированную водяную баню RC6 LAUDA (Германия) с температурой 42–44°С. Кроме температуры, варьировали продолжительность пребывания клеток в условиях гипертермии.
Относительные количества апоптотических и некротических клеток определяли на проточном цитофлуориметре “FACS Vantage” (Becton Dickinson, США) после двойного окрашивания клеточных суспензий ФИТЦ-меченным аннексином V и йодистым пропидием по известной методике [10].
Активность работы выкачивающего мембранного насоса (продукт гена MDR1 gp170) оценивали на том же проточном цитофлуориметре после окрашивания клеточных суспензий флуоресцирующим красителем Hoechst 33342 (Invitrogen, США).
Выживаемость обработанных клеток оценивали в МТТ-тесте, а также по клоногенности (т.е. способности образовывать многоклеточные колонии после цитотоксических воздействий) [10]. Значения факторов изменения дозы (ФИД) для 10% выживания облученных клеток рассчитывали из кривых роста клеточных колоний, как описано ранее [7].
Для анализа уровня экспрессии генов осуществляли сбор проб РНК спустя 0 (сразу после воздействия), 2, 4 и 24 ч после гипертермической обработки клеток (43°C в течение 1 ч в водяной бане), а также в контрольных клетках, не подвергавшихся действию повышенной температуры. Клетки лизировали при помощи реагента RNAzol (Sigma, США). Дальнейшее выделение и очистку РНК проводили согласно инструкции производителя. Качество очищенной РНК проверяли при помощи электрофореза по соотношению 16S и 28S рибосомальной РНК в пробе, а также на спектрофотометре “NanoDrop” (NanoDrop Technologies, США). По 1 мкг РНК с каждой пробы брали для получения кДНК при помощи набора реагентов High-Capacity cDNA Reverse Transcription Kit (Applied Biosystems, США) согласно протоколу производителя. Реакцию обратной транс-крипции проводили в амплификаторе “Терцик” (ДНК-технология, Россия). Анализ уровня экспрессии генов осуществляли при помощи ПЦР с детекцией в реальном времени (ПЦР-РВ) на амплификаторе “Rotor Genе” (“Corbet Research”, Австралия) с использованием набора реагентов “SYBR ® Premix Ex Taq™ II” (TaKaRa Bio Inc., Япония) согласно инструкции производителя. Обработку данных для анализа изменения уровня экспрессии генов, что отражает транскрипционный ответ на ГТ, проводили методом дельта-дельта Ct [11], в качестве референсного был выбран ген “домашнего хозяйства” ALAS1. Последовательности прямых и обратных праймеров, используемых в работе, приведены в табл. 1.
Таблица 1.
Последовательности праймеров, используемых в работе Table 1. Sequences of primers used in the work
| № | Целевой ген | Последовательность 5' → 3' и тип праймера (F – прямой, R – обратный) |
Длина ампликона, п.о. |
|---|---|---|---|
| 1 | HSP27 | F: GTGTCCCTGGATGTCAACCACTT | 112 |
| 2 | R: TGTAGCCATGCTCGTCCTGC | ||
| 3 | HSP70 | F: CCTGCGAGAGGGCCAAGA | 111 |
| 4 | R: CGAACCTCGCCCTGGTGA | ||
| 5 | ALAS1 | F: TGCTGCAAAGATCTGACCCCTC | 113 |
| 6 | R: AAACTCATGGGCCACATCACAC |
Изменения относительного содержания шаперонов HSP90, HSP70 и HSP27 в цитозольной (Тритон Х-100-растворимой) и в содержащей белковые агрегаты ядерно-цитоскелетной (Тритон Х-100-нерастворимой) фракциях определяли с помощью иммуноблоттинга и последующего сканирования проявленных блотов [12, 13]. После теплового стресса клетки инкубировали в присутствии циклогексимида (50 мкг/мл), чтобы исключить прирост содержания HSPs в цитозоле за счет их de novo синтеза.
Все количественные результаты представлены как усредненные данные 4–6 независимых экспериментов с тремя повторностями для каждой точки. Статистическую обработку результатов проводили по критерию Манна–Уитни с помощью программы “Statistica 6.0” (“Microcal Softcare, Inc.”).
РЕЗУЛЬТАТЫ
Поскольку ранее нами было установлено, что химиорезистентные клетки линии MCF-7/MDR1 более устойчивы к облучению, чем клетки MCF-7 [7], важно было сравнить термочувствительность этих двух опухолевых культур. Результаты МТТ-теста, представленные на рис. 1, как и данные по определению апоптоза и некроза после прогрева (см. контроль без облучения на рис. 2), показывают, что по сравнению с клетками MCF-7 клетки MCF-7/MDR1 не являются значимо более терморезистентными. Такое сходство реакций на гипертермию в этих двух культурах позволяло предположить, что клетки MCF-7/MDR1 тоже возможно радиосенсибилизировать путем предварительного прогрева.
Рис. 1.
Результаты МТТ-теста, демонстрирующие близкую термочувствительность клеток MCF-7 и MCF-7/MDR1. Среднее значение оптической плотности, полученное для образцов клеток при нормальной температуре (37°С), принимали за 100%.
Fig. 1. MTT test results showing similar radiosensitivity of MCF-7 and MCF-7/MDR1 cells. The average optical density obtained for cell samples at normal temperature (37°C) was taken as 100%.
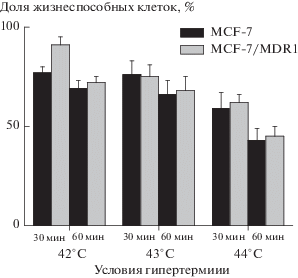
Рис. 2.
Процент апоптоза и некроза в клетках MCF-7 и MCF-7/MDR1, подвергнутых гипертермии, облучению или комбинации обоих воздействий. * Значимое отличие от показателей, представленных в виде соседнего (черного) столбика, р < 0.05. ** Значимое отличие от показателей, представленных в виде пары столбиков с пометкой 4 Гр, p < 0.05.
Fig. 2. Percentage of apoptosis and necrosis in MCF-7 and MCF-7/MDR1 cells exposed to hyperthermia, radiation, or a combination of both. * Significant difference from the neighboring (black) column, p < 0.05. ** Significant difference from a pair of columns marked 4 Gy, p < 0.05.

Действительно, сравнительный анализ клоногенности клеток MCF-7/MDR1, облученных без или после прогрева, выявил радиосенсибилизирующие эффекты гипертермической предобработки, причем степень радиосенсибилизации коррелировала с температурой прогрева (рис. 3). В табл. 2 приведены величины факторов изменения дозы (ФИД), рассчитанные для 10%-ной выживаемости прогретых и облученных клеток обеих линий. Из представленных данных следует, что в качестве радиосенсибилизирующего воздействия гипертермия не менее эффективна для клеток MCF-7/MDR1, чем для клеток MCF-7. Сравнив значения ФИД, можно заметить, что степень радиосенсибилизации прогретых клеток MCF-7/MDR1 вполне сопоставима с таковой в клетках MCF-7, обработанных проникающими в клетку низкомолекулярными радиосенсибилизаторами (см. [7]). Радиосенсибилизирующий эффект гипертермии проявлялся не только в падении клоногенности (рис. 3, табл. 2), но и в значительном усилении пострадиационной клеточной гибели. А именно, более чем трехкратное увеличение уровня пострадиационного апоптоза имело место в образцах прогретых клеток MCF-7/MDR1 по сравнению с клетками этой же линии, не подвергшихся гипертермическому воздействию. Причем этот прирост апоптотической фракции был даже больше, чем в прогретых и облученных клетках MCF-7 (рис. 2). В целом результаты анализа клоногенности и клеточной гибели хорошо согласуются друг с другом. В совокупности все это доказывает возможность эффективного использования гипертермии для радиосенсибилизации радиорезистентных опухолей, невосприимчивых к фармакологическим радиосенсибилизаторам.
Рис. 3.
Результаты теста на клоногенность, демонстрирующие термо-радиосенсибилизацию клеток MCF-7 и MCF-7/MDR1. Выживаемость колоний, полученную для образцов клеток при нормальной температуре (37°С), принимали за 100%.
Fig. 3. Clonogenicity test results showing thermo-radiosensitization of MCF-7 and MCF-7/MDR1 cells. The colony survival rate obtained for cell samples at normal temperature (37°C) was taken as 100%.

Таблица 2.
Значения ФИД для клеток MCF-7 и MCF-7/MDR1, радиосенсибилизированных предварительным прогревом Table 2. FID values for MCF-7 and MCF-7/MDR1 cells radiosensitized by preheating
| Воздействие/клетки | Гипертермия: 42°С, 90 мин | Гипертермия: 43°С, 60 мин | Гипертермия: 44°С, 30 мин |
|---|---|---|---|
| MCF-7 | ФИД = 1.15 | ФИД = 1.34 | ФИД = 1.53 |
| MCF-7/MDR1 | ФИД = 1.26 | ФИД = 1.30 | ФИД = 1.60 |
Мы также старались исследовать молекулярные механизмы выявленного феномена. Принято считать, что в основе радиосенсибилизирующего действия гипертермии лежит термо-денатурация и агрегация белков в клетках-мишенях, что приводит к нарушению клеточного гомеостаза и серьезно затрудняет реализацию механизмов радиопротекции и пострадиационного восстановления [3]. Поскольку ранее были показаны корреляции радиосенсибилизирующих эффектов гипертермии с протеотоксичностью теплового воздействия [8], здесь мы сравнивали проявления протеотоксичности в прогретых клетках MCF-7/MDR1 и MCF-7. Характерными клеточными реакциями на протеотоксический стресс являются активация транскрипционного фактора HSF1 и HSF1-опосредованная экспрессия генов индуцибельных HSP [9]. Поэтому мы проанализировали динамику экспрессии генов индуцибельных HSP27 и HSP70 в двух клеточных культурах, подвергнутых тепловому стрессу, с целью сравнительной оценки протеотоксичности. Эта динамика должна отражать степень повреждения (термо-денатурации) клеточных белков в том и другом случаях. В ходе работы было установлено, что клетки обеих линий – и химиочувствительные клетки MCF-7, и химиорезистентные клетки MCF-7/MDR1, в первые четыре часа после прогрева сходным образом отвечают на тепловой стресс. А именно, запускается экспрессия генов HSP27 и HSP70 (рис. 3) уже в момент действия высокой температуры, и затем наращивается уровень мРНК этих генов в течение, как минимум, 4 ч после окончания прогрева. Эти результаты подтверждают, что химиорезистентные клетки MCF-7/MDR1 почти столь же чувствительны к действию повышенной температуры, как и химиочувствительные клетки MCF-7.
Ранее было показано, что сила радиосенсибилизирующих, цитотоксических и протеотоксических эффектов гипертермии коррелирует с истощением цитозольного пула шаперонов (HSP) за счет их перехода в Тритон Х-100-нерастворимую (ядерно-цитоскелетную) фракцию в результате связывания с термо-денатурированными клеточными белками [8]. В этой работе мы проводили аналогичные исследования, чтобы сравнить динамику “инсолюбилизации” HSP90, HSP70 и HSP27 в прогретых клетках MCF-7 и MCF-7/MDR1. Результаты, представленные в табл. 3, демонстрируют для обоих вариантов схожую динамику накопления HSP в ядерно-цитоскелетной фракции, что должно говорить о примерно одинаковых уровнях и скорости термо-денатурации внутриклеточных белков в той и другой культуре. Данные табл. 3 находятся в полном соответствии с показателями, представленными на рис. 4, а также с результатами по клеточной гибели и клоногенности (см. рис. 1–3 и табл. 2).
Таблица 3.
Накопление цитозольных шаперонов (HSP90, HSP70 и HSP27) в Тритон Х-100-нерастворимых фракциях из клеток MCF-7 и MCF-7/MDR1 Table 3. Accumulation of cytosolic chaperones (HSP90, HSP70 and HSP27) in Triton X-100-insoluble fractions from MCF-7 and MCF-7/MDR1 cells
| Линия клеток | 43°С, 20 мин | 43°С, 40 мин | 43°С, 60 мин | ||||||
|---|---|---|---|---|---|---|---|---|---|
| HSP90 | HSP70 | HSP27 | HSP90 | HSP70 | HSP27 | HSP90 | HSP70 | HSP27 | |
| MCF-7 | 20 ± 5% | 22 ± 4% | 25 ± 6% | 55 ± 8% | 51 ± 8% | 44 ± 7% | 80 ± 9% | 72 ± 9% | 63 ± 8% |
| MCF-7/MDR1 | 19 ± 4% | 25 ± 7% | 22 ± 6% | 57 ± 7% | 50 ± 6% | 38 ± 5% | 82 ± 9% | 70 ± 8% | 65 ± 7% |
Рис. 4.
Динамика изменения уровня экспрессии генов HSP27 и HSP70 в ответ на гипертермию. По оси ординат отложена кратность изменения уровня экспрессии гена HSP27 и HSP70 относительно уровня экспрессии этого же гена в контроле (принят за 1). Условные обозначения: “К” – контроль; “43°C” – сразу после прогрева; “43°C + 2 ч”, “43°C + 4 ч”, “43°C + 24 ч” – через 2, 4 и 24 ч после прогрева соответственно.
Fig. 4. Dynamics of changes in the level of expression of HSP27 and HSP70 genes in response to hyperthermia. On the ordinat-axis pending the frequency change of the gene expression levels of HSP27 and HSP70 relative expression level of that gene in the control (taken as 1). Symbols: “C” – control; “43°C” – immediately after heating up; “43°C + 2 h”, “43°C + 4 h”, “43°C + 24 h” – 2, 4 and 24 hours after heating up, respectively.

ОБСУЖДЕНИЕ
Установлено, что гипертермическая предобработка может значительно усилить цитотоксическое действие γ-излучения на радиорезистентные опухолевые клетки линии MCF-7/MDR1, которые, как было ранее показано, невосприимчивы к “химиотерапевтическим” радиосенсибилизаторам, таким как доксорубицин, таксол или 17AAG [7]. Даже относительно мягкие условия гипертермической предобработки позволяли снизить пострадиационую клоногенность MCF-7/MDR1 клеток на 50–80% (рис. 3).
Полученные результаты позволяют утверждать, что раковые клетки с химио- и радиорезистентными фенотипами не обязательно обладают еще и терморезистентностью, причем этот факт можно использовать в терапевтических целях. Чтобы понять молекулярную природу обнаруженного феномена, необходимо обсудить механизмы, благодаря которым происходит радиосенсибилизация прогретых клеток-мишеней. Известно, что радиосенсибилизирующие эффекты гипертермии обусловлены, в основном, ее протеотоксичностью, т.е. повреждающим действием теплового стресса на термолабильные клеточные белки, которые денатурируют, теряют функциональную активность и образуют агрегаты. Инактивация и агрегация многих белков в ядре, цитоплазме и органеллах прогретой клетки приводят к нарушению биосинтеза, сигнальной регуляции, ионному дисбалансу и пр., что делает ее более уязвимой к облучению [3, 8]. Соответственно, оценивая уровень протеотоксичности того или иного воздействия на клетки, можно сделать вывод относительно эффективности ожидаемой радиосенсибилизации. Внутриклеточным сенсором протеотоксичности можно считать транскрипционный фактор HSF1, который активируется в ответ на появление в цитоплазме денатурированных и агрегированных белков [9]. Прямым следствием активации HSF1 являются транскрипция HSP генов и накопление мРНК, кодирующих индуцибельные HSPs, что можно определить с помощью ПЦР; именно такой подход был нами применен для генов HSP70 и HSP27. Из полученных результатов следует, что в прогретых клетках той и другой культуры HSF1-опосредованные реакции довольно похожи (см. рис. 4), и это говорит о близких уровнях протеотоксичности в обоих случаях, а значит, объясняет, почему термо-радиосенсибилизация практически равно эффективна для клеток MCF-7 и для радиорезистентных клеток MCF-7/MDR1.
Важным событием в механизме термо-радиосенсибилизации раковых клеток является, на наш взгляд, переход цитозольных HSP90, HSP70 и HSP27 в Тритон Х-100-нерастворимую фракцию прогретых клеток (см. табл. 3). Такая спровоцированная клеточным стрессом “инсолюбилизация” шаперонов была описана еще давно [12, 13], и причины этого явления более менее понятны. Когда в испытавшей тепловой шок клетке многие белки денатурируют и агрегируют, HSPs активно вовлекаются в этот процесс, узнавая белковые молекулы с нарушением нативной структуры и образуя с ними шаперон-субстратные комплексы. Так, цитозольные HSPs коагрегируют с денатурированными белками, и эти агрегаты, достигнув определенных размеров и массы, седиментируют при низкоскоростном центрифугировании клеточных лизатов в Тритон Х-100-содержащем буфере [12, 13]. Другая причина обогащения шаперонами Тритон Х-100-нерастворимой (ядерно-цитоскелетной) фракции прогретых клеток – это то, что цитозольные HSPs связываются с поврежденными сайтами изначально нерастворимых в детергенте белковых структур цитоскелета, хроматина и ядерного матрикса. И одно, и другое являются естественным проявлением биологической (шаперонной) функции HSPs, которые должны взаимодействовать с поврежденными стрессом белками, чтобы способствовать их ренатурации и дезагрегации или деградации [12, 13]. Считается, что “отвлечение” HSP70 и HSP90 на взаимодействие с денатурированными белками приводит к распаду комплексов HSP70-HSF1-HSP90, благодаря чему HSF1 освобождается, активируется и запускает транскрипцию HSP генов [9]. Важно, что в течение какого-то промежутка времени после прогрева шаперонная функция HSPs может быть в конфликте с их антиапоптотической функцией. Действительно, и HSP90, и HSP70, и HSP27 известны как эндогенные супрессоры апоптоза; они образуют ингибирующие комплексы с эффекторами апоптоза (цитохром-Ц, Apaf-1, каспазы и др.) или активирующие комплексы с антиапоптотическими белками (Akt, сюрвивин и др.) и таким образом способны блокировать каскады реакций, ведущие к апоптотической гибели клетки [14, 15]. Сразу после теплового шока в клетке, вероятно, возникает своего рода конкуренция между белковыми субстратами за связывание с цитозольными шаперонами (HSPs) [8]. Очевидно, что появившиеся в большом количестве термо-денатурированные внутриклеточные белки будут рекрутировать HSP90, HSP70 и HSP27, тем самым не давая этим шаперонам взаимодействовать с белками-регуляторами апоптоза и прерывать исполнение апоптотического сценария. По своей сути, такие внутриклеточные конфликты и конкуренции есть осуществление физиологического “контроля качества”: клетка, перенесшая стресс и получившая слишком серьезные повреждения, должна быть элиминирована через апоптоз. Здесь мы показали, что этот же механизм, по-видимому, можно реализовать и в отношении радиорезистентных опухолевых клеток: в прогретых MCF-7/MDR1 клетках истощается цитозольный пул шаперонов (см. табл. 3), и после облучения в них интенсифицируется апоптоз (см. рис. 2), что свидетельствует о термо-радиосенсибилизации этих клеток, которая определялась и в других тестах (рис. 1 и 3).
Множественная лекарственная устойчивость опухолей является одной из главных проблем в лечении рака. Многие злокачественные новообразования человека оказываются устойчивыми к химиотерапии или приобретают такую устойчивость в процессе лечения [5]. Если опухоль, демонстрирующая множественную лекарственную устойчивость, к тому же еще и радиорезистента, это резко сужает возможности консервативной терапии, тем более что применение фармакологических радиосенсибилизаторов не имеет здесь перспектив по понятной причине. Мы полагаем, что в таких случаях гипертермия, вызывающая радиосенсибилизацию химио- и радиорезистентных опухолей, может существенно повысить эффективность лучевой терапии. В пользу этого говорят наши экспериментальные данные, полученные на сублинии опухолевых клеток MCF-7/MDR1, обладающих химио- и радиорезистентностью. Современные устройства для клинической гипертермии позволяют с помощью фокусирования высокочастотных или ультрачастотных электромагнитных полей создавать локальный прогрев опухоли-мишени без серьезного повреждения прилегающих нормальных тканей [16]. Следовательно, предлагаемый нами способ вполне применим на практике.
ЗАКЛЮЧЕНИЕ
Данное исследование показало, что терморезистентность не ассоциируется с радио- и химиорезистентным фенотипом раковых клеток и, следовательно, локальная гипертермия может успешно применяться для радиосенсибилизации радиорезистентных солидных опухолей, обладающих множественной лекарственной устойчивостью.
Список литературы
Hyperthermic oncology from bench to bedside / Eds. S. Kokura, T. Yoshikawa, T. Ohnishi. Springer, 2016. 444 p.
Peeken J.C., Vaupel P., Combs S.E. Integrating hyperthermia into modern radiation oncology: What evidence is necessary? // Front. Oncol. 2017 Jun 30. V. 7. P. 132. https://doi.org/10.3389/fonc.2017.00132
Кабаков А.Е., Анохин Ю.Н., Лебедева Т.В. Реакции нормальных и опухолевых клеток и тканей на гипертермию в сочетании с ионизирующей радиацией. Обзор // Радиация и риск. 2018. Т. 27. № 4. С. 141–154. [Kabakov A.E., Anokhin Yu.N., Lebe-deva T.V. Reactions of normal and tumor cells and tissues to hyperthermia in combination with ionizing radiation. Review // Radiation and risk. 2018. V. 27. № 4. P. 141–154. (in Russian)]
Курпешев О.К., ван дер Зее Я. Анализ результатов рандомизированных исследований по гипертермии в онкологии. Обзор // Медиц. радиология и радиац. безопасность. 2018. Т. 63. № 3. С. 52–67. [Kurpeshev O.K., van der Zee J. Results of Randomized Studies on Hyperthermia in Oncology // Medical Radiology and Radiation Safety. 2018. V. 63. № 3. P. 52–67. (in Russian)] https://doi.org/10.12737/article_5b179d60437d54.24079640
Mansoori B., Mohammadi A., Davudian S. et al. The different mechanisms of cancer drug resistance: A brief review // Adv. Pharm. Bull. 2017 Sep. V. 7. № 3. P. 339–348. https://doi.org/10.15171/apb.2017.041
Katayama K., Noguchi K., and Sugimoto Y. Regulations of P-glycoprotein/ABCB1/MDR1 in human cancer cells // New J. Sci. V. 2014. Art. ID 476974. 10 p. https://doi.org/10.1155/2014/476974
Kudryavtsev V.A., Khokhlova A.V., Mosina V.A. et al. Induction of Hsp70 in tumor cells treated with inhibitors of the Hsp90 activity: A predictive marker and promi-sing target for radiosensitization // PLoS One. 2017. Mar. 14. V. 12. № 3. e0173640. https://doi.org/10.1371/journal.pone.0173640
Кабаков А.Е., Кудрявцев В.А., Хохлова А.В. и др. Апоптоз в опухолевых клетках, подвергнутых сочетанному действию гипертермии и облучения: исследование молекулярных механизмов и мишеней // Радиация и риск. 2018. Т. 27. № 2. С. 62–75. [Kabakov A.E., Kudryavtsev V.A., Khokhlova A.V. et al. Apoptosis in tumor cells subjected to the combined action of hyperthermia and irradiation: a study of the molecular mechanisms and targets // Radiation and Risk. 2018. V. 27. № 2. P. 62–75. (in Russian)]
Anckar J., Sistonen L. Regulation of HSF1 function in the heat stress response: implications in aging and disease // Annu Rev. Biochem. 2011. V. 80. P. 1089–1115. https://doi.org/10.1146/annurev-biochem-060809-095203
Kabakov A.E., Gabai V.L. Cell death and survival assays // Meth. Mol. Biol. 2018. V. 1709. P. 107–127.
Schmittgen T.D., Livak K.J. Analyzing real-time PCR data by the comparative C(T) method // Nature Prot. 2008. V. 3. № 6. P. 1101–1108.
Kabakov A.E., Gabai V.L. Protein aggregation as primary and characteristic cell reaction to various stresses // Experientia. 1993. V. 49. № 8. P. 706–713.
Kabakov A.E., Gabai V.L. Stress-induced insolubilization of certain proteins in ascites tumor cells // Arch. Biochem. Biophys. 1994. V. 309. № 2. P. 247–253.
Kabakov A.E., Kudryavtsev V.A. Heat shock proteins as molecular targets for anticancer therapy: approaches, agents, and trends // Heat shock proteins. Classifications, functions, and applications / Ed. S. Usmani. New York: Nova Science Publishers, 2013. P. 25–56.
Kennedy D., Jager R., Mosser D.D. et al. Regulation of apoptosis by heat shock proteins // IUBMB Life. 2014. V. 66. № 5. P. 327–338.
Курпешев О.K., van der Zee J. Локорегионарная гипертермия злокачественных опухолей: Методики, термометрия, аппаратура // Мед. радиология и радиац. безопасность. 2017. Т. 62. № 5. С. 52–63. [Kurpeshev O.K., van der Zee J. Locoregional Hyperthermia of Malignant Tumors: Methods, Thermometry, Machines // Medical Radiology and Radiation Safety. 2017. V. 62. № 5. P. 52–63. (in Russian)]
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология


