Радиационная биология. Радиоэкология, 2020, T. 60, № 5, стр. 507-515
ОСОБЕННОСТИ ГЕНОТОКСИЧЕСКОГО ДЕЙСТВИЯ α-ИЗЛУЧЕНИЯ В ТЕСТ-СИСТЕМАХ Drosophila melanogaster
З. М. Бияшева 1, *, М. Ж. Тлеубергенова 1, Ю. А. Зарипова 1, В. В. Дьячков 1, С. Ж. Колумбаева 1
1 Казахский национальный университет имени аль-Фараби,
Научно-исследовательский институт проблем биологии и биотехнологии
Алматы, Казахстан
* E-mail: zaremabiya@gmail.com
Поступила в редакцию 26.07.2019
После доработки 12.10.2019
Принята к публикации 20.11.2019
Аннотация
Радон является естественным радиоактивным газом без цвета и запаха, а дочерние продукты его распада (ДПР) являются радиоизотопами – источниками α-излучения в окружающей среде. Вдоль короткого пути α-частицы генерируют большое число ионов, т.е. обладают высокой ионизирующей способностью, что обусловливает относительно высокую биологическую активность этого излучения, в 10 раз превышающую таковую для β- и γ-радиации. В связи с этим нами были проведены исследования генотоксических эффектов α-излучения с использованием разных тест-систем на плодовой мушке Drosophila melanogaster: Меллер-5 (Basc), спаянных (сцепленных) Х-хромосом и сцепленных ХY-хромосом. Долгоживущий изотоп радона – 222Rn имеет основную α-линию с энергией 5.5 МэВ, а создавать достаточно интенсивные и направленные пучки α-излучения этого радионуклида технически затруднительно. Поэтому для моделирующих экспериментов был выбран изотоп 238Pu, имеющий необходимую α-линию при распаде, равную 5.5 МэВ. В первом и втором поколениях наблюдали следующие морфологические нарушения: различные морфозы крыльев (асимметрии, отсутствие крыла), глаз, тела, торакса, антенн, образование меланом на разных участках тела, которые проявлялись вплоть до F3 и исчезали в F4. Эти выявленные эффекты указывают на генотоксическую и канцерогенную активность радона и его дочерних продуктов распада. Полученные данные свидетельствуют о том, что α-излучение, использованное в эксперименте для моделирования ситуации на радоноопасных территориях, обладает генотоксическим влиянием, проявляющимся, в основном, в формировании морфозов или уродств.
Казахстан занимает второе место в мире по запасам урана, что составляет примерно 12% мировых запасов урана [1]. Естественно, богатые залежи урана обеспечивают высокий радиационный фон, который в регионах Казахстана весьма разнообразен и составляет в среднем 3.2 мЗв/год [2].
При распаде урана образуется инертный радиоактивный газ – радон. Изотопы радона обладают весьма коротким периодом полураспада, однако на их долю приходятся 2.12 мЗв/год от средней суммарной дозы облучения человека [3]. Радон является источником α-излучения, представляющего собой поток положительно заряженных ядер гелия. Из-за относительно крупных размеров α-частицы обладают малой проникающей способностью, но имеют наибольшую плотность ионизации, поэтому для этого излучения типична более высокая относительная биологическая эффективность в отличие от таковой для β- и γ-радиации [4]. Попадая в организм, α-частицы могут вызывать микроожоги, повреждать клетки, генетический материал и стать причиной появления раковых клеток.
По данным Научного комитета по действию атомной радиации (НКДАР) ООН, радон является причиной около 20% всех заболеваний раком легких в мире. Воздействие радона считается первой причиной рака легких у никогда не курящих [5]. Кроме того, этот газ может усиливать эффекты воздействия других факторов, таких как сигаретный дым, пыль и выхлопные газы. Табачный дым увеличивает онкогенный эффект радона в 2–10 раз, и, что наиболее важно, радон значительно снижает латентный период при раке легкого [6, 7]. Исследования, проведенные Агентством по охране окружающей среды США, показали, что связанные с радоном заболевания рака легких у курящих в 3 раза выше, чем у некурящих из той же группы населения [8].
Радон высвобождается из земной коры повсеместно, его концентрация существенно различается для различных точек земного шара. Алматинская область ввиду наличия большого количества тектонических разломов, усиливающих эманацию радона, может быть отнесена к радоноопасным территориям. В связи с этим нами были проведены исследования генотоксических эффектов α-излучения с использованием разных тест-систем на плодовой мушке Drosophila melanogaster.
МАТЕРИАЛЫ И МЕТОДИКА
С целью изучения генетических последствий, возникающих в тест-системах дрозофил при воздействии α-излучения изотопов радона, планировали использовать долгоживущий изотоп радона – 222Rn, который генерирует основную α-линию с энергией 5.5 МэВ. Однако создать достаточно интенсивные и направленные пучки α-излучения радона оказалось технически затруднительно. Поэтому для моделирующих экспериментов был выбран изотоп 238Pu, имеющий необходимую α-линию, при распаде равную 5.5 МэВ (рис. 1).
Рис. 1.
Спектр α-источника, используемого в экспериментах (полученный на α-спектрометре “МУЛЬТИРАД-АС” с полупроводниковым детектором).
Fig. 1. α-Source spectrum used in the experiments (obtained on the α-spectrometer “MULTIRAD-AS” with a semiconductor detector).

Использовали изотоп 238Рu в стальных образцах спектрометрических источников с активностью радионуклида в источнике 4.01 × 104 Бк, периодом полураспада 3.205 × 104 дней и потоком α-частиц через рабочую поверхность источника в телесный угол 2π – 1.99 × 104 ср/с.
Такой источник генерирует α-частицы, которые вдоль короткого пути создают большое число ионов, т.е. обусловливают большую линейную плотность ионизации. Это обеспечивает выраженную относительную биологическую эффективность, в 10 раз большую, чем таковая для рентгеновского и γ-излучений. Поэтому α-частицы могут вызвать тяжелые последствия при непосредственном попадании в организм человека. В тканях и клетках живых организмов образуются свободные радикалы. Радиоактивные изотопы фактически не выводятся из организма самостоятельно, поэтому они будут накапливаться и облучать ткани изнутри на протяжении многих лет, пока не приведут к серьезным изменениям [9]. Организм человека не способен нейтрализовать, переработать, усвоить или утилизировать, большинство радиоактивных изотопов, попавших внутрь организма [10].
Для оценки генотоксической активности α-излучения использовали традиционные тест-системы Меллер-5 (Basc), спаянных (сцепленных) Х-хромосом и сцепленных ХY-хромосом Drоsорhilа melаnоgаster.
Метод Меллер-5 (Basc) позволяет выявить мутации в Х-хромосоме, приводящие к летальным исходам и морфологическим аномалиям во втором поколении. Схема опыта была разработана Г. Мёллерем. Им была синтезирована линия Basc с двумя инверсиями – sc8 и – sc49 (δ 49), которые препятствуют кроссинговеру между половыми хромосомами. Инверсия sc8 захватывает большую часть Х-хромосомы. Поскольку в длинных инверсиях перекрест все же происходит, в инверсию sc8 введена другая, более короткая инверсия, δ 49, которая подавляет перекрест в средней области Х-хромосомы. Порядок генов в хромосоме sc8 δ 49 нарушен дважды, и поэтому перекрест в ней полностью исключен. Обе инверсии не связаны с рецессивным летальным действием, и гомозиготные по хромосоме Меллер-5 самки и такие же гемизиготные самцы жизнеспособны [11]. Фенотипическими маркерами служат рецессивная мутация wа – абрикосовые глаза и полудоминантная мутация Bar – полосковидные глаза.
В качестве второй тест-системы использовали спаянные, или сцепленные, Х-хромосомы, что позволяет обнаружить видимые рецессивные, сцепленные с полом мутации в первом поколении у самцов [12]. Метод основан на том, что сцепленные Х-хромосомы всегда передаются вместе, так как они соединены по центромере. У самок со сцепленными Х-хромосомами в генотипе присутствует также Y-хромосома, которую они получают от отца. При скрещивании таких самок ($\widehat {{\text{XX}}}{\text{Y}}$) с нормальными самцами (XY) в следующем поколении рождаются самки ($\widehat {{\text{XX}}}{\text{Y}}$) и самцы, получающие одну Х-хромосому от отцовской особи, а Y-хромосому от материнской [13]. В эксперименте использовали самок дрозофилы линии 1-112. Фенотипическими маркерами были гены y (yellow) – желтое тело, w – белые глаза, f (forked) – короткие вильчатые щетинки.
В третьей тест-системе использовали генетическую линию ЭП-2, которая имеет сцепленные Х-хромосомы и XY-хромосомы. Фенотипическими маркерами линии ЭП-2 являются гены y (yellow) – желтое тело, v (vermillion) – алые глаза у самок. Линии 1-112 и ЭП-2 были синтезированы в Институте молекулярной и клеточной биологии СО РАН (г. Новосибирск) и любезно нам предоставлены.
Таким образом, в эксперименте использовали тест-системы Меллер-5, 1-112 и ЭП-2. Самцов дрозофилы подвергали воздействию α-излучения на смонтированной установке из стекла (рис. 2). Виргинных самок этих линий скрещивали с облученными самцами дикого типа (линия Oregon).
Рис. 2.
Установка для воздействия α-излучением на имаго дрозофилы (D – диаметр стального образца спектрометрического источника α-излучения; h – высота кюветы; I – толщина питательной среды).
Fig. 2. Installation for α-radiation exposure on drosophila imago (D – the diameter of the steel spectrometric α-radiation source sample; h – the cuvette height; I – the nutrient medium thickness).
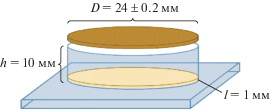
На дно стеклянных кюветов заливали питательную среду, приготовленную по общепринятой методике, толщиной 1 мм [14]. В каждую кювету помещали до 50 имаго дрозофилы. Одна кювета не облучалась и являлась контрольной, на вторую кювету накладывали источник – изотоп 238Рu (стальные образцы спектрометрических источников α-излучения). Общий размер источника составляет 24.0 ± 0.2 мм, диаметр полированной части 16 ± 2 мм. Источник находился непосредственно сверху исследуемого образца, чтобы он весь подвергался воздействию α-излучения.
Перед началом эксперимента исходные тестерные генетические линии плодовых мушек дрозофилы были проверены цитологически на наличие инверсий и сцепленных половых хромосом на временных препаратах политенных хромосом слюнных желез дрозофил.
Культивирование мух, отбор и скрещивание проводились при температуре 23–25°C, которая является наиболее оптимальной температурой для развития Drosophila melanogaster. Самцов подвергали воздействию α-излучения в течение 24 ч. Поглощенная доза с учетом взвешенного коэффициента по α-излучению (Wα ≡ 20), которая может влиять на гормональный статус особи, составляла около 400–500 мГр [15]. Использовали самок и самцов не старше 5 дней, во избежание увеличения возрастного уровня мутирования.
В тест-системе Меллер-5 (Basc) скрещивания проводили по следующей схеме (рис. 3) [11]. В тест-системах ЭП-2 и 1-112 скрещивание проводили согласно схемам на рис. 4.
Рис. 3.
Схема скрещиваний по методу Меллер-5 для обнаружения мутаций в Х-хромосоме, приводящих к летальным исходам и морфологическим аномалиям в F2: 1 – самки Меллер-5; 2 – самки с серым телом, узкими абрикосового цвета глазами, гетерозиготные по вновь возникшей летальной мутации в Х-хромосоме; 3 – серые самцы с узкими абрикосового цвета глазами; 4 – самцы дикого типа, при наличии летальной мутаций в Х-хромосоме не развиваются. Жирной линией обозначена облученная Х-хромосома.
Fig. 3. Scheme of crosses by the Muller-5 method for revealing lethal and morphological mutations in X-chromosome F2: 1 – Muller-5 females; 2 – females with a gray body, narrow apricot eyes, heterozygote by inducing lethal mutations in X-chromosome; 3 – gray males with narrow apricot eyes; 4 – wild type males with a lethal mutation in X-chromosome are not develop. The bold line indicates the irradiated X-chromosome.
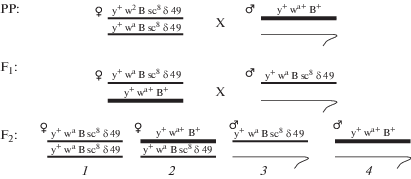
Рис. 4.
Схема генетического скрещивания самок 1-112 (a) и ЭП-2 (b), содержащих сцепленные Х-хромосомы и сцепленные XY-хромосомы с самцами линии Oregon.
Fig. 4. Scheme of females genetic crossing 1-112 (a) and PE-2 (b) containing linked X-chromosomes and linked XY-chromosomes with Oregon males.

Каждая пробирка второго поколения (F2) в тест-системе Меллер-5 и первого поколения (F1) в тест-системах сцепленных половых хромосом (1-112 и ЭП-2) подвергалась визуальному анализу после полного вылета генерации для выявления мутаций. Визуальный анализ сопровождался подсчетом количества мух без мутаций – a, c, и с условными мутациями (морфозами) – b, d.
Сравнение результатов в опыте и контроле проводили по методу χ2 с поправкой Иейтса [16]. Расчеты были выполнены по формуле:
где a, c – мухи без мутаций в опыте; b, d – мухи с мутациями в опыте; N – общее число мух.РЕЗУЛЬТАТЫ
В тест-системах со сцепленными половыми хромосомами были обнаружены только морфозы. В тест-системе М-5, помимо морфозов, были выявлены мутации нивелирования фертильности самцов, но для достоверного сравнения генотоксичности в разных тест-системах во внимание брали только морфозы. Образование морфозов – одно из проявлений условных мутаций, которые не связаны с первичной структурой ДНК и возникают в регуляторных генах, ответственных за образование признаков внутривидового сходства [17]. Морфозы – это ненаследственные морфологические нарушения (уродства), которые образуются в результате воздействия на организм стрессовых факторов внешней среды [18]. В нашем случае стрессовым фактором являлось α-излучение.
В результате анализа F1 и F2 были выявлены следующие морфологические нарушения: различные морфозы крыльев (асимметрии, отсутствие крыла), глаз, тела, торакса, антенн, образование меланом на разных участках тела (рис. 5–7).
Рис. 5.
Обнаруженные морфозы и новообразования у мух F2Drosophila melanogaster в тест-системе Меллер-5: А и B – черные пятна на теле (меланома); С – изменение формы крыльев; D – скрученные крылья с неправильным жилкованием); E – образование пузыря вместо одного крыла; F –сочетание нескольких морфозов: отсутствие крыла, деформация торакса, брюшка, щитка.
Fig. 5. Morphoses detected in flies F2Drosophila melanogaster in the Muller-5 test-system: A and B – black spots on the body (melanoma); C – changing the wings shape; D – twisted wings with irregular venation; E – the bubble formation instead a single wing; F – combination of several morphoses: wing absence, deformation of the thorax, abdomen, shield.

Рис. 6.
Обнаруженные морфозы и новообразования у мух F1Drosophila melanogaster в тест-системе ЭП-2: A – отсутствие одного крыла и меланома; B – меланома на правой стороне брюшка; C – черные пятнышки на брюшке; D – пятно на тораксе; Е – нарушение жилкования крыла и асимметрия; F – пятно на брюшке.
Fig. 6. Morphoses detected in flies F1Drosophila melanogaster in the PE-2 test-system: A – wing absence and melanoma; B – melanoma on the abdomen right side; C – black spots on the abdomen; D – spot on the thorax; E – violation of wing venation and asymmetry; F – spot on the abdomen.

Рис. 7.
Обнаруженные морфозы у мух F1Drosophila melanogaster в тест-системе 1-112: A – скрученное крыло; B – короткое правое крыло; C – нарушение фасеток глаза; D – отсутствие одного крыла; Е – изменение окраски торакса и ног, или “остекленение”; F – скрученные оплавленные крылья.
Fig. 7. Morphoses detected in flies F1Drosophila melanogaster in the 1-112 test-system: A – twisted wing; B – short right wing; C – violation of eye facets; D – wing absence; E – thorax and legs discoloration, or “glazing”; F – twisted fused wings.

Эти морфологические изменения указывают на генотоксическую и канцерогенную активность радона и его ДПР.
В тест-системах 1-112 и ЭП-2 было обнаружено большее относительное количество морфозов, чем в тест-системе Basc. Скорее всего, это связано с наблюдаемым в системах сцепленных половых хромосом эффектом положения генов. Данное явление было открыто А. Стёртевантом еще в 1925 г. [19], а в 1935 г. Н.П. Дубинин и Б.Н. Сидоров заметили, что при эффекте положения ген не теряется, а изменяется лишь его состояние [20]. С эффектом положения гена связаны и так называемые условные мутации (морфозы), потому что при таких мутациях чаще повреждаются не структурные, а регуляторные элементы генома, ответственные за транскрипцию, репликацию, компактизацию и другие важные процессы регуляции и реализации генетической информации [17]. Эффект положения проявляется в инактивации гена при перемещении его из эухроматиновых областей в гетерохроматиновые. У дрозофилы с развитием происходит изменение положения гетерохроматиновых областей, т.е. в процессе онтогенеза происходит активация одних районов хромосомы и инактивация других. Наличие сцепленных половых хромосом у линий 1-112 и ЭП-2 усиливает проявление эффекта положения [21].
Анализ имаго с морфозами показал, что последние практически не влияют на жизнедеятельность мух: не снижают выживаемость, способность спариваться и продуцировать генерации. У потомков облученных мух в F2 и до F4 можно наблюдать уродства (морфозы) различной степени выраженности, не влияющие на жизнеспособность и размножение мух. При обычных условиях культивирования дрозофил в отсутствие стрессовых факторов экспериментаторы также могут встретиться со случаями образования морфозов, но подобное происходит крайне редко [22].
Как видно из рисунков, морфозы могут затрагивать любую часть тела, либо одновременно несколько частей. В классификации морфозов можно выделить два основных типа: “ткань+” и “ткань–“ [23]. “Ткань+” – это различные новообразования тканей: темные пятна (или меланомы), похожие на некротические пятна, пузыри на крыльях и на брюшке. “Ткань–“ – это отсутствие части ткани или органов: отсутствие крыла, фасеток глаза или целого глаза, отсутствие ноги. Как отмечают исследователи и наблюдалось в наших экспериментах, общими чертами морфозов являются асимметричность и доминантный характер проявления [24]. Возникновение морфозов не зависело от пола мух, что объясняется нарушением работы регуляторных генов аутосомных хромосом, в результате чего происходило изменение фенотипа мутантов. Кроме того, в следующих поколениях (F2 и F4) типы морфозов не наследовались, так как не все морфозы меланомы F1 становились морфозами крыльев, и наоборот.
Обобщенные результаты (количество мух без мутаций и с условными мутациями, т.е. с морфозами) и итоги статистического анализа представлены в табл. 1.
Таблица 1.
Количество мутантных особей Drosophila melanogaster (результаты опыта с воздействием α-излучения и контроль)* Table 1. The results of experiment and control
| Тест-система | Меллер-5 (Basc) | ЭП-2 | 1-112 | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Опыт (Pu238) | a | b | Σ | a | b | Σ | a | b | Σ |
| 3820 | 28** | 3848 | 1797 | 38*** | 1835 | 3269 | 60** | 3329 | |
| Контроль (без облучения) | c | d | c | d | c | d | |||
| 3690 | 10 | 3700 | 1778 | 7 | 1785 | 1364 | 6 | 1370 | |
| Σ | 7510 | 38 | 7548 | 3575 | 45 | 3620 | 4633 | 66 | 4699 |
Статистическая обработка данных эксперимента в опыте Меллер-5 (Basc), в тест-системе сцепленных Х-хромосом и сцепленных XY-хромосом с использованием источника α-излучения (238Рu) показала, что α-излучение обладает генотоксическим эффектом, и наиболее чувствительной является тест-система сцепленных XY-хромосом (линия ЭП-2), что связанно с более выраженным эффектом положения генов из-за дополнительной Y-хромосомы.
ОБСУЖДЕНИЕ
Одной из главных задач экологической генетики является разработка адекватных тест-систем для оценки генетической опасности факторов окружающей среды. В качестве основного критерия, позволяющего оценить генотоксический эффект α-излучения на дрозофиле, нами были выбраны условные мутации, проявляющиеся как морфозы. Классическая генетика построена на изучении мутаций с автономным проявлением, в то время как мутации с неавтономным проявлением формируют особые “признаки”, в основном это модификации и морфозы, затрагивающие инвариантную часть видового облика организма.
Выявлено статистически значимое повышение частоты морфозов как результат наличия условных мутаций, индуцированных в Х-хромосоме самцов Drosophila melanogaster линии Oregon при воздействии α-излучения, по сравнению с таковым показателем в контроле. Используемый нами непараметрический критерий χ2 продемонстрировал различия в распределении частот наблюдаемых аномалий в эксперименте и контроле (p < 0.05). Таким образом, в экспериментальном исследовании с воздействием α-излучения на Drosophila melanogaster (линия Oregon) продемонстрирована генотоксическая активность α-частиц.
В этом исследовании также изучены генотоксические эффекты α-излучения (радон и его продукты распада) на развитие Drosophila melanogaster в нескольких тест-системах: Меллер-5, сцепленных Х-хромосом (1-112) и сцепленных ХY-хромосом (ЭП-2). В данном опыте морфозы у мушек дрозофилы первого и второго поколений выглядели как черные пятна, или меланомы на различных частях тела имаго; “генерализованные” меланомы; закрученные, изогнутые крылья; нарушение жилкования крыльев; укороченное крыло; пузырь на одном крыле; отсутствие одного крыла, деформация торакса, нарушение распределения глазных фасеток и волосков; отсутствие пигментации второй и третьей ног. Морфозы проявлялись в F1–F3 генерациях и исчезали в F4.
Выявлены статистически значимые различия (метод χ2) между экспериментом и контролем. Таким образом, можно считать, что α-частицы, источником которых в окружающей среде, в основном, является радон и его изотопы, характеризуются генотоксическим действием, проявляющимся, как правило, в формировании морфозов или уродств. Необходимы дополнительные исследования для оценки дозовой зависимости индукции α-излучением рассматриваемых аномалий.
Список литературы
Bersimbaev R., Bulgakova O. The health effects of radon and uranium on the population of Kazakhstan // Genes Environ. 2015. V. 37. P. 18. https://doi.org/10.1186/s41021-015-0019-3
Хусаинов А.Т., Скипин Л.Н., Софронова Л.И. Проблемы обеспечения радиационной безопасности в уранодобывающих регионах Северного Казахстана // Вестник Тюм. ГУ. 2011. № 4. С. 91–94. [Husainov A.T., Skipin L.N., Sofronova L.I. Influence of waste uranium companies on ecosystems of North Kazahstan // Vestnik Tyum. GU. 2011. № 4. P. 91–94. (in Russian)]
United Nations Scientific Committee on the Effects of Atomic Radiation. Sources, effects and risks of ionizing radiation. UNSCEAR 2012 report to the general Assembly with scientific annexes. New York: United Nations, 2015. 320 p.
Karam P.A., Stein B.P. Radioactivity. New York: Chelsea House, 2009. 128 p.
Torres-Durán M., Ruano-Ravina A., Parente-Lamelas I. et al. Lung cancer in never-smokers: a case–control study in a radon-prone area (Galicia, Spain) // Eur. Respir. J. 2014. V. 44. № 4. P. 850–852. https://doi.org/10.1183/09031936.00017114
Méndez D., Alshanqeety O., Warner K.E. et al. The Impact of Declining Smoking on Radon-Related Lung Cancer in the United States // Am. J. Public. Health. 2011. V. 101. № 2. P. 310–14. https://doi.org/10.2105/AJPH.2009.189225
Chahine T., Schultz B.D., Zartarian V.G. et al. Modeling Joint Exposures and Health Outcomes for Cumulative Risk Assessment: The Case of Radon and Smoking // Int. J. Environ. Res. Public. Health. 2011. V. 8. P. 3688–3711. https://doi.org/10.3390/ijerph8093688
United States Environmental Protection Agency. EPA Assessment of Risk from Radon in Homes. EPA 402-R-03-003; Office of Air and Radiation. USA, Washington, DC; 2003. 98 p.
Robertson A., Allen J., Laney R. et al. The Cellular and Molecular Carcinogenic Effects of Radon. Exposure // Int. J. Mol. Sci. 2013. V. 14. № 7. P. 14024–14063. https://doi.org/10.3390/ijms140714024
Kendall G.M., Smith T.J. Doses to organs and tissues from radon and its decay products // J. Radiol. Prot. 2002. V. 22. № 4. P. 389–406.
Медведев Н.Н. Практическая генетика. М.: Наука, 1968. 294 с. [Medvedev N.N. Prakticheskaya genetika. M.: Nauka, 1968. 294 p. (In Russian)]
Muller H.J. The Production of Mutations by X-Rays // Proc. Natl. Acad. Sci. USA. 1928. V. 14. № 9. P. 714–726. https://doi.org/10.1073/pnas.14.9.714
Жимулев И.Ф. Общая и молекулярная генетика. Новосибирск: Сибирское университетское издательство, 2007. 497 c. [Zhimulev I.F. Obshchaya i molekulyarnaya genetika. Novosibirsk: Sibirskoye universitetskoye izdatel’stvo, 2007. 497 p. (In Russian)]
Kohler R.E. Lords of the fly: Drosophila genetics and the experimental life. Chicago: University of Chicago Press, 1994. 321 p.
Moskalev A., Shapovnikov M., Snezhkina A. et al. Mining gene expression data for pollutants (dioxin, toluene, formaldehyde) and low dose of gamma-irradiation // PLoS One. 2014. V. 9. № 1. P. e86051. doi.org/https://doi.org/10.1371/journal.pone.0086051
Глотов Н.В., Животовский Л.А., Хованов Н.В. и др. Биометрия. Л.: ЛГУ, 1982. 264 с. [Glotov N.V., Zhivotovsky L.A., Khovanov N.V. et al. Biometrics. Leningrad: Leningrad State University, 1982. 264 p. (In Russian)]
Чадов Б.Ф., Чадова Е.В., Копыл С.А. и др. Новый класс мутаций у Drosophila melanogaster // Докл. РАН. 2000. Т. 373. № 5. С. 714–717. [Chadov B.F., Chadova E.V., Kopyl S.A. et al. A new class of mutations in Drosophila melanogaster // Dokl. Ros. Akad. Nauk. 2000. V. 373. № 5. P. 423–426. (In Russian)] https://doi.org/10.13140/RG.2.1.2585.5606
Chadov B.F. A new stage in the development of genetics and term epigenetics // Rus. J. Genetics. 2006. V. 42. № 9. P. 1053–1065.
Sturtevant A.H. The effects of unequal crossing over at the Bar locus in Drosophila // Genetics. 1925. V. 10. № 2. P. 117–147.
Дубинин Н.П., Сидоров Б.Н. Зависимость действия гена от его положения в системе // Биол. журн. 1934. Т. 3. № 2. С. 304–331. [Dubinin N.P., Sidorov B.N. Zavisimost’ deystviya gena ot yego polozheniya v sisteme // Biol. zhurnal. 1934. V. 3. № 2. P. 304–331. (In Russian)]
Жимулев И.Ф., Беляева Е.С. Гетерохроматин и эффект положения гена и генетический сайленсинг // Генетика. 2003. Т. 39. № 2. С. 187–201. [Zhimulev I.F., Beliaeva E.S. Heterochromatin, gene position effect and gene silencing // Genetika. 2003. V. 39. № 2. P. 187–201. (In Russian)]
Рапопорт И.А. Специфические морфозы у Drоsорhilа melаnоgаster, вызванные химическими соединениями // Бюл. эксперим. биол. мед. 1939. № 7. С. 415–417. [Rapoport I.A. Spetsificheskiye morfozy u Drosorhila melanogaster, vyzvannyye khimicheskimi soyedineniyami // Byul. eksperim. biol. med. 1939. № 7. P. 415–417. (In Russian)]
Chadov B.F., Fedorova N.B., Chadova E.V. et al. Conditional mutations in Drosophila // J. Life Sci. (USA). 2011. V. 5. № 3. P. 224–240.
Чадов Б.Ф., Чадова Е.В., Копыл С.А. и др. От генетики внутривидовых отличий к генетике внутривидового сходства // Генетика. 2004. Т. 40. № 9. С. 1157–1172. [Chadov B.F., Chadova E.V., Kopyl S.A. et al. From genetics of intraspecific differences to genetics of intraspecific similarity // Rus. J. Genetics. 2004. V. 40. № 9. P. 1157–1172. (In Russian)]
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология


