Радиационная биология. Радиоэкология, 2020, T. 60, № 6, стр. 595-603
Изучение механизма генотоксичности диоксидина с помощью lux-биосенсоров Esсherichia coli
Д. А. Свиридова 1, *, Э. А. Мачигов 1, Е. В. Игонина 1, Б. С. Жошибекова 1, С. К. Абилев 1
1 Институт общей генетики им. Н.И. Вавилова Российской академии наук
Москва, Россия
* E-mail: daria_sv11@mail.ru
Поступила в редакцию 29.06.2020
После доработки 21.08.2020
Принята к публикации 28.08.2020
Аннотация
Изучены способность антибактериального средства диоксидина генерировать в клетках E. coli супероксид анион-радикал, индуцировать SOS-ответ, вызывать фрагментацию ДНК, гибель бактерий, а также влияние антиоксидантов на перечисленные процессы с помощью люминесцирующих биосенсоров E. coli. Диоксидин индуцировал SOS-ответ у биосенсора pColD-lux в концентрациях, характерных для наиболее эффективной индукции люминесценции у биосенсора pSoxS-lux, интенсивность которой зависит от количества супероксида в клетке. Диоксидин в концентрациях более 0.001 моль/л вызывал снижение выживаемости бактериальных клеток, что, как выявил электрофоретический анализ, сопровождается деградацией их ДНК. Деградация ДНК усиливалась с увеличением концентрации диоксидина и снижалась в присутствии антиоксидантов глутатиона и ацетилцистеина. Антиоксиданты ослабляли индукцию диоксидином SOS-ответа, а также генерацию супероксидного радикала. Обсуждаются вероятные механизмы образования гидроксильного радикала при восстановлении группы NO диоксидина бактериальными редуктазами.
Диоксидин (1,4-диоксид 2,3-хиноксалиндиметанол) является антибактериальным средством, обладающим высокой бактерицидной активностью, и широко применяется в медицинской практике на территории Российской Федерации [1–3]. Диоксидин был разработан в конце 60-х годов прошлого века во Всесоюзном научно-исследовательском химико-фармацевтическом институте им. С. Орджоникидзе (в настоящее время – Центр по химии лекарственных средств (ЦХЛС ВНИХФИ), Москва) [1, 2]. После фармакотоксикологических исследований диоксидин был утвержден Фармакологическим комитетом СССР в 1976 г. в качестве антибактериального лекарственного средства. В настоящее время диоксидин используется при лечении гнойных процессов, ранений и нашел широкое применение в хирургии, травматологии, оториноларингологии, офтальмологии в виде местного применения и общего внутривенного введения.
Генотоксичность диоксидина была исследована в 70–80-е годы прошлого века с помощью различных тест-систем. Диоксидин вызывал повреждения ДНК в клетках E. coli и индуцировал мутации у тест-штаммов S. typhimurium [4]. В экспериментах in vivo диоксидин индуцировал у мышей хромосомные аберрации и микроядра в клетках костного мозга и доминантные летальные мутации в половых клетках у самцов [5, 6]. Позже была описана его способность индуцировать разрывы ДНК в клетках печени, легких и почек мышей [7].
В институте фармакологии им. В.В. Закусова РАМН СССР была проведена большая работа по изучению роли свободных радикалов кислорода в механизме мутагенного действия диоксидина in vivo и коррекции его с помощью антиоксидантов и антимутагенов [8–10].
Диоксидин по своей химической структуре является производным хиноксалин-1,4-диоксида, который во многих исследованиях является базовой молекулой для синтеза и поиска соединений с бактерицидной, противогрибковой, противовирусной, противоопухолевой, противотуберкулезной и фармакологической активности других видов [11–13]. Обязательное наличие в молекуле этих соединений двух групп NO позволяет им участвовать в окислительно-восстановительных реакциях. Так, восстановление клеточными редуктазами одной из двух NO приводит к образованию таких свободных радикалов, как супероксид-анион (О2), и гидроксильный радикал (ОН•), которые благодаря высокой реакционной способности обусловливают не только антимикробную активность, но и широкий спектр токсикологических свойств, включая мутагенную [13, 14].
Прямое доказательство образования в бактериальной клетке диоксидином супероксид аниона-радикала было получено с помощью люминесцирующего биосенсора E. coli K12: MG1655 (pSoxS-lux) [15]. Это указывает на то, что в основе механизма бактерицидного действия диоксидина лежит его способность к образованию в бактериальной клетке свободных радикалов. Последние могут нарушать функционирование многих клеточных структур и снижать активность ферментов. Поэтому возникает вопрос: насколько бактерицидность диоксидина связана с его генотоксичностью для бактерий.
Целью настоящей работы является одновременное изучение способности диоксидина генерировать в клетках E. coli супероксид анион-радикал, индуцировать SOS-ответ, вызывать фрагментацию ДНК и гибель бактерий, а также влияние антиоксидантов на перечисленные процессы.
МАТЕРИАЛЫ И МЕТОДИКА
Химические вещества. Химические препараты были аналитической чистоты. Диоксидин получен из АО “Новосибирскфарма”, глутатион восстановленный – из фирмы “AppliChemGmbH” (Германия), N-ацетилцистеин – из компании “Serva” (Германия). Все растворы готовили непосредственно перед их использованием.
Бактериальные штаммы. Были использованы два биосенсора на основе штамма E. coli K12: MG1655 (pSoxS-lux) и MG1655 (pColD-lux), несущие рекомбинантную плазмиду с lux-опероном люминесцирующей бактерии Photorhabdus luminescens, слитым с промоторами гена супероксид- дисмутазы soxS и гена колицина colD (cda), входящего в состав SOS-регулона. Далее эти биосенсоры обозначены как pSoxS-lux и pColD-lux. Lux-оперон обеспечивает биолюминесценцию, используемую в данном тесте в качестве репортерной функции. Белок-активатор SoxR в результате реакции с супероксидом снимает блок с промотора гена супероксиддисмутазы, что приводит к люминесценции биосенсора pSoxS-lux благодаря экспрессии lux-оперона. Биосенсор E. coli MG1655 (pColD-lux) люминесцирует в ответ на повреждение ДНК и активирует SOS-ответ клетки на генотоксическое воздействие. Таким образом, рост интенсивности люминесценции биосенсора pSoxS-lux указывает на увеличение уровня супероксид анион-радикала в бактериальной клетке, а интенсивность люминесценции биосенсора pColD-lux – на уровень SOS-ответа клетки на генотоксическое воздействие. Биосенсоры предоставлены Г.Б. Завильгельским и И.В. Мануховым (ГосНИИгенетика, Москва), их генотипы приведены в статье [16].
Питательные среды и условия роста. Для хранения и культивирований культур бактерий использовали агаризованные и жидкие среды Луриа–Бертани (LB), содержащие ампициллин в концентрации 100 мкг/мл. Для проведения работ использовали ночные культуры биосенсоров pColD-lux и pSoxD-lux в жидкой среде LB, которые инкубировали в течение 12 ч при 37°С.
Измерение люминесцентной реакции lux-биосенсоров. Ночные культуры биосенсоров pColD-lux и pSoxD-lux разводили до концентрации 107 кл/мл в свежей питательной среде LB и выращивали с аэрацией при 37°C до ранней экспоненциальной фазы. Затем пробы по 160 мкл переносили в ячейки 96-луночного планшета. В контрольный ряд ячеек добавляли по 40 мкл дистиллированной воды, в другие ряды ячеек вносили по 20 мкл раствора диоксидина в различных концентрациях и по 20 мкл воды. В случае изучения влияния антиоксидантов на активность диоксидина вместо воды добавляли 20 мкл раствора глутатиона восстановленного или ацетилцистеина. Затем планшеты, с заполненными ячейками, инкубировали при 37°С в течение 90 мин. После завершения описанных процедур проводили измерения люминесценции на микропланшетном ридере StatFax 4400, Awareness Technology Inc (США). Интенсивность биолюминесценции выражали в условных единицах светового потока (relative light units – RLU). Эксперименты проводили не менее 3 раз в восьми повторностях.
Определение выживаемости бактерий E. coli. Ночные культуры биосенсоров pColD-lux и pSoxD-lux разводили до концентрации 107 кл/мл в свежей питательной среде LB и выращивали с аэрацией при 37°C до ранней экспоненциальной фазы. К 2 мл суспензии бактерии добавляли 200 мкл раствора диоксидина в разных концентрациях. В вариантах экспериментов с антиоксидантами растворы глутатиона и ацетилцистеина добавляли в объеме 100 мкл. Затем суспензию бактерий с добавленными растворами диоксидина и антиоксидантов инкубировали в течение 90 мин при 37°C. По истечении времени инкубации суспензию бактерий серийно разводили до 10–6 в физиологическом растворе и из разных разведений высевали по 100 мкл на чашки Петри с агаризованной питательной средой LB. Через 18 ч инкубации при 37°C считали число бактериальных колоний. Каждая бактериальная колония является результатом деления одной бактериальной клетки, колониеобразующей единицы (КОЕ), и соответственно число КОЕ является показателем числа жизнеспособных бактерий в суспензиях после инкубации с диоксидином и в контроле.
Определение разрывов ДНК методом гель-электрофореза. Выращивание бактерий до ранней экспоненциальной фазы роста проводили как указано выше. К 10 мл суспензии бактерии добавляли 1 мл раствора диоксидина в разных концентрациях и 1 мл раствора глутатиона или ацетилцистеина в разных концентрациях.
После 90-минутной инкубации клетки отмывали 0.9%-ным раствором NaCl и добавляли к ним 350 мкл лизирующего раствора (0.1 ммоль/л ЭДТА, 0.5 моль/л NaOH, 0.05% SDS) и инкубировали в лизирующем растворе еще 90 мин. По истечении этого срока 35 мкл суспензии бактерий в лизируюшем растворе переносили в лунки 1%-ного агарозного геля. В эти же лунки геля вносили по 5 мкл красителя. В первую лунку добавляют 5 мкл леддера. Затем гель помещали в камеру с буфером ТВЕ и в течение 90 мин при 100 В подвергали электрофорезу. По завершении электрофореза флуоресценцию полос ДНК в геле анализировали гель путем просвечивания на трансиллюминаторе Vilber Lourmat serial N 10 102939 (Франция) и фотографировали цифровым фотоаппаратом Canon.
Статистическая обработка. Полученные в ходе экспериментальных исследований данные подвергали стандартной статистической обработке с вычислением среднего значения показателя и его ошибки. Значимость различий средних значений оценивали с использованием t-критерия Стьюдента. Вероятность ошибки p < 0.05 считали достаточной для вывода о статистической значимости различий полученных данных.
РЕЗУЛЬТАТЫ
Диоксидин наиболее эффективно индуцировал люминесценцию биосенсоров pColD-lux и pSoxS-lux в концентрациях 0.00025–0.0025 и 0.0005–0.005 моль/л соответственно при 90-минутной экспозиции (рис. 1). Максимальный эффект на обоих биосенсорах регистрировали в концентрации диоксидина 0.001 моль/л. Полученные результаты показывают, что диоксидин в клетках E. coli вызывает повреждения ДНК, приводящие к индукции SOS-ответа, с одной стороны, а с другой – генерирует супероксид анион-радикалы, инициирующие развитие окислительного стресса в клетке. Последнее обстоятельство может быть причиной как генотоксичности диоксидина, так и его бактерицидности. Для прямого экспериментального подтверждения этого предположения было изучено влияние антиоксидантов на люминесценцию биосенсоров и электрофоретический анализ целостности бактериальной ДНК. В первом случае использовали глутатион восстановленный и ацетилцистеин (АЦЦ) и регистрировали их влияние на люминесценцию биосенсоров pColD-lux и pSoxS-lux, индуцированной диоксидином в концентрациях 0.001, 0.0025 и 0.005 моль/л. Полученные результаты приведены на рис. 2 и 3.
Рис. 1.
Люминесценция биосенсоров pColD и pSoxS-lux при различных концентрациях диоксидина.
Fig. 1. Luminescence of pColD and pSoxS-lux biosensors at various dioxidine concentrations.
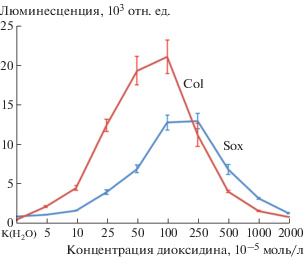
Рис. 2.
Влияние глутатиона (а ) и ацетилцистеина (б) на индукцию диоксидином SOS-ответа в клетках биосенсора pColD-lux. Примечание. Значимость отличия между результатами двух вариантов эксперимента: воздействие диоксидина (без антиоксидантов) и диоксидина + антиоксиданта: * р < 0.05, ** р < 0.01, *** р < 0.001.
Fig. 2. The effect of glutathione (а) and acetylcysteine (б) on induction SOS-response of by dioxidine in pColD-lux biosensor cells.

Рис. 3.
Влияние глутатиона (а) и ацетилцистеина (б) на образование супероксид-радикала диоксидином в клетках биосенсора pSoxD-lux. Примечание. Значимость отличия между результатами двух вариантов эксперимента: воздействие диоксидина (без антиоксидантов) и диоксидина + антиоксиданта: * р < 0.05, ** р < 0.01, *** р < 0.001.
Fig. 3.The effect of glutathione (а) and acetylcysteine (б) on the formation of superoxide radicals by dioxidine in pSoxD-lux biosensor cells.
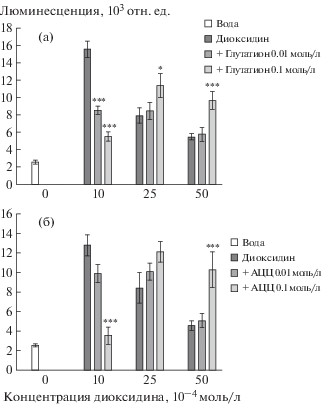
Глутатион снижал люминесценцию биосенсоров pColD и pSoxS-lux, индуцированную диоксидином в концентрации 0.001 моль/л, характерной для проявления максимальной генотоксичности и наибольшей способности генерировать в клетках биосенсоров супероксид-радикал (рис. 2 и 3). Глутатион в высокой концентрации 0.01 моль/л показал тенденцию к повышению люминесценции у pColD, индуцированной диоксидином в концентрации 0.005 моль/л, но она не была статистически значимой (рис. 2, а). В то же время глутатион снижал люминесценцию биосенсоров pSoxS-lux, индуцированную диоксидином в концентрации 0.001, и повышал ее при высоких концентрациях рассматриваемого фармакологического препарата 0.0025 и 0.005 моль/л (рис. 3, а). АЦЦ снижал люминесценцию обоих биосенсоров при низкой концентрации диоксидина и повышал ее при действии данного соединения в высоких концентрациях (рис. 2, б и рис. 3) Последнее обстоятельство указывает на то, что АЦЦ снижают уровень окислительного стресса в клетках бактерий и тем самым увеличивают количество люминесцирующих бактерий при высоких концентрациях диоксидина. Это может быть результатом снижения антиоксидантами бактерицидности диоксидина и соответственно повышения уровня выживаемости бактерий, т.е. числа жизнеспособных организмов.
Дальнейшие эксперименты проводились в двух направлениях: определение выживаемости бактерий, т.е. колониеобразующей способности, при различных концентрациях диоксидина и антиоксидантов, и определение целостности бактериальной ДНК методом электрофореза. В качестве меры жизнеспособности бактерий при различных концентрациях диоксидина без антиоксидантов и с антиоксидантами в инкубационной среде определяли число колониеобразующих единиц (КОЕ). Для этого по истечении времени инкубации экспериментальной смеси 0.1 мл аликвоту бактерий серийно разводили в физиологическом растворе до 10–6 и по 0.1 мл из разных разведений высевали на агаризованную питательную среду LB в чашках Петри. Через 19 ч инкубации при 37°С учитывали число выросших колоний, являющееся показателем КОЕ. Выявлены высокие статистически значимые отличия между результатами двух вариантов эксперимента: воздействие диоксидина (без антиоксидантов) и диоксидина + антиоксиданта (р < 0.01). Для наглядности представления полученных результатов число КОЕ в концентрации диоксидина 0.001 моль/л было принято за 100%. Число КОЕ в других вариантах соотносили к таковому в концентрации диоксидина 0.001 моль/л и тоже выражали в %. Полученные результаты приведены в табл. 1.
Таблица 1.
Влияние антиоксидантов АЦЦ и глутатиона (Глу) на жизнеспособность бактерий биосенсора pColD-lux Table 1. The effect of antioxidants ACC and glutathione (Glu) on viability pColD-lux biosensor
| Диоксидин, моль/л | % жизнеспособных бактерий* | ||||
|---|---|---|---|---|---|
| контроль (без антиоксидантов) | +АЦЦ, 0.01 | +АЦЦ, 0.1 | +Глу, 0.01 | + Глу, 0.1 | |
| 0.001 | 100 | 85 | 90 | 91 | 85 |
| 0.0025 | 17 | 24 | 61 | 23 | 63 |
| 0.005 | 1 | 6 | 21 | 4 | 19 |
Видно, что при пятикратном увеличении концентрации диоксидина (с 0.001 до 0.005 моль/л) число КОЕ составляет 1%, т.е. выживаемость бактерий падает в 100 раз. В присутствии АЦЦ и глутатиона этот показатель увеличивается. Так, при концентрации антиоксидантов 0.1 моль/л число КОЕ составляет 21 и 19% соответственно. Это указывает на то, что выживаемость бактерий в варианте диоксидин 0.005 моль/л + АЦЦ и глутатиона в концентрации 0.1 моль/л возрастает на 20% по отношению к таковому без антиоксидантов.
Был проведен дополнительный эксперимент в восьми повторностях по одновременному определению люминесценции и изучению выживаемости клеток биосенсора pColD-lux прямо в инкубационной смеси в лунках планшета в зависимости от концентрации диоксидина с целью определения интенсивности репарации ДНК у выживших бактерий. По истечении времени инкубации экспериментальной смеси замеряли интенсивность люминесценции биосенсора. Затем 0.1 мл аликвоту бактерий с каждой лунки серийно разводили в физиологическом растворе до 10–6 для последующего высева в чашки Петри с агаризованной питательной средой LB. Через 19 ч инкубации при 37°С учитывали число выросших колоний и определяли его зависимость от концентрации диоксидина. Статистическая обработка показателей по числу КОЕ в 0.1 мл и по интенсивности люминесценции этих бактерий в относительных единицах показала высокую значимость отличия результатов двух вариантов эксперимента с воздействием диоксидина в концентрации 0.001 моль/л и в высоких концентрациях (р < < 0.01). В табл. 2 приведены количественные показатели интенсивности люминесценции pColD-lux на 1000 КОЕ, т.е. на 1000 жизнеспособных бактерий. Для этого, например, при воздействии диоксидина в концентрации 0.001 моль/л делили показатель интенсивности люминесценции бактерий (20980.2 отн. ед.) на число КОЕ (4.8 × 107) и умножали на 1000. Получилось, что 1000 КОЕ дает свечение только в 0.44 ед. В случае другого варианта эксперимента (диоксидин 0.005 моль/л) 1000 КОЕ дает свечение 14.1 ед. Таким образом, мы видим, что уровень SOS-ответа у жизнеспособных бактерий в результате действия диоксидина в высоких дозах не падает, а увеличивается. Например, при концентрациях рассматриваемого препарата 0.001 и 0.01 моль/л интенсивность люминесценции составляет 0.44 и 30.3 отн. ед. соответственно, тогда как выживаемость бактерий падает почти в 1000 раз. Таким образом, с увеличением концентрации диоксидина происходит гибель части бактерий, а у выживших бактерий наблюдается интенсивная SOS-репарация ДНК.
Таблица 2.
Зависимость выживаемости и интенсивности люминесценции бактерий биосенсора pColD-lux от концентрации диоксидина Table 2. Dependence of the survival and luminescence intensity of pColD-lux biosensor on dioxidine concentration
| Диоксидин, моль/л | Количество КОЕ | Люминесценция, отн. ед. | Люминесценция, на 1000 КОЕ, отн. ед. |
|---|---|---|---|
| 0.001 | 4.8 × 107 | 20980.2 | 0.44 |
| 0.0025 | 9.1 × 106 | 11195.5 | 1.2 |
| 0.005 | 2.9 × 105 | 4086.5 | 14.1 |
| 0.01 | 5.5 × 104 | 1664.2 | 30.3 |
Электрофоретический анализ целостности ДНК в клетках биосенсора pColD-lux показал, что диоксидин вызывает разрывы ДНК, уровень которых зависит от его концентрации (рис. 4, дорожки 2, 5 и 8.) АЦЦ и глутатион снижают ДНК– повреждающую активность диоксидина. Наиболее эффективной является концентрация антиоксидантов 0.1 моль/л ((рис. 4, дорожки 4, 7 и 10).
Рис. 4.
Влияние АЦЦ (а) и глутатиона (б) на ДНК-повреждающую активность диоксидина в клетках биосенсора pColD-lux: 0 – маркер длин ДНК; 1 – контроль (вода); 2 – диоксидин, 0.001; 3 – диоксидин 0.001 + АО, 0.01; 4 – диоксидин, 0.001 + АО, 0.1; 5 – диоксидин, 0.0025; 6 –диоксидин, 0.0025 + АО, 0.01; 7 – диоксидин, 0.0025 + АО, 0.1; 8 – диоксидин, 0.005; 9 – диоксидин, 0.005 + АО, 0.01; 10 – диоксидин, 0.005 + АО, 0.1. Концентрации диоксидина и антиоксидантов (АО) приведены в моль/л.
Fig. 4. Effect of ACC (a) and glutathione (b) on the DNA-damaging activity of dioxidine in pColD-lux biosensor cells: 0 – marker of DNA lengths; 1 – control (water); 2 – dioxidine, 0.001; 3 – dioxidine 0.001 + AO, 0.01; 4 – dioxidine, 0.001 + AO, 0.1; 5 – dioxidine, 0.0025; 6 – dioxidine, 0.0025 + AO, 0.01; 7 – dioxidine, 0.0025 + AO, 0.1; 8 – dioxidine, 0.005; 9 – dioxidine, 0.005 + AO, 0.01; 10 – dioxidine, 0.005 + AO, 0.1. Concentrations of dioxidine and antioxidants (AO) are given in mol / l.

Полученные данные соответствуют тем результатам, которые были получены при изучении влияния антиоксидантов на индукцию диоксидином люминесценции биосенсоров и на бактерицидность препарата.
ОБСУЖДЕНИЕ
Всестороннее изучение свойств диоксидина в 70-е годы ХХ века показало, что препарат обладает широким спектром антибактериальной активности и относится к фармакологическим средствам с бактерицидным типом действия. При электронно-микроскопическом изучении его влияния на клеточные структуры Е. coli и St. aureus было обнаружено, что нарушение структуры нуклеоида происходит уже при действии препарата в субингибирующих концентрациях. Это позволило сделать предположение о ДНК-тропности диоксидина и способности нарушать процессы биосинтеза ДНК в микробной клетке [17]. Диоксидин проявлял летальное действие на штаммы recA и uvrA в большей степени, чем на немутантный штамм E. coli, что также косвенно указывало на его возможную ДНК-тропность [18]. Однако исследования с помощью трех независимых методов не выявили никаких доказательств связывания N-оксидов хиноксалина с ДНК бактерий [19]. Эти результаты укрепили предположение, что бактерицидность препаратов N-оксидов хиноксалина может быть обусловлена их способностью стимулировать в клетке свободнорадикальные процессы. Причем этот процесс идет наиболее интенсивно в условиях анаэробиоза, чем аэробных условиях [19].
Нами для проведения изучения генотоксичности и бактерицидности диоксидина были использованы биосенсоры pColD-lux и pSoxS-lux. Первый люминесцирует при SOS-ответе бактерий на повреждение ДНК, а также остановку репликации различными химическими и физическими агентами. Он характеризуется низким уровнем спонтанного свечения и высокой амплитудой ответа, т.е. высоким уровнем кратности превышения ответа при индукции над спонтанным уровнем [16, 20]. Второй биосенсор люминесцирует в ответ на повышение уровня в клетке супероксид анион-радикала. Белок-активатор SoxR промотора pSoxS специфически реагирует на супероксид анион-радикал и снимает блок с промотора гена и супероксиддисмутазы, что приводит к считыванию их и синтезу ферментов, инактивирующих супероксид. Поэтому интенсивность люминесценции биосенсора pSoxS-lux характеризует уровень образовавшего в бактериальной клетке супероксида [16].
В наших экспериментах диоксидин наиболее интенсивно индуцировал SOS-ответ у биосенсора pColD-lux в концентрациях, характерных для наиболее эффективной индукции люминесценции у биосенсора pSoxS-lux (рис. 1). Однако с увеличением концентрации диоксидина (более 0.001 моль/л) происходит снижение выживаемости бактериальных клеток и оно, как выявил электрофоретический анализ, сопровождается деградацией ДНК бактерий (рис. 4). Интенсивность свечения биосенсора pColD-lux свидетельствует об уровне повреждений ДНК под действием свободных радикалов, инициированных супероксидом в клетках бактерий. Если нормировать количественные показатели интенсивности люминесценции pColD-lux на 1000 КОЕ, т.е. на 1000 жизнеспособных бактерий, то мы видим, что уровень ответа, характеризующий уровень SOS-репарации ДНК у жизнеспособных бактерий, от увеличения концентрации диоксидина не падает, а возрастает (табл. 2). Это указывает на увеличение степени поврежденности ДНК, о чем свидетельствуют результаты электрофоретического анализа целостности ДНК бактерий (рис. 4). Из электрофореграмм видно, что деградация ДНК усиливается с увеличением концентрации диоксидина и снижается при совместном использовании диоксидина и антиоксидантов – глутатиона и ацетилцистеина. Последние в наших экспериментах снижали в бактериальных клетках уровни индукции диоксидином как SOS-ответа, так и экспрессии супероксиддисмутазы, инактивирующей супероксидный радикал (рис. 2 и 3).
Известно, что супероксид анион-радикал ${\text{O}}_{2}^{ - }$, образующийся при присоединении одного электрона к молекуле кислорода, является ключевой активной формой кислорода. Супероксид радикал сам по себе обладает малой реакционной способностью и в водной среде может спонтанно дисмутировать. Время его жизни в биологических субстратах составляет около 10–6 с. Из ряда свободных радикалов, возникающих при трехэлектронном восстановлении кислорода, наиболее сильной реакционной способностью обладает гидроксильный радикал (ОН–).
Важным вопросом является механизм образования диоксидином супероксидного радикала в бактериальных клетках. Диоксидин по своей химической структуре является производным хиноксалин-1,4-диоксида, который во многих исследованиях является базовой молекулой для синтеза и поиска соединений с фармакологической активностью [11, 12]. Наиболее близким к диоксидину по своей химической структуре является квиндоксин (1,4-N-диоксид хиноксалина). Установлено, что квиндоксин в результате ферментативного восстановления клеточными редуктазами образует свободные радикалы. Наличие в бактериальной клетке большого количества редуктаз не позволяет идентифицировать одного из них в качестве основного, связанного с активацией квиндоксина. При этом не получено никаких доказательств связывания квиндоксина или его восстановленного производного с ДНК. Предполагается, что весь процесс происходит следующим образом: под действием клеточных редуктаз происходит одноэлектронное восстановление одной из двух N-окиси молекулы квиндоксина с образованием супероксида и радикала гидроксилированного монооксид-квиндокса, который легко распадается на стабильный монооксид квиндокса и гидроксильный радикал (ОН–). Последний является разрушителем ДНК, о чем свидетельствует способность ди-N-оксидов хиноксалина индуцировать деградацию ДНК как в пролиферирующих, так и в непролиферирующих клетках. При этом мутанты polA, recA, recB, recC, exrA и uvrA были более восприимчивы, чем соответствующие штаммы дикого типа [19–21]. Гидроксильный радикал, помимо разрушения ДНК, может повреждать белки и инактивировать ферменты, что также вносит существенный вклад в бактерицидность препарата.
ЗАКЛЮЧЕНИЕ
Получены экспериментальные данные о сопряженности генотоксичности, бактерицидности диоксидина и его способности образовывать в бактериальной клетке свободные радикалы. Показано, что антиоксиданты глутатион и ацетилцистеин подавляют индукцию диоксидином в биосенсорах SOS-ответа и образование супероксидного радикала, приводящее к снижению уровня фрагментации ДНК. Проведенный анализ исследований механизма биологической активности ди-N-оксидов хиноксалина позволяет сделать предположение о том, что диоксидин в результате ферментативного восстановления клеточными редуктазами образует супероксидный радикал и радикал гидроксилированного монооксид-диоксидина. Последний легко распадается на стабильный моноооксид диоксидина и гидроксильный радикал (ОН–), который является главным фактором бактерицидности и генотоксичности диоксидина.
Список литературы
Падейская Е.Н. Рациональное применение диоксидина в клинике гнойных инфекций (по итогам клинического изучения) // Антибактериальные препараты: Сборник трудов ВНИХФИ. М., 1984. С. 6–23. [Padejskaya E.N. Racional’noe primenenie dioksidina v klinike gnojnyh infekcij (po itogam klinicheskogo izucheniya) // Antibakterial’nye preparaty: Sbornik trudov VNIHFI. M., 1984. S. 6–23. (In Russian)]
Падейская Е.Н. Антибактериальный препарат диоксидин: особенности биологического действия и значение в терапии различных форм гнойной инфекции // Инфекции и антимикроб. терапия. 2001. № 5. С. 150–155. [Padejskaya E.N. Antibakterial’nyj preparat dioksidin: osobennosti biologicheskogo dejstviya i znachenie v terapii razlichnyh form gnojnoj infekcii // Infekcii i antimikrob. terapiya 2001. № 5. S. 150–155. (In Russian)]
Попов Д.А., Анучина Н.М., Терентьев А.А. и др. Диоксидин: антимикробная активность и перспективы клинического применения на современном этапе // Антибиотики и химиотерапия. 2013. Т. 58. № 3–4. С. 37–42. [Popov D.A., Anuchina N.M., Terent’ev A.A. i dr. Dioksidin: antimikrobnaya aktivnost' i perspektivy klinicheskogo primeneniya na sovremennom etape // Antibiotiki i himioterapiya. 2013. Т. 58. № 3–4. S. 37–42. (In Russian)]
Фонштейн Л.М., Абилев С.К., Акиньшина Л.П. и др. Исследование генетических эффектов лекарственных веществ и других биологически активных соединений в тестах на мутагенез и ДНК-повреждающее действие // Хим.-фарм. журн. 1978. № 10. С. 11–16. [Fonshtejn L.M., Abilev S.K., Akin’shina L.P. i dr. Issledovanie geneticheskih effektov lekarstvennyh veshchestv i drugih biologicheski aktivnyh soedinenij v testah na mutagenez i DNK-povrezhdayushchee dejstvie // Him.-farm. zhurnal. 1978. № 10. S. 11–16. (In Russian)]
Фонштейн Л.М., Ревазова Ю.А., Золотарева Г.Н. и др. Изучение мутагенной активности диоксидина // Генетика. 1985. Т. 21. № 5. С. 11–19. [Fonshtejn L.M., Revazova Yu.A., Zolotareva G.N. i dr. Izuchenie mutagennoj aktivnosti dioksidina // Genetika. 1985. Т. 21. № 5. S. 11–19. (In Russian)]
Cычева Л.П., Коваленко М.А., Шереметьева С.М. и др. Изучение мутагенного действия диоксидина полиорганным микроядерным методом // Бюл. эксперим. биол. и мед. 2001. Т. 132. № 8. С. 188–195. [ Sycheva L.P., Kovalenko M.A., Sheremet’eva S.M. i dr. Izuchenie mutagennogo dejstviya dioksidina poliorgannym mikroyadernym metodom // Byul. eksperim. biol. i med. 2001. Т. 132. № 8. S. 188–195. (In Russian)]
Абилев С.К., Абдразаков М.М. Органоспецифичность ДНК-повреждающего действия диоксидина // Генетика. 1991. Т. 27. № 11. С. 2039–2041. [Abilev S.K., Abdrazakov M.M. Organospecifichnost’ DNK-povrezhdayushchego dejstviya dioksidina // Genetika. 1991. Т. 27. № 11. S. 2039–2041. (In Russian)]
Дурнев А.Д., Середенин С.Б. Мутагены: (Скрининг и фармакол. профилактика воздействий). М.: Медицина, 1998. 326 с. ISBN 5-225-04429-8. [Durnev A.D., Seredenin S.B. Mutageny: (Skrining i farmakol. profilaktika vozdejstvij). M.: Medicina, 1998. 326 s. ISBN 5-225-04429-8. (In Russian)]
Дурнев А.Д., Дубовская О.Ю., Нигарова Э.А. и др. Роль свободных радикалов кислорода в механизме мутагенного действия диоксидина // Хим.-фарм. журн. 1989. Т. 23. № 11. С. 1289–1291. [Durnev A.D., Dubovskaya O.Yu., Nigarova E.A. i dr. Rol’ svobodnyh radikalov kisloroda v mekhanizme mutagennogo dejstviya dioksidina // Him.-farm. Zhurnal. 1989. Т. 23. № 11. S. 1289–1291. (In Russian)]
Середенин С.Б., Сазонтова Т.Г., Дурнев А.Д., Гусева Н.В. Влияние диоксидина и циклофосфана на перекисное окисление липидов и активность супероксиддисмутазы и каталазы у мышей линий С57ВI/6 и ВАLВ/с // Бюл. эксперим. биологии и медицины. 1996. Т. 121. № 5. С. 528–553. [Seredenin S.B., Sazontova T.G., Durnev A.D., Guseva N.V. Vliyanie dioksidina i ciklofosfana na perekisnoe okislenie lipidov i aktivnost' superoksiddismutazy i katalazy u myshej linij C57Bl/6 i BALB/c // Byulleten’ eksperimental’noj biologii i mediciny. 1996. Т. 121. № 5. S. 528–553. (In Russian)]
Carta A., Corona P., Loriga M. Quinoxaline 1,4-di-oxide: a versatile scaffold endowed with manifold activities // Cur. Med. Chem. 2005. V. 12. № 19. P. 2259–2272. https://doi.org/10.2174/0929867054864831
Ramli Y., Moussaif A., Karrouchi K., Essassi E.M. Pharmacological Profile of Quinoxalinone // J. Chem. 2014. Art. ID 563406, 21 p. https://doi.org/10.1155/2014/563406
Cheng G., Sa W., Cao C. et al. Quinoxaline 1,4-di-N-Oxides: Biological Activities and Mechanisms of Actions // Front. Pharmacol. 2016. V. 7. Art. 64. P. 1–21. https://doi.org/10.3389/fphar.2016.00064
Wang X., Martínez M.A., Cheng G. et al. The critical role of oxidative stress in the toxicity and metabolism of quinoxaline 1,4-di-N-oxides in vitro and in vivo // Drug. Metab. Rev. 2016. V. 48. № 2. P. 159–182. https://doi.org/10.1080/03602532.2016.1189560
Мазанко М.С., Чистяков В.А., Празднова Е.В. и др. Диоксидин индуцирует антибиотикорезистентность бактерий // Молек. генетика, микробиология и вирусология. 2016. Т. 34. № 4 С. 149–154. [Mazanko M.S., Chistyakov V.A., Prazdnova E.V. i dr. Dioksidin induciruet antibiotikorezistentnost' bakterij // Molekulyarnaya genetika, mikrobiologiya i virusologiya. 2016. Т. 34. № 4. S. 149–154. (In Russian)]https://doi.org/10.18821/0208-0613-2016-34-4-149-154
Котова В.Ю., Манухов И.В., Завильгельский Г.Б. Lux-биосенсоры для детекции SOS-ответа, теплового шока и окислительного стресса // Биотехнология. 2009. № 6. С. 16–25. [Kotova V.Yu., Manukhov I.V., Zavilgelsry G.B. Lux-Biosensors for Detection of SOS-Response, Heat Shock, and Oxidative Stress // Applied Biochemistry and Microbiology. 2010. V. 46. № 8. P. 781–788. (In Russian)]https://doi.org/10.1134/S0003683810080089
Падейская Е.Н., Тюрин И.И., Першин Г.Н. Субмикроскопические изменения в клетках Е. coli и St. aureus под влиянием диоксидина // Фармакология и токсикология. 1974. № 1. С. 80. [Padejskaya E.N., Tyurin I.I., Pershin G.N. Submikroskopicheskie izmeneniya v kletkah E. coli i St. aureus pod vliyaniem dioksidina // Farmakologiya i toksikologiya. 1974. № 1. S. 80. (In Russian)]
Фонштейн Л.М., Абилев С.К., Акиньшина Л.П. и др. Исследование генетических эффектов лекарственных веществ и других биологически активных соединений в тестах на мутагенез и ДНК-повреждающее действие // Хим.-фарм. журн. 1978. № 10. С. 11–16. [Fonshtejn L.M., Abilev S.K., Akin’shina L.P. i dr. Issledovanie geneticheskih effektov lekarstvennyh veshchestv i drugih biologicheski aktivnyh soedinenij v testah na mutagenez i DNK-povrezhdayushchee dejstvie // Him.-farm. zhurnal. 1978. № 10. S. 11–16. (In Russian)]
Suter W., Rosselet A., Knüse F. Mode of Action of Quindoxin and Substituted quinoxaline-di-N-oxides on Escherichia coli // Antimicrob. Agents Chemother. 1978. V. 13. № 5. P. 70–83. https://doi.org/10.1128/aac.13.5.770
Абилев С.К., Котова В.Ю., Смирнова С.В. и др. Специфические lux-биосенсоры Еscherichia coli, содержащие плазмиды pRecA::lux, pColD::lux и pDinI::lux, для детекции генотоксичных агентов // Генетика. 2020. Т. 56. № 6. С. 648–656. [Abilev S.K., Kotova V.Y., Smirnova S.V. et al. Specific Lux Biosensors of Escherichia coli Containing pRecA::lux, pColD::lux, and pDinI::lux Plasmids for Detection of Genotoxic Agents // Russian Journal of Genetics. 2020. V. 56. № 6. P. 666–673. https://doi.org/10.1134/S1022795420060022 (In Russian)]
Ganley B., Chowdhury G., Bhansali J. et al. Redox-activated, hypoxia-selective DNA cleavage by quinoxaline1,4-di-N-oxide // Bioorg. Med.Chem. 2001. V. 9. P. 2395–2401. https://doi.org/10.1016/S0968-0896(01)00163-8
Cheng G., Li B., Wang C., Zhang H. et al. Systematic and Molecular Basis of the Antibacterial Action of Quinoxaline 1,4-Di-NOoxides against Escherichia coli // PLoS ONE 2015. V. 10. № 8: e0136450. https://doi.org/10.1371/journal.pone.0136450
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология


