Радиотехника и электроника, 2022, T. 67, № 10, стр. 993-1000
Методика выделения кардиоинтервалограммы из сигнала фотоплетизмограммы для оценки суммарного процента фазовой синхронизации контуров вегетативной регуляции кровообращения
А. В. Курбако a, *, В. В. Сказкина a, Е. И. Боровкова a, А. Р. Киселев b, c, d, В. И. Пономаренко a, М. Д. Прохоров a, В. И. Гриднев a, c, А. С. Караваев a, А. В. Кулигин c, Н. С. Красикова c, С. А. Миронов c, Б. П. Безручко a
a Саратовский филиал Института радиотехники и электроники им. В.А. Котельникова РАН
410019 Саратов, ул. Зеленая, 38, Российская Федерация
b Саратовский национальный исследовательский государственный университет им. Н.Г. Чернышевского
410012 Саратов, ул. Астраханская, 83, Российская Федерация
c Саратовский государственный медицинский университет им. В.И. Разумовского
410012 Саратов, ул. Большая Казачья, 112, Российская Федерация
d Национальный медицинский исследовательский центр терапии и профилактической медицины
101990 Москва, Петроверигский пер., 10, стр. 3, Российская Федерация
e Университет “Иннополис”
420500 Иннополис, ул. Университетская, 1, Республика Татарстан, Российская Федерация
* E-mail: kurbako.sasha@mail.ru
Поступила в редакцию 31.03.2022
После доработки 31.03.2022
Принята к публикации 25.04.2022
- EDN: MSKCNL
- DOI: 10.31857/S0033849422100084
Аннотация
Проведено сопоставление четырех методик выделения последовательности интервалов между сердечными сокращениями из сигнала фотоплетизмограммы для оценки суммарного процента фазовой синхронизации контуров вегетативной регуляции кровообращения, рассчитанных на работу в реальном времени. В ходе анализа экспериментального ансамбля записей здоровых испытуемых выбраны оптимальные параметры для используемых подходов. Проведено сравнение кардиоинтервалограмм, полученных из сигналов фотоплетизмограмм, с кардиоинтервалограммами, выделенными из одновременно зарегистрированных сигналов электрокардиограммы в ходе анализа фазовой синхронизации между фазами выделенных сигналов в низкочастотном диапазоне (0.04–0.15 Гц), который отражает активность элементов вегетативного контроля кровообращения. Продемонстрирована работоспособность используемых подходов в ходе анализа суммарного процента фазовой синхронизации контуров вегетативной регуляции сердечно-сосудистой системы по сигналу фотоплетизмограммы для групп здоровых людей и пациентов во время болезни COVID-19.
ВВЕДЕНИЕ
Организм человека – сложная нелинейная система высокой размерности. Регуляция работы его элементов обеспечивается согласованной работой множества контуров нервной и гуморальной регуляции. Гибкая подстройка работы сердечно-сосудистой системы под текущие потребности организма обеспечивается как гуморальными факторами, так и двойной иннервацией от симпатической и парасимпатической ветвей вегетативной нервной системы при участии различных колебательных процессов, отражающих активность подсистем вегетативной регуляции, активно взаимодействующих друг с другом [1].
Для контроля состояния организма возможна и важна количественная оценка особенностей индивидуальной и коллективной динамики подсистем нервной регуляции с помощью анализа низкочастотных спектральных составляющих в сигналах сердечно-сосудистой системы [2–4].
Синхронизация 0.1 Гц колебаний в ритме сердца и периферическом кровообращении является важной физиологической особенностью организма человека, позволяющая ему адаптироваться и саморегулироваться [5]. Степень этой синхронизации указывает на функциональное состояние сердечно-сосудистой системы (ССС): у пациентов контуры вегетативной регуляции частоты сердечных сокращений и тонуса артериальных сосудов демонстрируют более редкие эпохи синхронизации по сравнению со здоровыми людьми, что может указывать на частичное функциональное разобщение механизмов вегетативной регуляции кровообращения [6].
Ранее был предложен новый показатель оценки степени синхронизованности 0.1 Гц колебаний, ориентированный на анализ нестационарных сигналов биологической природы – суммарный процент фазовой синхронизации S [7]. С помощью разработанного индекса были получены новые фундаментальные сведения о внутреннем устройстве и особенностях взаимодействия вегетативной регуляции ССС человека [3, 8], а также показана его практическая важность для решения задач диагностики и персонализированной терапии патологий кровообращения [4, 9, 10].
Для массового внедрения анализа суммарного процента фазовой синхронизации необходима разработка аппаратно-программных систем и методов, позволяющих анализировать сигналы ССС в реальном времени. В наших предыдущих исследованиях был получен ряд результатов в данном направлении [11–13]. Важным шагом при создании компактных массовых и эргономичных диагностических устройств является переход от анализа синхронизации по паре одновременно регистрируемых сигналов: электрокардиограммы (ЭКГ) и фотоплетизмограммы (ФПГ) к оценке S по унивариантному сигналу ФПГ. Принципиальная возможность этого была показана нами ранее [14], однако систематических исследований с сопоставлением различных способов выделения из ФПГ информации о динамике сердечного ритма и выбором значений свободных параметров таких подходов не осуществлялось.
В данной работе предложенный нами ранее подход сопоставлен с тремя новыми методиками. В ходе сравнения кардиоинтервалограмм, выделенных из ЭКГ и ФПГ, зарегистрированных у здоровых испытуемых и пациентов, страдающих COVID-19, уточнены параметры методик и сделан выбор в пользу наиболее чувствительной.
1. ДАННЫЕ И МЕТОДЫ
Были рассмотрены полученные экспериментально 25 одновременных записей ЭКГ (I стандартное отведение) и ФПГ (дистальная фаланга безымянного пальца левой руки) здоровых добровольцев без выявленных патологий ССС (13 мужчин 21.2 ± 3.1 лет, 12 женщин 20.9 ± 2.2 лет) и пациентов с COVID-19, находящихся на стационарном лечении, не нуждающихся в кислородной поддержке и без выявленных легочных осложнений (12 мужчин 49.4 ± 11.6 лет, 9 женщин 51.0 ± 12.5 лет). Регистрация всех записей осуществлялась сертифицированным электроэнцефалографом-анализатором ЭЭГА-21/26 “Энцефалан-131-03” фирмы “Медиком” Частота дискретизации составляла 250 Гц/канал, полоса пропускания аналогового тракта 0.016…70 Гц. Длительность записей составляла 120 мин. Для анализа выбирали пятиминутные участки записей, не содержащие артефактов и участков аритмий.
Рассматриваемые в данной работе методики в конечном счете ориентированы на анализ фазовой синхронизации контуров вегетативной регуляции сердечного ритма и артериального давления с помощью предложенного ранее метода, основанного на расчете суммарного процента фазовой синхронизации S. Данный метод был предложен в работе [7] и предполагает использование одновременно зарегистрированных сигналов ФПГ и ЭКГ. Из сигнала ЭКГ выделяют последовательность временных интервалов между последовательными сердечными сокращениеми (RR-интервалы, кардиоинтервалограмма). Для этого используется процедура сплайн-интерполяции (рекомендуемая в методической работе [2]), в результате которой получается эквидистантный временной ряд RR-интервалов, имеющий частоту дискретизации 5 Гц. Этот сигнал и сигнал ФПГ фильтруются в так называемом LF-диапазоне (0.04…0.15 Гц) с помощью полосового фильтра выделения составляющих, связываемых с работой контуров симпатической регуляции частоты сердечных сокращений (ЧСС) и артериального давления соответственно [2]. Частота дискретизации фильтрованного ФПГ понижается до 5 Гц с помощью децимации. С использованием преобразования Гильберта из полученных сигналов выделяются временные ряды мгновенных фаз и рассчитывается их разность. В соответствии с [15] участок сигнала разности мгновенных фаз идентифицируется как участок фазовой синхронизации, если разность фаз остается близка к константе. Изменение значения отслеживается с помощью линейной аппроксимации в скользящем окне методом наименьших квадратов. Если угол наклона аппроксимирующей линии (имеющий смысл расстройки мгновенных частот колебаний) остается меньше заданного порогового значения, то участок идентифицируется как синхронный. В результате количественный индекс S, суммарный процент фазовой синхронизации, рассчитывается как сумма длительностей всех идентифицированных участков синхронизации, отнесенная к полной длине реализации и выраженная в процентах.
Ранее [16] была показана принципиальная возможность оценки S по унивариантному сигналу ФПГ, причем информация о последовательности интервалов между сердечными сокращениями также выделялась из этого сигнала. На небольшой статистике было показано, что последовательность локальных минимумов ФПГ на интервале кардиоцикла может использоваться в качестве аналога RR-интервалов. При этом результаты анализа синхронизации при использовании пары сигналов ЭКГ, ФПГ и при использовании лишь последнего демонстрировали отличия в оценках S до 10.5%. Это объясняется тем, что традиционно используемый для идентификации момента ССС R-пик ЭКГ (соответствующий моменту сокращения желудочков сердца) у здоровых добровольцев представляет собой короткий высокоамплитудный импульс, слабо подверженный шумам и искажениям измерительного тракта, а сигнал ФПГ в силу его физиологической природы и технических особенностей регистрации имеет плавную форму и существенно более подвержен шумам и искажениям. Кроме того, известные результаты указывают на наличие ряда физиологических факторов, вносящих погрешности при выделении информации о сокращениях сердца из ФПГ [17]. В данной работе сопоставлены четыре методики выделения последовательности интервалов между сердечными сокращениями из ФПГ (далее – PP‑интервалы) с выбором значений свободных параметров методик и сопоставлением полученных сигналов PP-интервалов с RR-интервалами, выделенными из одновременно зарегистрированных сигналов ЭКГ.
Естественным способом борьбы с помехами и шумами измерительного канала при выделении PP-интервалов является узкополосная фильтрация ФПГ (рис. 1а) около основной частоты сердечного ритма (около 1 Гц у здоровых добровольцев). В нашей работе сопоставляются случаи выделения PP-интервалов как интервалов между локальными максимумами (методика 1) или минимумами (методика 2) этого сигнала. Из рис. 1а видно, что узкополосная фильтрация существенно искажает фазы и амплитуды спектральных составляющих сигнала ФПГ, что, очевидно, может сказаться на точности работы таких методик выделения PP‑интервалов. Поэтому для сопоставления были взяты и две другие методики. Для их реализации узкополосная фильтрация около основной ЧСС являлась предварительным этапом, необходимым для определения положения текущего кардиоцикла. В пределах идентифицированного таким образом кардиоцикла выявлялись локальные максимумы (методика 3) или минимумы (методика 4) сигнала ФПГ (см. рис. 1а), фильтрованного в относительно широкой полосе (шире, чем при использовании методик 1 и 2, но уже, чем полоса пропускания аналогового тракта для устранения низкочастотных трендов и высокочастотной помехи).
Рис. 1.
Этапы выделения PP-интервалов методиками 1–4: a – детектирование расстояния между экстремумами ФПГ (пунктир – исходный сигнал ФПГ (полоса 0.016…70 Гц), тонкая линия – ФПГ, фильтрованный узкополосным фильтром (полоса 0.8…1.8 Гц), жирная линия – сигнал, фильтрованный широкополосным фильтром (полоса 0.6…6.0 Гц); локальные экстремумы для ФПГ, фильтрованного в узкой полосе (методики 1 и 2 обозначены темным и светлым треугольниками соответственно) и широкой (методики 3 и 4 обозначены темным и светлым кружочками соответственно); б – разности мгновенных фаз PP- и RR-интервалов в LF-диапазоне, построенных методами 1–4; в – RR- и PP‑интервалы, выделенные методом 1 для испытуемого № 1; г – RR- и PP-интервалы для испытуемого № 1, фильтрованные в LF-диапазоне.
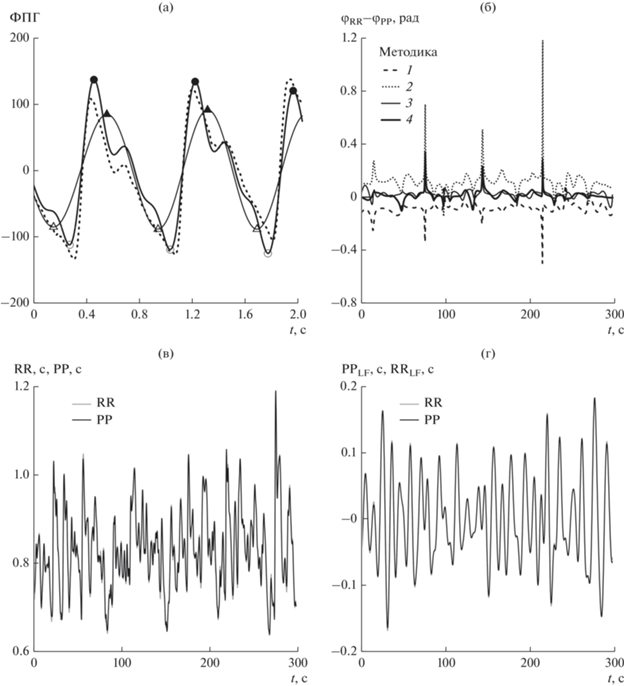
Для ограничения полосы сигналов ФПГ при реализации четырех перечисленных методик были использованы фильтры с прямоугольной амплитудно-частотной характеристикой.
Для выбора параметров сопоставляемых методик – оптимальных значений частот среза, обеспечивающих наилучшее соответствие сигналов RR- и PP-интервалов в LF-диапазоне, осуществлялся перебор этих параметров с максимизацией значения коэффициента фазовой когерентности (КФК) [18] между мгновенными фазами пятиминутных участков соответствующих сигналов RR- и PP-интервалов (см. рис. 1в) в этом диапазоне (см. рис. 1г). Этот индекс достигает 1.0 при полной фазовой когерентности сигналов (распределение свернутой разности фаз представляет собой δ-пик) и значения 0.0 при отсутствии фазовой когерентности (равномерное распределение разности фаз).
2. ПОЛУЧЕННЫЕ РЕЗУЛЬТАТЫ
На первом этапе были выбраны параметры для предложенных методик выделения PP-интервалов (рис. 2). Проведенный анализ позволил выбрать оптимальные полосы фильтрации для четырех сопоставляемых методик, которые обеспечивали наибольшую вероятность наблюдения по ансамблю высокой фазовой когерентности RR- и PP-интервалов в LF-диапазоне. Методика 1: 0.8…1.8 Гц; методика 2: 0.8…1.8 Гц; методика 3: 0.8…1.8 Гц для узкополосного и 0.8…4 Гц для широкополосного фильтров; методика 4: 0.6…1.8 Гц и 0.6…6.0 Гц соответственно.
Рис. 2.
Вероятность Р встретить в выборке значение КФК выше 0.95 для настроек полос пропускания по методикам 1–4. Осуществлялся перебор частот среза: а – нижняя и б – верхняя граница узкополосного фильтра, в – нижняя и г – верхняя граница широкополосного фильтра. Представлены сечения многомерной поверхности в пространстве параметров для вектора параметров, обеспечивающего максимальные значения КФК в данном сечении.

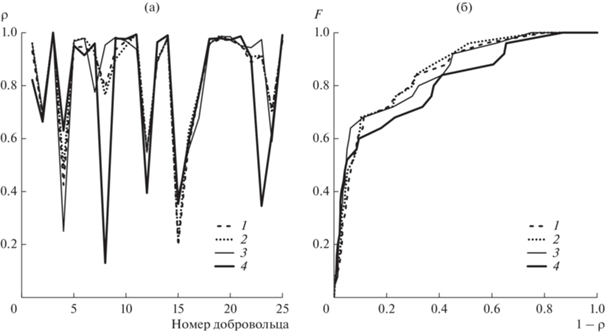
На рис. 3 представлены значения КФК, рассчитанные по экспериментальным реализациям здоровых добровольцев при выбранных полосах пропускания фильтров. КФК составляет 0.83 ± 0.20 (среднее ± стандартное отклонение) для методики 1, 0.84 ± 0.20 для методики 2, 0.84 ± 0.21 для методики 3 и 0.79 ± 0.26 для методики 4.
Рис. 3.
Экспериментальные значения, полученные по методикам 1–4, коэффициента фазовой когерентности (а) RR- и PP-интервалов при выбранных параметрах фильтрации и функция его распределения (б).
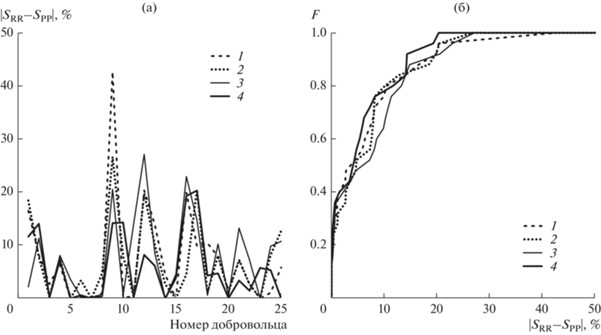
Работоспособность использованных методик выделения PP-интервалов сопоставлялась в ходе расчета суммарного процента фазовой синхронизации S различных категорий испытуемых при использовании пары сигналов ЭКГ и ФПГ – SRR, либо по унивариантном сигналу ФПГ – SPP. Модули разности этих значений представлены на рис. 4а. Средние по ансамблю значения разности составляют: 7.34 ± 9.69 для методики 1, 7.05 ± 7.43 для методики 2, 7.69 ± 7.84 для методики 3, 5.83 ± ± 6.34 для методики 4. Функции распределения этих величин представлены на рис. 4б. Видно, что лучшее соответствие эталонному методу обеспечивает методика 4, а худшее – методика 3.
Рис. 4.
Сравнение результатов оценки суммарного процента фазовой синхронизации здоровых добровольцев для эталонного метода, основанного на анализе пары сигналов ЭКГ и ФПГ SRR, и используемых методик 1–4 SPP: a – модули разности оценок S для всех здоровых добровольцев, б – функция распределения модуля разности оценок.
Параметры сопоставляемых методик выделения PP-интервалов были выбраны в ходе анализа записей здоровых добровольцев. Оценка возможностей подхода при анализе пациентов была проведена при анализе ансамбля записей пациентов с COVID-19, так как ранее в работе [19] было показано, что у данной категории пациентов величина S значимо снижена относительно группы здоровых добровольцев.
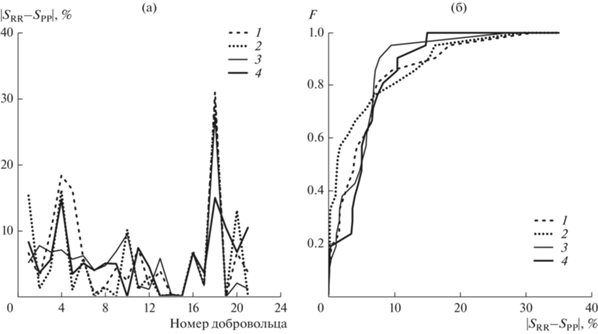
Результаты анализа пациентов представлены на рис. 5а. Средние по ансамблю значения разницы составляют 6.28 ± 7.50, 5.32 ± 7.61, 5.34 ± 5.79 и 5.75 ± 4.29 для методик 1–4 соответственно. Функции распределения этих величин представлены на рис. 5б. Видно, что лучшее соответствие эталонному методу обеспечивает методика 2, а худшее – методика 1.
Рис. 5.
Сравнение результатов оценки суммарного процента фазовой синхронизации пациентов с COVID-19 для эталонного метода, основанного на анализе пары сигналов ЭКГ и ФПГ SRR, и используемых методик 1–4 SPP: a – модули разности оценок S для всех здоровых добровольцев, б – функция распределения модуля разности оценок.
3. ОБСУЖДЕНИЕ ПОЛУЧЕННЫХ РЕЗУЛЬТАТОВ
Проведенный анализ показывает качественное соответствие результатов анализа групп добровольцев (здоровых и пациентов, страдающих COVID-19), при том что параметры фильтров сопоставляемых методик выбирались в ходе анализа лишь выборки здоровых испытуемых. Это позволяет рассчитывать на работоспособность используемых подходов при анализе различных групп испытуемых.
Сопоставление результатов анализа указывает на лучшее соответствие эталонному подходу методики анализа синхронизации по унивариантной ФПГ с использованием методики 4 выделения PP‑интервалов. Этот споcоб демонстрирует удовлетворительное соответствие эталонному методу. Преимущества такой методики над тремя другими можно объяснить тем, что узкополосная фильтрация, используемая в методиках 1 и 2, значительно искажает фазочастотную характеристику сигнала, хотя и обеспечивает лучшее соотношение сигнал/шум. Использование методики 4 для оценки S по унивариантному сигналу ФПГ потенциально может быть реализовано на базе массовых носимых малогабаритных эргономичных аппаратно-программных диагностических систем для скрининга психофизического состояния испытуемых. Анализ синхронизации по унивариантному сигналу ФПГ может иметь преимущества по сравнению с методом, основанным на анализе пары сигналов ЭКГ и ФПГ, при анализе данных пациентов, страдающих аритмиями и кардиологическими патологиями, искажающими форму ЭКГ.
В данном исследовании анализировались участки сигналов, заведомо не содержащие артефактов и аритмий. Однако при реализации в перспективе мониторирующих диагностических систем вопрос выявления, коррекции и/или исключения из анализа участков записей, содержащих артефакты, является важным вопросом, требующим отдельного рассмотрения и решения. Наличие у пациентов аритмий также является критерием исключения таких пациентов из анализа суммарного процента фазовой синхронизации.
ЗАКЛЮЧЕНИЕ
В работе показана возможность анализа фазовой синхронизации контуров вегетативного контроля кровообращения по унивариантным сигналам ФПГ здоровых добровольцев и пациентов, страдающих COVID-19.
Проведено сопоставление предложенного ранее и зарекомендовавшего себя эталонного подхода, использующего для анализа синхронизации сигналы ЭКГ и ФПГ и четырех методик, основанных на выделении PP-интервалов из унивариантного сигнала ФПГ. Были выбраны параметры (полосы пропускания полосовых фильтров) для сопоставляемых методик, обеспечивающие наилучшее соответствие эталонному подходу. Проведенное исследование позволяет рекомендовать при выделении PP-интервалов сделать выбор в пользу методики 4, предполагающего предварительное осуществление фильтрации ФПГ в полосе 0.6…1.8 Гц для уточнения положения кардиоцикла, а затем нахождения локального минимума ФПГ в пределах идентифицированного кардиоцикла по сигналу ФПГ, фильтрованному в полосе 0.6…6.0 Гц.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Шмидт Р., Тевс Г. Физиология человека. В 3-х тт. М.: Мир, 2005. Т. 2.
Баевский Р.М., Иванов Г.Г., Чирейкин Л.В. и др. // Вестник аритмологии. 2001. Т. 24. С. 65.
Kiselev A.R., Mironov S.A., Karavaev A.S. et al. // Physiol. Measurement. 2016. V. 37. P. 580.
Kiselev A.R., Gridnev V.I., Prokhorov M.D. et al. // Annals of Noninvasive Electrocardiology. 2012. V. 17. № 3. P. 204.
Schäfer C., Rosenblum M.G., Kurths J., Abel H.-H. // Nature. 1998. V. 392. № 6673. P. 239.
Ponomarenko V.I., Prokhorov M.D., Karavaev A.S. et al. // Eur. Physical J. Special Topics. 2013. V. 222. № 10. P. 2687.
Karavaev A.S., Prokhorov M.D., Ponomarenko V.I. et al. // Chaos. 2009. V. 19. № 3. P. 033112.
Караваев А.С., Ишбулатов Ю.М., Пономаренко В.И. и др. // Физиология человека. 2017. Т. 43. № 1. С. 70.
Киселев А.Р., Гриднев В.И., Караваев А.С. и др. // Артериальная гипертензия. 2011. Т. 17. № 4. С. 354.
Киселев А.Р., Караваев А.С., Гриднев В.И. и др. // Саратов. науч.-мед. журн. 2010. Т. 6. № 1. С. 061.
Кульминский Д.Д., Курбако А.В., Сказкина В.В. и др. // Изв. Сарат. ун-та. Новая серия. Сер. Физика. 2021. Т. 21. Вып. 1. С. 58.
Курбако А.В., Боровкова Е.И., Киселев А.Р. и др. // Изв. Сарат. ун-та. Новая серия. Сер. Физика. 2021. Т. 21. Вып. 3. С. 213.
Курбако А.В., Кульминский Д.Д., Боровкова Е.И. и др. // Изв. вузов. Прикладная и нелинейная динамика. 2021. Т. 29. № 6. С. 892.
Кульминский Д.Д., Астахов О.В., Киселев А.Р., Караваев А.С. // Тез. докл. VIII Всерос. конф. молодых ученых “Нанофотоника, наноэлектроника и нелинейная физика”. Саратов: Изд-во Сарат. ун-та; 2013. С. 139.
Rosenblum M.G., Pikovsky A.S., Kurths J. et al. // Neuro-Informatics and Neural Modelling. Handbook of Biological Phys. V.4. Eds. by F. Moss, S. Gielen. Amsterdam: Elsevier, 2001. P. 269.
Боровкова Е.И., Караваев А.С., Киселев А.Р. и др. // Анналы аритмологии. 2014; V. 11. № 2. Р. 84.
Imai Y.1., Aihara A., Ohkubo T. et al. // Amer. J. Hypertension. 1997. V. 10. № 11. P. 1281.
Mormann F., Lehnertz K., David P., Elger C.E. // Physica D: Nonlinear Phenomena. 2000. V. 144. № 3–4. P. 358.
Skazkina V.V., Krasikova N.S., Borovkova E.I. et al. // Russian Open Med. J. 2021. V. 10. № 3. P. e0307.
Дополнительные материалы отсутствуют.
Инструменты
Радиотехника и электроника


