Радиотехника и электроника, 2022, T. 67, № 10, стр. 1001-1005
Изменение статистических характеристик электроэнцефалограмм крыс после аудиального воздействия
Д. Д. Кульминский a, b, *, Е. И. Боровкова c, А. Н. Храмков c, А. В. Курбако a, b, Ю. М. Ишбулатов a, c
a Саратовский филиал Института радиотехники и электроники им. В.А. Котельникова РАН
410019 Саратов, ул. Зеленая, 38, Российская Федерация
b Научно-технологический университет “Сириус”
354340 Краснодарский край, пгт. Сириус, Олимпийский просп., 1, Российская Федерация
c Саратовский национальный исследовательский государственный университет им. Н.Г. Чернышевского
410012 Саратов, ул. Астраханская, 83, Российская Федерация
* E-mail: kulminskydd@gmail.com
Поступила в редакцию 30.03.2022
После доработки 30.03.2022
Принята к публикации 25.04.2022
- EDN: BRCCPJ
- DOI: 10.31857/S0033849422100072
Аннотация
В ходе анализа экспериментальных записей внутричерепных электроэнцефалограмм крыс в состояниях сна, бодрствования и после аудиального воздействия показано, что статистические меры, характеризующие особенности индивидуальной и коллективной динамики электрической активности головного мозга в δ-частотном диапазоне, позволяют классифицировать состояния животного. Фактором, определяющим такие изменения электроэнцефалограмм, является изменение скорости дренажа мозговой жидкости, что подтверждается, в частности, близостью свойств низкочастотной электрической активности мозга во сне и после аудиального воздействия, в отличие от состояния бодрствования.
ВВЕДЕНИЕ
Разработка биоинформационных систем, использующих математические модели и методы обработки больших данных, является одной из актуальных задач междисциплинарной науки. Исследования активности головного мозга, как и многие другие направления, нуждаются в подобных системах для ранней и персонифицированной диагностики, а также точечной терапии различных заболеваний. Развитие технологий регистрации биопотенциалов мозга, электроэнцефалограмм (ЭЭГ) [1–4] открыло широкие возможности для работы по биомедицинскому, нейрофизиологическому и психометрическому направлениям исследований. Разработка методов анализа сигналов ЭЭГ становится основой для создания современных нейроинтерфейсов и источником дополнительной информации об особенностях функционирования различных структур головного мозга [5–7]. В данной работе на основе анализа экспериментальных данных ЭЭГ крыс предложены подходы количественной оценки изменения состояния животного на основе статистики линейных и нелинейных характеристик.
1. ДАННЫЕ И МЕТОДЫ
Дизайн экспериментальной работы включал в себя регистрацию двух каналов внутричерепных электроэнцефалограмм у животных в условиях свободного поведения на протяжении двух часов. Выделялись два состояния животных: бодрствование, включающее в себя локомоторную активность, в том числе в вертикальной позе, редкие замирания на короткие промежутки, и поведенческий сон, включающий в себя лежачую позу, мышечное расслабление при закрытых или полузакрытых глазах. Далее проводилась процедура длительного звукового воздействия, по технологии, описанной в работе [8], после которой также проводилась регистрация ЭЭГ, когда животное бодрствовало. В итоге проводился анализ записей ЭЭГ животных (три фенотипически-здоровые крысы, самцы в возрасте пяти месяцев) в трех состояниях: бодрствования, сна и после звукового воздействия.
Важным этапом исследования являлся спектральный анализ данных, позволяющий выделить диапазоны частот, изменения мощности в которых в различных состояниях животного делает их перспективными для концентрации исследовательского интереса с помощью дополнительных инструментов анализа. Оценка спектральной плотности мощности осуществлялась с помощью периодограммного метода Уэлча [9]. Для этого экспериментальные реализации разбивались на окна во временной области длительностью 100 с, которые скользили по временной реализации с шагом 50 с. Для уменьшения влияния эффектов утечки в каждом таком окне к временной реализации применялось оконное преобразование Бартлетта. По каждому окну оценивались периодограммы, которые затем усреднялись в частотной области методом Даньелла [10] с шириной окна усреднения 0.03 Гц, для подавления флуктуаций спектральной плотности мощности, обусловленных влияниями стохастических составляющих сигналов различной природы.
Использование методов диагностики связи между двумя сигналами по их временным реализациям было продиктовано гипотезой о генерализации процессов в головном мозге после звукового воздействия, связанной, по-видимому, с оттоком лимфатической жидкости, а также критериями отличия, выделенными при спектральном анализе.
В первую очередь попарно между отведениями ЭЭГ проводили оценку функции когерентности $C\left( f \right)$ [11]. Для двух колебательных процессов x(t) и y(t) функция когерентности оценивается по формуле
(1)
$C\left( f \right) = \frac{{\left| {{{S}_{{xy}}}\left( f \right)} \right|}}{{\sqrt {\left\langle {{{S}_{x}}\left( f \right)} \right\rangle \left\langle {{{S}_{y}}\left( f \right)} \right\rangle } ~}},$Для более детального анализа такого взаимодействия использовался метод диагностики связанности нелинейных систем, основанный на моделировании фазовой динамики [12], который в ряде случаев позволял выявлять преимущественное направление связи и запаздывание в связи между сигналами. Как было показано ранее, модели и методы нелинейной динамики [13, 14] позволяют решить целый ряд фундаментальных и прикладных задач [15–17].
Так как введение мгновенных фаз подразумевает анализ относительно узкополосных процессов, то экспериментальные сигналы перед выделением из них мгновенных фаз предварительно фильтровали, рассматривая динамику связи независимо в частотных областях: δ-диапазоне (0.5…1.0 Гц) и θ-диапазоне (6.5…7.5 Гц). Мгновенные фазы φx(t) и φy(t) колебательных процессов x и y выделяли с помощью преобразования Гильберта [18, 19]. Динамику отфильтрованных фазовых сигналов моделировали с помощью фазовых генераторов первого порядка [20]:
(2)
$\begin{gathered} \frac{{d{{\varphi }_{x}}\left( t \right)}}{{dt}} = {{G}_{x}}\left( {{{\varphi }_{x}}\left( t \right),{{\varphi }_{y}}\left( t \right)} \right) + \xi {\kern 1pt} {{{\kern 1pt} }_{x}}\left( t \right), \\ ~x,y = 1,2,\,\,\,\,y \ne x, \\ \end{gathered} $(3)
$\begin{gathered} \delta {{\varphi }_{x}}\left( t \right) = {{\varphi }_{x}}\left( {t + \tau } \right) - {{\varphi }_{x}}\left( t \right) = \\ = {{F}_{x}}\left( {{{\varphi }_{x}}\left( t \right),{{\varphi }_{y}}\left( {t - {{\Delta }_{{y \to x}}}} \right)} \right) + {{\varepsilon }_{x}}\left( t \right),~\,\,\,y \ne x, \\ \end{gathered} $(4)
${{G}_{x}} = \mathop \smallint \limits_0^{2\pi } \mathop \smallint \limits_0^{2\pi } (\partial {{F}_{x}}{{\left( {{{\varphi }_{x}},{{\varphi }_{y}}} \right)} \mathord{\left/ {\vphantom {{\left( {{{\varphi }_{x}},{{\varphi }_{y}}} \right)} {\partial {{\varphi }_{{y,x}}})}}} \right. \kern-0em} {\partial {{\varphi }_{{y,x}}})}}d{{\varphi }_{x}}d{{\varphi }_{y}}.$Расчет проводили при значении временного сдвига между рядами τ = 10 с и пробных значениях запаздывания ${{\Delta }_{{x \to y}}}~$ в интервале от 0 до 4 с, чтобы оценить ${{G}_{x}}\left( {{{\Delta }_{{y \to x}}}} \right)$. Аналогичные параметры использовались для оценки связи в противоположном направлении. Для оценки статистической значимости направленной связи мы рассчитали максимальные значения функций нелинейного взаимодействия между двумя процессами и сравнили их с максимальной силой связи между суррогатными данными.
При оценке значений функции когерентности и значений направленных связей проводили контроль их статистической значимости с помощью генерации ансамбля суррогатных данных. Использовался метод Amplitude Adjusted Fourier Transform (AAFT), предложенный в работе [21] для проверки статистической гипотезы о линейно-несвязанных системах. Такой способ приготовления суррогатных данных сохранял периодограммы анализируемых сигналов, но заведомо разрушал корреляции между фазами сигналов. Результаты считались статистически значимыми, если p-значение не превышало 0.05.
2. ПОЛУЧЕННЫЕ РЕЗУЛЬТАТЫ
Результаты спектрального анализа, представленные на рис. 1, позволяют изучить особенности сигналов ЭЭГ в разных состояниях.
Рис. 1.
Результаты спектрального анализа, усредненные по ансамблю: a – средние значения спектральной плотности мощности в δ- (0–4) Гц, θ- (4–8) Гц и α- (8–14) Гц диапазонах частот, б – низкочастотная часть спектров с отложенным стандартным отклонением в δ-диапазоне (увеличенный масштаб); кривая 1 – бодрствование, 2 – после аудиального воздействия, 3 – сон.

В результате спектрального анализа была выявлена похожесть динамики сигналов ЭЭГ в состоянии сна животного и после звукового воздействия в θ-диапазоне частот, интервал от 4 до 8 Гц. Мощность осцилляций спектральных составляющих в этом диапазоне во время бодрствования, напротив, оказывалась более низкой. Поведение спектров мощности в наиболее низкочастотном δ-диапазоне, интервал от 1 до 4 Гц, зарегистрированных в состояниях бодрствования, в том числе после аудиального воздействия, не демонстрировали выраженных пиков, в то время как во время сна мощность колебательной активности в полосе частот от 1 до 2.5 Гц возрастала, демонстрируя максимум около 1.5…1.8 Гц. Однако для наиболее медленной активности, характеризуемой частотами в диапазоне частот от 0.1 до 0.5 Гц, картина качественно менялась. Во время сна активность на этих частотах практически отсутствовала, однако во время бодрствования мощность в этой полосе демонстрировала небольшой рост, а после звукового воздействия мощность значимо и резко возрастала, в среднем на 6 дБ. Спектральный анализ, таким образом, демонстрировал качественные отличия в динамике ЭЭГ в различных состояниях крыс.
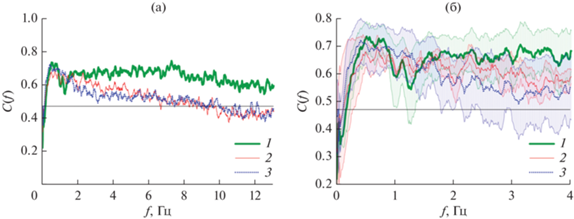
Усредненные по экспериментальному ансамблю функции когерентности представлены на рис. 2. Во всех состояниях ЭЭГ демонстрировали значимую когерентность в широкой полосе частот в δ- и θ-диапазонах частот. В θ-диапазоне функции когерентности ЭЭГ крыс во время сна и после аудиального воздействия оказались близки, что хорошо согласуется с результатами спектрального анализа. В состоянии бодрствования в этих диапазонах когерентность оставалась в среднем несколько выше, чем в других состояниях. В δ-диапазоне значения когерентностей во всех состояниях в среднем возрастали, приближались друг к другу, и достигали максимума на частоте около 1 Гц, а на частотах ниже 0.5 Гц быстро спадали. При этом на частотах ниже 1 Гц когерентности демонстрировали более сложную форму, что может отражать особенности сложного нелинейного взаимодействия спектральных компонент сигналов ЭЭГ в этой полосе.
Рис. 2.
Усредненные по ансамблю функции когерентности: a – функции когерентности в δ- , θ- и α-диапазонах частот, б – функции когерентности в δ-диапазоне частот с отложенным стандартным отклонением; кривая 1 – бодрствование, 2 – после аудиального воздействия, 3 – сон; горизонтальная линия – полный критический уровень значимости (p = 0.05).
Анализ связей методом, основанным на фазовой динамике, позволил выявить статистически значимые связи между отведениями ЭЭГ, причем максимального значения коэффициенты связи достигали при практически одинаковом значении запаздывания. Вместе с тем анализ экспериментальной выборки показал высокую симметрию связей между анализируемыми отведениями ЭЭГ в обоих направлениях. Коэффициент вариации разницы максимальных значений в двух направлениях относительно средней величины коэффициента связи составил 0.17. Поэтому, полагая связь между отведениями симметричной, по ансамблю были рассчитаны средние значения ее величины. Эта зависимость демонстрирует в среднем близкие значения фазовой связи для отведений ЭЭГ во время сна и бодрствования, однако после звукового воздействия наблюдается резкое снижение связи, динамика фаз отведений в анализируемой полосе частот становится существенно более независимой.
3. ОБСУЖДЕНИЕ ПОЛУЧЕННЫХ РЕЗУЛЬТАТОВ
Результаты спектрального анализа и оценки когерентности (см. рис. 1 и 2) между сигналами ЭЭГ показали связь электрической активности головного мозга в δ-частотном диапазоне с физиологическими характеристиками поведенческих состояний крысы, демонстрируя качественное изменение характера осцилляций сигналов ЭЭГ после звукового воздействия по сравнению с бодрствованием и сном животного. При этом наиболее выраженные изменения этих характеристик наблюдались в наиболее низкочастотной области этого диапазона для спектральных составляющих с характерными частотами <1.5 Гц. Такие результаты позволили при анализе сигналов ЭЭГ для сопоставления особенностей электрической активности головного мозга во сне, бодрствовании и после аудиального воздействия сконцентрироваться на исследовании медленно волновой активности. Спектральный анализ, оценка функции когерентности, расчет нелинейного взаимодействия на основе фазовой динамики позволили сделать вывод о том, что характерные свойства электрической активности головного мозга бодрствующих крыс в δ-диапазоне после аудиального воздействия оказываются более близкими к состоянию сна и максимально отличаются от состояния бодрствования животного. Был сделан вывод об активизации во сне и после звукового воздействия некоего общего для этих состояний фактора, оказывающего существенное влияние на электрическую активность структур головного мозга. Характерные временные масштабы таких изменений (доли и единицы секунд) позволяют в существенной степени исключить влияние на их формирование процессов высшей нервной деятельности. Известные результаты связывают электрическую активность мозга в таких частотных диапазонах преимущественно с процессами автономного контроля и медленной регуляции [7, 22, 23]. Эти известные факты, а также результаты, полученные в состоянии сна в работе [24], позволили предположить, что этим общим фактором является дренаж мозговой жидкости, который активируется во сне и значительно ускоряется при открытии гематоэнцефалического барьера [25]. Данный процесс имеет сложную природу и существенно нелинейный характер. Динамика низкочастотных компонент различных отведений ЭЭГ в последнем случае качественно меняется, существенно усложняясь и становясь менее когерентной и детерминированной, о чем свидетельствовали результаты анализа связанности на основе фазовой динамики. Полученные результаты позволили использовать рассмотренные нелинейные меры для классификации состояния головного мозга крыс по сигналам ЭЭГ.
ЗАКЛЮЧЕНИЕ
Основным результатом проведенных исследований является качественное изменение динамики ЭЭГ крысы в δ-частотном диапазоне после аудиального воздействия, которое остается при этом ближе свойствам сигналов электрической активности структур головного мозга во сне. Полученные результаты указывают на то, что ускорение дренажа мозговой жидкости играет определяющую роль в изменении свойств осцилляций ЭЭГ в δ-частотном диапазоне во время перехода животного от состояния сна к бодрствованию, а также после аудиального воздействия. В работе показаны возможности методики количественной оценки скорости/свойств дренажа мозговой жидкости на основе нелинейно-динамических индексов.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Brazier M.A.B. // Electroencephalography and Clinical Neurophysiology. 1949. V. 1. № 1–4. P. 195. https://doi.org/10.1016/0013-4694(49)90176-5
Sencaj R.W., Aunon J.I. // IEEE Trans. 1982. V. BME-1. № 1. P. 26. https://doi.org/10.1109/TBME.1982.324960
Lüthi A. // Neuroscientist. 2014. V. 20. № 3. P. 243. https://doi.org/10.1177/1073858413500854
Lin M.H.J., Cross S.N.N., Jones W.J., Childers T.L. // Europ. J. Marketing. 2018. V. 52. № 1/2. P. 66. https://doi.org/10.1108/EJM-12-2016-0805
Bell C.J., Shenoy P., Chalodhorn R., Rao R.P.N. // J. Neural Engineering. 2008. V. 5. № 2. P. 214. https://doi.org/10.1088/1741-2560/5/2/012
McFarland D.J., Parvaz M.A., Sarnacki W.A. et al. // J. Neural Engineering. 2016. V. 14. № 1. P. 016009. https://doi.org/10.1088/1741-2552/14/1/016009
Karavaev A.S., Kiselev A.R., Runnova A.E. et al. // Chaos. 2018. V. 28. № 8. P. 081102. https://doi.org/10.1063/1.5046758
Semyachkina-Glushkovskaya O., Bragin D., Bragina O. et al. Oxygen Transport to Tissue XLII (Advances in Experimental Medicine and Biology. V.1269) / Eds. by E.M. Nemoto, E.M. Harrisson, S.C. Pias et al. N.Y.: Springer Int. Publish., P. 197. https://doi.org/10.1007/978-3-030-48238-1_31
Welch P. // IEEE Trans. 1967. V. AU-15. № 2. P. 70. https://doi.org/10.1109/TAU.1967.1161901
Daniell P.J. // Suppl. to J. Royal Statistic Soc. 1946. V. 8. P. 27.
White L.B., Boashash B. // IEEE Trans. 1990. V. IT-36. № 4. P. 830. https://doi.org/10.1109/18.53742
Rosenblum M.G., Pikovsky A.S. // Phys. Rev. E. 2001. V. 64. № 4. P. 045202. https://doi.org/10.1103/PhysRevE.64.045202
Киселев А.Р., Караваев А.С., Гриднев В.И. и др. // Кардио-ИТ. 2016. Т. 3. № 1. Статья e0101. https://doi.org/10.15275/cardioit.2016.0101
Караваев А.С., Ишбулатов Ю.М., Пономаренко В.И. и др. // Физиология человека. 2017. Т. 43. № 1. С. 70. https://doi.org/10.7868/S0131164616060096
Kiselev A.R., Gridnev V.I., Karavaev A.S. et al. // Appl. Medical Informatics. 2011. V. 28. № 1. P. 1.
Киселев А.Р., Караваев А.С., Гриднев В.И. и др. // Саратов. научно-медицинский журн. 2010. Т. 6. № 1. С. 061.
Kiselev A.R., Borovkova E.I., Shvartz V.A. et al. // Scientific Reports. 2020. V. 10. P. 2118. https://doi.org/10.1038/s41598-020-58196-z
Pikovsky A.S., Rosenblum M.G., Osipov G.V., Kurths J. // Physica D. 1997. V. 104. № 3–4. P. 219. https://doi.org/10.1016/S0167-2789(96)00301-6
Gabor D. // J. IEE. 1946. V. 93. № 3. P. 429.
Kuramoto Y. Chemical Oscillations. Waves and Turbulence. Berlin: Springer-Verlag, 1984.
Schreiber T., Schmitz A. // Phys. Rev. Lett. 1996. V. 77. № 4. P. 635. https://doi.org/10.1103/PhysRevLett.77.635
Aladjalova N.A. // Nature. 1957. V. 179. № 4567. P. 957. https://doi.org/10.1038/179957A0
Knyazev G.G. // Neuroscience and Biobehavioral Reviews. 2012. V. 36. № 1. P. 677. https://doi.org/10.1016/j.neubiorev.2011.10.002
Fultz N.E., Bonmassar G., Setsompop K. et al. // Science. 2019. V. 366. № 6465. P. 628. https://doi.org/10.1126/science.aax5440
Зинченко Е.М., Климова М.М., Хороводов А.П. и др. // Изв. Сарат. ун-та. Нов. сер. Сер. Химия. Биология. Экология. 2020. Т. 20. В. 3. С. 339–351.https://doi.org/10.18500/1816-9775-2020-20-3-339-351
Дополнительные материалы отсутствуют.
Инструменты
Радиотехника и электроника


