Радиотехника и электроника, 2022, T. 67, № 2, стр. 99-116
Магнитные наночастицы в медицине: успехи, проблемы, достижения
Ю. А. Кокшаров a, b, С. П. Губин c, И. В. Таранов b, *, Г. Б. Хомутов a, b, Ю. В. Гуляев b
a Физический факультет МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, дом 1, стр. 2, Российская Федерация
b Институт радиотехники и электроники им. В.А. Котельникова РАН
125009 Москва, ул. Моховая, 11, стр. 7, Российская Федерация
c Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский просп., 31, Российская Федерация
* E-mail: i.v.t@bk.ru
Поступила в редакцию 20.07.2021
После доработки 04.08.2021
Принята к публикации 11.08.2021
- EDN: RSWKYR
- DOI: 10.31857/S0033849422020073
Аннотация
Представлен анализ современного состояния исследований, связанных с разработкой, развитием и практическим применением методов биомедицинской радиоэлектроники и наномедицины, включающих применения магнитных наночастиц. Подчеркивается важная роль рациональных физических научных подходов и экспериментальных методов при создании эффективных и безопасных средств терапии, адресной управляемой доставки лекарственных препаратов и диагностики включая пространственную визуализацию, использующих магнитные наночастицы. Приведены примеры успешного практического применения магнитных наночастиц в медицине на основе этих методов, проведен анализ основных проблем и перспектив этого направления науки.
ВВЕДЕНИЕ
Разработка новых высокоэффективных средств диагностики и терапии имеет в настоящее время стратегическое значение, что, в частности, показала продолжающаяся пандемия коронавируса. Повышение эффективности традиционной медицины связано с созданием и внедрением в практику новых подходов к диагностике и терапии, включающих наряду с биохимическими методами различные физические воздействия и средства диагностики. Введение в организм коллоидных наночастиц и функциональных наноструктурированных систем может обеспечить такие возможности визуализации и диагностики. Кроме того, это может позволить реализовать избирательное дистанционное внешнее физическое воздействие в локальных областях организма и обеспечить непосредственный терапевтический эффект (например, гипертермию) или управляемую адресную доставку и высвобождение лекарственных препаратов в целевой области. Применение функциональных наночастиц и других коллоидных нанообъектов и наноструктур (систем, состоящих из нанообъектов) в медицине – сложнейшая мультидисциплинарная научная и практическая задача, решение которой далеко от своего завершения. В предлагаемом обзоре основное внимание уделено медицинскому применению магнитных наночастиц (МНЧ). Несмотря на очевидные и зачастую впечатляющие успехи фундаментальных исследований в этой области (см., например, обзоры и монографии, а также оригинальные статьи [1–54 ]), при реальном практическом биомедицинском применении МНЧ и композиций на их основе возникают те же проблемы, что и при применении других видов лекарственных нанопрепаратов. Главные проблемы, обусловливающие медленное внедрение нанолекарств в реальную клиническую практику, связаны прежде всего со сложностью и многофакторностью процессов взаимодействия неорганических наночастиц с различными биологическими структурами организма человека. Эти взаимодействия и их последствия не всегда можно предсказать, проводя доклинические исследования (in vitro и на животных моделях). В последнее время стало очевидно, что для дальнейшего прогресса в изучении поведения магнитных наночастиц непосредственно в организме человека особенно необходимы разработка и внедрение новых радиоэлектронных технологий их пространственной визуализации.
Относительно медленный прогресс наномедицины уже начал порождать сомнения в принципиальной возможности преодолеть существующие проблемы наномедицины в обозримом будущем [7, 55–66]. Недостатки практически ориентированых медицинских методов, использующих наночастицы и другие нанообъекты и наноструктуры, обусловлены, в частности, большой сложностью таких методов [7], их недостаточной надежностью (невоспроизводимостью результатов) [67], эффективностью, много меньшей ожидаемой [57, 60, 66, 68], и другими причинами [69]. Так, с 1995 по 2018 г. только 15 “пассивных” антираковых лекарственных наноносителей были одобрены для практического применения, и ни один “активный” наноноситель не прошел успешно клинические испытания, необходимые для широкого медицинского использования [61, 66, 70]. В период с 1985 по 2005 г. было опубликовано около 3 млн научных статей по онкологической наномедицине, но только 3% заявленных методик дошло до стадии клинических испытаний [59]. Как следствие, крупный научный фонд США National Cancer Institute (NCI), который в 2005 г. с энтузиазмом начал финансировать 10‑летний Cancer Nanotechnology Plan, в 2019 г. прекратил финансирование программы Centers of Cancer Nanotechnology Excellence (CCNEs) [65].
Все сказанное в полной мере относится и к методам, использующим МНЧ [71–76]. МНЧ и магнитные коллоидные системы на их основе отличаются от других видов лекарственных коллоидных наноносителей расширенными возможностями управляемой доставки к больному органу (с помощью внешнего магнитного поля [1, 77–85], а также возможностью их самостоятельного использования в качестве терапевтических средств, например в методе гипертермии [86–93], диагностических средств, например в магниторезонансной томографии [94–99], и мультифункциональных (тераностических) средств [100–102]. Однако химические, биологические, медицинские проблемы, возникающие на пути к практическому применению, сходны для всех видов коллоидных наноносителей [103].
Возникает вопрос, почему же, несмотря на очевидные достижения в понимании фундаментальных основ наномедицины [31, 41, 104, 105] и разнообразные современные высокоточные экспериментальные методы изучения нанообъектов [26, 106–109], ее практическое применение тормозится. В данном обзоре мы постарались ответить на этот вопрос, а также обсудили возможное будущее наномедицины, уделив особое внимание особенностям и перспективам медицинского использования магнитных наночастиц, являющихся функциональными объектами ряда методов биомедицинской радиоэлектроники.
1. ОБЩИЕ СВЕДЕНИЯ О НАНОМЕДИЦИНЕ
В настоящее время наномедицина достигла уровня развития, когда ее начинают рассматривать как отдельную область наук о жизни [110, 111]. Истоки наномедицины принято относить к работам немецкого врача и исследователя П. Эрлиха, высказавшего идею создания лекарства, избирательно и специфически действующего на больной орган и не затрагивающего здоровые ткани. Такое идеальное лекарство Эрлих назвал “магической пулей” [112]. Сейчас этот подход к созданию средств лекарственной терапии онкологических заболеваний принято называть избирательной токсичностью [113], причем избирательное действие предполагается на клеточном или даже внутриклеточном уровне [114]. Эрлих создал [115] первое лекарство для химиотерапии (и сам предложил этот термин) и ввел важное понятие терапевтического индекса (отношение минимальной уже действующей и максимальной еще безопасной концентраций лекарства (рис. 1 [116]), используемого до сих пор для количественной оценки относительной безопасности лекарства [116]. Эрлих считал, что действие лекарства на клетку объясняется последовательностью обычных химических реакций, а наиболее эффективные лекарства должны иметь низкую молекулярную массу [113]. Последнее предположение впоследствии полностью подтвердилось для искусственных химически синтезируемых лекарств, к которым относится большинство (более 80%) современных фармакологических препаратов [114].
Рис. 1.
Фармакинететическая кривая лекарства для носителя без защитной оболочки (а) и с оболочкой (б). Адаптировано из [116, p. 1025]. “Плато” на кривой (б) обеспечивает требуемую эффективность лекарства без риска превышения максимального безопасного уровня концентрации.

Для любого лекарства важным является вопрос дозы. Для того чтобы лекарство подействовало, его концентрация в крови достаточно долго должна быть в пределах, задающих терапевтический индекс (см. рис. 1). Если лекарственное средство не капсулировано в носителе (не имеет защитной оболочки, отделяющей его от жидкой биологической среды организма), его концентрация в крови после введения в организм сначала быстро возрастает, а затем быстро убывает (см. рис. 1а) вследствие метаболизации и вывода из организма [116]. Такая фармакинетическая зависимость приводит, как правило, к необходимости увеличения вводимой дозы лекарства и, как следствие, превышения максимально нетоксичной концентрации (см. рис. 1а). Постепенное высвобождение терапевтических молекул из носителя лекарства, благодаря специальной оболочке, позволяет избежать этой проблемы (см. рис. 1б).
Идея замедленного поступления лекарства в кровь сыграла важную роль в истории наномедицины [117]. В 60-е годы ХХ в. появились макроскопические носители лекарств, которые благодаря своей оболочке медленно выделяли содержимое наружу. Первыми материалами для таких носителей были парафин (технология Spansules [118]), силиконовая резина [119] и сополимер полиэтиленвинилацетат [120]; использовались они, в частности, для лечения катаракты (препарат Ocusert®) и контрацепции (Norplant®). В 80-е годы появились биоразлагаемые полимеры, в частности, (полилактидгликолид, PLGA), на основе которых стали делать пористые микрочастицы, содержащие терапевтическое вещество. По этому принципу был создан, к примеру, антираковый препарат Decapeptyl®, одобренный в Европе в 1986 г. Другой биоразлагаемый полимер полиэтиленгликольтетрафталат (PEG-T) стал основой препарата Locteron® для доставки α-интерферона, используемого с середины 90-х годов прошлого века до сих пор. Дальнейшее уменьшение размера лекарственных нано-носителей произошло, когда были синтезированы конъюгаты полимеров, в частности полигидроксипропилметакриламид (PHPMA) и стирол-малеиновый ангидрид (SMA), с терапевтическими молекулами, например молекулой доксирубицина [121, 122].
Еще одним важным для наномедицины событием стало открытие в 1984 г. Х. Маэда эффекта “усиленного проникновения и удержания” коллоидных частиц в активно растущих опухолях (“enhanced permeation and retention”, или эффект EPR) [123]. Конъюгат полимер–лекарство (SMA, конъюгированный с противораковым пептидным препаратом, неокарциностатином), который Маэда назвал “SMANCS”, был дополнительно “помечен” молекулой красителя. Оказалось, что краситель накапливается в опухолевой ткани в заметно большей степени, чем в здоровой. Маэда предположил, что быстро формирующаяся сосудистая сеть в опухолях имеет поры большего размера (около 800 нм), чем нормальная, а лимфодренажная система не способна работать эффективно (рис. 2). Это и приводит к повышенной концентрации коллоидного нанолекарства в опухолевой ткани.
Рис. 2.
Схема, поясняющая эффект ЭПР. Адаптировано из [68]. Проницаемость для наноносителей кровеносных сосудов в опухоли гораздо выше, чем в нормальной ткани, благодаря “пористой” структуре стенок сосудов, вызванной, возможно, ускоренным ростом опухоли.
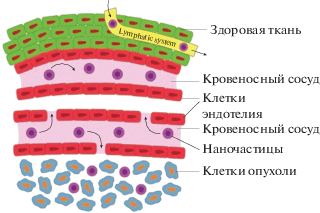
До настоящего времени эффект EPR является основой почти всех методик “пассивной” доставки лекарств. Одним из недостатков эффекта EPR с точки зрения применения в наномедицине является трудность удаления наноносителей, уже освободивших лекарство, из опухоли, с тем чтобы освободить место новым носителям лекарства [124]. Поиск новых полимерных конъюгатов привел к открытию и последующему активному использованию наноносителей на основе полимерных мицелл [125–127]. Хорошо известно, что амфифильные блок-сополимеры самопроизвольно собираются в полимерные мицеллы диаметром несколько десятков нанометров в водных средах. Такие полимерные мицеллы имеют уникальную структуру “ядро–оболочка”, в которой внутренняя часть может служить наноконтейнером для лекарственных средств, в том числе гидрофобных. Внешняя оболочка мицеллы образована гидрофильными полимерами, такими, например, как полиэтиленгликоль (PEG). Полимерные мицеллы имеют ряд преимуществ, таких как простое приготовление, эффективная загрузка лекарственного средства без химической модификации исходного лекарственного средства, контролируемое высвобождение лекарственного средства, увеличение времени циркуляции в кровотоке. Для полимерных мицелл также характерен эффект EPR.
Одновременно с созданием полимерных мицелл возрос интерес к биомиметическим везикулам – липосомам в качестве возможных наноносителей лекарств. Липосомы активно изучались с 60-х годов XX в., так как рассматривались достаточно адекватными искусственными моделями клеточных мембран [128]. Липосомы представляют собой небольшие искусственные везикулы сферической формы с мембраной, состоящей из фосфолипидных бислоев [2, 17, 129–132]. Они могут быть изготовлены из природных нетоксичных фосфолипидов и холестерина в виде одного или нескольких концентрических бислоев, способных инкапсулировать гидрофильные и гидрофобные лекарственные средства. Размер липосом зависит от их состава и способа получения и варьируется от ≈10 нм до ≈2.5 мкм [133]. Во многих одобренных к практическому использованию наномедицинских методиках используют именно липосомы [134, 135]. Это обусловлено, в частности, возможностью получать липосомы с различными размерами, их биосовместимостью, биоразлагаемостью, низкими токсичностью и иммуногенностью [128, 136]. Большой интерес и перспективы с точки зрения избирательного управления высвобождением капсулированного лекарства внешними дистанционными физическими радиоэлектронными воздействиями (переменные электромагнитные поля [51, 52], импульсы электрического поля [53]) имеют нанокомпозитные липосомы, мембраны которых содержат суперпарамагнитные наночастицы оксидов железа.
В настоящее время в наномедицине кроме липосом и полимерных мицелл для создания наноносителей лекарств используют дендримеры, наногели, неорганические наночастицы (в том числе магнитные), биомиметические частицы, а также различные сложные наноконструкции на их основе [23, 137–139]. Перечислим некоторые наиболее типичные и полезные для медицинских применений особенности нанообъектов [17, 21, 140], показанных на рис. 3.
Рис. 3.
Классификация нанообъектов, используемых для создания наноносителей лекарств. Адаптировано из [139].
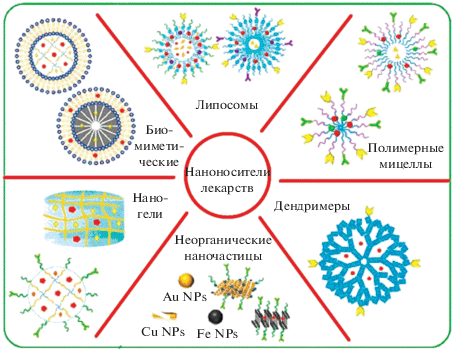
Неорганические наночастицы (включая магнитные): повышают скорость и предел растворимости лекарственных средств, их биодоступность; они относительно малотоксичны; магнитные наночастицы могут управляться внешним магнитным полем.
Наночастицы на основе полимеров: многофункциональны, повышают стабильность лекарственного препарата, улучшают проникновение лекарства в ткани и клетки.
Липосомы и мицеллы: существенно увеличивают количество переносимого лекарственного средства и снижают его токсичность, защищают переносимое лекарство от деградации, увеличивают время циркуляции лекарства в кровеносной системе.
Биомиметические: отличаются повышенной биосовместимостью и низкой иммуногенностью.
Дендримеры: повышают однородность нанолекарства по размеру и форме.
Наногели: высокая полезная нагрузка, допускают различные управления процессом высвобождения лекарства.
Отметим, что перечисленные особенности отдельных нанообъектов в той или иной степени присущи и всем другим их типам. В данном обзоре подробно остановимся на медицинском использовании МНЧ, которые относятся к неорганическим наночастицам.
2. ОСОБЕННОСТИ МЕДИЦИНСКОГО ПРИМЕНЕНИЯ МАГНИТНЫХ НАНОЧАСТИЦ
Основные физико-химические свойства МНЧ подробно описаны в литературе (см., например, [80–82, 100, 141]). Главной особенностью, отличающей МНЧ от других видов наноносителей лекарств, является возможность воздействовать на них внешним электромагнитным полем и использовать в различных методах и подходах биомедицинской радиоэлектроники. Это воздействие может обеспечить управление движением наночастиц и их аккумулирование в целевых локальных областях организма, а при необходимости и существенный нагрев (в методе гипертермии). С точки зрения классификации магнитных свойств МНЧ являются ферро- или ферримагнетиками, проявляющими благодаря однодоменности суперпарамагнитные свойства при достаточно высоких температурах (выше так называемой температуры блокировки) [142]. Для медицинских применений наиболее пригодны МНЧ на основе оксидов железа – магнетита (Fe3O4) и маггемита (γ-Fe2O3) [143–145], поскольку нанофазные оксиды железа малотоксичны, они широко распространены в живых системах и могут метаболизироваться клетками [145]. Биогенные магнитные наночастицы оксида железа (магнетит и маггемит) в настоящее время найдены в самых разных живых организмах и играют важную физиологическую роль, позволяя организму ориентироваться в магнитном поле Земли (магнитосомы у бактерий, насекомых, рыб, птиц и пр.) а также являются следствием и проявлением патологий, в частности, у человека их присутствие коррелирует с нейродегенеративными заболеваниями [17].
Часто МНЧ на основе оксидов железа в литературе называют SPIONs (superparamagnetic iron oxide nanoparticles), имея в виду характерное свойство этими наночастиц – суперпарамагнетизм [141, 146]. В последние десятилетия SPIONs становятся все более популярными благодаря их многочисленным биомедицинским применениям, таким как терапия рака с помощью гипертермии, опосредованной магнитным полем, адресная доставка лекарств, заместительная терапия железом, а также МРТ [147–149]. Хотя SPIONs, как правило, считаются биосовместимыми и обладают низким цитотоксическим потенциалом [150], очевидно, что эти частицы в организме человека являются все же инородными телами и могут оказывать различные эффекты на иммунную систему, которые приводят к гиперчувствительности, иммуносупрессии или, наоборот, иммунной стимуляции [151, 152].
Цели поиска новых лекарственных средств с использованием нанотехнологий, основным или вспомогательным элементом которых являются МНЧ, многообразны. К ним можно отнести [153‒155]:
– улучшение так называемого терапевтического индекса путем повышения эффективности и/или снижения токсичности;
– направленная доставка лекарств, специфичная к типу ткани, или даже на клеточном или субклеточном уровне;
– улучшение фармацевтических свойств терапевтических молекул – стабильности, растворимости, времени циркуляции в организме, повышение концентрации лекарства в больном органе;
– возможность управляемого высвобождения лекарства [156];
– возможность направленной внутриклеточной доставки терапевтических средств на основе биологических макромолекул – ДНК, малые интерферирующие РНК, мРНК и др. [157];
– одновременную доставку (co-delivery) сложных терапевтических средств для повышения эффективности и преодоления лекарственной резистивности, возможность более точного подбора соотношения компонентов сложного лекарства с учетом конкретного пациента (так называемая “персонализированная медицина”) [158];
– возможность успешного трансцитоза лекарств, т.е. преодоления эндотелиального (например, гематоэнцефалического) и эпителиального (гастроэнтерологического) барьеров;
– возможность более точных методов диагностики (визуализации);
– возможность одновременной диагностики и терапии, в том числе в режиме реального времени, так называемая тераностика;
– возможность использования собственных специфических свойств наноносителей для терапии, например, гипертермия с применением МНЧ.
Обычно медицинское применение МНЧ рассматривается либо как терапевтическое либо как диагностическое (рис. 4) [159]. Однако МНЧ могут быть и многофунциональными, т.е. одновременно и диагностическими и терапевтическими (т.е. тераностическими) препаратами [100, 160–162]. Для каждой конкретной практической медицинской задачи МНЧ модифицируются, чтобы улучшить уже имеющиеся или получить особые специфические свойства, т.е. функциализируются. Это необходимо, в частности, потому, что наноноситель лекарства до достижения “мишени” должен свободно находиться в биологических жидкостях сложного химического состава (кровь, лимфа, цитоплазма и пр.). При достижении “мишени”, носитель должен специфически провзаимодействовать с ней, что также требует модификации МНЧ. Если МНЧ используются с диагностической целью, радиоактивные или флуоресцентные молекулы должны быть заранее прикреплены к поверхности МНЧ. На рис. 5 схематично показаны возможные виды функциализации МНЧ [163, 164].
Рис. 4.
Наглядное представление основных видов медицинского использования МНЧ. Адаптировано из [159]. Показаны схемы двух основных терапевтических методов (гипертермии и направленной доставки лекарств), а также факторы, ключевые для использования МНЧ в диагностических целях: специфичность связывания для биосенсоров и влияние магнитного поля МНЧ на время магнитной релаксации T2 в методе МРТ.
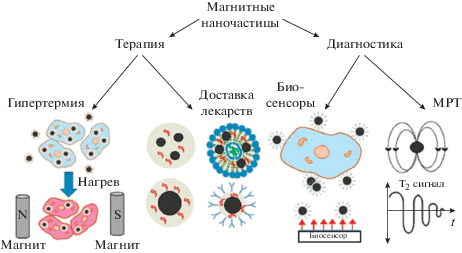
Рис. 5.
Возможные виды функциализации МНЧ. Адаптировано из [164]. “Линкер” – искусственно синтезированная двухцепочечная молекула ДНК. “Якорь” – лиганд, специфичный для конкретной мишени (молекулы или молекулярного комплекса).

Важной задачей является контролируемое высвобождение лекарства из защитной оболочки или везикулы тогда, когда наноноситель достиг мишени [117, 165]. В идеале, функциализация МНЧ должна позволить управлять процессом высвобождения лекарств, используя различные виды стимуляции [166] и, кроме того, дать возможность учитывать индивидуальные особенности пациента, т.е. применять персонализированную наномедицину [70, 167].
3. УСПЕХИ МЕДИЦИНСКОГО ПРИМЕНЕНИЯ МАГНИТНЫХ НАНОЧАСТИЦ
Примеры успешного медицинского применения МНЧ можно условно разделить на две группы: 1) внедрение метода, использующего МНЧ, в реальную медицинскую практику; 2) разработку метода или его отдельной части, обещающего преимущества по сравнению с аналогичными методами, использующимися в практической деятельности медиков, но пока не разрешенного к клиническому использованию. Примеров первого рода гораздо меньше, чем второго [42, 134, 168–172]. Причины этого обсуждаются в следующем разделе, здесь же отметим, что одной из основных причин медленного внедрения МНЧ в медицинскую практику являются строгие критерии допуска новых лекарственных средств и методик, ужесточающиеся с каждым годом. Наиболее известными организациями, принимающими или отклоняющими новые лекарства, являются Американское управление по санитарному надзору за качеством пищевых продуктов и медикаментов (US Food and Drug Administration, FDA) и Европейское медицинское агентство (EMA) [134, 106, 107, 162, 173 ]. Кроме того, многие аспекты медицинских устройств и приборов регулирует Международная организация по стандартизации (ISO) (www.iso.org). Чтобы дойти до финальной стадии реального медицинского применения новое лекарственное средство должно пройти несколько стадий [69, 174, 175]. Первая стадия включает фундаментальные исследования, завершающиеся детальной разработкой научных основ всех элементов нового метода. В процессе реализации второй стадии (доклинических испытаний) необходимо in vitro и in vivo (на адекватной предлагаемому к лечению органу человека модели животного) определить множество характеристик нового лекарственного метода, например, особенности метаболизма лекарства, его относительную эффективность в сравнении с другими лекарствами, оптимальную дозу, оптимальный метод доставки, побочные эффекты, в частности цитотоксичность, возможное взаимодействие с другими лекарствами. Организация и проведение доклинических испытаний должны соответствовать рекомендациям “good laboratory practices” [176–178]. Стадия клинических испытаний включает четыре фазы. Первая обычно задействует менее 20 здоровых добровольцев, длится несколько месяцев и ставит основной целью найти безопасную дозу. Вторая фаза клинического исследования проходит с участием добровольцев-пациентов (обычно несколько сотен) и ставит основной целью найти оптимальную дозу. Третья фаза во многом дублирует вторую, но число добровольцев может достигать нескольких тысяч человек. Цель третьей фазы – подтвердить результаты двух предыдущих фаз и выявить максимально возможное число побочных эффектов. На основе результатов третьей фазы новое лекарство регистрируется. На четвертой фазе (пост-регистрационной) число добровольцев еще увеличивается, проверяется статистическая достоверность данных об эффективности и безопасности, полученных на предыдущих этапах исследования. Вторая, третья и четвертая фазы клинических испытаний могут длиться по несколько лет. Нередко от рождения концепции нового лекарственного средства до его коммерциализации проходит 10–20 лет [140]. На протяжении всего процесса клинических испытаний и после их завершения результаты всех исследований, а также патентная информация и информация о предполагаемом производителе передаются в уполномоченную выдавать разрешение на практическое использование организацию, например, FDA. После завершения клинических испытаний в случае одобрения после тщательной экспертизы, в частности, сравнения эффективности и безопасности уже существующих лекарств и методов с предлагаемыми, новое лекарство или метод могут производиться как коммерческий продукт. Но и после начала реального применения этого продукта FDA или аналогичная организация инспектирует заводы производители, выявляет случаи не выявленных ранее побочных эффектов, контролирует выпуск дженериков после окончания действия патента. Нередки случаи отзыва разрешения на практическое использования ранее одобренных лекарственных препаратов [179]. Кроме того, даже внедренные в практику препараты могут оказаться не оправдывающими всех первоначальных, возникших на стадии фундаментальных исследований ожиданий. Так, капсулированный в липосомы доксирубицин (торговая марка Doxil®), одобренный FDA в 1995 г. и входящий в тройку наиболее коммерчески успешных нанопрепаратов, не увеличивает существенно время жизни использующих его пациентов, хотя и существенно снижает токсичность [61], т.е. повышает качество жизни пациентов.
Наиболее известный пример успешного доведения до коммерческого использования нанолекарства с МНЧ, в котором используются именно магнитные свойства наночастиц – препарат для лечения глиобластомы головного мозга NanoTherm®, производимый компанией MagForce AG (www.magforce.com), одобренный EMA в 2011 г. [180–184]. Использование NanoTherm® предполагает внутривенное введение покрытых аминосиланом наночастиц оксида железа со средним диаметром 12 нм непосредственно в опухоль (для этого требуется предварительная трепанация черепа) и нагрев переменным магнитным полем частотой 100 кГц, создаваемым специальной системой NanoActivator®. Магнитная гипертермия сочетается с химиотерапией и радиотерапией. Хотя после внедрения в терапевтическую практику NanoTherm® глиобластома головного мозга по-прежнему остается неизлечимым заболеванием, однако среднюю продолжительность жизни после первого диагностирования этой болезни удалось увеличить более чем в два раза [181]. Успех NanoTherm® при лечении глиабластомы привел к попыткам его более широкого использования. В настоящее время продолжаются клинические испытания NanoTherm® для лечения рака простаты [185] и некоторых других видов онкологии [184, 186].
Другой пример реального успешного медицинского использования МНЧ – препарат Ferumoxytol (коммерческие названия Ferahem® в США, Rienso® в ЕС) [187–189]. Первоначально он был одобрен FDA в 2009 г. для лечения анемии больных с почечной недостаточностью, для которых обычные препараты были либо токсичны, либо малоэффективны [190]. Ferumoxytol представляет собой коллоидный раствор наночастиц магнетита со средним диаметром около 8 нм, покрытых оболочкой из полусинтетического углевода (размер вместе с оболочкой около 30 нм) [191]. Оболочка изолирует биоактивное железо от компонентов плазмы после инъекции до тех пор, пока частицы не будут поглощены макрофагами ретикулоэндотелиальной системы печени, селезенки и костного мозга. Железо высвобождается из углеводной оболочки в везикулах внутри макрофагов и либо накапливается внутриклеточно в виде ферритина, либо транспортируется трансферрином в плазму для включения в гемоглобин во время эритропоэза [192]. Ferumoxytol вводится внутривенно и обеспечивает достаточно быстрое восстановление уровня железа в организме без существенных побочных эффектов [188].
Хотя наночастицы Ferumoxytol суперпарамагнитные, это их свойство никак не используется при лечении анемии. Однако для целей МРТ нужны именно суперпарамагнитные наночастицы. Поэтому Ferumoxytol начали исследовать для проверки возможности его использования как контрастного агента в диагностике методом МРТ широкого круга болезней: рассеянного склероза, панкреатита, кардиологических и онкологических заболеваний и др. [169, 193, 194]. На сайте www.clinicaltrials.gov Международного реестра клинических исследований Национального института здоровья США некоторые такие исследования отмечены как законченные (на ранних фазах). Вопрос, будут ли эти исследования продолжены и будет ли Ferumoxytol использоваться в качестве контрастного агента для МРТ, остается открытым. Схожий с Ferumoxytol препарат Ferumoxtran-10 (другое название Ferrotran, коммерческие названия – Sinerem®, Combidex®), в котором оболочка наночастиц магнетита образована полисахаридом декстраном, изначально предназначался для применения в МРТ-диагностике рака лимфатических узлов и был разрешен к применению в некоторых европейских странах [169]. Однако в 2005 г. в FDA и 2007 г. В EMA заявки были отозваны из-за появившихся сообщений о побочных эффектах. В настоящее время почти в половине всех МРТ-анализов с использованием контрастных агентов применяются различные соединения гадолиния [97, 99]. Однако из-за накопления ионов гадолиния в тканях (в том числе в мозге) эти соединения могут быть небезопасными, особенно при неоднократном использовании [195]. Поэтому вероятность использования Ferumoxytol и других видов SPIONs в качестве замены гадолиний-содержащих агентов в МРТ остается достаточно большой [196–199], даже несмотря на сообщения о возможных побочных эффектах при использовании Ferumoxytol в качестве лекарства от анемии [200] и в целом не вполне ясную ситуацию со степенью токсичности МНЧ на основе оксидов железа [201]. Здесь, по-видимому, нужно сделать выбор: либо вообще отказаться от использования SPIONs из-за возможных побочных эффектов [202], либо все же использовать SPIONs в методе МРТ для определенных типов онкологии, где другие виды контрастных агентов неприемлемы [203, 204]. Второе решение, с нашей точки зрения, выглядит предпочтительней.
У МНЧ есть уникальное свойство, отличающее их от других видов нанопрепаратов – ими можно управлять с помощью внешнего магнитного поля, что делает их незаменимыми в методах “направленной доставки лекарств”. Однако успехи клинического применения МНЧ в этой области пока очень скромные [171, 205]. Единственный на сегодняшний день пример направленной доставки лекарства с помощью МНЧ – работы [1, 77], не вышедшие, однако, за рамки второй фазы клинических испытаний. Это обусловлено, в частности, ограниченной применимостью использованного в [1, 77] метода – только к поверхностным опухолям. Это заведомо снижает число добровольцев-пациентов и не дает полноценно провести статистически достоверные клинические испытания с достаточно большим числом участников, что требуется для одобрения методики регулятором. В работах [1, 77] SPIONs диаметром около 100 нм, химически связанные с эпирубицином [206], вводили в кровеносные сосуды вблизи опухоли на поверхности лица или шеи пациента. Постоянный магнит, создающий магнитное поле с индукцией 0.8 Тл, помещали вблизи опухоли, чтобы он притягивал к ней МНЧ c лекарством. Процедура применялась к 14 пациентам, для которых предыдущие этапы лечения по традиционным схемам не привели к заметному успеху. Кроме того, все опухоли были неоперабельны. Хотя благодаря применению метода направленной доставки доксирубицина с помощью МНЧ некоторых успехов в лечении поверхностных опухолей удалось достичь, в целом пока полученные результаты не вполне убедительны [1].
В литературе можно найти многочисленные примеры исследований МНЧ, потенциально интересных для практического медицинского применения, но не дошедшие до клинических испытаний, т.е. проводившихся либо на культуре ткани, либо на животных (см., например, недавний обзор [159]).
Крайне важным при использовании МНЧ в терапевтических или диагностических медицинских методах является прямой контроль пространственного расположения наночастиц внутри организма пациента. Особенно это актуально в методах с управляемым высвобождением лекарства в целевой области организма, которое нужно производить только после того, как МНЧ достигнет органа-“мишени”. Решающая эту задачу экспериментальная радиоэлектронная методика, получившая название MPI (magnetic particle imagine), была предложена в 2005 г. [207]. В основе метода лежит специфическое свойство МНЧ – суперпарамагнетизм. В отличие от макроскопических ферромагнетиков и парамагнетиков, насыщение намагниченности которых при комнатной температуре происходит в очень малых (∼1 Э) и очень больших (∼1 МЭ) магнитных полях соответственно, намагниченность суперпарамагнетиков выходит на плато во внешних магнитных полях с напряженностью величиной около 1 кЭ, легко достижимой с помощью обычных лабораторных источников магнитного поля. Зависимость намагниченности M от напряженности H внешнего магнитного поля, характеризующаяся участками насыщения, на которых намагниченность практически не изменяется, показана на рис. 6. Сканер MPI содержит систему из шести катушек, создающих ортогональные друг другу квазистатические магнитные поля, сумма которых обеспечивает смещение (т.е. сканирование) в пространстве области нулевого поля (field-free point, FFP), на которое накладывается гармонически меняющееся переменное магнитное поле с амплитудой, позволяющей проходить нелинейный участок кривой намагничивания (левая панель рис. 6). Приемная катушка сканера регистрирует зависимость намагниченности от времени, которая будет нелинейной, только если в область FFP попали МНЧ. В этом случае фурье-преобразование сигнала приемной катушки даст заметные амплитуды гармоник, на частотах, кратных частоте переменного магнитного поля. Если МНЧ находятся вне области FFP, соответствующий сигнал приемной катушки будет почти постоянен и амплитуда фурье-гармоник будет мала (правая панель рис. 6).
Рис. 6.
Принцип метода MPI, позволяющего визуализировать пространственное расположение суперпарамагнитных МНЧ, для которых поле магнитного насыщения отличается как от макроскопических ферромагнетиков, так и от парамагнетиков. Адаптировано из [207]. Повернутая но 90° синусоида показывает зависимость от времени переменной компоненты внешнего магнитного поля. Постоянная компонента магнитного внешнего поля отсутствует на левой панели и положительна на правой панели, где величина суммарного внешнего поля лежит в области насыщения намагниченности МНЧ. Регистрируемый сигнал магнитного отклика МНЧ и амплитуды S его фурье-гармоник показаны столбиками на правой стороне каждой панели.

Метод MPI получил дальнейшее развитие в работах [208, 209]. В работе [209] описана пилотная установка, позволяющая применять MPI к исследованиям на мозге человека. Состояние теории и техники эксперимента MPI на 2021 г. подробно описано в обзоре [186].
Завершая этот раздел, в целом можно сделать вывод, что пока применение МНЧ в медицине не соответствует ожиданиям, которые на них возлагали на начальных этапах развития наномедицины [210–213]. Тем не менее за последние 20 лет удалось доказать принципиальную возможность практической реализации магнитной гипертермии [181], направленной магнитной управляемой доставки лекарств и снижения благодаря этому их токсичности [1, 77], способности МНЧ играть роль контрастных агентов в МРТ [191]. Таким образом, особые физические свойства МНЧ, которые рассматриваются как их преимущества при создании новых лекарственных препаратов и методов диагностики и терапии, вполне реальны и обусловливают необходимость и перспективность дальнейших исследований в этой области.
4. ПРОБЛЕМЫ МЕДИЦИНСКОГО ПРИМЕНЕНИЯ МАГНИТНЫХ НАНОЧАСТИЦ
Как отмечалось выше, основная проблема медицинского применения МНЧ, как и других нанолекарств, заключается в крайне медленном их практическом внедрении [111, 168, 214–216]. Эта проблема присуща и нанотехнологиям в целом [217]. На то, что проблема шире и очень актуальна, указывает вхождение в научный оборот терминов “кризис трансляции” [218], кризис невоспроизводимости [219, 220] и другие подобные словосочетания, выражающие озабоченность медленным прогрессом в данной области.
Причины, препятствующие широкому практическому использованию (“трансляции”) МНЧ можно условно разбить на три группы [66, 103, 111, 221]: I) научные (фундаментальные и технические); II) клинические (медицинские и социальные); III) маркетинговые (коммерческие).
Группа I включает: 1) недостаточное понимание механизмов взаимодействия МНЧ с биологическими компонентами и структурами организма при доставке лекарства в больной орган [222], а также 2) механизмов аккумуляции МНЧ с лекарством в самом органе; 3) различное поведение МНЧ в экспериментах in vitro и in vivo; 4) технические сложности реализации метода (или его отдельных частей), использующего МНЧ, препятствующие их использованию где-либо кроме отдельных высокотехнологичных лабораторий [223]; 5) плохая изученность процессов фармакокинетики с участием МНЧ; 6) неоднозначность данных о биобезопасности [224, 225], 7) возможная неадекватность используемых животных моделей аналогам в организме человека [153, 226].
Группа причин II включает: 1) неприемлемую для многих научных коллективов дороговизну клинических испытаний (сотни миллионов долларов [227]); 2) неверно выбранную “мишень” (например, тип онкологической опухоли) для данного метода; 3) ошибки в выборе дозировки и длительности лечения; 4) плохую воспроизводимость результатов вследствие недостаточно строгого контроля за синтезом и характеризацией используемых МНЧ (т.е. отсутствие достаточно строгих стандартов для МНЧ); 5) возможное изменение свойств МНЧ при переходе от лабораторного синтеза к промышленному (проблема масштабирования): 6) разнообразие и труднопредсказуемость возможных побочных эффектов при проведении 3-й и 4-й фаз клинических испытаний на большой выборке добровольцев.
Проблемы группы III (маркетинга) нанолекарств с МНЧ разнообразны, но главная – большая конкуренция, в том числе и из-за появляющихся новых традиционных (не “нано”) лекарственных средств, менее токсичных и более эффективных, чем их предшественники.
Можно схематично изобразить основные препятствия, возникающие на пути внедрения нанопрепаратов в медицинскую практику, в виде “горной гряды” (рис. 7).
Рис. 7.
Схематическое представление основных проблем с переходом от исследований нанолекарств в лаборатории in vitro и in vivo (на культурах ткани и животных моделях) к полноценному медицинскому применению. Адаптировано из [111]. Высота треугольников-“барьеров” может быть различна для различных видов нанолекарств.
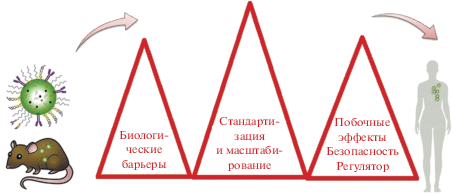
Термин “биологические барьеры” (см. рис. 7) обобщает большое количество различных факторов [54]. Как указывалось выше, одним из основополагающих принципов наномедицины является требование, чтобы лекарство не влияло на здоровые ткани организма, что приводит к задаче “капсулирования” (создания защитных оболочек) лекарственных средств. Вместе с тем биологическая среда, воздействующая на лекарство в процессе доставки к больному органу, не должна менять его терапевтические свойства. Однако при поступлении даже капсулированных или поверхностно-модифицированных МНЧ в кровь вследствие опсонизации их поверхность быстро покрывается “биокороной”, состоящей преимущественно из молекул белка и липидов, существенно влияющей на их стабильность, участие в метаболизме, в том числе времени вывода из организма, и на его иммунный ответ [114, 228, 229]. Детали взаимодействия введенных в организм пациента лекарственных препаратов, содержащих МНЧ, и разнообразных биологических структур могут существенно зависеть от индивидуальных особенностей организма и поэтому должны тщательно изучаться при клинических испытаниях на значительном числе добровольцев. Медико-биологическая гетерогенность потенциальных потребителей нанолекарств – серьезное препятствие на пути его практического внедрения.
Проблема выработки единых стандартов качества для МНЧ, предполагаемых к использованию в медицине, также остается пока нерешенной [230]. Хотя в целом лабораторный синтез наночастиц достиг высокого уровня совершенства [231], проблемой остается “невоспроизводимость” – ситуация, когда опубликованные результаты научного исследования не могут быть воспроизведены в других лабораториях (или, что хуже, даже в той, где проводились исследования) [232]. Особенно важно иметь точные сведения о токсичности МНЧ, если предполагается их медицинское применение. Среди важнейших и наиболее общих вопросов, которые требуют своего разрешения, можно выделить следующие [233].
1. Будут ли наночастицы проявлять сходные свойства и взаимодействия в различных органах и клетках? Зависят ли эти свойства и взаимодействия от возраста человека? Оказывает ли история перемещения частицы в организме какое-либо влияние на эти взаимодействия?
2. Как результаты исследований наночастиц in vivo и in vitro на клеточных культурах зависят от свойств (и происхождения) этих культур ? Результаты исследований на одних и тех же (формально) клеточных культурах могут сильно различаться даже при использовании одних и тех же наноматериалов.
3. Может ли скорость введения частиц in vivo влиять на скорость агрегации частиц, приводящей к их локально повышенной концентрации и, как следствие, осаждению, тромбообразованию и тому подобным эффектам. Как скорость введения влияет на поглощение наночастиц и метаболизм в ключевых органах фильтрации, таких как печень, селезенка, капилляры легких и почки, и не возникнут ли при этом токсичные побочные продукты?
4. Как функциализация наночастиц изменяет их токсичность in vivo?
До сих пор мы перечисляли проблемы медицинского применения наночастиц общие для всех видов нанолекарств. Однако магнитные свойства МНЧ обусловливают и некоторые специфические проблемы [41]. Первая из этих проблем имеет фундаментальный характер. Так, направленная доставка лекарственных препаратов с помощью статического магнитного поля возможна только к больным органам, находящимся на поверхности человеческого тела [205]. Как известно [234], частица сферической формы во внешнем магнитном поле испытывает силу, направленную по градиенту квадрата напряженности H 2. Чтобы локализовать МНЧ в заданной области пространства, как это требуется в методе управляемой доставки лекарств, нужно создать магнитное поле, имеющее в некоторой точке внутри области локализации максимум величины H 2. Возникает вопрос, возможно ли это. Ответ дает магнитостатическая теорема Томсона [234]: в области, в которой отсутствуют источники рассматриваемого магнитостатического поля квадрат напряженности H 2, как функция пространственных координат, может иметь в качестве экстремума только минимум, но не максимум. Из теоремы Томсона следует, что суперпарамагнитные наночастицы не могут находиться в устойчивом равновесии под действием только магнитостатических сил.
Это вносит трудности при использовании МНЧ в методах направленной доставки лекарств [235, 236]. Очевидно, что для направленной доставки лекарственных препаратов с помощью МНЧ удобно использовать именно статическое магнитное поле, создаваемое постоянными магнитами или соленоидами [85]. Именно постоянные магниты применялись в клинических испытаниях [77] для лечения поверхностных опухолей.
Проблема может быть в принципе решена, если применять динамическое управление МНЧ с использованием магнитного поля, медленно изменяющегося по определенному алгоритму [235, 237]. Однако это сильно усложняет и без того технически непростой магнитный метод направленной доставки лекарств. Другой путь решения указанной проблемы – использование миниатюрного ферромагнитного стента, внедряемого в опухоль и становящегося центром притяжения МНЧ [238]. Однако при этом теряется важное преимущество магнитного метода доставки лекарств – неинвазивность.
Есть и другие специфические проблемы медицинского использования МНЧ – повышенная склонность к агрегированию из-за магнитных диполь-дипольных взаимодействий [239], необходимость создания значительной степени неоднородности магнитных полей [240]. Первая из указанных проблем принципиально решаема соответствующей модификацией поверхности МНЧ, подбором правильной концентрации и магнитных параметров частиц, вторая проблема – техническая, она может быть решена правильной пространственной конфигурацией источников магнитного поля.
5. ПЕРСПЕКТИВЫ МЕДИЦИНСКОГО ПРИМЕНЕНИЯ МАГНИТНЫХ НАНОЧАСТИЦ
Перед наномедициной, частью которой являются методы, использующие МНЧ – управляемые магнитным полем гипертермия, направленная доставка и управляемое высвобождение лекарства, магниторезонансные методы диагностики, в настоящее время стоят сложные задачи [103, 111, 172, 241]. Суть этих задач – преодоление многочисленных проблем, описанных в предыдущих разделах. Чтобы успешно разрешить эти проблемы, необходимо в том числе устранить некоторые перекосы к организации научных исследований. До сих пор большинство исследований проводились коллективами, включающими химиков, физиков, биологов, материаловедов, инженеров и лишь изредка практикующих медиков. Тем самым, уже в начале исследовательского процесса конечная задача – создание нового более эффективного и безопасного по сравнению с существующими лекарственного нанопрепарата, предназначенного для лечения конкретной болезни (а не абстрактных “онкологических заболеваний”), отодвигается на будущее, а основное внимание уделяется получению наноконструкций с очень хорошими физико-химическими свойствами, критерий качества для которых, однако, может быть никак не связан с конечной целью. Эта особенность современных работ по наномедицине получила название “эффект невидимой гориллы” [63]. На русском языке содержание этого эффекта можно выразить пословицей “не видеть леса за деревьями”.
Другая отрицательная особенность научных работ по наномедицине последних 20–30 лет, требующая преодоления, в англоязычной литературе получила название “publication bias” или “the file drawer problem” [242, 243]. Она состоит в том, что в подавляющем большинстве исследовательских статей сообщают только о положительных результатах, не упоминая о негативных. То же относится к большинству обзорных статей по наномедицине, в которых основное внимание уделяется успехам и в гораздо меньшей степени обсуждаются неудачи или “подводные камни”. В случае поиска новых лекарственных средств и разработки новых методов диагностики и терапии знание об отрицательных или негативных результатах не менее важно, чем о позитивных.
Еще одна важная задача, без решения которой невозможен прогресс наномедицины – стандартизация характеристик нанообъектов для того, чтобы иметь возможность сравнивать как доклинические результаты исследовательских работ, так и, что более важно, результаты клинических испытаний [92, 233]. Необходимо ввести перечень стандартных и обязательных для измерения физико-химических характеристик МНЧ, в частности, степени полидисперсности (разброса по размерам), степени токсичности, патогенности, биоразлагаемости, склонности к агрегации, основных магнитных свойств (для МНЧ) и др. Все наиболее важные характеристики, влияющие на токсичность, биодоступность, иммуногенность должны быть экспериментально измерены (определены) и подробно описаны, чтобы правильно и полно интерпретировать результаты работы и позволить сравнить их с ранее опубликованными данными. Разумеется, такая стандартизация должна учитывать специфику отдельных разделов наномедицины и особенности различных заболеваний.
Научные группы, создающие биомедицинские методы с использованием МНЧ, могут не синтезировать их сами, а воспользоваться уже готовыми. В настоящее время 14 коммерческих фирм предлагают МНЧ научно-исследовательского уровня [92]. Из них один тип частиц (Ferrotran) проходит клинические испытания, и еще несколько типов VivoTrax™, VivoTrax Plus™, FeraSpin™, RCL-01, nanomag®, Perimag®, Synomag® готовы к ним.
Во многом успех будущих медицинских применений МНЧ зависит от развития радиоэлектронной технологии MPI визуализации магнитных наночастиц внутри организма [186, 207]. Невозможно контролировать действие лекарства, адресно доставляемого с помощью МНЧ к больному органу, не имея прямой информации об успешности этой доставки. Кроме того, с использованием технологии MPI недавно удалось применить тераностический подход на животной модели – визуализация МНЧ сопровождалась процессом гипертермии [244]. Стремление к многофункциональности, сочетанию терапевтического и диагностического эффектов, будет, по-видимому, основной тенденцией будущих исследований, связанных с применением МНЧ в медицине [245–247].
ЗАКЛЮЧЕНИЕ
Проведенный нами анализ успехов и проблем биомедицинских применений МНЧ и использующих такие наночастицы методов биомедицинской радиоэлектроники показывает, что их потенциальные возможности в этой области раскрыты пока далеко не в полной мере. Лишь в единичных случаях и в ограниченном виде удалось на практике реализовать методы магнитной гипертермии и управляемой направленной доставки лекарств. Хотя практическое использование МНЧ для диагностических целей более успешно, но и здесь возникает много проблем, связанных с неизбежными побочными эффектами. В научном сообществе постепенно созревает понимание необходимости изменений как в самом подходе к научным исследованиям в этой области, так и в содержании этих исследований. Мультидисциплинарность исследований должна расширяться за счет экспертов в медицине и физиологии. Кроме продолжения исследований по оптимизации процессов направленной доставки и управляемого высвобождения лекарственных препаратов, гепертермии, особенно важно развивать физические методы визуализации МНЧ в живом организме, а также мультифункциональные методы и подходы, эффективно решающие одновременно несколько диагностических и терапевтических задач.
Список литературы
Lübbe A.S., Alexiou C., Bergemann C. // J. Surgical Research. 2001. V. 95. P. 200.
Muzykantov V., Torchilin V. Biomedical Aspects of Drug Targeting. N.Y.: Springer, 2002.
Nanocarrier Technologies Frontiers of Nanotherapy / Ed. M.R. Mozafari. N.Y.: Springer, 2006.
Biomedical Applications of Nanotechnology / Eds. V. Labhasetwar, D.L. Leslie-Pelecky. Hoboken: John Wiley & Sons, 2007.
Micro and Nano Technologies in Bioanalysis: Methods and Protocols / Eds. J.W. Lee, R.S. Foote. N.Y.: Humana Press, 2009.
Oral Controlled Release Formulation Design and Drug Delivery. Theory to Practice / Eds. H. Wen, K. Park. Hoboken: John Wiley & Sons, 2010.
MacEwan S.R., Chilkoti A. // Angew. Chem. Int. Ed. 2017. V. 56. P. 6712.
Ventola C.L. // Pharmacy and Therapeutics. 2012. V. 37. № 9. P. 512.
Ventola C.L. // Pharmacy and Therapeutics. 2012. V. 37. № 10. P. 582.
Ventola C.L. // Pharmacy and Therapeutics. 2012. V. 37. № 11. P. 631.
Multifunctional Nanoparticles for Drug Delivery Applications / Eds. S. Svenson, R.K. Prud’homme. N.Y.: Springer, 2012.
Chauhan V.P., Jain R.K. // Nature Materials. 2013. V. 12. P. 958.
Karimi Z., Karimi L., Shokrollahi H. // Materials Science and Engineering C. 2013. V. 33. P. 2465.
Drug Delivery Systems. Strategies, Technologies and Applications / Ed. Y. Yeo. Hoboken; New Jersey: John Wiley & Sons, 2013.
Etheridge M.L., Campbell S.A., Erdman A.G. et al. // Nanomedicine: Nanotechnology, Biology, Medicine 2013. V. 9. P. 1.
Nanoparticulates as Drug Cariers / Ed. V.P. Torchilin. L.: Imperial College Press, 2006.
Handbook of Nanobiomedical Research: Fundamentals, Applications, and Recent Developments. Frontiers in Nanobiomedical Research: V. 3. / Ed. V.P. Torchilin. Singapore: World Sci. Publ. Company, 2014.
Park K. // J. Control. Release. 2014. V. 190. P. 3.
Protein and Peptide Nanoparticles for Drug Delivery / Ed. R. Donev. Oxford: Acad. Press, 2015.
Nanoparticles in the Lung: Environmental Exposure and Drug Delivery / Eds. A. Tsuda, P. Gehr. Boca Raton: CRC Press, 2015.
Hillery A.M., Park K. Drug Delivery. Fundamentals and Applications. Boca Raton: CRC Press, 2016.
Bhatia S. Natural Polymer Drug Delivery Systems. N.Y.: Springer, 2016.
Nanomedicines Design, Delivery and Detection / Ed. M. Braddock. Cambridge: Royal Society of Chemistry, 2016.
Agotegaray M.A., Lassalle V.L. Silica-coated Magnetic Nanoparticles: An Insight into Targeted Drug Delivery and Toxicology. N.Y.: Springer, 2017.
Kumar P., Srivastava R. Nanomedicine for Cancer Therapy: From Chemotherapeutic to Hyperthermia-Based Therapy. N.Y.: Springer, 2017.
Characterization of Nanoparticles Intended for Drug Delivery / Ed. S.E. McNeil. N.Y.: Humana Press, 2018.
Hui H., Yi X., Hou F. et al. // ACS Nano. 2019. V. 13. P. 7410.
Ferrari E., Soloviev M. Nanoparticles in Biology and Medicine: Methods and Protocols. N.Y.: Humana Press, 2020.
Nanoparticles in Medicine / Ed. A.K. Shukla. N.Y.: Springer, 2020.
Lammers T., Kiessling F., Hennink W.E., Storm G. // J. Control. Release. 2012. V. 161. P. 185.
Lammers T., Ferrari M. // Nano Today. 2020. V. 31. P. 100853.
Martins J.P., das Neves J., de la Fuente M. et al. // Drug Delivery and Translational Research. 2020. V. 10. P. 726.
Mucosal Delivery of Drugs and Biologics in Nanoparticles / Eds. P. Muttil, N.K. Kunda. N.Y.: Springer, 2020.
Gerrard J.A., Domigan L.J. Protein Nanotechnology, Protocols, Instrumentation and Applications. N.Y.: Springer, 2020.
Antibacterial Drug Discovery to Combat MDR. Natural Compounds, Nanotechnology and Novel Synthetic Sources / Eds. I. Ahmad, S. Ahmad, K.P. Rumbaugh. N.Y.: Springer, 2020.
Nanostructured Biomaterials for Regenerative Medicine / Eds. V. Guarino, M. Iafisco, S. Spriano. N.Y.: Elsevier, 2020.
Nanoscience in Medecine. V. 1 / Eds. Daima H.K., Navya P.N., Ranjan S. et al. N.Y.: Springer, 2020.
Model Organisms to Study Biological Activities and Toxicity of Nanoparticles / Eds. B. Siddhardha, M. Dyavaiah, K. Kasinathan. N.Y.: Springer, 2020.
Bueno J. Preclinical Evaluation of Antimicrobial Nanodrugs. N.Y.: Springer, 2020.
Richardson J.J., Caruso F. // Nano Lett. 2020. V. 20. P. 1481.
Lane L.A. // Appl. Phys. Rev. 2020. V. 7. ID 011316. https://doi.org/10.1063/1.5052455
Anik M.I., Hossain M.K., Hossain I. et al. // Nano Select. 2021. V. 2. P. 1.
Mirza Z., Karim S. // Seminars in Cancer Biology. 2021. V. 69. P. 226.
Nanomaterials for Application in Medicine and Biology / Eds. M. Giersig, G.B. Khomutov. Dordrecht: Springer, 2008.
Khomutov G.B., Kim V.P., Koksharov Yu.A. et al. // Colloids and Surfaces. A: Physicochemical and Engineering Aspects. 2017. V. 532. P. 26.
Antipina M.N., Sukhorukov G.B. // Adv. Drug Delivery Rev. 2011. V. 63. P. 716.
Handbook of Clinical Nanomedicine: Nanoparticles, Imaging, Therapy, and Clinical Applications / Eds. R. Bawa, G.F. Audette, I. Rubinstein. Boca Raton: CRC Press, 2016.
Гуляев Ю.В., Черепенин В.А., Вдовин В.А. и др. // РЭ. 2015. Т. 60. № 10. С. 1051.
Кислов В.В., Колесов В.В., Таранов И.В. // РЭ. 2002. Т. 47. № 11. С. 1385.
Gorin D.A., Shchukin D.G., Koksharov Yu.A. et al. // Proc. of SPIE. 2007. V. 6536. № 6. P. 653604.
Amstad E., Kohlbrecher J., Muller E. et al. // Nano Lett. 2011. V. 11. P. 1664.
Tai L.A., Tsai P.J., Wang Y.C. et al. // Nanotechnol. 2009. V. 20. № 1. P. 135101.
Гуляев Ю.В., Черепенин В.А., Таранов И.В., Вдовин В.А. и др. // РЭ. 2021. Т. 66. № 1. С. 82.
Nanostructured Biomaterials for Overcoming Biological Barriers / Eds. M.J. Alonso, N.S. Csaba. Cambridge: Royal Soc. Chemistry, 2012.
Bae Y.H., Park P. // J. Control. Release. 2011. V. 153. P. 198.
Cancer Targeted Drug Delivery. An Elusive Dream / Eds. Y.H. Bae, R.J. Mrsny, K. Park. N.Y.: Springer, 2013.
Kwon I.K., Lee S.C., Han B., Park K. // J. Control. Release. 2012. V. 164. P. 108.
Kratz F., Warnecke A. // J. Control. Release. 2012. V. 164. P. 221.
Venditto V.J., Szoka F.C., Jr. // Adv. Drug Delivery Rev. 2013. V. 65. P. 80.
Wilhelm S., Tavares A.J., Dai Q. et al. // Nature Rev. Mater. 2016. V. 1. https://doi.org/10.1038/natrevmats.2016.14
Salvioni L., Rizzuto M.A., Bertolini J.A. et al. // Cancers. 2019. V. 11. https://doi.org/10.3390/cancers11121855
Allen C., Park K. // J. Controlled Release. 2019. V. 302. P. 203.
Park K. // J. Controlled Release. 2016. V. 240. P. 2.
Park K. // J. Controlled Release. 2019. V. 298. P. 213.
Park K. // J. Controlled Release. 2019. V. 305. P. 221.
He H., Liu L., Morin E.E. et al. // Acc. Chem. Res. 2019. V. 52. P. 2445.
Leroux J.-C. // Angew. Chem. Int. Ed. 2017. V. 56. P. 15170.
Torrice M. // ACS Cent. Sci. 2016. V. 2. P. 434.
Foulkes R., Man E., Thind J. et al. // Biomater. Sci. 2020. V. 8. P. 4653.
Rosenblum D., Peer D. // Cancer Lett. 2014. V. 352. P. 126.
Krishnan K.M. // IEEE Trans. 2010. V. Magn-46. P. 2523.
Krishnan K.M. Fundamentals and Applications of Magnetic Materials. Oxford: Oxford Univ. Press, 2016.
Clavijo-Jordan V., Kodibagkar V.D., Beeman S.C. et al. // WIREs Nanomedecine and Nanotechnology. 2012. V. 4. P. 345.
Laurent S., Saei A.A., Behzadi S. et al. // Expert Opinion on Drug Delivery. 2014. V. 11. P. 1449.
Xiong F., Huang S., Gu N. // Drug Development and Industrial Pharmacy. 2018. V. 44. P. 697.
Tong S., Zhu H., Bao G. //Materials Today. 2019. V. 31. P. 86.
Lübbe A.S., Bergemann C., Riess H. et al. // Cancer Research. 1996. V. 56. P. 4686.
Alexiou Ch., Schmidt A., Klein R. et al. // J. Magn. Magn. Mater. 2002. V. 252. P. 363.
Pankhurst Q.A., Connolly J., Jones S.K., Dobson J. // J. Phys. D: Appl. Phys. 2003. V. 36. P. R167.
Gubin S.P., Koksharov Y.A., Khomutov G.B., Yurkov G.Y. // Russ. Chem. Rev. 2005. V. 74. P. 489.
Magnetic Nanoparticles / Ed. S.P. Gubin. Hoboken: John Wiley & Sons, 2009.
Reddy L.H., Arias J.L., Nicolas J., Couvreur P. // Chem. Rev. 2012. V. 112. P. 5818.
Tietze R., Zaloga J., Unterweger H. et al. // Biochemical and Biophysical Research Commun. 2015. V. 468. P. 463.
Ye H., Shen Z., Yu L. et al. // Proc. R. Soc. A. 2018. V. 474. https://doi.org/10.1098/rspa.2017.0845
Liu Y.-L., Chen D., Shang P., Yin D.-C. // J. Control. Release. 2019. V. 302. P. 90.
Hyperthermia in Cancer Treatment: A Primer / Eds. G.F. Baronzio, E.D. Hager. N.Y.: Springer, 2006.
Dennis C.L., Ivkov R. // Int. J. Hyperthermia. 2013. V. 29. P. 715.
Kozissnik B., Bohorquez A.C., Dobson J., Rinaldi C. // Int. J. Hyperthermia. 2013. V. 29. P. 706.
Raikher Yu.L., Stepanov V.I. // J. Magn. Magn. Mater. 2014. V. 368. P. 421.
Nedyalkova M., Donkova M., Romanova J. et al. // Advances in Colloid and Interface Sci. 2017. V. 249. P. 192.
Fatima H., Charinpanitkul T., Kim K.-S. // Nanomaterials. 2021. V. 11. https://doi.org/10.3390/nano11051203
Rubia-Rodríguez I., Santana-Otero A., Spassov S. et al. // Materials. 2021. V. 14. https://doi.org/10.3390/ma14040706
Shawa S.K., Kailashiya J., Gangwar A. et al. // Appl. Surface Sci. 2021. V. 560. https://doi.org/10.1016/j.apsusc.2021.150025
Weissleder R., Bogdanov A., Neuwelt E.A., Papisov M. // Advanced Drug Delivery Rev. 1995. V. 16. P. 321.
Okuhata Y. // Advanced Drug Delivery Rev. 1999. V. 37. P. 121.
Nanotechnology for Biomedical Imaging and Diagnostics. From Nanoparticle Design to Clinical Applications / Ed. M.Y. Berezin. Hoboken: John Wiley & Sons, 2015.
Wahsner J., Gale E.M., Rodríguez-Rodríguez A., Caravan P. // Chem. Rev. 2019. V. 119. P. 957.
Mirza S., Ahmad M.S., Shah M.I.A., Ateeq M. Metal Nanoparticles for Drug Delivery and Diagnostic Applications / Eds. M.R. Shah, M.I.S. Ullah. N.Y.: Elsevier, 2019. P. 189.
Chakravarty S., Shapiro E.M. Modern Techniques in Biosensors / Eds. G. Dutta, A. Biswas, A. Chakrabarti. N.Y.: Springer, 2021. P. 135.
Magnetic Nanomaterials. Applications in Catalysis and Life Sciences / Eds. S.H. Bossmann, H. Wang. Cambridge: Royal Soc. of Chemistry, 2017.
Gould P. // Materials Today. 2004. V. 7. P. 36.
Varadan V.K., Chen L., Xie J. Nanomedicine Design and Applications of Magnetic Nanomaterials, Nanosensors and Nanosystems. Hoboken: John Wiley & Sons, 2008.
Hua S., de Matos M.B.C., Metselaar J.M., Storm G. // Frontiers in Pharmacology. 2018. V. 9. https://doi.org/10.3389/fphar.2018.00790
Cardoso V.F., Francesko A., Ribeiro C. et al. // Adv. Healthcare Mater. 2018. V. 7. https://doi.org/10.1002/adhm.201700845
Nia H.T., Munn L.L, Jain R.K. // Science. 2020. V. 370. https://doi.org/10.1126/science.aaz0868
Biomedical Nanotechnology Methods and Protocols / Ed. S.H. Petrosko. N.Y.: Humana Press, 2011.
Biomedical Nanotechnology Methods and Protocols / Eds. S.H. Petrosko, E.S. Day. N.Y.: Humana Press, 2017.
Алексеев К.В., Блынская Е.В., Кедик С.А. Фармацевтическая нанотехнология. М.: Ин-т фармацевт. технологий, 2012.
Chemistry of Nanomaterials Fundamentals and Applications / Eds. T.I. Awan, A. Bashir, A. Tehseen. Amsterdam: Elsevier, 2020.
Moghimi S.M., Hunter A.C., Murray J.C. // The FASEB J. 2005. V. 19. P. 311.
Wu L.-P., Wang D., Li Z. // Mater. Sci. & Engineering C. 2020. V. 106. https://doi.org/10.1016/j.msec.2019.110302
Witkop B. // Proc. Amer. Philos. Soc. 1999. V. 143. P. 540.
Альберт А. Избирательная токсичность. Физико-химические основы терапии. М.: Медицина, 1989.
Immune Aspects of Biopharmaceuticals and Nanomedicines / Eds. R. Bawa, J. Szebeni, T.J. Webster, G.F. Audette. Singapore: Pan Stanford Publ., 2018.
Winau F., Westphal O., Winau R. // Microbes and Infection. 2004. V. 6. P. 786.
Ratner B.D., Hoffman A.S., Schoen F.J., Lemons J.E. Biomaterials Science. An Introduction to Materials in Medicine. N.Y.: Acad. Press, 2012.
Hoffman A.S. // J. Control. Release. 2008. V. 132. P. 153.
Helfand W.H., Cowen D.L. // Pharmacy in History. 1983. V. 25. P. 3.
Folkman J., Long D. // J. Surgical Research. 1964. V. 4. P. 139.
Langer R., Folkman J. // Nature. 1976. V. 263. P. 797.
Duncan R., Kopecek J. // Adv. Polymer Sci. 1984. V. 57. P. 51.
Duncan R. // Nature Rev. 2003. V. 2. P. 347.
Maeda H. // J. Personalized Medicine. 2021. V. 11. https://doi.org/10.3390/jpm11030229
Ngoune R., Peters A., von Elverfeldt D. et al. // J. Controlled Release. 2016. V. 238. P. 58.
Birrenbach G., Speiser P.P. // J. Pharm. Sci. 1976. V. 65. P. 1763.
Nishiyama N., Kataoka K. // Pharmacol. Ther. 2006. V. 112. P. 630.
Kreuter J. // Intern. J. Pharmaceutics. 2007. V. 331. P. 1.
Lasic D.D., Martin F.J. Stealth Liposomes. Boca Raton: CRC Press, 2018.
Liposomes. Metods and Protocols / Ed. G.G.M. D’Souza. N.Y.: Humana Press, 2017.
Bitounis D., Fanciullino R., Iliadis A., Ciccolini J. // ISRN Pharmaceutics. 2012. https://doi.org/10.5402/2012/738432
Liposome Technology. Liposome Preparation and Related Techniques / Ed. G. Gregoriadis. N.Y.: Informa Healthcare, 2006.
Yang F., Jin C., Jiang Y. et al. // Cancer Treatment Rev. 2011. V. 37. P. 633.
Malam Y., Loizidou M., Seifalian A.M. // Trends in Pharmacological Sci. 2009. V. 30. P. 592.
Bobo D., Robinson K.J., Islam J. et al. // Pharm Res. 2016. V. 33. P. 2373.
Rommasi F., Esfandiari N. // Nanoscale Res.Lett. 2021. V. 16. P. 95.
Bozutto G., Milinari A. // Intern. J. Nanomedicine. 2015. V. 10. P. 975.
Ganguly K., Chaturvedi K., More U.A. et al. // J. Controlled Release. 2014. V. 193. P. 162.
Sevastre A.-I., Horescu C., Baloi S.C. et al. // Coatings. 2019. V. 9. https://doi.org/10.3390/coatings9100628
Mu W., Chu Q., Liu Y., Zhang N. // Nano-Micro Lett. 2020. V. 12. P. 142.
Farjadian F., Ghasemi A., Gohari O. et al. // Nanomedicine. 2019. V. 14. P. 93.
Gubin S.P., Koksharov Yu.A. // Inorg. Mater. 2002. V. 38. P. 1085.
Magnetic Nanoparticles in Biosensing and Medicine / Eds. N.J. Darton, A. Ionescu, J. Llandro. Cambridge: Cambridge Univ. Press, 2019.
Wu W., Wu Z., Yu T. et al. // Sci. Technol. Adv. Mater. 2015. V. 16. № 2. P. 023501. https://doi.org/10.1088/1468-6996/16/2/023501
McNamara K., Tofail S.A.M. // Adv. Phys.: X. 2017. V. 2. P. 54.
Geppert M., Himly M. // Frontiers in Immunology. 2021. V. 12. https://doi.org/10.3389/fimmu.2021.688927
Neuberger T., Schopf B., Hofmann H. et al. // J. Magn. Magn. Mater. 2005. V. 293. P. 483.
Gupta A.K., Gupta M. // Biomaterials. 2005. V. 26. P. 3995.
Martinkova P., Brtnicky M., Kynicky J., Pohanka M. // Adv. Healthc. Mater. 2018. V. 7. https://doi.org/10.1002/adhm.201700932
Vangijzegem T., Stanicki D., Laurent S. // Expert. Opin. Drug. Delivery. 2019. V. 16. P. 69.
Patil R.M., Thorat N.D., Shete P.B. et al. // Biochem. Biophys. Rep. 2018. V. 13. P. 63.
Dobrovolskaia M.A., Shurin M., Shvedova A.A. // Toxicol. Appl. Pharmacol. 2016. V. 299. P. 78.
Shah A., Dobrovolskaia M.A. // Nanomedicine. 2018. V. 4. P. 977.
Shi J., Kantoff P.W., Wooster R., Farokhzad O.C. // Nature. 2017. V. 17. P. 20.
Anderson S.D., Gwenin V.V., Gwenin C.D. // Nanoscale Research Lett. 2019. V. 14. P. 188.
Stueber D.D., Villanova J., Aponte I. et al. // Pharmaceutics. 2021. V. 13. https://doi.org/10.3390/pharmaceutics13070943
Longo R., Gorrasi G., Guadagno L. // Nanomaterials. 2021. V. 11. https://doi.org/10.3390/nano11040848
Moghimi S.M., Peer D., Langer R. // ASC Nano. 2011. V. 5. P. 8454.
Guchet X. // Nanomedicine (Lond.). 2015. V. 10. P. 3167.
Farzin A., Etesami S.A., Quint J. et al. // Adv. Healthcare Mater. 2020. https://doi.org/10.1002/adhm.201901058
Chen F., Ehlerding E.B., Cai W. // J. Nuclear Medicine. 2014. V. 55. P. 1919.
Gobbo O.L., Sjaastad K., Radomski M.W. et al. // Theranostics. 2015. V. 5. P. 1249.
Dadfar S.M., Roemhild K., Drude N.I. et al. // Adv. Drug Delivery Rev. 2019. V. 138. P. 302.
Hola K., Markova Z., Zoppellaro G. et al. // Biotechnology Adv. 2015. V. 33. P. 1162.
Zoppellaro G. Magnetic Nanoheterostructures / Eds. S.K. Sharma, Y. Javed. N.Y.: Springer, 2020. P. 57.
Liu J.F., Jang B., Issadore D., Tsourkas A. // WIREs Nanomed. Nanobiotechnol. 2019. V.11. https://doi.org/10.1002/wnan.1571
Sun Y., Davis E. // Nanomaterials. 2021. V. 11. https://doi.org/10.3390/nano11030746
Zhang Y., Cheng M., Cao J. et al. // Nanoscale. 2019. V. 11. https://doi.org/10.1039/c8nr09347d
Singh D., McMillan J.M., Kabanov A.V. et al. // Nanomedicine. 2014. V. 9. P. 501.
Anselmo A.C., Mitragotri S. // The AAPS J. 2015. V. 17. P. 1041.
Anselmo A.C., Mitragotri S. // Bioengineering & Translational Medicine. 2016. V. 1. P. 10.
Clinical Applications of Magnetic Nanoparticles / Ed. N.T.K. Thanh. N.Y.: CRC Press, 2018.
Mitchell M.J., Billingsley M.M., Haley R.M. et al. // Nature Rev. 2021. V. 20. P. 101.
Soetaert F., Korangath P., Serantes D. et al. // Adv. Drug Delivery Rev. 2020. V. 163–164. P. 65.
Machin D., Day S., Green S. et al. Textbook of Clinical Trials. Hoboken: John Wiley & Sons, 2004.
Das R., Masa J.A., Kalappattil V. et al. // Nanomaterials. 2021. V. 11. P. 1380.
Baldeshwiler A.M. // Qual. Assur. J. 2003. V. 7. P. 157.
Adamo J.E., Bauer G., Derro M. et al. // Acad. Med. 2012. V. 87. P. 279.
Zielínska A., Costa B., Ferreira M.V. et al. // Int. J. Environ. Res. Public Health. 2020. V. 17. https://doi.org/10.3390/ijerph17134657
Wysowski D.K., Swartz L. // Arch. Intern. Med. 2005. V. 165. P. 1363.
Maier-Hauff K., Rothe R., Scholz R. et al. // J. Neuro-Oncology. 2007. V. 81. P. 51.
Maier-Hauff K., Ulrich F., Nestler D. et al. // J. Neuro-Oncology. 2011. V. 103. P. 317.
Thiesen B., Jordan A. // Intern. J. Hyperthermia. 2008. V. 24. P. 467.
Nanoparticles for Biomedical Applications Fundamental Concepts, Biological Interactions and Clinical Applications / Eds. E.J. Chung, L. Leon, C. Rinaldi. N.Y.: Elsevier, 2019.
Etemadi H., Plieger P.G. // Adv. Therap. 2020. V. 3. https://doi.org/10.1002/adtp.202000061
Johannsen M., Gneveckow U., Thiesen B. et al. // Eur. Urol. 2007. V. 52. P. 1653.
Rivera-Rodriguez A., Rinaldi-Ramos C.M. // Annual Rev. Chem. Biomol. Eng. 2021. V. 12. P. 163.
Danielson B.G. // J. Amer. Soc. Nephrol. 2004. V. 15. P. S93.
Auerbach M., Ballard H. // Hematology Am. Soc. Hematol. Educ. Program. 2010. V. 2010. P. 338.
Rund D. // British J. Hematology. 2021. V. 193. P. 466.
Pai A.B., Garba A.O. // J. Blood Medicine. 2012. V. 3. P. 77.
Spinowitz B.S., Schwenk M.H., Jacobs P.M. et al. // Kidney Intern. 2005. V. 68. P. 1801.
Scott L.J., Lyseng-Williamson K.F., McCormack P.L. // Drugs and Therapy Perspectives. 2013. V. 29. P. 223.
Simon G.H., von Vopelius-Feldt J., Fu Y. et al. // Investigative Radiology. 2006. V. 41. P. 45.
Toth G.B., Varallyay C.G., Horvath A. et al. // Kidney Intern. 2017. V. 92. P. 47.
Harvey H.B., Gowda V., Cheng G. // J. Amer. Coll. Radiol. 2020. V. 17. P. 546.
Crist R.M., Dasa S.S.K., Liu C.H. // WIREs Nanomed Nanobiotechnol. 2020. V. 13. https://doi.org/10.1002/wnan.1665
Elhalawani H., Awan M.J., Ding Y. et al. // Scientific Data. 2020. V. 7. P. 63. https://doi.org/10.1038/s41597-020-0392-z
Daldrup-Link H.E., Theruvath A.J., Rashidi A. et al. // Pediatric Radiology. 2021. https://doi.org/10.1007/s00247-021-05098-5
Scheenen T.W.J., Zamecnik P. // Investigative Radiology. 2021. V. 56. P. 42.
McCulley L., Gelperin K., Bird S., Harris S. et al. // Amer. J. Hematol. 2016. V. 91. P. E496.
Chrishtop V.V, Mironov V.A., Prilepskii A.Y. et al. // Nanotoxicology. 2021. V. 15. P. 167.
Moghimi S.M. // J. Control. Release. 2014. V. 190. P. 556.
Fortuin A.S., Brüggemann R., van der Linden J. et al. // WIREs Nanomed Nanobiotechnol. 2018. V. 10. https://doi.org/10.1002/wnan.1471
Czarniecki M., Pesapane F., Wood B.J. et al. // Transl. Androl. Urol. 2018. V. 7 (Suppl 4). P. S453.
Shapiro B., Kulkarni S., Nacev A. et al. // WIREs Nanomed. Nanobiotechnol. 2015. V. 7. P. 446.
Bonadonna G., Gianni L., Santoro A. et al. // Ann. Oncol. 1993. V. 4. P. 359.
Gleich B., Weizenecker J. // Nature. 2005. V. 435. P. 1214.
Nikitin M.P., Orlov A.V., Sokolov I.L. et al. // Nanoscale. 2018. V. 10. P. 11642.
Graeser M., Thieben F., Szwargulski P. et al. // Nature Commun. 2019. V. 10. https://doi.org/10.1038/s41467-019-09704-x
Widder K.J., Senyei A.E., Scarpelli D.G. // Proc. Soc. Exp. Biol. Med. 1978. V. 58. P. 141.
Widder K.J., Senyei A.E., Ranney D.F. // Chemotherapy. 1979. V. 16. P. 213.
Controlled Drug Delivery. Fundamentals and Applications / Eds. J.R. Robinson, V.H.L. Lee. Boca Raton: CRC Press, 1987.
Ruuge E.K., Rusetski A.N. // J. Magn. Magn. Mater. 1993. V. 122. P. 335.
Weiss P.S. // ASC Nano. 2015. V. 9. P. 3397.
Luxenhofer R., Barz M., Schillmeier M. // Nanomedicine (Lond.) 2014. V. 9. P. 2083.
Barz M., Luxenhofer R. // Nanomedicine (Lond.). 2015. V. 10. P. 3089.
Mӧhwald H., Weis P.S. // ASC Nano. 2015. V. 9. P. 9427.
Pourgashtasbi G. // Nanomedicine (Lond.) 2015. V. 10. P. 3121.
Baker M. // Nature. 2016. V. 533. P. 452.
Bhattacharjee S. // Int. J. Pharmacokinet. 2017. V. 2. P. 15.
Metselaar J.M., Lammers T. // Drug Delivery and Translational Res. 2020. V. 10. P. 721.
Behzadi S., Serpooshan V., Tao W. et al. // Chem. Soc. Rev. 2017. V. 46. P. 4218.
Lammers T. // Intern. J. Pharmaceutics. 2013. V. 454. P. 527.
Nel A., XiaT., Mädler L., Li N. // Sci. 2006. V. 311. P. 622.
Najahi-Missaoui W., Arnold R.D., Cummings B.S. // Int. J. Mol. Sci. 2021. V. 22. https://doi.org/10.3390/ijms22010385
Eliasof S., Lazarus D., Peters C.G. et al. // PNAS. 2013. V. 10. P. 15127.
Moore T.J., Zhang H., Anderson G., Alexander G.C. // JAMA Intern. Med. 2018. V. 178. P. 1451.
Friberg S., Nyström A.M. // Future Oncology. 2015. V. 11. P. 1961.
Villanueva-Flores F., Castro-Lugo A., Ramírez O.T., Palomares L.A. // Nanotechnology. 2020. V. 31. https://doi.org/10.1088/1361-6528/ab5bc8
Socoliuc V., Peddis D., Petrenko V.I. et al. // Magnetochemistry. 2020. V. 6. https://doi.org/10.3390/magnetochemistry6010002
Majidi S., Sehrig F.Z., Farkhani S.M. et al. // Nanomedicine, Biotechnology. 2014. V. 44. P. 722.
The Problem with Science: The Reproducibility Crisis and What to Do About It / Ed. R.B. Bausell. N.Y.: Oxford Univ. Press, 2020.
Hofmann-Amtenbrink M., Grainger D.W., Hofmann H. // Nanomedicine: Nanotechnology, Biology, Medicine. 2015. V. 11. P.1689.
Zangwill A. Modern Electrodynamics. Cambridge: Cambridge Univ. Press, 2013.
Nacev A., Weinberg I.N., Stepanov P.Y. et al. // Nano Lett. 2015. V. 15. P. 359.
Shapiro B. // J. Magn. Magn. Mater. 2009. V. 321. P. 1594.
Komaee A., Shapiro B. // Proc. Am. Contr. Conf. Baltimore, 30 June–02 Jule, 2010. N.Y. IEEE, 2010. P. 6543.
Avilés M.O., Chen H., Ebner A.D. et al. // J. Magn. Magn. Mater. 2007. V. 311. P. 306.
Hoshiar A.K., Le T.-A., Amin F.U., Kim M.O. et al. // J. Magn. Magn. Mater. 2017. V. 427. P. 181.
Li D., Ren Y. // IEEE Trans. 2018. V. AS-28. № 6. P. 4402107.
Crommelin D.J.A., Florence A.T. // Intern. J. Pharmaceutics. 2013. V. 454. P. 496.
Kennedy D. // Sci. 2004. V. 305. P. 451.
Ashkarran A.A., Swann J., Hollis L., Mahmoudi M. // Trends in Biotechnology. 2021. V. 39. P. 425.
Gaudet J.M., Weber M., Mark A. et al. // Proc. Am. Ass. Canc. Res. Ann. Meet. 2021, 10–15 Apr, 17–21 May. Philadelphia: AACR; Cancer Res / 2021; 81(13_Suppl): Abstract nr 2801.
Albanese A., Tang P.S., Chan W.C.W. // Annual Rev. Biomed. Eng. 2021. V. 14. P. 1.
Bondarenko O., Mortimer M., Kahru A. et al. // Nano Today. 2021. V. 39. https://doi.org/10.1016/j.nantod.2021.101184
Chouhan R.S., Horvat M., Ahmed J. et al. // Cancers. 2021. V. 13. https://doi.org/10.3390/cancers13092213
Дополнительные материалы отсутствуют.
Инструменты
Радиотехника и электроника


