Радиотехника и электроника, 2022, T. 67, № 4, стр. 377-383
Применение акустической микроскопии для визуализации структурных перемещений при развитии эмбрионов рыб
А. Б. Бурлаков a, С. А. Титов b, *, А. Н. Богаченков c
a Московский государственный университет им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Российская Федерация
b Научно-технологический центр уникального приборостроения РАН
117342 Москва, ул. Бутлерова, 15, Российская Федерация
c МИРЭА – Российский технологический университет
119454 Москва, просп. Вернадского, 78, Российская Федерация
* E-mail: sergetitov@mail.ru
Поступила в редакцию 21.04.2021
После доработки 21.11.2021
Принята к публикации 25.11.2021
- EDN: OUAINB
- DOI: 10.31857/S0033849422040027
Аннотация
Разработана методика неинвазивной ультразвуковой визуализации процессов эмбрионального развития малых биологических организмов. Создан сканирующий акустический микроскоп с диапазоном рабочих частот 50…100 МГц, позволяющий регистрировать ультразвуковые данные в режиме замедленной съемки и наблюдать in vivo трансформации и перемещения структурных элементов эмбриона. С помощью разработанной методики были проведены исследования эмбриона вьюна (Misgurnus fossilis), развивающегося непосредственно в иммерсионной ячейке микроскопа. Для 6-й и 15-й стадий развития эмбриона произведены записи данных продолжительностью по 10 мин, демонстрирующие процессы деления и движения клеток. Показано, что на 15-й стадии движение клеток во внутренней и наружной областях клеточного слоя с толщиной 0.1 мм происходит в противоположных направлениях со скоростями приблизительно 0.3 и 0.1 мкм/с соответственно.
ВВЕДЕНИЕ
Эмбрионы низших позвоночных являются общепринятыми модельными организмами для исследований в биологии развития, экологии, фармацевтике и генетике [1]. При исследованиях низших позвоночных, таких как рыбы, широко используются методы, основанные на использовании электромагнитного излучения. В подавляющем большинстве случаев исследования проводятся in vitro на специально подготовленных образцах. Наблюдать структурные изменения в живом организме, рост и деление клеток, их движение и интеграцию в органы и ткани позволяет оптическая микроскопия. Однако использование оптического излучения имеет ограничения при визуализации внутренних областей эмбриона, вызванные низким контрастом структурных элементов и рассеянием света на оптических неоднородностях. Некоторые методы оптической микроскопии были разработаны для преодоления этих ограничений [1–5]; однако все они так или иначе основаны на использовании излучения высокой интенсивности. Инвазивное воздействие интенсивного излучения на живой организм (фототоксичность) представляет собой серьезную проблему при длительном наблюдении развития эмбрионов in vivo.
Как было показано в результате многочисленных исследований, незначительное влияние на живой организм оказывает диагностический ультразвук [6]. Акустические методы позволяют визуализировать пространственное распределение изменений упругости, плотности и вязкости объекта. Ультразвуковые приборы широко используются в медицине; однако частотный диапазон медицинских сканеров ограничен из-за глубокого расположения интересующих областей внутри человеческого тела и высокого затухания ультразвука в тканях. В результате пространственное разрешение медицинских сканеров оказывается недостаточным для визуализации эмбрионов рыб, размеры которых не превышают 1…2 мм.
Более высокое разрешение обеспечивает сканирующий акустический микроскоп [7–12]. Его использовали для изучения мелких животных [7], эмбрионов кур и мышей [8–10]. Также недавно с помощью акустического микроскопа были выполнены предварительные исследования по визуализации структуры эмбрионов рыб на некоторых стадиях их развития [11, 12]. Ультразвуковые изображения живых объектов в этих исследованиях формировались с периодом в несколько часов или дней. Такой режим работы микроскопа позволяет наблюдать за общим ростом эмбриона, но не может использоваться для визуализации процессов формирования и движения тканей и отдельных структурных элементов.
Несколько высокочастотных ультразвуковых методов были разработаны для визуализации сердечно-сосудистой системы и измерения скорости кровотока мышей, эмбрионов цыпленка и рыб [13–15]. В этих методах дискриминация сигналов, рассеянных на движущихся элементах крови, происходит в частотной области за счет приобретаемого ими доплеровского сдвига. В данных случаях доплеровский сдвиг достаточно велик для надежного выделения сигналов благодаря значительной скорости крови в этих организмах. Однако скорость перемещения структурных элементов в эмбрионах рыб значительно ниже и доплеровский принцип не может быть использован для исследования их развития.
Данная работа посвящена разработке сканирующего акустического микроскопа с замедленной регистрацией ультразвуковых данных и его применению для изучения развивающейся биологической системы типа эмбриона рыбы.
1. ОПИСАНИЕ ЭКСПЕРИМЕНТА
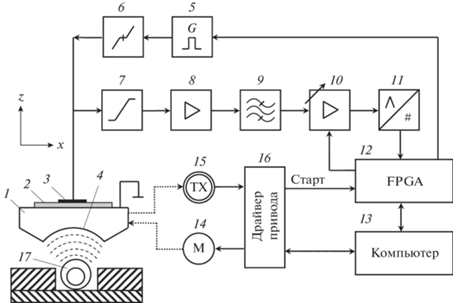
Структурная схема разработанного акустического микроскопа приведена на рис. 1. Центральным элементом прибора является фокусирующий ультразвуковой преобразователь, работающий в эхо-импульсном режиме. Преобразователь излучает в иммерсионную жидкость короткие ультразвуковые импульсы, которые фокусируются внутри исследуемого объекта. Ультразвуковые волны, рассеянные на структурно-упругих неоднородностях объекта, принимаются тем же преобразователем и записываются в цифровом виде. Для формирования изображения объекта осуществляется перемещение преобразователя относительно образца и отображение принятого сигнала в зависимости от пространственной координаты. Данный принцип ультразвуковой визуализации позволяет использовать широкие угловые апертуры сфокусированных коротких ультразвуковых импульсов, что обеспечивает высокое пространственное разрешение в продольном и поперечных направлениях [16]. Вместе с тем механическое сканирование, необходимое для формирования изображений, сопряжено со значительным временем сбора данных. Однако данный недостаток не является решающим при исследовании медленно протекающих процессов развития низших позвоночных.
Рис. 1.
Структурная схема акустического микроскопа: 1 – звукопровод; 2 – пьезоэлектрическая пластина; 3 – электрод преобразователя; 4 – акустическая линза; 5 – генератор возбуждающих импульсов; 6 – схема подавления шумов генератора; 7 – амплитудный ограничитель; 8 – предварительный усилитель; 9 – полосовой фильтр; 10 – усилитель с регулируемым коэффициентом передачи; 11 – аналого-цифровой преобразователь; 12 – модуль управления; 13 – компьютер; 14 – двигатель; 15 – энкодер; 16 – драйвер привода; 17 – исследуемый объект.
Ультразвуковой преобразователь разработанного акустического микроскопа состоит из кремниевого звукопровода 1, на металлизированный торец которого методом холодной сварки в вакууме присоединена пластина 2 из ниобата лития среза Y + 36° (см. рис. 1). На свободной поверхности пластины выполнен круглый электрод 3 с диаметром 6 мм, соосно которому на противоположном торце 3 размещена сферическая акустическая линза 4. Толщина пьезопластины составляла 60 мкм, что обеспечивало центральную частоту и относительную полосу частот преобразователя приблизительно 50 МГц и 50% соответственно. Фокусное расстояние преобразователя было равно 5.25 мм, а угловая апертура при использовании воды в качестве иммерсионной жидкости составляла θ0 = 35°. Поперечная разрешающая способность δx, глубина резкости zf устройства визуализации, построенного по конфокальной схеме, могут быть оценены на уровне 3 дБ по известным формулам [16]:
(1)
$\delta x = \frac{{0.61\lambda }}{{\sin {{\theta }_{0}}}},\,\,\,\,{{z}_{f}} = \frac{{1.8\lambda }}{{{{{\left( {\sin {{\theta }_{0}}} \right)}}^{2}}}},$Ультразвуковой элемент возбуждается импульсами с генератора 5, который позволяет получать на выходе импульсы с амплитудой не менее 30 В с регулируемой длительностью 5…50 нс. Между выходом генератора и ультразвуковым элементом включена диодная схема 6 подавления слабых (шумовых) сигналов, которые могут исходить от генератора в режиме приема.
Отраженные ультразвуковые сигналы, характерная амплитуда которых составляет 0.1…1 мВ, поступают в приемный тракт 7–11. Схема ограничения 7, выполненная на диодах, защищает приемный тракт от высоковольтных возбуждающих импульсов и предотвращает его перегрузку. Предварительный усилитель 8 имеет полосу пропускания до 1 ГГц, полосовой фильтр 9 может индивидуально подстраиваться под используемый ультразвуковой датчик, его типичная полоса пропускания 5…200 МГц. Основной регулируемый усилитель 10 имеет на входе цифровой аттенюатор, позволяющий регулировать усиление в диапазоне 50 дБ с шагом 2 дБ. Последним компонентом в приемном тракте является 12-разрядный АЦП 11 с реальной частотой дискретизации 500 МГц. Цифровой поток с АЦП поступает в модуль управляющей логики – программируемую логическую интегральную схему (ПЛИС) 12. В ПЛИС происходит предварительная обработка данных, например усреднение, фильтрация, также ПЛИС управляет генерацией и параметрами возбуждающих импульсов, реализует регулировку коэффициента усиления в процессе регистрации сигналов, обеспечивает передачу данных в компьютер 13 по высокоскоростному интерфейсу USB 3.0.
Механическое сканирование осуществляется перемещением ультразвукового датчика вдоль осей x, y. С платформой, на которой установлен датчик (на рис. 1 не показана), винтовой передачей связан двигатель 14 и энкодер 15. Характерная односторонняя повторяемость привода составляет 1.5 мкм. Драйвер привода 16 является автономным, имеет независимое управление от компьютера по низкоскоростному интерфейсу USB. Для синхронизации моментов регистрации ультразвуковых сигналов с механическим перемещением используется сигнал “Старт”, вырабатываемый драйвером привода в моменты прохождения заданных координат и инициирующий логику управления 12 на начало процесса регистрации.
Исследуемый организм 17 помещали в иммерсионную ячейку из биоинертного пластика. В ячейке имелась пластина с отверстием, в которой собственно и находился эмбрион. Такая конструкция обеспечивала достаточную иммобилизацию объекта, предотвращая его перемещение от возмущений иммерсионной среды, возникающих при движении преобразователя. Общий вид акустического микроскопа показан на рис. 2.
Эксперименты проводили на эмбрионе вьюна (Misgurnus fossilis), который является классическим модельным объектом в биологии развития [1, 18]. Самок вьюна содержали в холодильнике при температуре 4…5°С. Для ускорения созревания самок применяли гормональную стимуляцию хорионическим гонадотропином при комнатной температуре, получение половых продуктов и искусственное осеменение проводили по стандартной методике [19]. Оплодотворенные яйцеклетки тщательно промывали двумя порциями свежей воды. После этого часть зародышей размещали в термостате с температурой 17°С. Стадии развития определяли по таблицам нормального развития вьюна [19]. Отобранный для экспериментов эмбрион помещали в иммерсионную ячейку микроскопа, в которой его исследовали при комнатной температуре в течение времени, доходящего до 10 ч.
Обычно в сканирующем импульсном акустическом микроскопе регистрируется пространственно-временной сигнал вида s(x, y, t), где x, – координаты преобразователя, t – время прихода эхо-сигналов, отсчитываемое в каждой точке от момента излучения зондирующего импульса. При визуализации сигнал s часто отображается градациями серого тона на двумерной диаграмме x, t при некотором выбранном значении y. Получаемые изображения, называемые B-сканами, отображают структуру объекта в плоскости, параллельной вертикальной оси z. Для построения ультразвукового изображения сигнал s(x, y, t) подвергается преобразованию Гильберта G по отношению к временной переменной t, затем рассчитывается огибающая сигнала и для каждой точки находится максимум огибающей во временном окне [t1, t2]:
(3)
$I\left( {x,y} \right) = \mathop {\max }\limits_{{{t}_{1}} \leqslant t \leqslant {{t}_{2}}} \left\{ { \left| {G\left[ {s\left( {x,y,t} \right)} \right]} \right|} \right\}.$Изображение I(x, y), традиционно называемое C-сканом, для однородной среды со скоростью звука CW отображает поперечное распределение отражателей в слое [z1, z2], где z1 = CWt1/2, z2 = CWt2/2.
Особенностью представляемого в данной работе акустического микроскопа является возможность регистрации пространственно-временного сигнала s(x, y, t, T), где T – “медленное” время, характеризующее процессы, происходящие в исследуемых биологических объектах. Наглядным способом представления изменений в организме является режим замедленной съемки, в котором сигнал s(x, t, T) записывается при фиксированном значении y, а последовательность кадров s(x, t) воспроизводится в виде анимации. Изображение, формируемое из сигнала s(x, t, T) аналогично (3)
(4)
$W\left( {x,T} \right) = \mathop {\max }\limits_{{{t}_{1}} \leqslant t \leqslant {{t}_{2}}} \left\{ { \left| {G\left[ {s\left( {x,t,T} \right)} \right]} \right|} \right\}$– показывает временную эволюцию отражательной способности объекта в выбранной области. Наконец диаграммы вида s(t, T) могут быть использованы для оценки скорости движения неоднородностей в вертикальном направлении.
2. РЕЗУЛЬТАТЫ ЭКСПЕРИМЕНТА И ИХ ОБСУЖДЕНИЕ
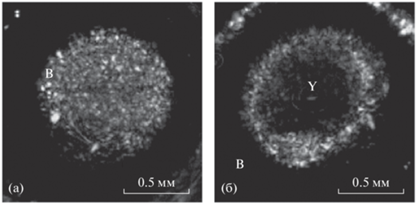
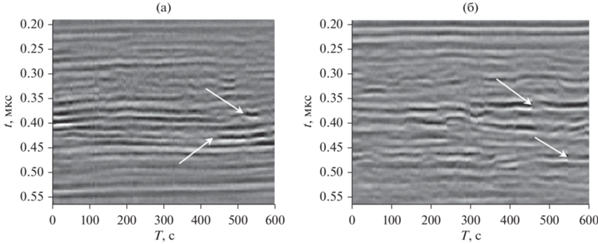
Разработанный акустический микроскоп был использован для исследования процессов развития эмбриона вьюна. Для исследований были выбраны 6-я и 15-я стадии развития, на которых оказываются ярко выраженными различные функциональные этапы. На 6-й стадии идет процесс образования бластулы, которая представляет собой область из делящихся клеток зародыша. Эта область эмбриона имеет форму шарового сегмента, прилегающую к желтку [1, 18]. На 15-й стадии имеет место процесс гаструляции, выражающийся в интенсивном направленном перемещении клеток вдоль поверхности желтка и в их дифференцировке. В качестве примера на рис. 3а и 3б показаны ультразвуковые изображения I(x, y) эмбриона на 6-й и 15-й стадиях развития соответственно. На рис. 4 приведены соответствующие B-сканы s(x, t), построенные для поперечной координаты y = 0.9 мм. При исследованиях клетки зародыша были ориентированы кверху, по направлению к преобразователю. Фокус преобразователя при регистрации данных располагался несколько выше центра эмбриона, положение фокальной плоскости при выбранном начале отсчета задавалось значением t = 0.4 мкс. Временное окно [t1, t2], применявшееся при построении изображений по формуле (3), было установлено равным 0.3, 0.5 мкс. Положение этого окна на рис. 4 показано пунктирными линиями.
На 6-й стадии развития в изображение (см. рис. 3а) дают вклад только отражения от клеток бластулы B, а желток Y располагается ниже визуализируемого слоя и в изображение вклада не дает. В силу дискретности строения бластулы ее ультразвуковое изображение имеет характерную для биологических тканей спекл-структуру. По мере развития эмбриона происходит распространение клеток вдоль поверхности желтка, бластула становится тоньше, а во временное окно в центре изображения (рис. 4б) попадают ткани желтка. Отражательная способность желтка меньше, чем у клеток, поэтому на изображении I(x, y) (см. рис. 3б) желток выглядит темной областью Y, обрамленной яркой кольцевой областью отражений от клеток B.
Для исследования процессов развития эмбриона на данных стадиях были записаны сигналы s(x, t, T). Для этого сигналы s(x, t), подобные приведенным на рис. 4, регистрировались с периодом 6 с, реализуя режим замедленной съемки. Полученные наборы из 100 кадров оформлялись в виде анимаций, просмотр которых наглядно демонстрирует движения и трансформации элементов эмбриона.
Изображения W(x, T), построенные согласно (4) на основе записанных пространственно-временных сигналов s(x, t, T), представлены на рис. 5. При построении использовалось то же временное окно, 0.3, 0.5 мкс, что и при формировании изображений I(x, y) (см. рис. 3). Как видно из сравнения приведенных диаграмм, характер изменения сигнала в зависимости от времени T является различным для 6-й и 15-й стадий развития эмбриона.
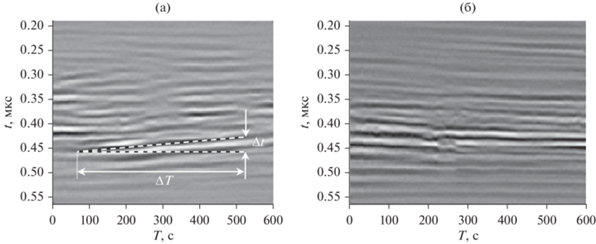
На рис. 6 и 7 представлены сигналы s(t, T) для нескольких значений координаты x, которые обозначены на рис. 5 вертикальными пунктирными линиями. Как видно из рис. 5а и 6, на 6-й стадии имеют место резкие изменения сигнала, но отсутствует направленное движение откликов с течением времени T. Эти особенности могут быть следствием хаотических процессов в бластуле. В некоторых местах, помеченных на диаграммах стрелками, наблюдаемые ультразвуковые отклики внезапно исчезают или появляются. Такое явление может быть объяснено делением клеток или трансформацией их кластеров, которое происходит за время, сравнимое с периодом дискретизации сигнала по времени T (6 с). На 15-й стадии развития изменения структуры сигнала преимущественно происходят в тонком клеточном слое, прилегающем к желтку со всех сторон. Характер поведения сигнала становится более плавными, и в разных частях клеточного слоя наблюдаются преимущественные движения отражателей. Располагая данными диаграммами, можно оценить скорость движения в вертикальном направлении:
где Δt – есть изменение задержки ультразвуковой волны, отраженной от подвижного элемента за время ΔT.В сечении x = 1.15 мм, которое соответствует внутренней области клеточного слоя, движение клеток происходит вверх с преимущественной скоростью v ≈ 0.3 мкм/с. В поверхностной области клеточного слоя происходит изменение направления движения клеток. Для сечения x = 1.25 мм оценка вертикальной составляющей скорости движения составляет v ≈ 0.1 мкм/с. Известно, что движение клеточных структур в разных направлениях и с разными скоростями является характерным для 15-й стадии развития эмбриона [1, 18]. Вместе с тем наблюдение такого движения клеток во внутренних слоях эмбриона in vivo и измерение скорости их движения является затруднительным при применении традиционных методов.
ЗАКЛЮЧЕНИЕ
Результаты ультразвукового исследования живого эмбриона вьюна, полученные по разработанной методике, соответствуют современным знаниям в области биологии развития. Ультразвуковые изображения органов, полученные без какого-либо химического воздействия на исследуемый объект, обладают высоким контрастом. Незначительное воздействие ультразвуковых волн на живые организмы и разработанный в данной работе режим замедленной съемки позволяют длительное время наблюдать за эмбрионами, которые развиваются в иммерсионной ячейке акустического микроскопа. В работе получены результаты по визуализации структурных изменений в клеточной массе в бластуле и оценке скоростей движения структурных компонентов во внутренних и внешних областях клеточного слоя. Подобные сведения трудно или невозможно получить in vivo с помощью оптических методов. Использованный нами неинвазивный метод ультразвуковой визуализации позволяет более тонко оценивать морфо-функциональные изменения у эмбрионов в процессе развития. Поскольку существует множество стадий развития эмбрионов низших позвоночных и множество различных явлений, связанных с их развитием, предлагаемую методику можно рассматривать как универсальный, неинвазивный и эффективный инструмент для будущих исследований.
Список литературы
Gilbert S.F., Barresi M.J.F. Developmental Biology. N.Y.: Oxford Univ. Press, 2017.
Megason S.G. // Methods Mol. Biol. 2009. V. 546. P. 317. https://doi.org/10.1007/978-1-60327-977-2_19
Swinburne I.A., Mosaliganti K.R., Green A.A., Megason S.G. // PLoS One. 2015. V. 10. № 8. P. 0134005. https://doi.org/10.1371/journal.pone.0134005
Keller P.J., Schmidt A.D., Wittbrodt J., Stelzer E.H.K. // Science. 2008. V. 322. № 5904. P. 1065. https://doi.org/10.1126/science.1162493
Daetwyler S., Günther U., Modes C.D. et al. // Development. 2019. V. 146. № 6. P. dev173757. https://doi.org/10.1242/dev.173757
Szabo T.L. Diagnostic ultrasonic imaging: inside out. Amsterdam: Elsevier Academic Press, 2004.
Greco A., Mancini M., Gargiulo S. et al. // J. Biomed. Biotechnol. 2012. V. 2012. Article ID 519238. https://doi.org/10.1155/2012/519238
Денисова Л.А., Маев Р.Г., Храмцова Е.А. и др. // Технологии живых систем. 2006. Т. 1. № 3. С. 56.
Schellpfeffer M.A., Bolender D.L., Kolesari G.L. // Ultras. Med. Biol. 2007. V. 33. № 5. P. 751. https://doi.org/10.1016/j.ultrasmedbio.2006.10.019
Phoon C.K.L. // Pediatric Research. 2006. V. 60. P. 14.
Бурлаков А.Б., Хохлов Д.Д., Мачихин А.С. и др. // РЭ. 2020. Т. 65. № 7. С. 717.
Burlakov A.B., Khokhlov D.D., Domanskiy V.L., Titov S.A. // J. Phys.: Conf. Ser. 2019. V. 1421. № 1. P. 012050.
Sun L., Lien C.L., Xu X., Kirk Shung. K. // Ultras. Med. Biol. 2008. V. 34. № 1. P. 31. https://doi.org/10.1016/j.ultrasmedbio.2007.07.002
Ho S., Tan G.X.Y., Foo T.J. et al. // Ann. Biomed. Eng. 2017. V. 45. № 10. P. 2309. https://doi.org/10.1007/s10439-017-1882-9
Tan G.X., Jamil M., Tee N.G. et al. // Ann. Biomed. Eng. 2015. V. 43. № 11. P. 2780. https://doi.org/10.1007/s10439-015-1339-y
Кайно Г. Акустические волны. М.: Мир, 1990. С. 208.
Smith N., Webb A. Introduction to Medical Imaging Physics, Engineering and Clinical Applications. Cambridge: Cambridge Univ. Press, 2011. P. 163.
Макеева А.П. Эмбриология рыб. М.: Изд-во МГУ, 1992.
Костомарова А.А. Объекты биологии развития. М.: Наука, 1975. С. 309.
Дополнительные материалы отсутствуют.
Инструменты
Радиотехника и электроника