Радиотехника и электроника, 2022, T. 67, № 4, стр. 384-390
Разработка лазерно-волоконного флуориметра для инфракрасной люминесцентной диагностики рака
И. П. Шилов a, *, Г. Л. Даниелян b, С. В. Маречек a, Л. Ю. Кочмарев a, Е. П. Новичихин a
a Фрязинский филиал Института радиотехники и электроники им. В.А. Котельникова РАН
141190 Фрязино, Московской обл., пл. Введенского, 1, Российская Федерация
b Институт общей физики им. А.М. Прохорова РАН
119991 Москва, ул. Вавилова, 38, Российская Федерация
* E-mail: laserlab@ms.ire.rssi.ru
Поступила в редакцию 21.04.2021
После доработки 18.05.2021
Принята к публикации 30.05.2021
- EDN: QSVWTL
- DOI: 10.31857/S003384942204009X
Аннотация
Разработан опытный вариант лазерно-волоконного флуориметра для люминесцентной диагностики рака кожи и слизистых оболочек, работающий в ближнем ИК-спектральном диапазоне (900…1100 нм). Рассмотрены основные элементы устройства: компактный полупроводниковый источник лазерного излучения на рабочей длине волны 405 нм, высокочувствительный оптоэлектронный блок, ноутбук с разработанной программой, высокоапертурный волоконно-оптический зонд (числовая апертура до 0.32). Показано. что данный прибор, работающий совместно с фармацевтической композицией типа “Флюроскан” на основе дикалиевой соли итербиевого комплекса 2,4‑ди(α-метоксиэтил)дейтеропорфирина IX, обеспечивает достижение высоких значений люминесцентного диагностического контрастного индекса новообразование/нормальная ткань (вплоть до 50 единиц).
ВВЕДЕНИЕ
В настоящее время основным методом лазерной медицинской визуализации и анализа биотканей на наличие новообразований (доброкачественные, злокачественные опухоли) является лазерный флуоресцентный анализ. Флуоресценция соответствует разрешенному оптическому переходу со сравнительно малым (наносекунды) временем жизни, возникает после поглощения света и связана с электронным переходом из возбужденного состояния молекулы в основное состояние. Интенсивность флуоресценции пропорциональна концентрации и квантовому выходу флуоресценции поглощающих молекул [1]. Флуоресцентная спектроскопия применяется для анализа большого числа различных объектов: от индивидуальных биохимических образцов до целых органов in vivo. Одним из подходов флуоресцентной диагностики (ФД) новообразований является использование специальных вводимых в организм экзогенных флуоресцентных маркеров, накапливающихся в опухолевых и других быстро пролиферирующихся биотканях.
Следует отметить, что имеющиеся в настоящее время в распоряжении врачей для проведения процедур ФД спектральные устройства созданы в основном для спектрального диапазона 600…750 нм, дающего в некоторых случаях ложноположительные результаты из-за присутствия в биотканях эндогенных порфиринов [2]. Эта аппаратура работает с фотосенсибилизаторами (ФС) типа “Фотодитазин”, “Фотофрин”, “Аласенс”, которые при проведении ФД опухолей создают токсичные концентрации синглетного кислорода, разрушающего как больные ткани, так и здоровые. В последнее время появился ряд работ [3, 4], исследующих различные биомедицинские применения, включая диагностику новообразований, где предлагаются фотосенсибилизаторы на основе некоторых лантанидных комплексов порфиринов, люминесцирующих в ближней ИК-области спектра (БИК-люминесценция). К ним относятся комплексы порфиринов на основе Yb, Ho, Er и Nd. При этом у иона Yb3+ наиболее высокий внутренний квантовый выход люминесценции (до 4%), благодаря чему он является наиболее перспективным кандидатом на применение в ИК-люминесцентной диагностике (ЛД) новообразований.
Как оказалось, введение иона иттербия в центр порфириновой матрицы приводит к резкому снижению фотохимической активности соединения [5], сохраняя при этом свойственную большинству порфиринов тропность к злокачественным опухолям. Дело в том, что ионы иттербия, введенные в соответствующие производные порфириновых комплексов, в значительной степени снижают квантовый выход генерации синглетного кислорода. В результате фототоксичность у иттербиевых комплексов порфиринов (ИКП) значительно снижается, а при возбуждении π-электронной системы органической части молекулы порфиринов наблюдается люминесценция, обусловленная переходами 4f-электронов иона Yb3+: 4F5/2 → 2F7/2.
Необходимо также подчеркнуть, что Yb3+-ион во всем диапазоне энергий, вплоть до энергий, соответствующих УФ-области спектра, имеет только два энергетических уровня: основной (2F7/2) и возбужденный (4F5/2) [6]. При этом электронные уровни 4F5/2 и 2F7/2 в свою очередь расщепляются на три и четыре вырожденных уровня соответственно (рис. 1).
По этой причине при возбуждении в диапазоне 300…630 нм 4f-люминесценция иона Yb3+ в ИКП наблюдается в достаточно широком спектральном интервале БИК-диапазона 920…1080 нм. Наличие многочисленных полос люминесценции в этой области спектра позволяет эффективно контролировать накопление иона Yb3+ в опухоли методом БИК-люминесценции в “окне прозрачности” биотканей, где практически отсутствует фоновая люминесценция, обусловленная наличием эндогенных порфиринов.
Наиболее перспективным для биомедицинских диагностических исследований БИК-диапазон является из-за большей глубины проникновения фотонов через биоткань и минимальной аутофлуоресценции в этом диапазоне спектра [7]. Для спектрального БИК-диапазона (800…1100 нм) в настоящее время отсутствует оптоэлектронная аппаратура достаточной чувствительности для детектирования сигнала люминесценции малой интенсивности.
Цель данной работы – создать опытный образец высокочувствительного лазерно-волоконного флуориметра для люминесцентной ИК-диагностики рака на основе использования ИКП в виде нанокомпозиций, которые в диагностических концентрациях не создают токсичных концентраций синглетного кислорода.
1. МЕТОДЫ И МАТЕРИАЛЫ
Лазерно-волоконный флуориметр основан на разработанном ранее методе люминесцентной БИК-диагностики опухолей с использованием ИКП [5, 8]. В основе метода лежат два явления: 1) избирательность накопления люминесцирующего маркера-фотосенсибилизатора в тканях новообразований и возможность его обнаружения по характерной люминесценции на освещаемой лазерным излучением области; 2) различия в интенсивности люминесценции здоровых и патологически измененных тканей при их возбуждении лазерным излучением в ультрафиолетовом диапазоне спектра.
Использование метода ЛД, часто называемого оптической биопсией, предпочтительней традиционной биопсии, требующей удаления нескольких квадратных миллиметров тканевой поверхности и последующего ожидания результатов гистологического исследования.
В БИК-диапазоне спектра наблюдаются две основные люминесцентные полосы – вблизи 930 и 980 нм (наиболее интенсивная) – и многочисленные эмиссионные полосы в спектральном диапазоне 920…1080 нм. В связи с этим появляется возможность отказаться в конструкции от использования монохроматора, а для сбора интегрального малого сигнала люминесценции использовать весь названный выше спектральный диапазон с помощью системы интерференционных фильтров. В качестве диагностикума использовали гель “Флюроскан” (сертификат № РОССRU.0001.510608, совместная разработка РТУ МИРЭА и ФИРЭ РАН). Фармацевтическая композиция (ФК) “Флюроскан” состоит из Yb-комплекса 2,4-ди(α-метоксиэтил)дейтеропорфирина IX (дикалиевая соль), люминесцирующего в БИК-области спектра, и различных гелей (кремофор, тизоль) с использованием диметилсульфоксида, глюкозамина и глицерина, обеспечивающих хорошую проницаемость в кожу и слизистые оболочки (так называемые пенетраторы) [9].
2. РЕЗУЛЬТАТЫ
2.1. Лазерно-волоконный флуориметр. Устройство и принцип работы
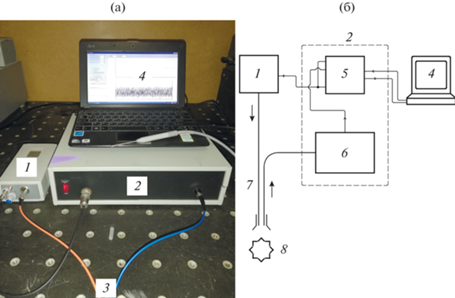
На рис. 2б представлена блок-схема макетного лазерно-волоконного флуориметра (разработки ФИРЭ им. В. А. Котельникова РАН) для БИК-люминесцентной диагностики опухолей кожи и слизистых оболочек, а на рис. 2а – внешний вид прибора.
Рис. 2.
Внешний вид (а) и блок-схема (б) ЛВФ: 1 – 405-нанометровый источник лазерного излучения, 2 – оптоэлектронный блок (ОЭБ), 3 – волоконно-оптический зонд, 4 – ноутбук, 5 – блок модуляции и оцифровки (БМО), 6 – блок приема сигнала люминесценции, 7 – волоконно-оптический зонд, 8 – биоткань.
Устройство содержит следующие основные элементы (см. рис. 2).
1. Компактный полупроводниковый лазер 405 нм 1, который включает блок питания, драйвер лазерного диода, блок управления драйвером и оптический узел лазерного диода. Оптический узел включает непосредственно лазерный диод, установленный на радиаторе и фокусирующую оптическую систему, заканчивающуюся оптическим разъемом типа SMA-905.
2. Блок приема сигнала люминесценции 5, основу которого составляет рефокусатор (рис. 3а), а в корпусе размещены линзы, фокусирующие полезный сигнал люминесценции на приемную площадку фотодиодного модуля (рис. 3б).
Рис. 3.
Общий вид рефокусатора (а) и схема блока приема сигнала люминесценции (б): 1 – оптический коннектор волоконно-оптического зонда (ввод сигнала люминесценции), 2, 4 – короткофокусные линзы из кварца, 3 – интерференционные фильтры, 5 – стыковочный блок фотодиодного модуля с оптической схемой.
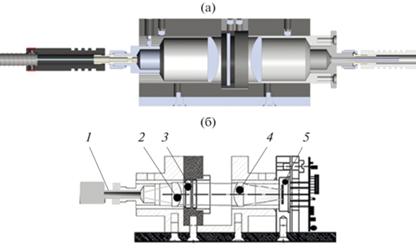
Между линзами рефокусатора смонтированы две ячейки со сменными интерференционными фильтрами (ИФ). Их диаметр составляет 10…20 мм, а толщина 2 мм. В качестве ИФ были использованы фильтры SL 930-1100, оптическое пропускание которых достигает значений вплоть до 80%. При этом степень блокировки возбуждающего излучения составляет не менее 10–6. Слева к корпусу рефокусатора через разъем SMA-905 крепятся подводящие люминесценцию световоды. В правой части рефокусатора размещен детектирующий фотодиодный модуль с предусилителем. Блок приема сигнала люминесценции достаточно подробно описан в [10], а на рис. 3б представлена общая схема блока. В качестве фотодиодного модуля был использован модуль S9269 “Hamamatsu” (Япония), обладающий повышенной чувствительностью до 10 фВт.
3. Блок модуляции и оцифровки (4, рис. 2б), как и блок приема, входит конструктивно в состав оптоэлектронного блока и выполняет три основные задачи: 1) формирование меандра на частоте модуляции излучателя (по цифро-аналоговому каналу), 2) регистрация результатов измерений (по аналого-цифровому каналу), 3) обработка результатов. При обработке данных использован метод синхронного детектирования для увеличения отношения сигнал–шум. Интерфейс программы позволяет устанавливать различные параметры для оптимизации измерений. Программа написана и отлажена в среде программирования Delphi, разработана в ИРЭ им. В. А. Котельникова РАН и зарегистрирована в Реестре программ для ЭВМ [11].
4. Одним из основных элементов ЛВФ является волоконно-оптический зонд (ВО-зонд). Известно, что при проведении ЛД опухолей необходимо облучать довольно большие поверхности биообъекта. Чем выше числовая апертура NA световода, тем больший размер поверхности может быть освещен. При этом можно повысить производительность процесса ЛД.
С целью создания высокоапертурных световодов состава SiO2-F/SiO2 (SiO2 – сердцевина световода, SiO2-F – светоотражающая оболочка) была разработана лабораторная технология формирования заготовок световодов указанного состава. Заготовки изготавливали на макетной СВЧ-плазмохимической установке (разработка ФИРЭ им. В.А. Котельникова РАН) [12]. Вытяжка из получаемых заготовок осуществлялась по известной технологии с использованием графитовой печи.
Конструктивно зонд представляет собой гексагональную сборку многомодовых световодов (рис. 4а), плотно упакованных в тонкостенную термопластичную полимерную трубку.
Рис. 4.
Гексагональная упаковка световодов на дистальном конце ВО-зонда (а) и зависимость (б) интенсивности люминесценции от расстояния Zd между дистальным концом зонда и поверхностью биоткани при различной числовой апертуре: NA = 0.5 (1) и 0.22 (2).
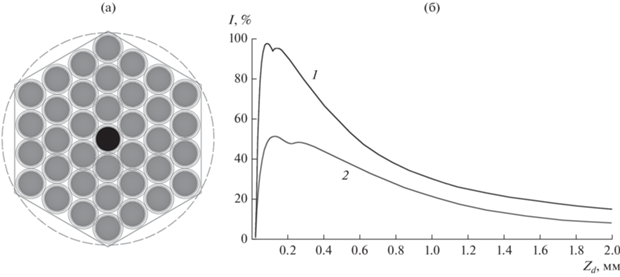
Функционально световоды в ВО-зонде разделяются на зондирующие и приемные. С помощью первых к объекту (новообразование биоткани) доставляется возбуждающее люминесценцию лазерное зондирующее излучение, а с помощью вторых собирается люминесцентное излучение и доставляется к блоку приема сигнала люминесценции. На дистальном конце ВО-зонда торцы всех световодов отполированы и расположены в одной плоскости и на нем установлена гайка-наконечник, позволяющая регулировать расстояние до объекта. На другом конце ВО-зонда зондирующие и приемные световоды разделены и закреплены в двух оптических разъема типа SMA-905.
Приемные волокна зонда были сформированы путем перетяжки заготовки кварцевого световода состава SiO2/SiO2-F. Заготовка была получена с использованием метода плазмохимического СВЧ-осаждения при пониженном давлении, а также метода “штабик в трубке”. Сердцевины этих световодов были изготовлены из суперсухого кварцевого стекла типа “Heraeus”, Германия (стекло типа WF), с содержанием гидроксил-ионов менее 1 ppm. Вытяжка волокон из заготовок осуществлялась по технологии, предусматривающей нанесение защитного покрытия на волокно, вытягиваемое из расплавов термопластов фильерным способом. В качестве защитного покрытия применялся полиамид П-12, а также сополимер тетрафторэтилена с этиленом марки “Tefzel”. Диаметр сердцевины (SiO2) составил около 200 мкм, диаметр светоотражающей оболочки (SiO2-F) – 220 мкм, внешний диаметр защитного покрытия ~280…290 мкм; числовая апертура NA составила 0.32. В качестве зондирующих световодов ВО-зонда, обеспечивающих подачу лазерного излучения к биообъекту для возбуждения люминесценции, были использованы световоды такого же состава, что и приемные, но с содержанием гидроксил-ионов в сердцевине 1000…1300 ppm (световоды типа UV) с алюминиевым защитным покрытием. Размеры сечения зондирующего световода такие же, как у приемных световодов, а числовая апертура NA = 0.30. Тонкий слой алюминия обеспечивает надежную изоляцию зондирующего световода ВО-зонда от приемных, что принципиально важно при анализе спектров люминесценции. Следует отметить, что в спектральных исследованиях, в частности во флуоресцентной диагностике, применяются, как правило, световоды с чисто кварцевой сердцевиной, так как это исключает появление нежелательных центров окраски при прохождении по ним излучения в ультрафиолетовом и видимом диапазоне спектра.
Проведенное для данной гексагональной укладки из 19 волокон (18 + 1) численное моделирование [13] влияния числовой апертуры световодов на характеристики ВО-зонда показало (см. рис. 4б), что с увеличением числовой апертуры (NA) с 0.22 до 0.5 интенсивность приемного сигнала люминесценции возрастает почти в два раза (при расстоянии от дистального конца ВО-зонда до поверхности биоткани ~0.2 мм).
Основные технические характеристики разработанного опытного варианта ЛВФ представлены в табл. 1.
Таблица 1.
Основные технические характеристики ЛВФ
| Параметр | Значение |
|---|---|
| Оптическая мощность лазера, мВт | до 30 |
| Рабочая длина волны лазера, нм | 405 |
| Рабочая частота модулирующего сигнала, Гц | 20…100 |
| Чувствительность обнаружения препарата, мкгр/кг | 10.0 |
| Габариты корпуса ALAS 61.09, мм | 80 × 307 × 257 |
| Вес ЛВФ, кг | 3 |
| Фильтры SL 930-1100 | |
| Коэффициент пропускания в полосе спектра 930…1100 нм, % | до 80 |
| Коэффициент пропускания в полосе фонового спектра 350…850 нм, % | 10–6 |
| Спектральный диапазон измерений, нм | 930…1100 |
| Фотодиодный модуль с предусилителем | |
| Тип модуля (Hamamatsu) S9269 | |
| Пороговая чувствительность, фВт | 10 |
| Длина волны максимальной чувствительности, нм | 960 |
| Волоконно-оптический зонд | |
| Тип – многожильный | 19 жил |
| Световоды – кварц-кварц, SiO2 + F/SiO2 | – |
| Числовая апертура световодов | 0.30…0.32 |
Флуориметр работает следующим образом. Излучение от лазера 1 (см. рис. 2) с регулируемой оптической мощностью (до 10 мВт) через центральный световод волоконно-оптического зонда 6 попадает на исследуемую биоткань 7, в которой селективно накоплен ион иттербия. С помощью блока модуляции и оцифровки 4 обеспечивается модуляция лазерного излучения. Частотой и амплитудой модуляции управляет программа, установленная на ноутбуке 3. Далее малый сигнал ИК-люминесценции иона иттербия после УФ‑возбуждения вместе с фоновыми флуоресцентными сигналами от эндогенных порфиринов и других хромофоров биоткани (флавины, коллагены и т.д.) через приемные световоды ВО-зонда поступает в блок приема сигнала люминесценции 5. Данный блок устраняет попадание на фотодиодный модуль возбуждающего излучения (405 нм), а также фоновой аутолюминесценции, излучающейся в основном в зеленом и красном диапазонах спектра. Выделенный полезный сигнал ИК-люминесценции детектируется и после усиления и оцифровки с помощью аналого-цифрового и цифро-аналогового преобразователей, расположенных в БМО 2, поступает на ноутбук 3 с разработанной программой.
На ноутбуке детектируемый сигнал представляется в виде усредненной за время получения сигнала интегральной интенсивности люминесценции, относящейся к зоне локализации ВО-зонда. Следует отметить, что ЛВФ с его волоконно-оптическим зондом, по сути, можно рассматривать как биомедицинский фотонный локатор.
2.2. Экспериментальная часть
Для ЛД рака кожи и слизистых оболочек была разработана ФК “Флюроскан”, состоящая из Yb-ДМДП (дикалиевой соли), люминесцирующей в БИК-области спектра, и различных гелей (кремофор, тизоль) с использованием диметилсульфоксида, глюкозамина и глицерина [14].
Апробация разработанного ЛВФ была проведена в Государственном научном центре “Лазерная медицина” (ФМБА, Москва) на 34-х пациентах-добровольцах с базальноклеточным раком кожи (поверхностная форма). У большинства пациентов имели место множественные и сочетанные поражения кожи. Из них: базалиом без изъязвления – 20, базалиом с изъязвлением – 14. Гель наносился на поверхность новообразований и окружающую здоровую кожу на 30 мин. Затем остатки препарата тщательно удаляли и измеряли уровень люминесценции для исследования процесса накопления препарата, содержащего ионы иттербия, в патологически измененных и здоровых тканях.
Типичная зависимость интегральной интенсивности люминесценции в случае поверхностной формы базальноклеточного рака кожи от различных ее участков представлена на рис. 5.
Рис. 5.
Базальноклеточный рак кожи (поверхностная форма); фото различных участков кожи, подвергшихся обследованию с помощью ЛВФ (а) и зависимость интегральной интенсивности люминесценции от различных участков кожи (б): 1–3 – участки опухолевого роста без изъявления; 4 – изъявления по краю очага, 5 – кожа, не обработанная гелем (внешне здоровая), 6 – неизмененная кожа (соседняя с поз. 4, внешне здоровая), обработанная гелем.
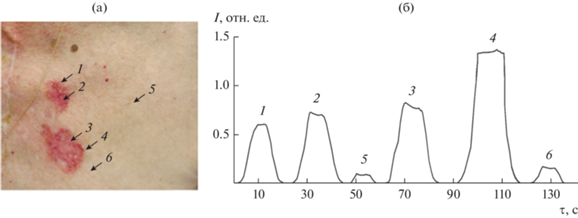
Интегральная (в спектральном диапазоне 930…1100 нм) интенсивность люминесценции характеризует накопление ИКП в различных элементах новообразований и областях здоровой кожи, так что с помощью графика можно оценить величину люминесцентного диагностического контрастного индекса (ЛДКИ):
В результате исследований было установлено, что уровень люминесценции здоровых участков кожи составлял 0.1…0.2 отн. ед. При этом фиксировалось повышение уровня люминесценции до 0.9…1.5 отн. ед. над очагами рака кожи без изъязвления. Максимальные уровни наблюдались на поверхности эрозированных опухолевых очагов 1.8…3.7 отн. ед.
ЗАКЛЮЧЕНИЕ
Разработан, изготовлен и освоен рядом медицинских учреждений г. Москвы опытный вариант лазерно-волоконного флуориметра для БИК-люминесцентной диагностики рака на основе нанокомпозиций с иттербиевыми комплексами порфиринов. Данный прибор, совместно с фармацевтической композицией типа “Флюроскан” на основе дикалиевой соли итербиевого комплекса 2,4-ди(α-метоксиэтил)дейтеропорфирина IX, обеспечивает достижение высоких значений люминесцентного диагностического контрастного индекса новообразование/нормальная ткань (~5…50). Чувствительность разработанной аппаратуры позволяет с повышенной точностью определять границы поражений кожи, изучать накопление ФК при воспалительных и пролиферативных процессах.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Optical Biomedical Diagnostics / Ed. V.V. Tuchin. Bellingham: SPIE PRESS, 2002. V. 2.
Zaak D., Alexander K., Stepp H. et al. // BJU International. 2005. V. 96. № 2. P. 217. https://doi.org/10.1111/j.1464-410X.2005.05604.x
Comby S., Bunzli J. // Handbook on the Physics and Chemistry of Rare Earths. Amsterdam: Elsevier Sci., 2007. P. 217.
Bulach V., Sguerra F., Hosseini M.W. // Coord. Chem. Rev. 2012. V. 256. № 15-16. P. 1468. https://doi.org/10.1016/j.ccr.2012.02.027
Ivanov A.V., Rumyantseva V.D., Shchamkhalov K.S., Shilov I. P. // Laser Phys. 2010. V. 20. № 12. P. 2056. https://doi.org/10.1134/s1054660x10220032
Болдырев К.Н., Попова М.Н., Безматерных Л.Н., Беттинелли М. // Квант. электроника. 2011. Т. 41. № 2. С. 120.
Kumar R., Ohulchanskyy T.Y., Roy I. et al. // ACS Appl. Mater. Interfaces. 2009. V. 1. № 7. P. 1474. https://doi.org/10.1021/am9001293
Gaiduk M.I., Grigoryants V.V., Mironov A.F. et al. // Photochem. Photobiol. B: Biology. 1990. V. 7. № 1. P. 15. https://doi.org/10.1016/1011-1344(90)85139-n
Алексеев Ю.В., Румянцева В.Д., Шилов И.П. и др. // Лазерная медицина. 2016. № 2. С. 20. https://doi.org/10.37895/2071-8004-2016-20-2
Шилов И.П., Даниелян Г.Л., Маречек С.В., Кочмарев Л.Ю. // РЭ. 2021. Т. 66. № 1. С. 96. https://doi.org/10.1134/s1064226921010095
Шилов И.П., Рябов А.С., Новичихин Е.П. Свидетельство о государственной регистрации программы для ЭВМ №2018617536, Опубл. офиц. бюл. “Программы для ЭВМ. Базы данных. Топология интегральных микросхем” № 7 от 26.06.2018.
Бабенко В.А., Кочмарев Л.Ю., Шилов И.П. // РЭ. 2005. Т. 50. № 1. С. 100.
Явелов И.С., Каплунов С.М., Даниелян Г.Л. Волоконно-оптические измерительные системы. Прикладные задачи. М., 2011. С. 304.
Alekseev Y., Rumyantseva V., Gorshkova A. et al. // J. Biomed. Opt. 2017. V. 22. № 9. P. 098001. https://doi.org/10.1117/1.jbo.22.9.098001
Дополнительные материалы отсутствуют.
Инструменты
Радиотехника и электроника



