Радиотехника и электроника, 2022, T. 67, № 7, стр. 686-692
Магнито-люминесцентная тераностика рака на основе иттербиевых комплексов порфиринов и магнетитовых наночастиц
И. П. Шилов a, *, В. Д. Румянцева a, А. В. Иванов b, А. С. Горшкова a
a Фрязинский филиал Института радиотехники и электроники им. В.А. Котельникова РАН
141190 Фрязино, Московской обл., пл. Введенского, 1, Российская Федерация
b Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина
115478 Москва, Каширское шос., 23, Российская Федерация
* E-mail: laserlab@ms.ire.rssi.ru
Поступила в редакцию 03.02.2021
После доработки 05.03.2021
Принята к публикации 24.03.2021
- EDN: VHECGS
- DOI: 10.31857/S0033849422070129
Аннотация
Разработаны основы перспективного метода магнитолюминесцентной тераностики опухолей визуально и эндоскопически доступной локализации. Метод основан на использовании композитных наночастиц, состоящих из полимерной матрицы типа “Лексан” (оболочки нанокомпозита) с инкорпорированными в нее иттербиевыми комплексами порфиринов (гидрофобный иттербиевый комплекс тетраметилового эфира гематопорфирина IX), а также наночастиц магнетита. При этом инкорпорированные в полимерную матрицу наночастицы иттербиевого комплекса порфиринов ответственны за проведение процесса люминесцентной диагностики опухолей, а наночастицы магнетита обеспечивают терапию опухолей посредством магнитной гипертермии. Показано, что оптимальным размерным диапазоном магнитных наночастиц при использовании в данном методе является d = 10…20 нм. Проведенные исследования по биораспределению нанокомпозита в различных органах и новообразованиях лабораторных животных (мыши-самки линии Bulb/c с перевитой карциномой Эрлиха) показали значительную селективность накопления наночастиц в опухоли уже через 24 ч после внутривенного введения.
ВВЕДЕНИЕ
Разработка новых методов, включающих в себя одновременно диагностику и лечение злокачественных новообразований (тераностика), на сегодняшний день является весьма актуальной задачей. Нанокомпозиты для диагностики и тераностики, состоящие из наноносителей (мицеллы, полимерные матрицы, липосомы и пр.) и инкапсулированных в них наночастиц для лечения, а также наночастиц для диагностики новообразований, имеют большие перспективы в диагностике онкологических заболеваний [1]. Для проведения эффективной диагностики и тераностики опухолей такие наночастицы и нанокомпозиты должны обладать повышенным временем циркуляции в крови, эффективным проникновением и высокой аккумуляцией в очагах патологии. Помимо этого, они должны иметь низкую общую токсичность и достаточно быстро выводиться из организма. Ранее было показано, что иттербиевые комплексы порфиринов (ИКП), в частности иттербиевый комплекс дикалиевой соли 2,4-ди(α-метоксиэтил) дейтеропорфирина IX (Yb-МДП IX), могут быть использованы в качестве одного из основных компонентов создаваемых нанокомпозитов для тераностики рака. Так, Yb-МДП IX был использован для функционализации композитных наночастиц, состоящих из золото-серебряных наноклеток, покрытых мезопористой оболочкой из двуокиси кремния [2]. Такие наноструктуры обладают рядом важных свойств, включая легко настраиваемый плазмонный резонанс наноклеток в диапазоне 650…950 нм и удобство функционализации пористой оболочки двуокиси кремния [3].
Таким образом, реализуется метод плазмонно-резонансной фототермотерапии [2], который является одним из относительно новых и многообещающих методов лечения опухолей.
Однако у таких нанокомпозитных частиц существует ряд недостатков, а именно: требующий дорогостоящих реактивов трудоемкий многостадийный химический синтез многофункциональных наночастиц на основе золото-серебряных наноклеток, покрытых диоксидом кремния и функционализированных ИКП; длительное время накопления данных нанокомпозитов в новообразованиях, которое составляет не менее 24 ч; силикатная матрица довольно пористая и склонна к агрегации в крови, в результате чего происходит преждевременный выход из нее компонентов комплекса [4].
В настоящее время проводятся интенсивные исследования наноразмерных ИКП, которые являются перспективными субстанциями для люминесцентной диагностики (ЛД) визуально и эндоскопически доступных форм рака в ближней инфракрасной (БИК) области спектра 800…1100 нм, а также для тераностики опухолей [5]. Эти соединения характеризуются люминесцентным сигналом повышенной интенсивности в спектральном диапазоне 900…1100 нм. Они обладают высоким коэффициентом экстинкции ~105 М–1 см–1 и временем жизни люминесценции до 20 мкс. Кроме того, многие комплексы представляют собой производные природных порфиринов и являются малотоксичными [6].
Следует также отметить, что к настоящему времени весьма развиты и продолжают совершенствоваться методы, в которых используются магнитные наночастицы (МНЧ) и греющие радиочастотные электромагнитные поля (ЭМП). В их число входит и магнитная гипертермия (МГТ), при этом частота ЭМП составляет 200…1000 кГц.
В последнее время развитие получили также и не тепловые механизмы магнитной тераностики (механизм магнитомеханической актуации), использующие негреющие ЭМП (1…1000 Гц) [7]. Использование МНЧ позволяет локально повысить интенсивность воздействия и снизить частоту и величину необходимой индукции переменного ЭМП и, следовательно, уменьшить вероятность нежелательных побочных эффектов со стороны поля. В большинстве биомедицинских приложений в качестве материала магнитного ядра используют магнетит Fe3O4, имеющий существенно меньшую токсичность, чем чистые магнитные металлы и многие магнитные сплавы.
Целью данной работы является разработка основ нового перспективного метода магнито-люминесцентной тераностики (МЛТ) рака: люминесцентная диагностика опухолей в ближнем инфракрасном диапазоне в сочетании с локальной ферромагнитной гипертермией.
1. МАТЕРИАЛЫ И МЕТОДЫ
Инкорпорированные в полимерную матрицу наночастицы ИКП в составе композитных наночастиц (КНЧ) для МЛТ ответственны за проведение процесса БИК-люминесцентной диагностики опухолей. Наноразмерные иттербиевые комплексы порфиринов в виде ацетилацетонатных комплексов были получены в соответствии с описанным [6] методом. Измерение электронных спектров поглощения (ЭСП) синтезированных ИКП проводили на спектрофлуориметре LS-5B, PerkinElmer и cпектрометре “Jasco-7800” (Япония). Изучение спектральных и временных характеристик люминесценции синтезированных ИКП, а также разработанных КНЧ для МЛТ проводили на экспериментальном измерительном стробоскопическом стенде для исследования люминесценции и кинетики спектров, разработанном в ИРЭ им. В. А. Котельникова РАН [8]. Возбуждение люминесценции исследуемых образцов осуществляется излучением твердотельного импульсного лазера LS-2132 фирмы Lotis-Tii на кристалле алюмоиттриевого граната с ионами неодима. Частота следования импульсов от 1 до 15 Гц. Длительность импульса по уровню 0.5 около 10 нс. Основная длина волны излучения ~1064 нм. Энергия в одиночном импульсе составляет 100…180 мДж. В состав лазера входит преобразователь частоты на нелинейных кристаллах. При изучении характера затухания люминесценции использовались фотоэлектронные умножители (ФЭУ) – ФЭУ-83 и ФЭУ-79, а регистрация спектров люминесценции осуществлялась с помощью CD-камеры.
Наночастицы оксидов железа FeOx (магнетит) были получены и первично аттестованы в лаборатории импульсных процессов Института электрофизики УрО РАН, с использованием метода электрического взрыва металлической проволоки посредством высоковольтных электрических импульсов (30 кВ, 1 Гц), детали которого описаны в работах [9, 10]. Размер наночастиц определяли методом динамического рассеяния света на лазерном корреляционном спектрометре “Курс-3” [11], позволяющем проводить измерения в диапазоне 0.5…104 нм. Исследования биораспределения и фармакокинетики КНЧ в органах и тканях животных (30 мышей-самок линии Bulb/c с перевитой карциномой Эрлиха) проводили на разработанном в ФИРЭ им. В.А. Котельникова РАН макетном лазерно-волоконном флуориметре (ЛВФ) [12, 13].
Устройство базируется на основе полупроводникового лазера на длине волны 405 нм; блока модуляции и оцифровки, включающего аналогово-цифровой преобразователь; ноутбука; блока регистрации и обработки сигнала люминесценции, включающего систему интерференционных фильтров, фотодиодного модуля с предусилителем, системы линз; многожильного высокоапертурного волоконно-оптического зонда.
По истечении определенных промежутков времени в интервале от 0.5 до 72 ч после введения препарата группы мышей по три особи выводили из опыта, после чего проводили биопсию органов и тканей: легкое, сердце, печень, селезенка, почки, мышца, кожа и опухоль, – для спектрального исследования. В процессе изучения селективности накопления композитных наночастиц дистальный конец волоконно-оптического зонда ЛВФ устанавливали на расстоянии 2…3 мм от поверхности биоптата, включали полупроводниковый лазер, оптическую мощность на дистальном конце зонда доводили до 10 мВт. Задающий генератор обеспечивал импульсный режим работы лазера с длительностью импульса 0.5 мс и частотой посылок 20…50 Гц. Люминесцентный сигнал, характерный для ИКП, выделяли блоком интерференционных фильтров и поступал на фотодиодный блок с предусилителем. После усиления и оцифровки сигнал воспринимался на ноутбуке и отображался в виде временного профиля интенсивности люминесценции от всех органов, включая опухоль.
Для целей магнитной нанотераностики был проведен синтез наночастиц, содержащих ядро оксидов железа, на основе устойчивой к преждевременному выходу наночастиц полимерной матрицы типа “Лексан”, включающей в себя ИКП. Конструкция разработанных КНЧ, имеющих структуру ЛПМ + ИКП + FeOx, представлена на рис. 1.
Рис. 1.
Структуры синтезированных композитных наночастиц: а – общий вид МНЧ, б – ИКП (нижняя часть), ацетилацетон (лиганд, верхняя часть), в – ТОФО, г – лексан, д – Тритон Х-100.
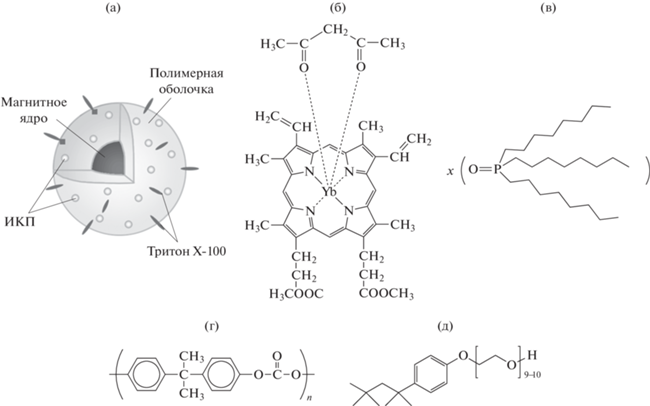
В качестве основы (матрицы) был выбран поликарбонатный бисфенольный полимер – лексан. Он обладает достаточной гидрофобностью, чтобы в него могли инкорпорироваться молекулы ИКП, и в то же время биологической совместимостью, чтобы частицы можно было использовать in vivo. В частности, из лексана делают контактные линзы для глаз и мембранные фильтры для фильтрации крови. Для придания поверхности частиц гидрофильности, а следовательно, меньшей агрегируемости и для более длительной циркуляции в организме в органическую фазу вводили также неионогенный детергент Тритон Х-100. При образовании частиц гидрофобная часть детергента встраивалась в частицу, а гидрофильная (полиэтиленгликолевая) оставалась на поверхности.
В синтезе были использованы: лексан производства компании GeneralElectricPlastics, США; бычий сывороточный альбумин, тетрагидрофуран (ТГФ), комплексообразователь триоктилфосфиноксид (ТОФО), детергент Тритон Х-100 производства компании Sigma-Aldrich, США. Включение ТОФО в ИКП проводили в растворе ТГФ. Синтез КНЧ осуществляли по методу [14], приводящему в нашем варианте реализации к получению частиц большего диаметра [15].
2. ЭКСПЕРИМЕНТАЛЬНЫЕ РЕЗУЛЬТАТЫ
Для эффективной МЛТ опухолей необходимы ИКП, имеющие повышенные фотофизические характеристики, а именно: абсорбционные характеристики, времена жизни и интенсивность люминесценции, относительный квантовый выход 4f-люминесценции. Кроме того, ИКП должны иметь низкую токсичность и обладать гидрофобными свойствами, поскольку гидрофобные наночастицы значительно лучше инкорпорируются в полимерную матрицу, чем гидрофильные. К тому же они, как правило, обладают и более высокими временами жизни люминесценции. Известно, что спектры поглощения исходных порфиринов состоят из интенсивной фундаментальной полосы Соре 370…420 нм (В-полоса) и четырех так называемых Q-полос в области 500…600 нм. При комплексообразовании полоса Соре становится более интенсивной и претерпевает незначительный батохромный сдвиг (8…12 нм). Кроме того, наблюдаются две полосы в диапазоне 550…600 нм. На рис. 2 в качестве примера представлены спектры поглощения Yb(acac)-МДП IX, Yb-комплекса тетраметилового эфира гематопорфирина IX (Yb(acac)-ТМЭ ГП IX), а также Yb-комплексадиметилового эфира протопорфирина IX(Yb(acac)-ДМЭ ПП IX). Необходимо также подчеркнуть, что коэффициент экстинкции для ИКП почти на 4 порядка величины больше, чем при прямом возбуждении самого Yb3+-иона. Следовательно, возбуждение Yb3+-иона через порфириновую матрицу обеспечивает более эффективный путь для получения сильной 4f-люминесценции, чем прямое возбуждение Yb3+-иона.
Рис. 2.
Электронные спектры поглощения: 1 – Yb-комплекс 2,4-ди(α-метоксиэтил)дейтеропорфирина IX, 2 – Yb-комплекс диметилового эфира протопорфирина IX, 3 – Yb-комплекс тетраметилового эфира гематопорфирина IX.

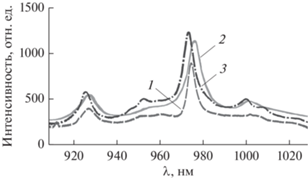
Спектральные характеристики люминесценции некоторых образцов ИКП представлены на рис. 3. Из рисунка видно, что ИКП обладают характерной для редкоземельных ионов узкой и достаточно яркой полосой люминесценции, которая для Yb3+-иона находится в ИК-диапазоне 975…985 нм, где собственная люминесценция биотканей практически отсутствует.
Рис. 3.
Спектр люминесценции ряда образцов ИКП (λвозб = 532 нм): 1 – Yb-комплекс 2,4-ди(α-метоксиэтил)дейтеропорфирина IX, 2 – Yb-комплекс диметилового эфира протопорфирина IX, 3 – Yb-комплекс тетраметилового эфира гематопорфирина IX.
При изучении спектральных характеристик ИКП было установлено, что время жизни люминесценции для синтезированных ИКП составляет 1…22 мкс, это существенно дольше времени жизни неодимовых комплексов порфиринов (0.72…1.34 мкс). Спад люминесценции имеет неэкспоненциальный характер, что обусловлено сильным тушением люминесценции колебаниями О–Н-групп из ближайшего окружения иона иттербия.
Проведенные исследования основных фотофизических свойств различных ИКП позволили из синтезированных субстанций для МЛТ рака выбрать гидрофобный Yb(acac)-ТМЭ ГП IX в связи с его повышенными фотофизическими характеристиками, что подтверждается значительной величиной произведения коэффициента экстинкции и квантового выхода люминесценции φ, а также с его низкой токсичностью. При этом относительный квантовый выход люминесценции составил ~0.90%.
Синтезированные МНЧ на основе магнетита для МЛТ опухолей в составе КНЧ ответственны за терапию опухолей посредством МГТ, выполняемой по результатам проведенной БИК-ЛД. Как было показано в [7], оптимальный размер МНЧ при осуществлении процедур локальной МГТ находится в диапазоне d = 10…15 нм.
Измерения, проведенные методом динамического рассеяния света на лазерном корреляционном спектрометре “Курс-3”, показали, что МНЧ магнетита представляли собой грубодисперсный порошок следующего состава по размерам (диаметрам): 3 нм – 25%, 8 нм – 35%, 10 нм – 10%, 15 нм – 20%, 35 нм – 5%, частицы диаметром 45, 55, 70, 85, 95, 108, 118, 133 и 145 нм ≤1%. Средний диаметр составил 15.2 нм, удельная поверхность 86 м2/г.
Конкурентным преимуществом магнитных КНЧ является то, что они могут быть визуализированы, направлены и удержаны в определенном месте с помощью магнитного поля и нагреты в нем для проведения гипертермии биотканей. Таким образом, синтезированные МНЧ со средним размером около 15 нм вполне подходят под задачи МЛТ.
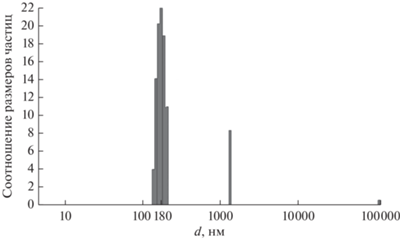
Проведенная оценка распределения синтезированных КНЧ по размерам показала, что с увеличением концентрации полимера в реакционном объеме диаметр синтезируемых частиц возрастает. Средний диаметр КНЧ составил ~180 нм (рис. 4), что обеспечивало длительную циркуляцию наночастиц в организме и преимущественное накопление в опухоли.
Рис. 4.
Распределение композитных наночастиц по размерам d при концентрации ЛПМ в реакционной смеси ~ 100 мкг/л.
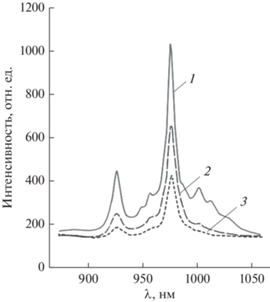
Проведенные исследования показали, что включение ядра магнетита (FeOx) в нанокомпозит приводит к снижению интенсивности люминесценции ИКП в синтезированных КНЧ. В связи с этим необходимо было определить оптимальный размер МНЧ как для процедур БИК-ЛД, так и МГТ. На рис. 5 представлены эмиссионные спектры в ИК-области спектра нанокомпозитов с ядром, содержащим МНЧ, со средними размерами 10 и 30 нм. Для сравнения приведен спектр КНЧ без МНЧ. Показано, что применение 10-нанометровой МНЧ приводит к некоторому снижению (~30%) интенсивности люминесценции Yb(асас)-ТМЭ ГП IX и всей КНЧ в целом, в то время как включение магнетитового ядра с размером 30 нм в КНЧ приводит к значительному, приблизительно двукратному снижению интенсивности люминесценции Yb(асас)-ТМЭ ГП IX в синтезированных вариантах КНЧ. Установлено, что основная доля люминесценции приходится на самую мелкодисперсную (надосадочную) фракцию, что свидетельствует о том, что грубодисперсная суспензия, содержащая “крупные” ядра магнетита (свыше 30 нм), практически не люминесцирует в результате тушения люминесценции Yb3+-иона. Этот недостаток для МНЧ 10…20 нм может быть компенсирован некоторым увеличением дозы нанокомпозита, что является допустимым для осуществления процедур ЛД опухолей. Таким образом, оптимальным размером МНЧ для МЛТ является d = 10…20 нм.
Рис. 5.
Эмиссионные спектры в ближней ИК-области (λвозб ~ 532 нм) композитов разного состава: 1 – ЛПМ + + Yb(асас)-ТМЭ ГП IX , 2 – ЛМП + Yb(асас)-ТМЭ ГП IX + FeOx (10 нм), 3 – ЛМП + Yb(асас)-ТМЭ ГП IX + + FeOx (30 нм).
Было исследовано также биораспределение нанокомпозита состава ЛПМ + ИКП + FeOx в органах и тканях животных (мыши-самки линии Bulb/c с перевитой карциномой Эрлиха) после его введения. Исследования проводили на разработанном в ФИРЭ им. В.А. Котельникова РАН макетном лазерно-волоконном флуориметре (ЛВФ). Доза, вводимая мышам внутривенно, составила ~1 мг/кг веса, что намного ниже порога выживаемости и терапевтических доз фотосенсибилизаторов при фотодинамической терапии опухолей. Следует отметить, что используемые в нанокомпозите ИКП практически не проявляют фотоцитотоксичности.
Исследование фармакокинетики показало, что в первые часы после введения субстанции она локализуется в основном в паренхиматозных органах, прежде всего в селезенке, что полностью согласуется с данными опытов по изучению острой токсичности, когда селезенка является мишенью № 1 для этого нанокомпозита. Но в течение суток препарат уже значительно “вымывается” из этих органов и довольно прочно оседает в опухолевой ткани.
На основе спектрофлуорометрических измерений была построена гистограмма распределения интенсивности люминесценции в различных органах и тканях мыши после внутривенного введения препарата (режим exvivo) (рис. 6).
Рис. 6.
Гистограмма распределения интенсивности люминесценции в различных органах и тканях мыши через 24 ч после внутривенного введения препарата (режим ex vivo, доза 1 мг/кг веса).
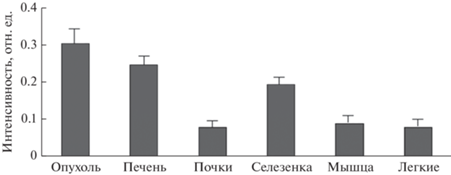
Из представленных на рисунке данных видна значительная селективность накопления КНЧ в опухоли уже через 24 ч после внутривенного введения. Этот результат можно частично объяснить размерным эффектом (размер наночастиц композита не превышает 200 нм), что вполне согласуется с размерами дефектов сосудистой сети в опухолевой ткани [16].
ЗАКЛЮЧЕНИЕ
Разработаны основы нового перспективного метода магнито-люминесцентной тераностики опухолей визуально и эндоскопически доступной локализации. Метод основан на создании композитных наночастиц для МЛТ, состоящих из магнетитового ядра диаметром 10…20 нм и ЛПМ с инкорпорированными в нее иттербиевыми комплексами порфиринов (гидрофобный Yb(асас)-ТМЭ ГП IX). При этом инкорпорированные в полимерную матрицу наночастицы ИКП ответственны за проведение процесса люминесцентной диагностики опухолей в БИК-диапазоне спектра, а наночастицы магнетита обеспечивают терапию опухолей посредством магнитной гипертермии.
Проведенные исследования свидетельствуют о перспективности применения синтезированных наночастиц магнетита для их использования в методе МЛТ. Включение ядра FeOx в нанокомпозит позволяет проводить контролируемую локальную высокочастотную гипертермию тканей, накопивших данные наночастицы, хотя и приводит к некоторому снижению интенсивности люминесценции по сравнению со структурой ЛПМ + ИКП. Однако этот недостаток может быть компенсирован увеличением дозы нанокомпозита, вводимой для диагностики и терапии.
Проведенные исследования основных фотофизических свойств различных ИКП позволили из синтезированных субстанций для МЛТ рака выбрать гидрофобный Yb(асас)-ТМЭ ГП IX в связи с его повышенными фотофизическими свойствами, а также с его низкой токсичностью. Коэффициент экстинкции данного комплекса достигал 105 М–1 см–1. При этом относительный квантовый выход люминесценции составил ~0.90%.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Su J., Sun H., Meng Q. et al. // Theranostics. 2017. V. 7. № 3. P. 523. https://doi.org/10.7150/thno.17259
Khlebtsov B., Panfilova E., Khanadeev V. et al. // ACS Nano. 2011. V. 5. № 9. P. 7077. https://doi.org/10.1021/nn2017974
Хлебцов Б.Н., Панфилова Е.В., Ханадеев В.А. и др. // Рос. нанотехнологии. 2011. Т. 6. № 7–8. С. 112.
Wang L.-S., Wu L.-C., Lu S.-Y. et al. // ACS Nano. 2010. V. 4. P. 4371. https://doi.org/10.1021/nn901376h
Шилов И.П., Иванов А.В., Румянцева В.Д., Миронов А.Ф. // Фундаментальные науки – медицине: Биофизические медицинские технологии. Монография: В 2-х т. / Под ред. А.И. Григорьева, Ю.А. Владимирова. М.: МАКС Пресс, 2015. Т. 2. С. 110.
Ivanov A.V., Rumyantseva V.D., Shchamkhalov K.S., Shilov I.P. // Laser Phys. 2010. V. 20. № 12. P. 2056. https://doi.org/10.1134/s1054660x10220032
Головин Ю.И., Клячко Н.Л., Мажуга А.Г. и др. // Рос. нанотехнологии. 2018. Т. 13. № 5–6. С. 3.
Маркушев В.М., Румянцева В.Д., Шилов И.П., Горшкова А.С. // Журн. радиоэлектроники. 2018. № 8. http://jre.cplire.ru/jre/aug18/19/text.pdf.
Kurlyandskaya G.V., Bhagat S.M., Safronov A.P. et al. // AIP Adv. 2011. V. 1. № 4. P. 042122. https://doi.org/10.1063/1.3657510
Beketov I.V., Safronov A.P., Medvedev A.I. et al. // AIP Adv. 2012. V. 2. № 2. P. 022154. https://doi.org/10.1063/1.4730405
Иванов А.В., Певгов В.Г. // Интеграл. 2011. № 59. С. 6.
Шилов И.П., Кочмарев Л.Ю., Новичихин Е.П. // Журн. мед. техника. 2020. № 6. С. 1.
Шилов И.П., Даниелян Г.Л., Маречек С.В., Кочмарев Л.Ю. // РЭ. 2021. Т. 66. № 1. С. 91.
Wu C., Bull B., Christensen K., McNeill J. // Angew. Chem. Int. Ed. 2009. V. 48. P. 2741. https://doi.org/10.1002/ange.200805894
Ivanovskaya N.P., Shilov I.P., Shchamkhalov K.S. et al. // Macroheterocycles. 2015. V. 8. № 1. P. 50. https://doi.org/10.6060/mhc140715r
Torchilin V. // Adv. Drug. Deliv. Rev. 2011. V. 63. P. 131. https://doi.org/10.1016/j.addr.2010.03.011
Дополнительные материалы отсутствуют.
Инструменты
Радиотехника и электроника


