Расплавы, 2020, № 3, стр. 291-301
Плотность расплавов KF–KCl–KI
А. О. Худорожкова a, А. В. Исаков a, *, А. А. Катаев a, А. А. Редькин a, Ю. П. Зайков a
a Институт высокотемпературной электрохимии УрО РАН
Екатеринбург, Россия
* E-mail: ihte_uran@mail.ru
Поступила в редакцию 12.01.2020
После доработки 26.01.2020
Принята к публикации 02.02.2020
Аннотация
Плотности расплавов KF–KCl–KI при мольном отношении KF/KCl равном 0.8 и 2 в зависимости от содержания KI были измерены с использованием метода гидростатического взвешивания. Измерения приводились в инертной атмосфере с использованием конструкционных материалов, устойчивых к исследуемым расплавам. Выполнено измерение плотности расплавов (45 мол. % KF–55 мол. % KCl)–KI и (66 мол. % KF–34 мол. % KCl)–KI c содержанием KI от 0 до 100% в диапазоне температур 973–1073 К. Установлено, что добавки йодида калия в расплав KF–KCl приводят к увеличению плотности. Температурные зависимости плотности расплавов были описаны при помощи линейных функций. Выявлено, что KI увеличивает коэффициент температурной зависимости плотности. Данные по плотности расплавов KF–KCl–KI были использованы для расчета молярных объемов. Представлены зависимости изменения молярного объема от температуры и состава расплавов. Найдено, что молярные объемы исследуемых расплавов близки величинам, рассчитанным по правилу аддитивности, что свидетельствует о том, что исходные соли смешиваются между собой без заметного химического взаимодействия.
ВВЕДЕНИЕ
В последнее время расплавленные среды широко используются для получения кремния и наноматериалов на его основе из различных неорганических кремниевых соединений [1–7]. В качестве источника Si в этих расплавах могут быть использованы соединения кремния SiO2, K2SiF6, SiCl4. Значительный прогресс, достигнут в направлении синтеза p–n переходов прямой электрокристаллизацией из расплавов солей [6].
Перспективными средами для синтеза новых материалов являются расплавы на основе водорастворимых галогенидов щелочных металлов. В системах KF–KCl, KF–KCl–KI могут быть синтезированы кремниевые наноматериалы заданной структуры для использования в фотоэлектрических и литий-ионных химических источниках тока [2, 5–7]. Расплавы на основе KF–KCl–KI позволяют проводить процессы получения Si при более низких температурах, чем KF–KCl расплавы [8]. Кроме этого, расплавы KF–KCl–KI за счет содержания KI и KCl будут менее агрессивны к конструкционным материалам.
Изменение состава солевой смеси позволяет менять характеристики электролита, что важно для управления процессом электрокристаллизации. В основу технологий получения кремниевых материалов из расплавов на основе KF–KCl–KI должны быть включены данные о физико-химических свойствах. Не смотря на преимущества KF–KCl–KI расплавов их свойства недостаточно исследованы.
На сегодняшний день доступны данные по температурам ликвидуса расплавленных смесей KF–KCl–KI [8, 9]. В работе [8] исследованы температуры ликвидуса тройной системы KF–KCl–KI с молярным соотношением KF/KCl 0.8 и 2 при помощи анализа кривых охлаждения и дифференциальной сканирующей калориметрии. Экспериментально показано, что в расплавах KF–KCl–KI существует эвтектика состава 25KF–34KCl–41KI (мол. %) с температурой плавления 750 K, что находится в согласии с расчетными данными [9]. Эти данные позволяют перейти к исследованию объемно-транспортных свойств.
Важными для постановки процессов получения кремния являются зависимости изменения объемных свойств – плотности и молярного объема. Зависимости изменения плотности обладают практической значимостью для разработки процессов, аппаратов и устройств. Не менее важно, что объемные свойства являются структурочувствительными и позволят расширить представления о процессах взаимодействий в расплавах.
В литературе [10] имеются данные по плотности и молярным объемам двойных смесей: KF–KCl, KF–KI, KCl–KI. Представлены расчетные значения молярных объемов двойных смесей, полученные с использованием значений плотности. Показано, что при 1100 K добавка иодида калия к KF сильнее влияет на изменение мольного объема, чем к KCl. Установлено, что в двойных системах объем моля солевых смесей увеличивается по мере роста в ней доли тяжелого аниона. Анализ результатов обобщенных в работе [10] свидетельствует о вероятном сложном взаимодействии в тройной системе KF–KCl–KI. Таким образом, плотность KF–KCl–KI расплавов должна быть измерена для того, что бы получить надежные количественные данные.
Целью данной работы является исследование плотности и изменения мольного объема расплавов KF–KCl–KI для расширения представлений о свойствах расплавов солей и формирования основ технологий получения кремниевых наноматериалов заданной структуры.
Полученные данные могут быть использованы для объяснения взаимодействий в системе KF–KCl–KI и расчетов при разработке химических процессов с привлечением этих расплавов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Измерения проводили в образцах KF–KCl–KI расплавов. Образцы расплавов для исследований предварительно готовили из индивидуальных солей по методике, описанной в работе [8]. Приготовление расплавов выполняли, используя соли: KF ⋅ HF (99.97 мас. %), KCl (99.9 мас. %) (“Реахим”), и KI (99.9 мас. %) (“Химреактивснаб”).
Хлорид калия сушили под вакуумом в течение 4 ч в контейнере из стеклоуглерода. Далее соль плавили и выдерживали в течение часа при 1073 К, затем охлаждали. Иодид калия подвергали йодированию. При помощи йодирования KI очищали от кислородных примесей. Йодирование проводили нагреванием навески KI, cмешанной с избытком кристаллического йода. Процесс вели при 723 K до испарения йода. При этом кислородные примеси удалялись согласно реакции, представленной в табл. 1 (№ 1).
Таблица 1.
Результаты расчета ΔG реакций при 723 K
| № | Химическая реакция | ΔG, кДж/моль |
|---|---|---|
| 1 | 2K2O + 2I2 = 4KI + O2↑ | –702.350 |
| 2 | KIO4 = KI + 2O2↑ | –105.730 |
| 3 | KIO3 = KI + 1.5O2↑ | –16.111 |
| 4 | 2I2 + 5O2(г) = 2I2O5 | 110.249 |
При этом согласно реакциям 2 и 3 (табл. 1) при температуре йодирования кислородные примеси в виде йодатов являются неустойчивыми. Так же предварительные расчеты (табл. 1, реакция 4) показывают, что ΔG реакции взаимодействия йода с кислородом положительна. По завершении процесса иодирования KI переплавляли и выдерживали при 1073 K в течение часа. Затем плав остужали до комнатной температуры. Плав хранили в сухом боксе.
Подготовленный хлорид калия смешивали с калием фтористым кислым в необходимом количестве и переплавляли на воздухе. Расплав KF–KCl выдерживали на воздухе в течение 3 ч. Фторид водорода удалялся из расплава вследствие термического разложения KF · HF. Далее KF–KCl расплав замораживали и направляли на приготовление расплавов. Образцы готовили сплавлением KF–KCl и KI.
Измерение плотности расплавов солей проводили методом гидростатического взвешивания (метод Архимеда), который заключается в мониторинге изменения веса платинового груза сферической формы, погружаемого в расплав согласно методике описанной в работе [11].
Схема измерительной ячейки представлена на рис. 1.
Рис. 1.
Схема установки для измерения плотность методом гидростатического взвешивания: 1 – печь сопротивления; 2 – кварцевая реторта; 3 – стеклоуглеродный контейнер; 4 – термопара; 5 – шлюз; 6 – весы; 7 – подвес; 8 – тело; 9 – подъемник.
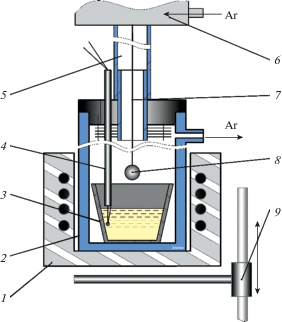
Измерительная ячейка представляла собой кварцевую реторту, снабженную пробкой из вакуумной резины, которая была соединена с пространством электронных весов “Mettler AT20”. Платиновый груз подвешивали на платиновую проволоку, длиной около 0.6 м и диаметром 0.5 мм, соединенную с электронными весами. Погружение в расплав и извлечение из расплава платинового груза производили при помощи подъемника. На этом же подъемнике была установлена печь. Все измерения проводили в атмосфере аргона 99.999% чистоты производства “Уралкриогаз”. Платиновый сферический груз последовательно взвешивали в газовой атмосфере, а затем в исследуемой расплавленной соли. Разность масс груза в газовой атмосфере и в расплаве, отнесенная к объему груза, позволяет найти плотность расплава солей. Расчет плотности производили согласно уравнению:
где ρ – плотность расплава, кг/м3; m1– масса не погруженного груза, г; m2 – масса погруженного груза, кг; V – объем груза, м3.РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Изучение плотности проводили в расплавах KF–KCl–KI с разным мольным соотношением KF/KCl. Измерения проводили с двумя молярными отношениями KF/KCl, мол. %: (45KF–55KCl) (KF/KCl = 0.8) и (66.7KF–33.3KCl) (KF/KCl = 2). Плотность измерялась в интервале от 973 до 1073 К, для всех составов. Температурные и концентрационные зависимости плотности регистрировали при разных концентрациях KI. На рис. 2 представлены температурные зависимости (45 мол. % KF–5 мол. % KCl)–KI.
Рис. 2.
Зависимость плотности расплавленных солевых систем (45 мол. % KF–55 мол. % KCl)–KI от температуры при содержании KI, мол. %: 1 – 0; 2 – 10; 3 – 30; 4 – 50; 5 – 75; 6 – 80; 7 – 90; 8 – 100.
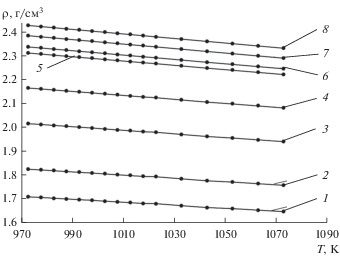
Установлено, что добавки KI в расплав (45 мол. % KF–55 мол. % KCl) приводят к увеличению плотности. Увеличение содержания KI в составе расплавов KF–KCl–KI приводят к росту значений плотности. Результаты демонстрируют, что наиболее значительно на плотность влияют добавки от 0–75 мол. % (кривые 1–5, рис. 2).
Установлено, что зависимости (рис. 2) изменения плотности для представленного диапазона температур могут быть аппроксимированы линейными уравнениями: $\rho = a - b \cdot T.$ Коэффициенты a и b для системы эвтектического состава представлены в табл. 2.
Таблица 2.
Коэффициенты температурных зависимостей плотности [45 мол. % KF–55 мол. % KCl]–KI расплавов
| № | Состав мол. % | $\rho = a - b \cdot T$ (К), г/см3 | Диапазон применимости, К | |||
|---|---|---|---|---|---|---|
| KF | KCl | KI | а | b · 103 | ||
| 1* | 45.00 | 55.00 | – | 2.3240 | 0.63 | |
| 2* | 40.50 | 49.50 | 10 | 2.4890 | 0.68 | |
| 3* | 31.50 | 38.50 | 30 | 2.7570 | 0.76 | |
| 4* | 22.50 | 27.50 | 50 | 2.9750 | 0.83 | 973–1073 |
| 5* | 11.25 | 13.75 | 75 | 3.1901 | 0.90 | |
| 6* | 9.00 | 11.00 | 80 | 3.2240 | 0.91 | |
| 7* | 4.50 | 5.50 | 90 | 3.2910 | 0.93 | |
| 8* | – | – | 100 | 3.3640 | 0.96 | |
* – номера соответствуют кривым на рис. 2.
На рис. 3 представлены изотермы плотности расплава (45 мол. % KF–55 мол. % KCl–KI) в зависимости от содержания KI. Показано, что плотность расплавов снижалась при увеличении температуры.
Рис. 3.
Зависимости плотности (45 мол. % KF–55 мол. % KCl)–KI расплавов от содержания KI при, K: ◼ – 973; ⚫ – 1023; ▲ –1073.
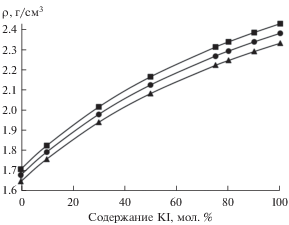
На рис. 4 представлена зависимость плотности расплава (66.6 мол. % KF–33.4 мол. % KCl)–KI от температуры с отношением KF/KCl равным 2.
Рис. 4.
Зависимость плотности расплавленных солевых систем (66.6 мол. % KF–33.4 мол. % KCl)–KI от температуры, при содержании KI, мол. %: 1 – 0; 2 – 10; 3 – 30; 4 – 50; 5 – 75; 6 – 80; 7 – 90; 8 – 100.

Показано, что добавки KI к расплаву (66.6 мол. % KF–33.4 мол. % KCl) с мольным соотношением KF/KCl равным 2 при водят к увеличению плотности. Установлено, что для расплавов систем KF–KCl–KI с мольным соотношением KF/KCl равным 0.8 и 2 плотность расплавов возрастает с увеличением концентрации KI. Выявлено, что зависимости изменения плотности для расплавов (66.6 мол. % KF–33.4 мол. % KCl)–KI также, как и для (45 мол. % KF–55 мол. % KCl)– KI расплавов могут быть аппроксимированы линейными уравнениями в температурном диапазоне применимости. Коэффициенты температурных зависимостей плотности расплавов (66.6 мол. % KF–33.4 мол. % KCl)–KI представлены в табл. 3.
Таблица 3.
Температурные зависимости плотности системы [66.6 мол. % KF–33.4 мол. % KCl]–KI
| № | мол. % | $\rho = a - b \cdot T$ (К), г/см3 | Диапазон применимости, К | |||
|---|---|---|---|---|---|---|
| KF | KCl | KI | а | b · 103 | ||
| 1* | 66.6 | 33.40 | 0 | 2.436 | 0.62 | 973–1073 |
| 2* | 60.0 | 30.00 | 10 | 2.592 | 0.67 | |
| 3* | 46.6 | 23.40 | 30 | 2.845 | 0.76 | |
| 4* | 33.3 | 16.70 | 50 | 3.037 | 0.83 | |
| 5* | 16.7 | 8.30 | 75 | 3.219 | 0.90 | |
| 6* | 13.3 | 6.70 | 80 | 3.247 | 0.91 | |
| 7* | 6.66 | 3.44 | 90 | 3.313 | 0.94 | |
| 8* | – | – | 100 | 3.364 | 0.96 | |
* – номера соответствуют кривым на рис. 4.
Установлено, что для расплавов (66.6 мол. % KF–33.4 мол. % KCl)–KI наиболее значительное изменение плотности происходит добавках KI вплоть до 75 мол. %. Это свидетельствует об определяющем вкладе содержания ионов I– в свойства расплавов KF–KCl–KI.
На рис. 5 представлены изотермы плотности расплава (66.6 мол. % KF–33.4 мол. % KCl)–KI в зависимости от содержания KI.
Рис. 5.
Зависимости плотности (66.6 мол. % KF–33.4 мол. % KCl)–KI расплавов от содержания KI при, K: ◼ – 973; ⚫ – 1023; ▲ –1073.
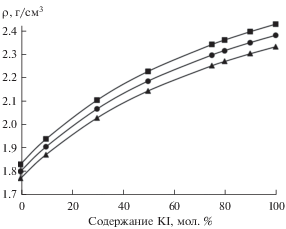
Показано, что повышение температуры приводит к снижению плотности расплавов (66.6 мол. % KF–33.4 мол. % KCl)–KI.
На рис. 6 представлены зависимости изменения плотности (45 мол. % KF–55 мол. % KCl)–KI и (66.6 мол. % KF–33.4 мол. % KCl)–KI расплавов при 988 K.
Рис. 6.
Влияние KI на плотность расплавленных солевых систем при 998 K: ▲ – 66.6 мол. % KF–33.4 мол. % KCl; ⚫ – 45 мол. % KF–55 мол. % KCl.
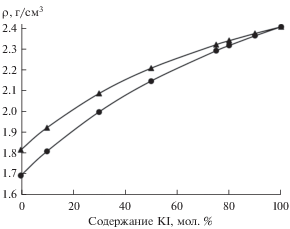
Установлено, что добавка KI в изотермических условиях повышает плотность расплавов системы KF–KCl–KI не линейно. Кривые на рис. 6 сходятся в одной точке соответствующей фазе KI.
Анализ данных показывает, что плотность расплавов KF–KCl–KI снижается по мере увеличения в них тяжелых анионов.
Информацию о строении смеси можно получить из свойств мольного объема. Данные по плотности использовали для расчета мольных объемов.
В целях оптимизации расчетов, исследованные расплавы рассматривали как квази-бинарные. Две квази-бинарные системы были рассмотрены с мольным соотношением KF/KCl 0.8 и 2: (45 мол. % KF–55 мол. % KCl)–KI и (66.6 мол. % KF–33.4 мол. % KCl)–KI. Такой подход позволяет вычислить молярный объем из экспериментально измеренных плотностей (ρexp) и молярной массы каждого компонента (Mi), по уравнению:
(2)
${{V}_{m}} = \frac{{{{x}_{1}} \cdot {{M}_{1}} + {{x}_{2}} \cdot {{M}_{2}}}}{{{{\rho }_{{\exp }}}}},$Мольные объемы исследуемых систем для трех температур представлены в табл. 4, 5.
Таблица 4.
Мольные объемы тройных расплавленных смесей [45 мол. % KF–55 мол. % KCl]–KI
| № | мол. % | V, см3 · моль–1 (Т = 973 К) |
V, см3 · моль–1 (Т = 998 К) |
V, см3 · моль–1 (Т = 1023 К) |
||
|---|---|---|---|---|---|---|
| KF | KCl | KI | ||||
| 1 | 45.00 | 55.00 | – | 39.270 | 39.603 | 39.940 |
| 2 | 40.50 | 49.50 | 10 | 42.176 | 42.543 | 42.916 |
| 3 | 31.50 | 38.50 | 30 | 47.987 | 48.424 | 48.867 |
| 4 | 22.50 | 27.50 | 50 | 53.798 | 54.302 | 54.819 |
| 5 | 11.25 | 13.75 | 75 | 61.062 | 61.655 | 62.258 |
| 6 | 9.00 | 11.00 | 80 | 62.515 | 63.125 | 63.746 |
| 7 | 4.50 | 5.50 | 90 | 65.421 | 66.065 | 66.722 |
| 8 | – | – | 100 | 68.327 | 69.005 | 69.695 |
Таблица 5.
Мольные объемы тройных расплавленных смесей [66.6 мол. % KF–33.4 мол. % KCl]–KI
| № | мол. % | V, см3 · моль–1 (Т = 973 К) |
V, см3 · моль–1 (Т = 998 К) |
V, см3 · моль–1 (Т = 1023 К) |
||
|---|---|---|---|---|---|---|
| KF | KCl | KI | ||||
| 1 | 66.60 | 33.40 | – | 34.690 | 34.967 | 35.275 |
| 2 | 60.00 | 30.00 | 10 | 38.053 | 38.371 | 38.717 |
| 3 | 46.60 | 23.40 | 30 | 44.781 | 45.178 | 45.601 |
| 4 | 33.30 | 16.70 | 50 | 51.508 | 51.986 | 52.486 |
| 5 | 16.70 | 8.30 | 75 | 59.917 | 60.496 | 61.092 |
| 6 | 13.30 | 6.70 | 80 | 61.599 | 62.198 | 62.813 |
| 7 | 6.66 | 3.44 | 90 | 64.963 | 65.601 | 66.255 |
| 8 | – | – | 100 | 68.327 | 69.005 | 69.697 |
Табличные значения были обобщены и на рис. 7 представлен график зависимости KI на мольный объем в сравнении для расплавов (45 мол. % KF–55 мол. % KCl)–KI и (66.6 мол. % KF–33.4 мол. % KCl)–KI при 998 K.
Рис. 7.
Влияние добавок KI на мольный объем расплавленных солевых систем: ▲ – 45 мол. % KF–55 мол. % KCl; ⚫ – 66.6 мол. % KF–33.4 мол. % KCl при температуре 998 К.
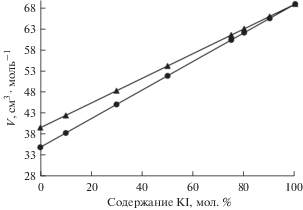
Показано, что в системе KF–KCl–KI объем моля солевых смесей увеличивается по мере роста в ней доли тяжелого аниона.
Согласно автокомплексной модели строения ионных расплавов [12] комплексные частицы представляют собой частицы типа ${\text{RX}}_{4}^{{3 - }},$ где R – катион щелочного металла, X – анионы. Таким образом, галогенидные расплавы представляют собой систему, состоящую из комплексных частиц и свободных ионов. Структура ${\text{RX}}_{4}^{{3 - }}$ определяется тем, что катионы, имея меньшие размеры, обладают большим ионным моментом. Для фторида калия эта схема выглядит иначе, поскольку ионный радиус калия больше ионного радиуса фтора. В этом случае комплексная частица выглядит так ${\text{FK}}_{4}^{{3 - }}$ [13].
При замене ионов фтора на другие анионы при концентрациях фторида калия больше 50 мол. % происходит образование комплексов классического типа наряду с комплексами, содержащими фтор в качестве центральной частицы. По этой причине наибольшие отклонения мольного объема в системах, состоящих из галогенидов калия, наблюдаются в системе KF–KJ [14] в силу значительной разницы в радиусах анионов.
В нашем случае, мы имеем дело с системами (66.6 мол. % KF–33.4 мол. % KCl) и (45 мол. % KF–55 мол. % KCl), в которых замена комплексов с центральным анионом на комплексы с центральным катионом уже почти завершена, поэтому замена аниона хлора в комплексе на анион йода уже существенно не влияет на энергию комплекса, и по этой причине изменение мольного объема носит аддитивный характер.
ВЫВОДЫ
Измерена плотность расплавов (66.6 мол. % KF–33.4 мол. % KCl )–KI и (45 мол. % KF– 55 мол. % KCl)–KI в зависимости от добавок KI (0–100 мол. %).
Показано, что добавки KI приводит к увеличению плотности расплавов. Установлено, что добавка KI в изотермических условиях повышает плотность расплавов системы KF–KCl–KI не линейно.
Рассчитан мольный объем исследованных KF–KCl–KI расплавов. Для исследованных составов систем мольный объем меняется аддитивно при добавлении KI.
Показано, что в системе KF–KCl–KI объем моля солевых смесей увеличивается по мере роста в ней доли тяжелого аниона.
Работа выполнена при финансовой поддержке РФФИ, проект № 19-33-90154.
Список литературы
Kuznetsov S.V., Dolmatov V.S., Kuznetsova S.A. // Russ. J. Electrochem. 2009. 45. № 7. P. 742–748. https://doi.org/10.1134/S1023193509070052
Isakov A.V., Zhang X., Jiang S., Zaykov Yu. P. // Tstevn. Met. 2017. 11. P. 49–54. https://doi.org/10.17580/tsm.2017.11.09
Peng J., Yin H., Zhao J., Yang X., Bard A.J., Sadoway D.R. // Advanced Functional Mater. 2018. 28. № 1703551. P. 1–6. https://doi.org/10.1002/adfm.201703551
Yang X., Ji L., Zou X., Lim T., Zhao J., Yu E.T., Bard A.J. // Angewandte Chemie. 2017. 56. № 47. P. 15078–15082. https://doi.org/10.1002/anie.201707635
Зайков Ю.П., Жук С.И., Исаков А.В., Гришенкова О.В., Исаев В.А. Электроосаждение кремния из расплава KF–KCl–KI–K2SiF6 // Расплавы. 2016. № 5. С. 441–445.
Zou X., Ji L., Ge J., Sadoway D.R., Yu E.T., Bard A.J. // Nature Communications. 2019. 10. № 5772. https://doi.org/10.1038/s41467-019-13065-w
Yasuda K., Maeda K., Nohira T., Hagiwara R., Homma T. // J. Electrochem. Soc. 2016. 163. D95–D99. https://doi.org/10.1149/2.0441509jes
Khudorozhkova A.O., Isakov A.V., Red’kin A.A., Zaikov Y.P. // Russian Metallurgy. 2019. № 8. P. 830–834. https://doi.org/10.1134/s0036029519080081
Sangster J.M., Pelton A.D. Critical Coupled Evaluation of Phase Diagrams and Their Thermodynamic Properties of Binary and Ternary Alkali Salt Systems. Special Report to the Phase Equilibria Program, Part D: The 60 Ternary Common-Ion Systems Involving (Li, Na, K, Rb, Cs) and (F, Cl, Br, I) //American Ceramic Soc. Westerville, Ohio. 1987. P. 2–181.
Минченко М.В., Степанов В.П. Ионные расплавы: упругие и калорические свойства. Екатеринбург: УрО РАН. 2008. С. 338.
Zaikov Yu.P., Redkin A.A., Apisarov A.A., Korzun I.V., Kulik N.P., Isakov A.V., Kataev A.A., Chemezov O.V. // J. Chem. Eng. Data. 2011. 58. № 4. P. 932–937. https://doi.org/10.1021/je301195x
Смирнов М.В., Шабанов О.М., Хайменов А.П. Структура расплавленных солей // Электрохимия. 1966. 2. № 11. С. 1240.
Смирнов М.В., Шумов Ю.А., Хохлов В.А. Электропроводность расплавленных фторидов щелочных металлов // Труды Института Электрохимии. 1972. № 18. С. 3–9.
Смирнов М.В., Шумов Ю.А., Хохлов В.А., Степанов В.П., Носкевич Е.В., Антоненко А.П. Плотность и электропроводность расплавленных смесей галогенидов калия металлов // Труды Института Электрохимии. 1972. № 20. С. 8–11.
Дополнительные материалы отсутствуют.


