Расплавы, 2020, № 3, стр. 313-327
Фазовые равновесия для Pb–Bi сплава при вакуумной дистилляции
А. А. Королев a, b, К. Л. Тимофеев a, b, Г. И. Мальцев a, b, *
a Акционерное общество “Уралэлектромедь”
Верхняя Пышма, Россия
b Негосударственное частное образовательное учреждение высшего образования
“Технический университете УГМК”
Верхняя Пышма, Россия
* E-mail: mgi@elem.ru
Поступила в редакцию 06.09.2019
После доработки 15.10.2019
Принята к публикации 29.10.2019
Аннотация
При обезвисмучивании свинца образуется Pb–Bi продукт, требующий комплексной переработки, с получением товарных моноэлементных материалов. Одним из возможных способов переработки является вакуумная перегонка, считающаяся одним из самых эффективных и экологически чистых методов для разделения и очистки, переработки и рафинирования различных металлов. Для предварительного выбора температуры и давления системы, оценки эффективности разделения компонентов при вакуумной перегонке используют фазовые диаграммы. Цель работы состоит в расчете равновесных состояний “газ–жидкость” VLE (vapor liquid equilibrium), включая зависимости состава фаз от температуры (Т–х) при заданном давлении для бинарных сплавов Pb–Bi при вакуумной перегонке на основе моделей MIVM (мolecular interaction volume model) и упрощенной – SMIVM (simple мolecular interaction volume model), включающей меньшее число изменяющихся параметров системы, в частности, при фиксированных значениях координационных чисел Zi и молекулярного объема Vmi компонентов сплавов. В результате подтверждена адекватность модели SMIVM в используемом расчетном методе. На фазовых диаграммах VLE кривые паровой и жидкой фаз расположены достаточно близко друг к другу, потому что разница между температурами кипения Bi (1837 К) и Pb (2022 К) составляет всего 185 K. Исходя из T–x и Р–x диаграмм, даже при небольшом исходном содержании свинца (1–10 мол. % Pb) в составе Pb–Bi сплава в Bi-конденсат переходит 36–51% свинца при заданном давлении 13.3–1330 Па и температуре 1093–1418 К или при фиксированных значениях температуры 1073–1473 К и давлении 8–2600 Па. Следовательно, качественно разделить сплав Pb–Bi обычной дистилляцией или фракционированием в одну стадию не представляется возможным, поскольку Pb и Bi испаряются практически одновременно в газовую фазу при нагревании сплава в вакууме. Для эффективного разделения Pb–Bi сплава должен использоваться процесс подобный ректификации, осуществляемый в вакуумных аппаратах с вертикальной насадкой, состоящей из большого числа испарительных тарелей, и градиентом температур по высоте. Жидкая фаза сплава, подаваемая на верхнюю тарель с минимально заданной предварительно обоснованной температурой, по мере продвижения вниз и увеличения температуры расплава будет обогащаться трудно возгоняемым компонентом сплава, а движущаяся ей навстречу газовая фаза – легко возгоняемым металлом, который конденсируется в составе возгона в верхнем сегменте насадки.
ВВЕДЕНИЕ
На металлургических предприятиях производят большое количество сплавов на основе свинца, которые представляют интерес для их разделения и повторного использования [1]. Поскольку свинец широко используют для изготовления батарей, сплавов и средств защиты от радиоактивного рентгеновского излучения, то эффективное извлечение и повторное использование свинца и других сопутствующих металлов является актуальной задачей. Также в производстве тяжелых металлов при обезвисмучивании свинца образуются Pb–Bi-дроссы, при переплавке которых (осуществляемой обычно в котлах при 450–600°С под слоем щелочного или солевого флюса) получают висмутистый свинец с содержанием 5–20% висмута [2]. Вакуумная дистилляция признана передовой технологией [3], используемой для разделения компонентов различных отработанных сплавов вследствие короткой продолжительности процесса, низкого энергопотребления и отсутствия электрического потенциала (в отличие от других традиционных методов плавки, таких как пиро- и электро-рафинирование. Равновесие “газ–жидкость” (VLE) описывает распределение химического вещества между газовой и жидкой фазами, поэтому адекватные данные VLE имеют важное значение для проектирования и эксплуатации различных процессов, в частности для вакуумной перегонки отработанных сплавов. На протяжении десятилетий большое число исследований в химической технологии было посвящено экспериментальному определению данных VLE для бинарных и многокомпонентных систем в силу их важного практического использования. Однако выявление параметров для различных сплавов оказалось достаточно трудоемким вследствие высоких температур, низкого давления в системе и особых характеристик паров металлов, таких как плохая текучесть и сильная адгезивность. Альтернативным, более удобным и экономичным вариантом является модельное прогнозирование данных для VLE различных сплавов.
Для расчета параметров VLE обычно используют уравнения коэффициентов активности согласно объемной модели молекулярного взаимодействия (MIVM), которая считается одной из наиболее адекватных для прогнозирования термодинамических свойств многокомпонентных растворных систем с использованием только обычных физических количеств чистых жидких металлов и связанная с ними активность бинарных коэффициентов для бесконечно разбавленных систем [4, 5]. В ряде предыдущих исследований [6–9] MIVM использовали для прогнозирования термодинамических свойств сплавов, с констатацией их надежности для различных цветных металлов – компонентов сплавов. Поскольку процесс расчета MIVM является относительно сложным, особенно расчет первых координационных чисел Zi и молекулярного объема Vmi компонентов сплавов, использовали метод прогнозирования, включающий меньшее число параметров системы, так называемый упрощенный MIVM или SMIVM. Таким образом, в данной работе активность компонентов сплавов Pb–Bi и фазовые диаграммы VLE были рассчитаны с использованием двух моделей – MIVM и SMIVM. Основной целью настоящего исследования является подтверждение адекватности модели SMIVM ранее использованной модели MIVM в расчетном методе, который позволит достаточно точно и быстро определять VLE при вакуумной перегонке. Фазовые диаграммы VLE, полученные в этом исследовании, обеспечивают интуитивно понятный и простой способ прогнозирования распределения компонентов Pb–Bi сплавов между фазами, в зависимости от состава изделий, температуры и давления в системе вакуумной перегонки. Оптимальные параметры процесса можно оперативно получить из VLE фазовых диаграмм.
МЕТОД РАСЧЕТА
Расчет VLE
Летучесть (фугитивность) каждого компонента в газовой и жидкой фазах равны, когда система достигает равновесия. Соотношение общего равновесия для VLE может быть выражено следующим образом [10]:
(1)
$\phi _{i}^{ \wedge }({{y}_{i}}p) = \phi _{i}^{{{\text{sat}}}}({{x}_{i}}{{\gamma }_{i}})\exp \left[ {\frac{{V_{i}^{L}\left( {P - P_{i}^{{{\text{sat}}}}} \right)}}{{RT}}} \right],$При низком давлении (p ≤ 1330 Па), используемом в данном исследовании, коэффициент Пойнтинга exp$\left[ {\frac{{V_{i}^{L}(P - P_{i}^{{{\text{sat}}}})}}{{RT}}} \right]$ ≈ 1. В добавлении, газовая фаза может рассматриваться как идеальный газ и зависимостью фугитивности жидкой фазы от давления можно пренебречь. Уравнение (1) может быть выражено следующим образом:
Если жидкая смесь идеальна, то по закону Рауля γi = 1. Для бинарного сплава i–j:
(4)
$p = р_{i}^{{{\text{sat}}}}{{\gamma }_{i}}{{x}_{i}} + р_{j}^{{{\text{sat}}}}{{\gamma }_{j}}{{x}_{j}} = р_{i}^{{{\text{sat}}}}{{\gamma }_{i}}{{x}_{i}} + р_{j}^{{{\text{sat}}}}{{\gamma }_{j}}(1 - {{x}_{i}}).$Из уравнений (2) и (4) можно выразить xi и уi , как:
Упрощенный MIVM (SMIVM)
MIVM считается одной из наиболее удобных и надежных моделей [11–13]. Однако, до сих пор ее практическое применение было затруднено из-за сложного процесса расчета координационных чисел (Z) и отсутствия молярных объемов в жидком состоянии ($V_{i}^{L}$) некоторых компонентов (например, С, Ta, V2O5, Cu2S, CaSiO3). Упрощение MIVM достигнуто путем придания обоим Zi и Zj значений, равных 10, и заменой молярного объема i-компонента в жидком состоянии на его молярный объем в твердом состоянии (Vi) [14, 15].
При расчете VLE коэффициент активности компонента в жидкой фазе является существенным параметром. Согласно MIVM, молярный избыток энергии Гиббса $~G_{m}^{E}$ жидкой смеси i–j может быть выражена как [16, 17]:
(6)
$\begin{gathered} \frac{{G_{m}^{E}}}{{RT}} = {{x}_{i}}\ln \left( {\frac{{{{V}_{{mi}}}}}{{{{x}_{i}}{{V}_{{mi}}} + {{x}_{j}}{{V}_{{mj}}}{{B}_{{ji}}}}}} \right) + {{x}_{j}}\ln \left( {\frac{{{{V}_{{mj}}}}}{{{{x}_{j}}{{V}_{{mj}}} + {{x}_{i}}{{V}_{{mi}}}{{B}_{{ij}}}}}} \right) - \\ - \,\,\frac{{{{x}_{i}}{{x}_{j}}}}{2}\left( {\frac{{{{Z}_{i}}{{B}_{{ji}}}{\text{ln}}{{B}_{{ji}}}}}{{{{x}_{i}} + {{x}_{j}}{{B}_{{ji}}}}} + \frac{{{{Z}_{j}}{{B}_{{ij}}}{\text{ln}}{{B}_{{ij}}}}}{{{{x}_{j}} + {{x}_{i}}{{B}_{{ij}}}}}} \right), \\ \end{gathered} $(7)
${{B}_{{ij}}} = {\text{ехр}}\left[ { - \left( {\frac{{{{\varepsilon }_{{ij}}} - {{\varepsilon }_{{jj}}}}}{{kT}}} \right)} \right],\,\,\,\,{{B}_{{ji}}} = {\text{ехр}}\left[ { - \left( {\frac{{{{\varepsilon }_{{ji}}} - {{\varepsilon }_{{ii}}}}}{{kT}}} \right)} \right],$Координационное число определяли следующим образом [18]:
(8)
${{Z}_{i}} = \frac{{4\sqrt {2\pi } }}{3}\left( {\frac{{r_{{mi}}^{3} - r_{{oi}}^{3}}}{{{{r}_{{mi}}} - {{r}_{{oi}}}}}} \right){{\rho }_{i}}{{r}_{{mi}}}{\text{exp}}\left( {\frac{{\Delta {{H}_{{mi}}}\left( {{{T}_{{mi}}} - T} \right)}}{{{{Z}_{c}}RT{{T}_{{mi}}}}}} \right),$Для бинарной смеси i–j, с помощью термодинамического соотношения (${{\partial G_{m}^{E}} \mathord{\left/ {\vphantom {{\partial G_{m}^{E}} {\partial {{x}_{i}}}}} \right. \kern-0em} {\partial {{x}_{i}}}}$)T, p, xj ≠ i, коэффициенты активности i- и j-компонентов могут быть получены из уравнения (6), соответственно, как:
(9)
$\begin{gathered} {\text{ln}}{{\gamma }_{i}} = \ln \left( {\frac{{{{V}_{{m,i}}}}}{{{{x}_{i}}{{V}_{{m,i}}} + {{x}_{j}}{{V}_{{m,j}}}{{B}_{{ji}}}}}} \right) + {{x}_{j}}\left( {\frac{{{{V}_{{m,j}}}{{B}_{{ji}}}}}{{{{x}_{i}}{{V}_{{m,i}}} + {{x}_{j}}{{V}_{{m,j}}}{{B}_{{ji}}}}} - \frac{{{{V}_{{m,i}}}{{B}_{{ij}}}}}{{{{x}_{j}}{{V}_{{m,j}}} + {{x}_{i}}{{V}_{{m,i}}}{{B}_{{ij}}}}}} \right) - \\ - \,\,\frac{{x_{j}^{2}}}{2}\left[ {\frac{{{{Z}_{i}}B_{{ji}}^{2}{\text{ln}}{{B}_{{ji}}}}}{{{{{({{x}_{i}} + {{x}_{j}}{{B}_{{ji}}})}}^{2}}}} + \frac{{{{Z}_{j}}B_{{ij}}^{2}{\text{ln}}{{B}_{{ij}}}}}{{{{{({{x}_{j}} + {{x}_{i}}{{B}_{{ij}}})}}^{2}}}}} \right], \\ \end{gathered} $(10)
$\begin{gathered} {\text{ln}}{{\gamma }_{j}} = \ln \left( {\frac{{{{V}_{{m,j}}}}}{{{{x}_{j}}{{V}_{{m,j}}} + {{x}_{i}}{{V}_{{m,i}}}{{B}_{{ij}}}}}} \right) + {{x}_{i}}\left( {\frac{{{{V}_{{m,i}}}{{B}_{{ij}}}}}{{{{x}_{j}}{{V}_{{m,j}}} + {{x}_{i}}{{V}_{{m,i}}}{{B}_{{ij}}}}} - \frac{{{{V}_{{m,j}}}{{B}_{{ji}}}}}{{{{x}_{i}}{{V}_{{m,i}}} + {{x}_{j}}{{V}_{{m,j}}}{{B}_{{ji}}}}}} \right) - \\ - \,\,\frac{{x_{i}^{2}}}{2}\left[ {\frac{{{{Z}_{j}}B_{{ij}}^{2}{\text{ln}}{{B}_{{ij}}}}}{{{{{({{x}_{j}} + {{x}_{i}}{{B}_{{ij}}})}}^{2}}}} + \frac{{{{Z}_{i}}B_{{ji}}^{2}{\text{ln}}{{B}_{{ji}}}}}{{{{{({{x}_{i}} + {{x}_{j}}{{B}_{{ji}}})}}^{2}}}}} \right]. \\ \end{gathered} $Необходимые двоичные параметры Bij и Bji могут быть рассчитаны из уравнений (10) и (11) с помощью метода Ньютона–Рафсона, если коэффициенты активности бесконечного разбавления, а именно: $\gamma _{i}^{\infty }$ и $\gamma _{j}^{\infty }$ бинарных жидких сплавов и соответствующие параметры их компонентов, например, Vmi и Zi доступны.
Значения Bij и Bji при любой температуре могут быть рассчитаны из уравнения (11) предполагая, что $ - \left( {\frac{{{{\varepsilon }_{{ij}}} - {{\varepsilon }_{{jj}}}}}{k}} \right)$ и $ - \left( {\frac{{{{\varepsilon }_{{ji}}} - {{\varepsilon }_{{ii}}}}}{k}} \right)$ в уравнении (7) не зависимы от температуры:
(11)
${{B}_{{ij}}}_{{\left( 2 \right)}} = {\text{ }}{{({{B}_{{ij}}}_{{\left( 1 \right)}})}^{{{{T(1)} \mathord{\left/ {\vphantom {{T(1)} {T(2)}}} \right. \kern-0em} {T(2)}}}}};\,\,\,\,{{B}_{{ji}}}_{{\left( 2 \right)}} = {\text{ }}{{({{B}_{{ji}}}_{{\left( 1 \right)}})}^{{T\left( 1 \right)/T\left( 2 \right)}}}.$Координационное число Zi жидких металлов может быть рассчитано из уравнения (8), однако, это несколько сложнее, поскольку ряда параметров, включая молекулярные объемы для некоторых компонентов, нет в литературе. Следовательно, упрощение MIVM необходимо для расширения области его применения, поскольку метод прогнозирования, включающий только некоторые параметры, является очень нужным.
Фактически, в решеточной теории растворов Z имеет одно и то же постоянное значение между 6 и 12. Кроме того, Z ≈ 10 для типичных жидкостей в обычных условиях [11, 15, 17, 19]. Установлено, что разница между координационными числами компонентов незначительно влияет на точность прогнозирования MIVM [11]. Однако лучшие результаты получены, когда Z близко к 10. Таким образом, в целях упрощения MIVM значения Zi и Zj могут быть равны 10. Кроме того, молярный объем i-компонента в жидком состоянии Vmi может быть заменен его молярным объемом в твердом состоянии Vi [11, 12], поскольку разность плотностей для вещества между жидким и твердым состояниями небольшая, то уравнение (7) можно упростить:
(12)
$\frac{{G_{m}^{E}}}{{RT}} = {{x}_{i}}\ln \left( {\frac{{{{V}_{i}}}}{{{{x}_{i}}{{V}_{i}} + {{x}_{j}}{{V}_{j}}{{B}_{{ji}}}}}} \right) + {{x}_{j}}\ln \left( {\frac{{{{V}_{j}}}}{{{{x}_{j}}{{V}_{j}} + {{x}_{i}}{{V}_{i}}{{B}_{{ij}}}}}} \right) - 5{{x}_{i}}{{x}_{j}}\left( {\frac{{{{B}_{{ji}}}{\text{ln}}{{B}_{{ji}}}}}{{{{x}_{i}} + {{x}_{j}}{{B}_{{ji}}}}} + \frac{{{{B}_{{ij}}}{\text{ln}}{{B}_{{ij}}}}}{{{{x}_{j}} + {{x}_{i}}{{B}_{{ij}}}}}} \right).$Уравнения (9) и (10) также можно упростить до (13) и (14):
(13)
$\begin{gathered} {\text{ln}}{{\gamma }_{i}} = 1 + \ln \left( {\frac{{{{V}_{i}}}}{{{{x}_{i}}{{V}_{i}} + {{x}_{j}}{{V}_{j}}{{B}_{{ji}}}}}} \right)--\left( {\frac{{{{x}_{i}}{{V}_{i}}}}{{{{x}_{i}}{{V}_{i}} + {{x}_{j}}{{V}_{j}}{{B}_{{ji}}}}} + \frac{{{{x}_{j}}{{V}_{i}}{{B}_{{ij}}}}}{{{{x}_{j}}{{V}_{j}} + {{x}_{i}}{{V}_{i}}{{B}_{{ij}}}}}} \right) - \\ - \,\,5x_{j}^{2}\left( {\frac{{B_{{ji}}^{2}{\text{ln}}{{B}_{{ji}}}}}{{{{{({{x}_{i}} + {{x}_{j}}{{B}_{{ji}}})}}^{2}}}} + \frac{{B_{{ij}}^{2}{\text{ln}}{{B}_{{ij}}}}}{{{{{({{x}_{j}} + {{x}_{i}}{{B}_{{ij}}})}}^{2}}}}} \right), \\ \end{gathered} $(14)
$\begin{gathered} {\text{ln}}{{\gamma }_{j}} = 1 + \ln \left( {\frac{{{{V}_{j}}}}{{{{x}_{j}}{{V}_{j}} + {{x}_{i}}{{V}_{i}}{{B}_{{ij}}}}}} \right)--\left( {\frac{{{{x}_{j}}{{V}_{j}}}}{{{{x}_{j}}{{V}_{j}} + {{x}_{i}}{{V}_{i}}{{B}_{{ij}}}}} + \frac{{{{x}_{i}}{{V}_{j}}{{B}_{{ji}}}}}{{{{x}_{i}}{{V}_{i}} + {{x}_{j}}{{V}_{j}}{{B}_{{ji}}}}}} \right) - \\ - \,\,5x_{i}^{2}\left( {\frac{{B_{{ij}}^{2}{\text{ln}}{{B}_{{ij}}}}}{{{{{({{x}_{j}} + {{x}_{i}}{{B}_{{ij}}})}}^{2}}}} + \frac{{B_{{ji}}^{2}{\text{ln}}{{B}_{{ji}}}}}{{{{{({{x}_{i}} + {{x}_{j}}{{B}_{{ji}}})}}^{2}}}}} \right). \\ \end{gathered} $Уравнения (13), (14) SMIVM не содержат координационного числа чистого компонента, что делает ее более удобной, по сравнению с MIVM.
Давление насыщенных паров
Давление насыщенных паров чистых компонентов, необходимое для расчета VLE, может быть получено следующим образом [3–5]:
где psat – давление насыщенных паров чистого компонента в Па; T – абсолютное значение температуры в Кельвинах; коэффициенты A–D являются константами испарения (табл. 1) [20].Таблица 1.
Значения $\gamma _{i}^{\infty },$ $\gamma _{j}^{\infty },$ ${{B}_{{ij}}},$ ${{B}_{{ji}}},$ $p_{i}^{{{\text{sat}}}},$ $p_{j}^{{{\text{sat}}}},$ ${{Z}_{{i,j}}},$ Vi, j сплава Pb–Bi
| Т, К | $\gamma _{{{\text{Pb}}}}^{\infty }$ | $\gamma _{{{\text{Bi}}}}^{\infty }$ | ${{Z}_{{{\text{Pb,\;Bi}}}}}$ | ${{B}_{{{\text{Pb}} - {\text{Bi}}}}}$ | ${{B}_{{{\text{Bi}} - {\text{Pb}}}}}$ | |
|---|---|---|---|---|---|---|
| Металл | 650 | 0.331 | 0.421 | 10.0 | 1.3185 | 0.8602 |
| А | В | С | D | Vi, j ·10–6 м3/моль | ||
| Pb | –10 130 | –0.985 | – | 13.28 | 18.17 | |
| Bi | –10 400 | –1.26 | – | 14.47 | 21.30 | |
Для проверки адекватности расчетных значений содержания компонентов сплавов в жидкой и газовой фазах, полученных по модели SMIVM сравнили их c данными, полученными по модели MIVM. Для этого были вычислены показания среднего относительного отклонения (${{S}_{i}}$) и среднего квадратичного отклонения ($S_{i}^{*}$):
(16)
${{S}_{i}} = \pm \frac{{100}}{n}\sum\limits_{i = 1}^n {\left| {\frac{{х{{{\left( у \right)}}_{{i,SMIVM}}} - х{{{\left( у \right)}}_{{i,MIVM}}}}}{{х{{{\left( у \right)}}_{{i,SMIVM}}}}}} \right|} \,\, \cdot \,\,100~\% ,$(17)
$S_{i}^{*} = ~~ \pm {{\left[ {\frac{1}{n}\sum\limits_{i = 1}^n {{{{\left[ {х{{{\left( у \right)}}_{{i,SMIVM}}} - х{{{\left( у \right)}}_{{i,MIVM}}}} \right]}}^{2}}} } \right]}^{{0.5}}},$РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Активность
Для проверки адекватности SMIVM и представительности расчета, значения активности компонентов бинарной системы Рb–Ві в жидком сплаве были рассчитаны с использованием как SMIVM, так и MIVM.
Для бесконечно разбавленных растворов коэффициенты активности $\gamma _{{{\text{Pb}}}}^{\infty }$ и $\gamma _{{{\text{Bi}}}}^{\infty }$ сплава Рb–Ві приведены в табл. 1 Бинарные параметры Bji и Bij рассчитаны из уравнений (13) и (14) по методу Ньютона–Рафсона с использованием значений $\gamma _{{{\text{Pb}}}}^{\infty }$ и $\gamma _{{{\text{Bi}}}}^{\infty }$ (табл. 1). Подставляя параметры Bij, Bji, Vi и Vj в уравнения (13) и (14), можно определить активность компонентов сплава Рb–Ві. Точное определение коэффициентов активности имеет важное значение для прогнозирования VLE, расчетные значения активности по модели SMIVM и соответствующие данные, полученные по модели MIVM, для сравнения приведены на рис. 1.
Рис. 1.
Активности (а) компонентов Pb–Bi сплава при 1173 К, рассчитанные по: MIVM (линии); SMIVM (маркеры).
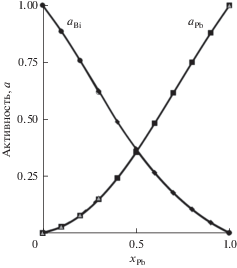
Рисунок 1 показывает, что рассчитанные по моделям MIVM и SMIVM результаты находятся в хорошем согласии, подтверждающем, что упрощение MIVM обосновано и рассчитанные активности компонентов сплавов на основе Pb с использованием SMIVM надежны. По уравнениям (18) и (19) были рассчитаны средние отклонения: относительные (S) и стандартные (S *), для значений, полученных с помощью моделей MIVM и SMIVM, для их точной проверки и сравнения (табл. 2).
(18)
${{S}_{i}} = \pm \frac{{100}}{n}\sum\limits_{i = 1}^n {\left| {\frac{{{{a}_{{i,SMIVM}}} - {{a}_{{i,MIVM}}}}}{{{{a}_{{i,SMIVM}}}}}} \right|} \,\,\cdot\,\,100~{\kern 1pt} \% ,$(19)
$S_{i}^{*} = ~~ \pm {{\left[ {\frac{1}{n}\sum\limits_{i = 1}^n {{{{\left[ {{{a}_{{i,SMIVM}}} - {{a}_{{i,MIVM}}}} \right]}}^{2}}} } \right]}^{{0.5}}},$Таблица 2.
Рассчитанные средние отклонения: относительные (S) и стандартные (S *) моделей MIVM и SMIVМ для активности компонентов сплава Pb–Bi
| i–j | T, K | ±Si (%) | ±Sj (%) | ±$S_{i}^{*}$ | ±$S_{j}^{*}$ |
|---|---|---|---|---|---|
| Pb–Bi | 1173 | 0.9370 | 0.8400 | 0.0018 | 0.0022 |
В табл. 2 показаны небольшие по абсолютной величине средние отклонения: относительные (S) и стандартные (S *), полученные при сопоставлении данных по моделям SMIVM и MIVM для сплавов Pb–Ві, которые подтверждают обоснованность упрощения MIVM до SMIVM без потери точности прогнозирования.
Простота вычислений является еще одним важным показателем оценки термодинамических моделей. Желателен метод прогнозирования, включающий лишь несколько необходимых параметров; кроме того, Zi и Vi не нужно вычислять в SMIVM. Таким образом, SMIVM превосходит MIVM в простоте вычислений без утраты точности выполнения расчетов.
VLE сплавов
Невозможно предсказать степень разделения металлов и состав продуктов вакуумной перегонки, сравнивая давления насыщенных паров компонентов сплавов. Модель MIVM использовалась для прогнозирования термодинамических свойств сплавов и для расчета диаграммы состава бинарных сплавов при сложном процессе вакуумной перегонки [9, 12]. Данное исследование, посвященное надежности SMIVM и расчету VLE бинарных сплавов на основе Pb при вакуумной дистилляции, расширит диапазон практического применения моделей объемного взаимодействия для характеристики диаграмм состава без прерывания процесса возгонки. Использование метода SMIVM обеспечит удобный способ прогнозирования процесса вакуумной переработки сплавов, включая многоступенчатые перегонки [22–24].
Для бинарной системы сплава i–j общая процедура построения T–x фазовой диаграммы доступна в работах [16–18] и реализуется с помощью интерактивного алгоритма. Подставляя соответствующие значения p, γ и psat при различных температурах в уравнения (5), можно получить T–x диаграмму для Pb–Bi сплава (рис. 2а). Давления насыщенного пара Pb и Bi можно высчитать по уравнению (15).
Рис. 2.
Фазовые диаграммы Т–х (а, в, д) при Р, Па: 13.3 (1); 133 (2); 1330 (3) и Р–х (б, г, е) при Т, К: 1073 (4); 1273 (5); 1473 (6).
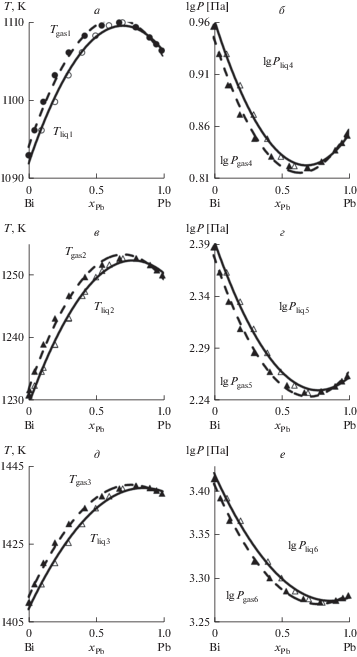
Установлено, что для сплавов состава 1–99 мол. % каждого из компонентов с понижением давления (Р, Па): 1330/133/13.3, уменьшаются температуры плавления и кипения металлических систем в диапазонах (Т, К): 1410–1438/1231–1250/1093–1106, а также максимальная разница между температурами плавления и кипения (Тliq – Тgas, К): 4.2/3.1/2.5, соответственно. В результате даже при небольшом исходном содержании свинца (1–10 мол. % Pb) в составе Pb–Bi сплава в Bi-конденсат переходит 36–51% свинца при давлении 13.3–1330 Па и температуре 1093–1418 К (табл. 3). При содержании свинца в исходном сплаве от 80 мол. % и более, он полностью переходит в состав возгонов вместе с висмутом при исследованном давлении и температуре 1106–1440 К.
Таблица 3.
Рассчитанные значения Tliq, Tgas, γPb, γBi, yPb Pb–Bi сплавa для “Т–х” диаграмм
| P, Па | xPb | 0.01 | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 |
|---|---|---|---|---|---|---|---|
| 1330 | Тliq, К | 1410.05 | 1414.78 | 1420.23 | 1425.40 | 1430.20 | 1434.26 |
| Тgas, К | 1411.96 | 1418.32 | 1424.44 | 1429.56 | 1433.68 | 1436.80 | |
| γPb | 0.593 | 0.650 | 0.709 | 0.765 | 0.814 | 0.859 | |
| γBi | 1.0 | 0.995 | 0.980 | 0.958 | 0.929 | 0.894 | |
| yPb | 0.0044 | 0.051 | 0.118 | 0.201 | 0.300 | 0.414 | |
| 133 | Тliq, К | 1230.79 | 1234.60 | 1238.92 | 1243.07 | 1246.71 | 1249.67 |
| Тgas, К | 1232.12 | 1237.27 | 1242.15 | 1246.15 | 1249.26 | 1251.48 | |
| γPb | 0.531 | 0.596 | 0.665 | 0.73 | 0.789 | 0.841 | |
| γBi | 1.0 | 0.994 | 0.977 | 0.95 | 0.916 | 0.876 | |
| yPb | 0.0040 | 0.048 | 0.114 | 0.199 | 0.302 | 0.42 | |
| 13.3 | Тliq, К | 1093.05 | 1096.22 | 1099.84 | 1103.23 | 1106.11 | 1108.25 |
| Тgas, К | 1094.40 | 1098.54 | 1102.41 | 1105.50 | 1107.83 | 1109.40 | |
| γPb | 0.471 | 0.543 | 0.622 | 0.696 | 0.763 | 0.823 | |
| γBi | 1.0 | 0.993 | 0.972 | 0.941 | 0.902 | 0.857 | |
| yPb | 0.0037 | 0.045 | 0.111 | 0.198 | 0.305 | 0.428 | |
| P, Па | xPb | 0.6 | 0.7 | 0.8 | 0.9 | 0.95 | 0.99 |
| 1330 | Тliq, К | 1437.29 | 1439.25 | 1439.95 | 1439.41 | 1438.76 | 1437.98 |
| Тgas, К | 1438.92 | 1440.04 | 1440.16 | 1439.41 | 1438.76 | 1437.98 | |
| γPb | 0.898 | 0.931 | 0.959 | 0.982 | 0.991 | 0.998 | |
| γBi | 0.856 | 0.814 | 0.770 | 0.724 | 0.701 | 0.682 | |
| yPb | 0.536 | 0.662 | 0.785 | 0.9 | 0.95 | 0.99 | |
| 133 | Тliq, К | 1251.67 | 1252.66 | 1252.64 | 1251.61 | 1250.78 | 1249.97 |
| Тgas, К | 1252,82 | 1253.28 | 1252.85 | 1251.61 | 1250.78 | 1249.97 | |
| γPb | 0.886 | 0.925 | 0.956 | 0.981 | 0.991 | 0.998 | |
| γBi | 0.832 | 0.784 | 0.735 | 0.685 | 0.660 | 0.641 | |
| yPb | 0.546 | 0.675 | 0.797 | 0.9 | 0.95 | 0.99 | |
| 13.3 | Тliq, К | 1109.54 | 1109.91 | 1109.33 | 1108.03 | 1107.17 | 1106.37 |
| Тgas, К | 1110.19 | 1110.21 | 1109.33 | 1108.03 | 1107.17 | 1106.37 | |
| γPb | 0.875 | 0.918 | 0.954 | 0.981 | 0.991 | 0.998 | |
| γBi | 0.807 | 0.755 | 0.702 | 0.648 | 0.622 | 0.601 | |
| yPb | 0.558 | 0.688 | 0.8 | 0.9 | 0.95 | 0.99 |
Расчет диаграммы Р–x аналогичен вычислению диаграммы T–x; значения γ можно определить по уравнениям (13) и (14) для ряда значений xi при определенной температуре системы; psat может быть рассчитана по формуле (15) при той же температуре. Давление р системы может быть получено путем замены этих значений в уравнении (4); уi можно рассчитать по формуле (5). Таким образом, диаграмма Р–x для системы бинарного сплава Pb–Bi может быть установлена с помощью xi, yi и p, как показано на рис. 2б.
При расчете диаграмм Р–x показано, что с понижением заданной температуры (Т, К): 1473/1273/1073 уменьшаются значения давлений плавления и кипения металлических систем в интервалах (Р, Па): 2600–1875/243–175/9.0–6.6, а также максимальная разность между давлениями плавления и кипения (Рliq – Рgas, Па): 101/9.8/0.4, соответственно. В итоге, подтверждается информация, полученная ранее из T–x диаграмм: при содержании свинца (1–10 мол. % Pb) в составе Pb–Bi сплава в Bi-конденсат переходит 36–51% свинца при температуре 1073–1473 К и давлении 8–2600 Па (табл. 4). При содержании свинца в исходном сплаве от 80 мол. % и более он полностью переходит в состав возгонов вместе с висмутом при исследованной температуре и давлении 6.7–1880 Па.
Таблица 4.
Рассчитанные значения Pliq, Pgas, γPb, γBi, yPb Pb–Bi сплавa для “P–х” диаграмм
| Т, К | xPb | 0.01 | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 |
|---|---|---|---|---|---|---|---|
| 1473 | Рliq, Па | 2602 | 2470 | 2329 | 2202 | 2089 | 2000 |
| Рgas, Па | 2559 | 2382 | 2228 | 2104 | 2014 | 1941 | |
| γPb | 0.611 | 0.664 | 0.720 | 0.772 | 0.819 | 0.862 | |
| γBi | 1.0 | 0.995 | 0.981 | 0.960 | 0.931 | 0.898 | |
| yPb | 0.0045 | 0.051 | 0.118 | 0.201 | 0.300 | 0.413 | |
| 1273 | Рliq, Па | 243.04 | 229.90 | 215.89 | 203.31 | 192.94 | 184.98 |
| Рgas, Па | 237.68 | 220.8 | 206.06 | 194.54 | 185.78 | 179.89 | |
| γPb | 0.541 | 0.609 | 0.675 | 0.736 | 0.793 | 0.844 | |
| γBi | 1.0 | 0.994 | 0.977 | 0.951 | 0.918 | 0.879 | |
| yPb | 0.0041 | 0.049 | 0.115 | 0.200 | 0.302 | 0.419 | |
| 1073 | Рliq, Па | 9.041 | 8.504 | 7.943 | 7.453 | 7.063 | 6.794 |
| Рgas, Па | 8.790 | 8.128 | 7.568 | 7.145 | 6.839 | 6.653 | |
| γPb | 0.461 | 0.533 | 0.612 | 0.687 | 0.756 | 0.818 | |
| γBi | 1.0 | 0.992 | 0.971 | 0.939 | 0.898 | 0.851 | |
| yPb | 0.0036 | 0.045 | 0.110 | 0.198 | 0.306 | 0.430 | |
| Т, К | xPb | 0.6 | 0.7 | 0.8 | 0.9 | 0.95 | 0.99 |
| 1473 | Рliq, Па | 1932 | 1891 | 1875 | 1884 | 1895 | 1910 |
| Рgas, Па | 1897 | 1871 | 1866 | 1884 | 1895 | 1910 | |
| γPb | 0.899 | 0.932 | 0.959 | 0.982 | 0.991 | 0.998 | |
| γBi | 0.859 | 0.818 | 0.775 | 0.730 | 0.707 | 0.689 | |
| yPb | 0.535 | 0.661 | 0.784 | 0.898 | 0.95 | 0.99 | |
| 1273 | Рliq, Па | 179.54 | 176.76 | 176.84 | 179.08 | 181.11 | 183.10 |
| Рgas, Па | 176.60 | 174.99 | 176.20 | 179.08 | 181.11 | 183.10 | |
| γPb | 0.888 | 0.925 | 0.957 | 0.981 | 0.991 | 0.998 | |
| γBi | 0.835 | 0.788 | 0.740 | 0.690 | 0.666 | 0.646 | |
| yPb | 0.545 | 0.673 | 0.795 | 0.9 | 0.95 | 0.99 | |
| 1073 | Рliq, Па | 6.646 | 6.623 | 6.707 | 6.883 | 7.005 | 7.114 |
| Рgas, Па | 6.561 | 6.577 | 6.707 | 6.883 | 7.005 | 7.114 | |
| γPb | 0.871 | 0.917 | 0.953 | 0.980 | 0.991 | 0.998 | |
| γBi | 0.800 | 0.746 | 0.692 | 0.638 | 0.611 | 0.590 | |
| yPb | 0.562 | 0.693 | 0.8 | 0.9 | 0.95 | 0.99 |
По определению при равновесии “пар–жидкость” температура и давление любого компонента в газовой фазе должны быть равны аналогичным показателям в жидкой фазе при достижении системой равновесия. Понятно, что вакуумная дистилляция не является равновесным состоянием, поскольку температура и давление газовой фазы сильно различаются для жидкой фазы вследствие наличия конденсата. Кроме того, при расчете VLE используются два ключевых параметра γ и psat, в которых γ является точным и надежным, особенно при использовании модели SMIVM (табл. 2). Однако существует погрешность в давлении насыщенных паров, поскольку расчетные давления насыщенных паров чистых компонентов сплавов не были проверены из-за отсутствия экспериментальных данных; это основная причина возможного отклонения рассчитанного VLE от опытного. Кроме того, предположения, принятые при расчете VLE, также могут приводить к некоторым неточностям.
Таким образом, кривые паровой и жидкой фаз расположены достаточно близко друг к другу (рис. 2а–2е), потому что разница между температурами кипения Bi (1837 К) и Pb (2022 К) составляет всего 185 K. Следовательно, не представляется возможным качественно разделить сплав Pb–Bi обычной дистилляцией в одну ступень [25], поскольку Pb и Bi испаряются практически одновременно в газовую фазу при нагревании сплава в вакууме. Для эффективного разделения Pb–Bi сплава должен использоваться процесс подобный ректификации, осуществляемый в вакуумных аппаратах с вертикальной насадкой, состоящей из большого числа испарительных тарелей, и градиентом температур по высоте. Жидкая фаза сплава, подаваемая на верхнюю тарель с минимально заданной предварительно обоснованной температурой, по мере продвижения вниз и увеличения температуры расплава будет обогащаться трудно возгоняемым компонентом сплава, а движущаяся ей навстречу газовая фаза – легко возгоняемым металлом, который конденсируется в составе возгона в верхнем сегменте насадки. Например, для отделения свинца и висмута от олова из сплава состава, мас. %: 50.9 Sn; 45.3 Pb; 3.8 Bi, предложен вакуумный аппарат с 10 испарительными тарелями. В результате содержание олова в кубовом остатке возросло до 99.5 мас. %, свинца и висмута в конденсате – 91.5 и 6.8 мас. % соответственно [26]. Очевидно, что для улучшения разделения близких по свойствам свинца и висмута необходимо увеличить число испарительных тарелей и предварительно обосновать расчетным путем выбор температуры в зонах испарения сплава и конденсации возгонов, для минимизации количества установочных опытов.
ЗАКЛЮЧЕНИЕ
По моделям SMIVM и MIVM рассчитана активность компонентов бинарного жидкого сплава Pb–Bi. Небольшие по абсолютной величине средние отклонения: относительные (S) и стандартные (S *), полученные при сопоставлении данных по моделям SMIVM и MIVM, подтверждают обоснованность упрощения MIVM до SMIVM без потери точности прогнозирования.
На основе теории VLE и модели SMIVM рассчитаны фазовые диаграммы системы Рb-Ві. Возможные отклонения между расчетными VLE и экспериментальными данными, в основном, обусловлены неточностями как экспериментальных данных VLE, так и расчетными значениями давления насыщенных паров чистых компонентов сплавов. В последующих исследования будут экспериментально уточнены давления насыщенных паров чистых металлов и опытным путем проверен метод определения параметров VLE сплавов.
Для эффективного разделения Pb–Bi сплава должен использоваться процесс подобный ректификации, осуществляемый в вакуумных аппаратах с вертикальной насадкой, состоящей из большого числа испарительных тарелей, и градиентом температур по высоте. Жидкая фаза сплава, подаваемая на верхнюю тарель с минимально заданной предварительно обоснованной температурой, по мере продвижения вниз и увеличения температуры расплава будет обогащаться трудно возгоняемым компонентом сплава, а движущаяся ей навстречу газовая фаза – легко возгоняемым металлом, который конденсируется в составе возгона в верхнем сегменте насадки.
Список литературы
Zhang R., Wilson V.L., Hou A.X., Meng G. Source of lead pollution, its influence on public health and the countermeasures // Int. J. Health, Animal science and Food safety. 2015. № 2. P. 18–31.
Грейвер Н.С., Сажин Н.П., Стригин И.А., Троицкий А.В. Основы металлургии. Т. 5. М.: Металлургия. 1968.
Dai Y., Yang B. Vacuum Metallurgy of Nonferrous Metals. Beijing, Metallurgical Industry Press. 2009.
Hultgren R., Desai P.D., Hawkins D.T., Gleiser M., Kelley K.K. Selected Values of the Thermodynamic Properties of Binary Alloys. OH, ASM Metals Park. 1973.
Landolt-Bornstein. Numerical Data and Functional Relationships in Science and Technology. Group IV: Physical Chemistry; V. 11: Ternary Alloy Systems. Phase Diagrams, Crystallographic and Thermodynamic Data. Subvolume D: Iron Systems. P. 1. Berlin-Heidelberg: Publisher Springer. 2008.
Awe O.E., Oshakuade O.M. Theoretical prediction of thermodynamic activities of all components in the Bi–Sb–Sn ternary lead-free solder system and Pb–Bi–Sb–Sn quaternary system // Thermochimica Acta. 2014. 589. P. 47–55.
Awe O.E., Oshakuade O.M. Theoretical prediction of thermodynamic activities of liquid Au–Sn–X (X = Bi, Sb, Zn) solder systems // Physica B: Condensed Matter. 2017. 507. P. 84–94.
Kong L., Yang B., Xu B., Li Y. Application of Molecular Interaction Volume Model for Phase Equilibrium of Sn-Based Binary System in Vacuum Distillation // Metallurgical and Materials Transactions A. 2014. 45. № 10. P. 4405–4410.
Kong L., Xu J., Xu B., Xu S., Yang B., Li Y., Liu D., Hu R. Application of MIVM for Sn–Ag and Sn–In Alloys in Vacuum Distillation // TMS 2016: 145-th Annual Meeting & Exhibition: Supplemental Proceedings. P. 367–374.
Smith J.M., Van Ness H.C., Abbott M.M., Swihart M.T. Introduction to Chemical Engineering Thermodynamics. New York: McGraw-Hill Education. 2018.
Poizeau S., Sadoway D.R. Application of the Molecular Interaction Volume Model (MIVM) to Calcium–Based Liquid Alloys Liquid Alloys of Systems Forming High-Melting Intermetallics // J. Am. Chem. Soc. 2013. 135. № 22. P. 8260–8265.
Yang B., Kong L., Xu B., Liu D., Dai Y. Recycling of metals from waste Sn-based alloys by vacuum separation // Transactions of Nonferrous Metals Society of China. 2015. 25. № 4. P. 1315–1324.
Liu K., Wu J.J., Wei K., Ma W. Application of molecular interaction volume model on removing impurity aluminum from metallurgical grade silicon by vacuum volatilization // Vacuum. 2015. 114. P. 6–12.
Tao D-P. Correct Expressions of Enthalpy of Mixing and Excess Entropy from MIVM and Their Simplified Forms // Metallurgical and Materials Transactions B. 2016. 47. № 1. P. 1–9.
Mao Z., Tao D. Prediction of melt activity of Mn-based ferroalloys // Journal of Kunming University of Science and Technology (natural science). 2015. № 3. P. 9–20.
Tao D-P. A new model of thermodynamics of liquid mixtures and its application to liquid alloys // Thermochimica Acta. 2000. 363. № 1–2. P. 105–113.
Yang H., Xu B., Yang B., Ma W., Tao D-P. Calculation of phase equilibrium in vacuum distillation by molecular interaction volume model // Fluid Phase Equilibria. 2012. 314. № 5. P. 78–81.
Tao D-P. Prediction of the coordination numbers of liquid metals // Metallurgical and Materials Transactions A. 2005. 36. № 12. P. 3495–3497.
Prausnitz J.M., Lichtenthaler R.N., Azevedo E.G.D. Molecular thermodynamics of fluid-phase equilibria (third edition). New Jersey, Prentice Hall PTR, Upper Saddle River. 1999.
Gao J., Xu J., Kong L., Xu B., Yang B. Calculation of vapor-liquid equilibria of binary lead-based alloys in vacuum distillation using simplified molecular interaction volume model // Fluid Phase Equilibria. 2019. 483. P. 189–196.
Jiang W.L., Zhang C., Xu N., Yang B., Xu B.Q., Liu D.C., Yang H.W. Experimental investigation and modelling of phase equilibria for the Ag–Cu–Pb system in vacuum distillation // Fluid Phase Equilibria. 2016. 417. P. 19–24.
Grenner A., Klauck M., Meinhardt R., Schumann R., Schmelzer J. Ternary Liquid−Liquid (−Liquid) Equilibria of Aniline + Cyclohexylamine + Water, Aniline + Cyclohexylamine + Octane, Aniline + Water + Toluene, and Aniline + Water + Octane // J. Chem. Eng. Data. 2006. 51. № 3. P. 1009–1014.
Diaf A., Aburideh H., Tigrine Z., Tassalit D., Alaoui F. Effect of temperature on the performance of multi-stage distillation // World Academy of Science, Engineering and Technology, International Journal of Environmental and Ecological Engineering. 2012. 6. № 6. P. 348–351.
Baig H., Antar M.A., Zubair S.M. Performance characteristics of a once-through multi-stage flash distillation process // Desalination and water treatment. 2010. 13. P. 174–185.
Kong L.-x., Yang B., Li Y.-f., Xu B.-q., Han L., Liu D.-c, Dai Y.-n. Application of molecular interaction volume model in separation of Sn–Zn alloy by vacuum distillation // J. Cent. South Univ. 2013. 20. P. 3372−3378.
Дьяков В.Е. Вакуумный аппарата для очистки отходов свинцово-оловянных сплавов от висмута // Научный альманах. 2016. № 3–3(17). С. 61–66.
Дополнительные материалы отсутствуют.


