Расплавы, 2021, № 3, стр. 253-261
Анализ химических превращений в системе BaO–B2O3–C
А. А. Акбердин a, А. С. Ким a, Р. Б. Султангазиев b, *
a Химико-металлургический институт им. Ж. Абишева
Караганда, Казахстан
b Карагандинский государственный технический университет
Караганда, Казахстан
* E-mail: sulrus83@mail.ru
Поступила в редакцию 16.04.2020
После доработки 21.01.2021
Принята к публикации 25.01.2021
Аннотация
Выполнен полный термодинамический анализ химических превращений в системе BaO–B2O3–C в диапазоне температур 1400–3000 К с использованием программного комплекса “Терра”. Установлено, что еще до начала процессов восстановления продуктами взаимодействия оксидов бора и бария являются орто-Ba3B2O6 и метаборат бария BaB2O4 с температурами кристаллизации 1656 и 1378 К соответственно. Изучено восстановление углеродом смеси оксидов с высоким (90 BaO + 10B2O3) и низким (35BaO + 65B2O3) содержанием оксида бария. Найдено, что во всех случаях продуктами взаимодействия могут быть карбид BaC2 и гексаборид бария BaB6, а также карбид бора B4C. При переработке богатой оксидом бария смеси в продуктах плавки превалирует карбид бария BaC2, а богатой оксидом бора – гексаборид бария. Образование боратов бария затрудняет восстановительный процесс из-за пониженной активности BaO и B2O3 в них. Как сильные основные (BaO) и кислотные (B2O3) оксиды они образуют прочные соединения. Температура начала восстановления бария до BaC2 из BaO составляет 1500 К, а из Ba3B2O6 – 2200 К. Совместное восстановление бария и бора происходит из боратов бария с образованием BaB6. На обеих смесях появление в продуктах плавки гексаборида бария фиксируется при 2300 К. Наличие в конденсированной фазе BaB6 свидетельствует о возможности производства комплексного ферросплава, одновременно содержащего бор и барий, известных как эффективные легирующие и модифицирующие элементы. При численном моделировании технологии применен метод математического планирования эксперимента. Получены уравнения зависимости количества образующихся фаз от расхода BaO, B2O3 и температуры. Изучен весь диапазон составов оксидов в соответствии с диаграммой состояния системы BaO–B2O3. Уравнения позволяют выбрать температурно-шихтовые условия плавки для получения требуемых составов конденсированных фаз. Полученные в работе результаты численных экспериментов могут быть применимы для производства борбариевых сплавов и синтеза высокотемпературных материалов на основе BaB6, BaC2 и B4С.
ВВЕДЕНИЕ
Научное обоснование технологического процесса является залогом успешной его реализации на практике. Распространенный способ его изучения по отдельным химическим реакциям представляется недостаточно корректным. В исследовательской практике для таких целей рекомендуется применять полный термодинамический анализ, который позволяет учесть взаимодействие всех компонентов процесса, находящихся в твердом, жидком и газообразном состояниях в широком диапазоне температур и давлений [1–3]. Усилия научного сообщества в этом направлении привели к созданию численных методов анализа сложных технологических процессов, реализованных в виде пакета прикладных компьютерных программ. В настоящее время стало очевидным, что такой подход позволяет многократно снижать материальные и временны́ е затраты на совершенствование существующих и создание новых технологических процессов и изделий. Осознание этого привело к объединению усилий научных коллективов разных стран в создании мощных расчетных термодинамических комплексов. Например, консорциум SGTE (Scientific Group Thermodata Europe), который состоит из 16 организаций разных стран Европы и Северной Америки [4]. В России разработаны программные продукты “АСТРА” “СЕЛЕКТОР”, “ИВТАНТЕРМО-Win” [4]. В отличие от разработок консорциума “SGTE” в них используются более строгие с точки зрения классической термодинамики принципы. В основу алгоритма многоцелевого программного комплекса “АСТРА” положен универсальный термодинамический метод определения характеристик равновесия произвольных гетерогенных систем, основанный на фундаментальном принципе максимума энтропии [5]. Этот метод предоставляет уникальную возможность обобщенного описания любого высокотемпературного состояния с помощью одних только фундаментальных законов термодинамики, независимо от условий и способов достижения равновесия [4].
МЕТОДЫ ИССЛЕДОВАНИЯ
Термодинамическое моделирование химически реагирующих систем получило широкое распространение в исследовательской практике [6–10]. Например, в Институте металлургии УрО РАН с использованием программного комплекса “АСТРА” были разработаны научные основы технологии производства сплава Fe–Si–Al [11], а также силикобария, внедренной на Ермаковском (ныне Аксуском) заводе ферросплавов [12, 13]. В последнем случае это было получено изучением процессов фазообразования в тройной системе BaO–SiO2–C. Было определено, что для увеличения растворимости бария в железе необходимо образование в этой системе силицида бария, являющегося продуктом взаимодействия оксида бария с карбидом кремния по реакции:
Таким образом, благодаря сугубо теоретическим исследованиям был создан новый ферросплав и организовано его промышленное производство. Необходимо отметить, что на начальном этапе [12] участие железа при анализе не рассматривалось.
Кремний является аналогом бора. Поэтому в настоящей работе показана возможность образования из бария и бора соединения, растворимого в железе, и получения бор-бариевого сплава. Для изучения этого процесса был применен программный комплекс “Терра” [14], являющийся модернизированной версией программы “АСТРА”, и проведен анализ химических превращений в системе BaO–B2O3–C. Используемый комплекс обнаруживает фазы в количестве от 1 до 10–30 массовых долей. Для облегчения анализа при моделировании учитывали фазы, количество которых составляет 10–3 и более массовых долей. Вопросам термодинамического моделирования процессов восстановления бария и бора посвящен ряд исследований [15–17]. В настоящей работе было принято решение расширить их за счет применения метода математического планирования эксперимента при численных расчетах.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ АНАЛИЗ
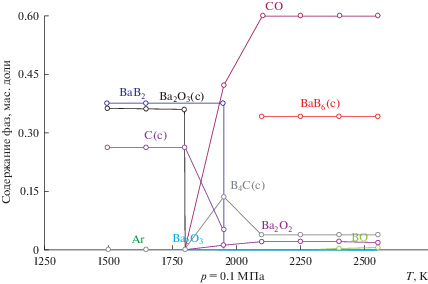
На рис. 1 и 2 приведены результаты оценки фазообразования при карботермическом восстановлении смеси оксидов с высоким (90%) и пониженным (35%) содержанием оксида бария. Рисунки показывают общий ход фазообразования в системе. Для детального анализа привлечены также получаемые в ходе расчетов цифровые значения количества образующихся фаз, поскольку на диаграмме сложно отобразить низкие концентрации последних. Расход углерода рассчитан по стехиометрии для реакций:
(3)
$2{{{\text{B}}}_{2}}{{{\text{O}}}_{3}} + 7{\text{C}} = {{{\text{B}}}_{4}}{\text{C}} + 6{\text{СО}}.$Рис. 1.
Результаты термодинамического моделирования фазообразования для системы с высоким содержанием оксида бария (90% BaO).
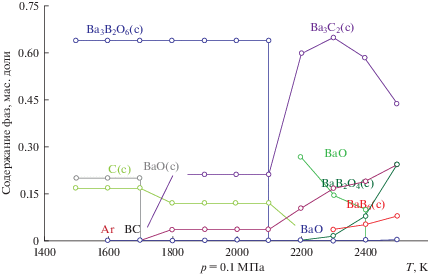
Рис. 2.
Результаты термодинамического моделирования фазообразования для системы с низким содержанием оксида бария (35% BaO).
Определено, что при взаимодействии имеющегося в системе свободного оксида бария с углеродом происходит образование при 1500 К дикарбида бария по реакции (2). Увеличению количества ВаС2 в процессе восстановления способствует вступление в реакцию с углеродом ортобората бария:
(4)
${\text{B}}{{{\text{a}}}_{3}}{{{\text{B}}}_{2}}{{{\text{O}}}_{6}} + 6{\text{С}} = 2{\text{Ba}}{{{\text{C}}}_{2}} + {\text{Ba}}{{{\text{B}}}_{2}}{{{\text{O}}}_{4}} + 2{\text{СО}}.$(5)
$3{\text{Ba}}{{{\text{B}}}_{{\text{2}}}}{{{\text{O}}}_{4}} + {\text{Ba}}{{{\text{C}}}_{2}} + 10{\text{С}} = {\text{Ba}}{{{\text{B}}}_{6}} + 12{\text{CO}} + 3{\text{B}}{{{\text{a}}}_{{{\text{газ}}}}}.$Фазообразование в системе с низким содержанием оксида бария (35% ВаО) и высоким – оксида бора (65% B2O3) имеет свои особенности (рис. 2). Наличие свободного B2O3 приводит к появлению карбида бора по реакции (3). По достижению температуры 2200 К в системе образуется BaB6 при одновременном снижении концентраций карбида бора В4С и углерода, что может быть результатом протекания реакции
(6)
${\text{Ba}}{{{\text{B}}}_{2}}{{{\text{O}}}_{4}} + {{{\text{B}}}_{4}}{\text{C}} + 3{\text{С}} = {\text{Ba}}{{{\text{B}}}_{6}} + 4{\text{СО}}{\text{.}}$Таким образом, при взаимодействии в системе оксидов ВаO и B2O3 с углеродом возможно образование следующих фаз: BaB6, BaC2 и B4C, сочетание и количество которых можно менять, изменяя отношение исходных оксидов в системе.
Для уточнения результатов термодинамических расчетов применили метод математического планирования эксперимента [19–21], поскольку моделирование является также экспериментом, но только численным [22]. Как и в предыдущих расчетах, расход углерода на восстановление бария и бора из оксидов определили по стехиометрии реакций (2) и (3). В табл. 1 показан перечень факторов и их уровней, а в табл. 2 – матрица планирования эксперимента. В качестве факторов выбраны расходы ВаO и B2O3, а также температура, которые меняли на пяти уровнях. Адекватность модели оценивали по коэффициенту детерминации (R 2).
Таблица 1.
Факторы и их уровни
| Факторы | Уровни факторов | |||||
|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | ||
| x1 | Температура, К | 2073 | 2193 | 2313 | 2433 | 2553 |
| x2 | Расход В2О3, г | 10 | 25 | 40 | 55 | 70 |
| x3 | Расход BаО, г | 90 | 75 | 60 | 45 | 30 |
| x4 | Вакантный фактор | 1 | 2 | 3 | 4 | 5 |
Таблица 2.
Матрица планирования эксперимента
| № | Т, К | В2О3, г | BаО, г | YBa | YB |
|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 |
| 1 | 2073 | 10 | 90 | 0.1686 | 0 |
| 2 | 2073 | 40 | 60 | 0.0889 | 0.0420 |
| 3 | 2073 | 25 | 75 | 0 | 0 |
| 4 | 2073 | 70 | 30 | 0.1800 | 0.0992 |
| 5 | 2073 | 55 | 45 | 0.2316 | 0.1094 |
| 6 | 2313 | 10 | 60 | 0.5765 | 0.0344 |
| 7 | 2313 | 40 | 75 | 0.4099 | 0.0791 |
| 8 | 2313 | 25 | 30 | 0.3303 | 0.1006 |
| 9 | 2313 | 70 | 45 | 0.2401 | 0.1134 |
| 10 | 2313 | 55 | 90 | 0.3859 | 0.0856 |
| 11 | 2193 | 10 | 75 | 0.4353 | 0 |
| 12 | 2193 | 40 | 30 | 0.2571 | 0.1214 |
| 13 | 2193 | 25 | 45 | 0.0471 | 0.0222 |
| 14 | 2193 | 70 | 90 | 0.1286 | 0.0607 |
| 15 | 2193 | 55 | 60 | 0.1687 | 0.0796 |
| 16 | 2553 | 10 | 30 | 0.4618 | 0.0584 |
| 17 | 2553 | 40 | 45 | 0.2825 | 0.1037 |
| 18 | 2553 | 25 | 90 | 0.4901 | 0.0512 |
| 19 | 2553 | 70 | 60 | 0.2468 | 0.1166 |
| 20 | 2553 | 55 | 75 | 0.3194 | 0.0943 |
| 21 | 2433 | 10 | 45 | 0.5352 | 0.0433 |
| 22 | 2433 | 40 | 90 | 0.4305 | 0.0708 |
| 23 | 2433 | 25 | 60 | 0.4415 | 0.0679 |
| 24 | 2433 | 70 | 75 | 0.2962 | 0.1060 |
| 25 | 2433 | 55 | 30 | 0.2146 | 0.1098 |
При использовании обычного метода отбора факторов требуется проведение N = 53 = = 125 расчетов. Применение метода планирования эксперимента на латинских квадратах позволяет провести 25 расчетов (табл. 2).
Результатом этих расчетов является фазовый состав образующихся продуктов. С использованием молекулярных весов участников процесса фазовый состав пересчитали на элементный.
На рис. 3 показано влияние выбранных факторов на содержание Ba и B в конденсированной фазе. Повышение температуры процесса способствует увеличению количества Ва и В, восстановленных из оксидной системы (рис. 3a). Но существует по этому параметру предел, за которым начинается снижение содержания этих элементов. Найденная решением аппроксимирующего уравнения (табл. 3) температурная граница, например, для Ва оценивается в 2450 К. При последующем повышении температуры наблюдается интенсивное снижение количества BaC2 из-за образования в газовой фазе Ba и накоплением в системе свободного углерода (рис. 1).
Рис. 3.
Зависимость содержание бария и бора в конденсированной фазе от температуры (а), количества В2О3 (б) и ВаО (в) в системе.
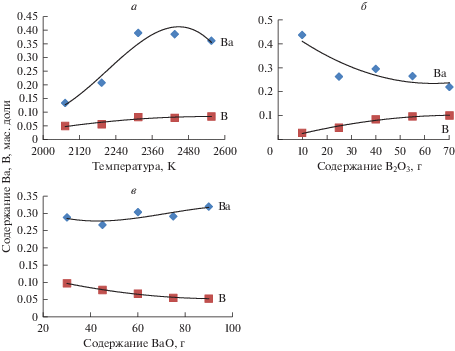
Таблица 3.
Аппроксимирующие уравнения
| Фактор | Уравнения | R2 |
|---|---|---|
| Т(х1) | Ba = –6 · 10–9 · T 3 + 4 · 10–5 · T 2 – 0.0881 · T + 63.611 | 0.9443 |
| B = –2 · 10–7 · T 2 + 0.0008 · T – 0.9463 | 0.8893 | |
| B2O3(x2) | Ba = 6 · 10–5 · ${{{\text{B}}}_{2}}{\text{O}}_{3}^{2}$ – 0.0078 · B2O3 + 0.4808 | 0.772 |
| B = –2 · 10–5 · ${{{\text{B}}}_{2}}{\text{O}}_{3}^{2}$ + 0.0028 · B2O3 – 0.0014 | 0.9781 | |
| BaO(x3) | Ba = –4 · 10–7 · BaO3 + 1 · 10–4 · BaO2 – 0.0058 · BaO + 0.3849 | 0.6401 |
| B = 1 · 10–5 · BaO2 – 0.002 · BaO + 0.1479 | 0.9942 |
Гексаборид бария термодинамически устойчив (∆G298.15 = –310.4 кДж/моль) и некоторое снижение его количества имеет место лишь при температурах более 2800 К.
Повышение в системе количества В2О3 с 10 до 70 г приводит к увеличению содержания бора с 0.02 до 0.1 и уменьшению бария с 0.43 до 0.21 (рис. 3б). Для системы с повышенным количеством BaO имеет место обратная картина (рис. 3в). Наблюдаемое можно объяснить трудностью восстановления бора и бария из образующихся боратов бария. Для системы, состоящей из 100% BaO, карбид бария образуется уже при 1550 К, в то время как температура начала восстановления его из BaB2O4 равна 2200 К (рис. 1). Приведенные в табл. 3 аппроксимирующие уравнения позволяют определить содержание исходных компонентов системы для получения сплава с необходимым содержанием бария и бора.
ВЫВОДЫ
Выполнен полный термодинамический анализ химических превращений в системе BaO–B2O3–C в диапазоне температур 1400–3000 К. Определено, что в системе продуктами взаимодействия оксидов бария и бора с углеродом могут быть карбид и гексаборид бария, а также карбид бора. При термодинамическом моделировании применен метод математического планирования эксперимента. Получены аппроксимирующие уравнения зависимости количества образующихся фаз от содержания BaO и B2O3 и температуры. Изучен весь диапазон составов в соответствии с диаграммой состояния системы BaO–B2O3. Уравнения позволяют выбрать температурные параметры и оксидные составляющие системы для получения необходимых составов конденсированных фаз. Полученные данные можно использовать для получения бор-бариевых ферросплавов и синтеза высокотемпературных материалов на основе BaB6, BaC2 и B4C.
Список литературы
Белов Г.В. Термодинамическое моделирование: методы, алгоритмы, программы. М.: Научный мир, 2002.
Ватолин Н.А. Термодинамическое моделирование в высокотемпературных неорганических системах. М.: Металлургия, 1994.
Цымбал В.П. Математическое моделирование сложных систем в металлургии: Учебник для вузов. Объед. “Российские университеты”: Кузбассвузиздат – АСТШ, 2006.
Удалов Ю.П. Применение программных комплексов вычислительной и геометрической термодинамики в проектировании технологических процессов неорганических веществ. СПб.: СПбГТИ(ТУ), 2012.
Трусов Б.Г. Моделирование химических и фазовых равновесий при высоких температурах (АСТРА.4). Версия 1.06. М.: МВТУ им. Баумана, 1991.
Тюшняков С.Н. Термодинамическое моделирование восстановления цинка медеплавильного шлака // Бутлеровские сообщения. 2015. 43. № 9. С. 108–115.
Моисеев Г.К., Вяткин Н.А., Барбин Н.М. Применение термодинамического моделирования для изучения взаимодействий с участием ионных расплавов. Челябинск: Из-во ЮУрГУ, 2002.
Дайнеко Е.Б. Прогнозные термодинамические расчеты вероятности твердофазовых реакций при термообработке масс электрофарфора // Вісник НТУ “ХПІ". Серія: Хімія, хімічна технологія та екологія. 2013. № 47(1020). С. 38–44.
Гончаров О.Ю. Термодинамическое моделирование высокотемпературного окисления сплавов системы Fe–Cr на воздухе // Неорганические материалы. 2004. 40. № 12. С. 1–7.
Тюшняков С.Н. Термодинамическое моделирование фазообразования при охлаждении цинксодержащего медеплавильного шлака // Бутлеровские сообщения. 2015. 43. № 9. С. 102–107.
Маршук Л.А., Жучков В.И., Шуняев К.Ю., Лисин В.Л., Мальцев Ю.Б. Термодинамическое моделирование процесса выплавки сплава Fe–Si–Al // Расплавы. 2003. № 6. С. 63–68.
Жучков В.И., Лукин С.В. Технология ферросплавов со щелочноземельными металлами. М: Металлургия, 1990.
Рябчиков И.В., Григорьев Ю.В. Термодинамический анализ процессов взаимодействия сульфатов магния и щелочноземельных металлов с углеродом // Тр. XIII межд. науч. конф. “Современные проблемы электрометаллургии стали”. 2007. 1. С. 61–65.
Трусов Б.Г. Программная система ТЕРРА для моделирования фазовых и химических равновесий при высоких температурах // В кн.: III межд. симпозиум “Горение и плазмохимия”. Казак. университетi. 2005. С. 52–57.
Рыбенко И.А., Нохрина О.И., Рожихина И.Д., Голодова М.А., Цымбал В.П. Разработка ресурсосберегающих технологий прямого легирования стали на основе методов термодинамического моделирования процессов восстановления металлов в элементарных системах // Изв. вузов. Ч.М. 2017. 60. № 2. С. 91–98.
Акбердин А.А., Карбаев М.М. Химические превращения при карботермическом восстановлении бора и бария из оксидов // Изв. вузов. Ч.М. 2019. 62. № 11. С. 846–851.
Невар Н.Ф., Фасевич Ю.Н. Термодинамическое моделирование равновесного фазового состава литого борсодержащего сплава // Литье и металлургия. 2005. 33. № 1. С. 96–99.
Лопатин С.И., Столярова В.Л., Тюрина Н.Г., Тюрина З.Г. Термодинамические свойства расплавов систем SrO–B2O3 и BaO–B2 // ЖО. 2006. 76. № 11. С. 1761–1767.
Протодьяконов М.М., Тедер Р.И. Методика рационального планирования эксперимента. М.: “Наука”, 1970.
Малых А.Е., Данилова В.И. Об историческом процессе развития теории латинских квадратов и некоторых их приложениях // Вестник Пермского университета. 2010. № 4. С. 95–104.
Беляев С.В., Малышев В.П. Пути развития вероятностно-детерминированного планирования эксперимента // В сб. Комплексная переработка минерального сырья Казахстана: Алматы. 2008. 9. С. 599–633.
Akberdin A.A., Kim A.S., Sultangaziev R.B. Experiment Planning in the Simulation of Industrial Processes // Steel in Translation. 2018. 48. № 9. P. 573–577.
Дополнительные материалы отсутствуют.


