Расплавы, 2022, № 1, стр. 73-81
Электронные спектры поглощения ионов Yb(II) в расплавах хлоридов щелочных металлов
О. А. Тропин a, *, В. А. Волкович a, **
a Уральский федеральный университет имени Б.Н. Ельцина
Екатеринбург, Россия
* E-mail: tropinoleg@gmail.com
** E-mail: v.a.volkovich@urfu.ru
Поступила в редакцию 24.08.2021
После доработки 23.09.2021
Принята к публикации 28.09.2021
- EDN: CNVIDP
- DOI: 10.31857/S0235010622010108
Аннотация
Зарегистрированы электронные спектры поглощения ионов Yb(II) в расплавах на основе эквимольной смеси NaCl–KCl (1023 К) и эвтектических смесей 6NaCl–5KCl–9CsCl (823–1023 K), 3LiCl–2KCl (723–1023 K) и 7LiCl–2KCl–3CsCl (623–1023 K). Поглощение обусловлено высокоинтенсивными 4 f 14 → 4 f 135d 1 электронными переходами. Максимумы полос поглощения находятся в области 360–380 нм. Рассчитаны коэффициенты экстинкции ионов Yb(II), проанализировано влияние температуры, концентрации и катионного состава на положение и интенсивность полос в электронных спектрах поглощения ионов Yb(II).
ВВЕДЕНИЕ
Редкоземельные элементы (РЗЭ) получили широкое применение в различных отраслях промышленности. Основными методами получения РЗЭ являются металлотермия и электролиз расплавленных сред. Электрохимическое получение РЗЭ обладает рядом преимуществ, поскольку электрический ток обладает необходимой селективностью, обеспечивающей эффективное восстановление металлов, и не вносит посторонних примесей в готовый продукт. Электролитическое рафинирование РЗЭ в солевых средах по своей технической и экономической эффективности может составить конкуренцию хорошо себя зарекомендовавшим методам физической очистки металлов, таким как вакуумный переплав, вакуумная дистилляция и сублимация, зонная плавка. Чистота продукта зависит от ряда факторов: эксплуатационных режимов электролиза (силы тока, температуры), химической стойкости конструкционных материалов и оборудования, природы и состава электролита. Электронная спектроскопия поглощения позволяет анализировать содержание различных ионных форм РЗЭ в расплавленных средах.
Обычной степенью окисления ионов РЗЭ в хлоридных расплавах является +3, но ряд элементов, включая иттербий, способен образовывать устойчивые ионы низшей степени окисления +2.
Спектроскопические исследования, посвященные солевым расплавленным системам, содержащим ионы Yb(III), достаточно подробно представлены в литературе [1, 2]. Значительно меньше внимания было уделено электронным спектрам поглощения (ЭСП) растворов дихлорида иттербия. В работе [3] представлен электронный спектр поглощения Yb(II) в эвтектическом расплаве 3LiCl–2KCl при температуре 723 K, полученный в ходе длительного термического разложения трихлорида иттербия. В спектрах присутствовали интенсивные полосы ниже 400 нм, которые были отнесены к поглощению ионов Yb(II). Электрохимическое восстановление ионов Yb(III) в расплаве NaCl–2CsCl при 550°С также привело к заметному увеличению оптической плотности ниже 580 нм [4]. Однако никаких систематических или количественных исследований ЭСП ионов Yb(II) в работах [3, 4] выполнено не было. Целью настоящей работы являлась разработка метода приготовления расплавов, содержащих дихлорид иттербия, регистрация ЭСП ионов Yb(II) в хлоридных расплавах различного катионного состава и анализ влияния температуры на ЭСП.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все эксперименты по получению солевых смесей, содержащих дихлорид иттербия, и регистрацию электронных спектров поглощения ионов Yb(II) проводили, в инертном перчаточном боксе Glovebox Systemtechnik (содержание в атмосфере кислорода менее 0.0002% и влаги менее 0.00001%), оборудованном двумя шахтными печами, обычной и оптической.
Принимая во внимание высокую интенсивность спектральных полос, соответствующих разрешенным f–d электронным переходам, для регистрации ЭСП необходимо было использовать солевые смеси с низкой концентрацией ионов иттербия. Предварительно готовили относительно концентрированную солевую смесь NaCl–KCl–YbCl2, которую далее использовали для приготовления разбавленных расплавов. В качестве исходной использовали солевую смесь NaCl–KCl–YbCl3 с известным содержанием хлорида иттербия(III), которую смешивали со стехиометрическим количеством порошка металлического иттербия.
Полученную смесь помещали в танталовый тигель и выдерживали в печи, разогретой до 850°С, в течение 40–45 мин. Затем расплав сливали в холодный тигель. В полученной солевой смеси определяли концентрацию иттербия (фотометрически с Арсеназо I) и среднюю степень окисления иттербия (оксидиметрическим титрованием). В результате был получен солевой плав светло-зеленого цвета с содержанием иттербия 1.032 мас. % и средней степенью окисления иттербия n = 2.004.
Для регистрации ЭСП использовали двухканальный волоконно-оптический спектрометр AvaSpec-2048FT-2-SPU (Avantes). Эксперименты проводили в расплавах на основе эквимольной смеси NaCl–KCl (при 1023 К) и эвтектических смесей 6NaCl–5KCl–9CsCl (при 823–1023 K), 3LiCl–2KCl (при 723–1023 K) и 7LiCl–2KCl–3CsCl (при 623–1023 K). Контейнерами служили кварцевые оптические ячейки с толщиной слоя расплава в оптической части 1 см. Сперва в ячейку помещали чистую соль-растворитель (около 5 г), ячейку помещали в оптическую печь, разогретую до необходимой температуры и после расплавления соли проводили регистрацию фонового сигнала. Далее в ячейку сбрасывали навеску соли NaCl–KCl–YbCl2 (массой 0.01–0.07 г), расплав перемешивали и проводили регистрацию ЭСП. Операцию введения добавки соли с дихлоридом иттербия повторяли несколько раз для получения серии спектров при различных концентрациях Yb(II).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Примеры ЭСП исследованных расплавов, содержащих дихлорид иттербия, приведены на рис. 1. После добавления к расплаву соли-растворителя навески соли, содержащей YbCl2, возрастала оптическая плотность в области 300–500 нм. Спектр состоял из широкой полосы поглощения с максимумом около 370 нм и слабо выраженного плеча около 450 нм. Из рис. 1, видно, что добавление новой порции соли, содержащей дихлорид иттербия, приводило к увеличению оптической плотности вследствие увеличения концентрации ионов Yb(II). Для всех исследованных растворителей цвет расплава, содержащего хлорид иттербия(II), был желтый или желто-оранжевый; с увеличением концентрации дихлорида иттербия интенсивность окраски возрастала. Все исследованные расплавы, содержащие хлорид иттербия(II), сильно поглощают излучение в области 360–380 нм даже при относительно низкой концентрации ионов Yb(II) (порядка 0.001–0.006 моль/л). Столь высокая интенсивность хорошо согласуется с ожидаемой для f–d электронных переходов [5]. С увеличением концентрации Yb(II) положение основного максимума в ЭСП для всех исследованных расплавов смещалось в сторону меньших энергий (рис. 2). Так при повышении концентрации иттербия с 0.001 до 0.007 моль/л максимум смещался примерно на 15 нм, причем зависимость положения максимума от концентрации имела линейный характер.
Рис. 1.
Электронные спектры поглощения расплавов, содержащих хлорид иттербия(II): а – 7LiCl–2KCl–3CsCl, 923 К; б – 3LiCl–2KCl, 923 К; в – 6NaCl–5KCl–9CsCl, 823 К; г – NaCl–KCl, 1023 К. Концентрации указаны на графиках в моль/л.
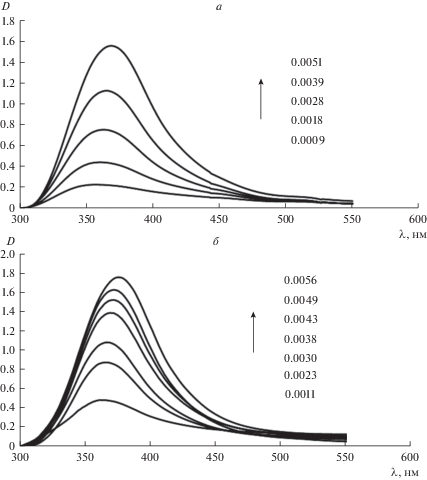
Рис. 1.
Окончание

Рис. 2.
Зависимость положения максимума в ЭСП от концентрации Yb(II) в расплавах различного катионного состава при 1023 К.

По экспериментальным ЭСП были рассчитаны коэффициенты молярного поглощения для всех исследованных расплавов. Коэффициенты экстинкции рассчитывали для каждого спектра в соответствии с ожидаемой концентрацией ионов иттербия. Затем значения, полученные в условиях каждого эксперимента, усредняли. Результаты расчетов для различных расплавов и температур представлены на рис. 3. Видно, что какой-либо однозначной тенденции изменения коэффициентов экстинкции с температурой для исследуемых расплавов не наблюдается, за исключением расплава 6NaCl–5KCl–9CsCl–YbCl2 для которого значения коэффициента молярного поглощения монотонно снижаются с увеличением температуры (табл. 1). Следует отметить, что для всех исследованных расплавов самые низкие значения коэффициентов экстинкции наблюдаются при 1023 К, т.е. наиболее высокой температуре.
Рис. 3.
Влияние температуры на коэффициенты экстинкции ионов Yb(II) в расплавах на основе: a – 7LiCl–2KCl–3CsCl; б – 3LiCl–2KCl; в – 6NaCl–5KCl–9CsCl; г – NaCl–KCl.
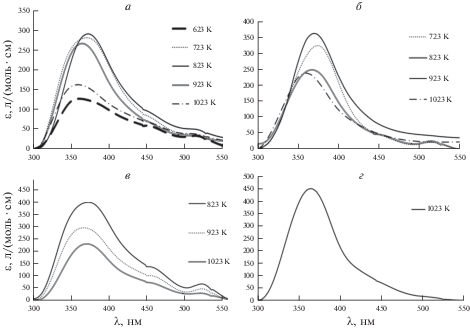
Таблица 1.
Характеристики максимумов в ЭСП ионов Yb(II) в расплавах хлоридов щелочных металлов
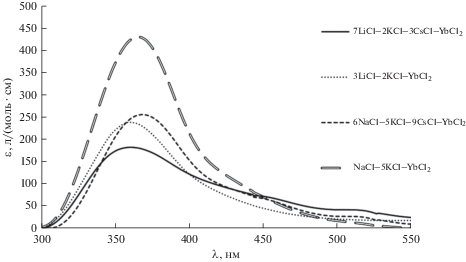
| Растворитель | Т, К | Положение максимума, нм | Коэффициент экстинкции, л/(моль · см) |
|---|---|---|---|
| 7LiCl–2KCl–3CsCl | 623 | 365 | 131 |
| 723 | 371 | 282 | |
| 823 | 372 | 292 | |
| 923 | 364 | 268 | |
| 1023 | 361 | 164 | |
| 3LiCl–2KCl | 723 | 371 | 322 |
| 823 | 365 | 248 | |
| 923 | 367 | 361 | |
| 1023 | 360 | 239 | |
| 6NaCl–5KCl–9CsCl | 823 | 367 | 395 |
| 923 | 360 | 293 | |
| 1023 | 369 | 230 | |
| NaCl–KCl | 1023 | 364 | 451 |
На рис. 4 проведено сравнение коэффициентов экстинкции ионов Yb(II) для четырех солей-растворителей: NaCl–KCl, 6NaCl–5KCl–9CsCl, 3LiCl–2KCl и 7LiCl–2KCl–3CsCl при 1023 К. Положение основного максимума в ЭСП практически не зависело от катионного состава расплава, разница составляла не более 10 нм. Явной тенденции влияния среднего ионного радиуса катионов соли-растворителя на величину коэффициента экстинкции выявлено не было.
Можно отметить рост значений коэффициентов экстинкции с ростом температуры плавления солевой смеси, от самой легкоплавкой 7LiCl–2KCl–3CsCl до самой тугоплавкой из рассмотренных, NaCl–KCl.
В литературе представлена очень скудная информация о ЭСП растворов дихлорида иттербия в расплавах хлоридов щелочных металлов. Представленные авторами [3] ЭСП имеют максимумы в области 300–330 нм, но концентрации иттербия в расплаве или значения коэффициентов экстинкции не приводятся. Поэтому детальное сравнение литературных спектров [3] и ЭСП, полученных в ходе данных исследований, является затруднительным. Профиль кривых электронных спектров поглощения в работе [3] схож с полученными в настоящей работе; авторы [3] также связывают природу пика с f–d переходом в комплексном хлоридном ионе иттербия(II).
Сравнение профилей ЭСП расплавов, содержащих хлориды Yb(II) и Yb(III), представлено на рис. 5. Видно, что форма ЭСП зависит от степени окисления иттербия. Для спектров растворов дихлорида иттербия характерен пик в области 360–380 нм с достаточно большими значениями коэффициентов экстинкции, 400–450 л/(моль · см). Для ЭСП растворов трихлорида иттербия в рассматриваемых солевых смесях характерен пик в районе 980 нм и два менее выраженных пика в области длин волн 940 и 960 нм. Данные пики соответствуют единственному электронному переходу 2F7/2 → 2F5/2 в комплексном ионе ${\text{YbCl}}_{6}^{{3 - }}$ (электронная конфигурация 4 f 13), возникновение трех полос связано с расщеплением возбужденного состояния на три штарковские компоненты. Коэффициенты экстинкции для этих полос относительно низкие и составляют 0.4–0.9 л/(моль · см). Так же в спектрах расплавов, содержащих трихлорид иттербия, необходимо отметить пик в области 340 нм со значениями коэффициентов экстинкции около 6–9 л/(моль · см); данный пик схож по форме с аналогичным для дихлорида иттербия.
Рис. 5.
Коэффициенты экстинкции ионов Yb(II) и Yb(III) в расплавах на основе: a – NaCl–KCl (1023 K); б – 6NaCl–5KCl–9CsCl (823 К).
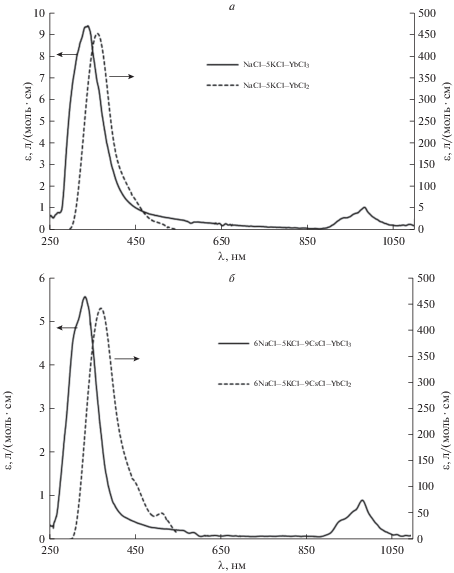
Возможно, что данный пик обусловлен небольшим термическим разложением трихлорида иттербия в исследуемых расплавах, что, безусловно, вносит свой вклад в профили ЭСП растворов трихлорида иттербия; с увеличением температуры интенсивность данного пика возрастает. Также в этой области можно ожидать проявления спектра переноса заряда (СПЗ) с лиганда на металл, но значения коэффициентов экстинкции для СПЗ существенно выше, чем отмечены для полосы около 340 нм в спектрах расплавов, содержащих ионы Yb(III). Достаточное большое различие между величинами коэффициентов экстинкции для ионов иттербия(II) и (III) обусловлено различной электронной конфигурацией. Для хлорида Yb(III) в исследуемых расплавах характерен f–f переход, для хлорида Yb(II) характерен f–d переход с большей энергией и большей интенсивностью ЭСП в ближней ультрафиолетовой области.
ВЫВОДЫ
Взаимодействие стехиометрических количеств трихлорида иттербия и металлического иттербия в среде расплавленной эквимольной смеси NaCl–KCl позволяет получить солевые смеси, содержащие дихлорид иттербия. Была выполнена регистрация электронных спектров поглощения разбавленных растворов приготовленного таким образом дихлорида иттербия в расплавах хлоридов щелочных металлов различного катионного состава: 3LiCl–2KCl (723–1023 K), NaCl–KCl (1023 К), 7LiCl–2KCl–3CsCl (623–1023 K) и 6NaCl–5KCl–9CsCl (823–1023 K). Показано, что в электронных спектрах поглощения ионов иттербия(II) присутствует интенсивный максимум в области 360–380 нм, обусловленный 4 f–5d электронным переходом в комплексном хлоридном ионе иттербия(II). Коэффициенты экстинкции, рассчитанные на основании экспериментальных данных, составили в максимуме 400–450 л/(моль · см). Влияния катионного состава расплава и температуры на положение максимумов не выявлено. Выполнено сравнение профилей ЭСП ионов Yb(II) и Yb(III) в рассмотренных расплавах.
Список литературы
Banks C.V., Heusinkveld M.R., O’Laughlin J.W. Absorption spectra of the lanthanides in fused lithium chloride-potassium chloride eutectic // Anal. Chem. 1961. 33. P. 1235–1240.
Volkovich V.A., Ivanov A.B., Yakimov S.M., Tsarevskii D.V., Golovanova O.A., Sukhikh V.V., Griffiths T.R. // AIP Conference Proceedings. 2016. 1767. P. 020023. https://doi.org/10.1063/1.4962607
Cho Y.-H., Kim T.-J., Park Y.-J., Im H.-J., Song K. // J. Luminescence. 2010. 30. P. 280–282. https://doi.org/10.1016/j.jlumin.2009.09.003
Иванов А.Б., Соболев А.А., Волкович В.А., Васин Б.Д. Электрохимическое и спектроэлектрохимическое исследование поведения иттербия в расплаве эвтектической смеси хлоридов натрия и цезия // Расплавы. 2015. № 1. С. 55–63.
van Pieterson L., Reid M.F., Wegh R.T., Soverna S., Meijerink A. // Physical review B. 2002. 65. № 045113. P. 1–16. https://doi.org/10.1103/PhysRevB.65.045113
Дополнительные материалы отсутствуют.