Растительные ресурсы, 2019, T. 55, № 2, стр. 259-267
Сезонная динамика терпеноидов эфирного масла Picea glauca в городских условиях
С. А. Ламоткин 1, *, Е. В. Гиль 1, Л. И. Романюк 1, Е. Д. Скаковский 2
1 Белорусский государственный технологический университет
г. Минск, Республика Беларусь
2 Институт физико-органической химии НАН Беларуси
г. Минск, Республика Беларусь
* E-mail: jossby@rambler.ru
Поступила в редакцию 26.10.2018
После доработки 21.11.2018
Принята к публикации 16.01.2019
Аннотация
Отбор образцов древесной зелени ели канадской, произрастающей на территории городского парка, проводился в течение года. Измерено содержание токсичных (Pb, Cd, Cu, Co, Ni, Mn, Cr, S) элементов в хвое, на основании чего определена степень загрязненности образцов промышленными полютантами. Из всех образцов выделено эфирное масло, измерен его выход и определены физико-химические характеристики. Показано, что колебание содержания масла в течение года составляет около 30%. Величины значений плотности и показателя преломления в указанный период изменялись незначительно и находились в пределах ошибки измерений. Методами газожидкостной хроматографии и ЯМР спектроскопии, проведен детальный анализ динамики накопления камфоры, борнилацетата, лимонена, камфена, α-пинена и 1,8-цинеола в эфирном масле ели канадской в течение календарного года. Установлены вариации основных компонентов эфирного масла в течение года. Показано, что высокое содержание камфоры и борнилацетата в эфирном масле в течение всего года позволяет использовать его в качестве сырья для получения биологически активных веществ.
Ель белая или ель канадская Picea glauca (Moench) Voss. – вечнозеленое древесное растение, вид рода Ель Picea, семейства Сосновые Pinaceae [1]. Ареал и место происхождения вида Северная Америка, от северной Аляски на западе до Ньюфаундленда на востоке. На севере территория распространения ограничена лесотундрой, на юге – севером штатов Монтана, Мичиган, Мэн, Висконсин. Также существуют изолированные популяции в Южной Дакоте и Вайоминге. Ель канадская представляет собой дерево высотой 15–20 м, редко до 40 м, диаметр ствола до 1 м. Род насчитывает 60 видов. Большинство видов имеет небольшие ареалы, и только немногие, как, например, ель канадская P. glauca, имеют весьма обширные ареалы [2].
Ель канадская является одним из наиболее используемых видов в озеленении, в то же время вся биомасса данного растения находит широкое практическое применение в различных отраслях промышленности [3].
Леса Республики Беларусь состоят на 60% из хвойных пород деревьев [4], при этом наиболее распространенным видом является сосна обыкновенная Pinus sylvestris L. и ель обыкновенная Picea abies (L.) H. Karst. Почвенно-климатические условия Беларуси благоприятны для произрастания не только аборигенных видов хвойных растений, но и интродуцированных. В дендрариях, ботанических садах Республики, а также для озеленения территорий города представлено около 13 видов елей, в том числе и ель канадская [5].
Эфирное масло ели канадской, как многие масла хвойных растений, обладает антибактериологическим и антиоксидантным эффектом [6–8].
Качество эфирного масла и получаемой продукции определяется количеством компонентов входящих в его состав. При этом существенное влияние на состав масла оказывает значительное количество факторов (сезонность, климатические условия, режимы питания и т.д.), и в том числе экологическая обстановка в местах произрастания [9]. В настоящее время наблюдается устойчивый интерес к исследованиям в области влияния различных факторов на качественный и количественный состав компонентов растительного сырья.
В связи с этим целью настоящей работы был анализ изменения содержания компонентов эфирного масла елей канадских P. glauca, произрастающих в одинаковых почвенно-климатических условиях, под действием одинаковых техногенных факторов, в течение календарного года.
МАТЕРИАЛ И МЕТОДЫ
В качестве объекта исследования были выбраны деревья ели канадской, произрастающие на территории городского парка г. Минска. Хвою отбирали с различных, рядом растущих 17 деревьев и получали усредненный образец. Это позволяет получить результаты исследований характеристик эфирного масла на 90%-ном доверительном уровне [10]. Пробы помещали в полиэтиленовые пакеты для минимизации потерь наиболее летучих компонентов. Из отобранных образцов хвои по методике, предложенной в работе [11], составляли сборную пробу, с которой и проводили дальнейшие эксперименты. Поскольку на выход и содержание основных компонентов эфирного масла оказывает влияние срок хранения отобранных образцов, поэтому для минимизации потерь компонентов выделение эфирного масла проводили не позднее чем через 4 ч после отбора [12].
Конкурирующими методами получения эфирных масел являются дистилляция и экстракция растворителями [13]. Для случая, когда эфирных масел в растении достаточно много (более 1%), предпочтительнее использовать метод перегонки с водяным паром. Отобранную хвою отделяли от стволиков, измельчали до размера 3–5 мм, составляли навеску от 200 до 250 г и из нее методом гидродистилляции в течение 16 ч отгоняли эфирное масло, а количественный выход определяли вольюметрически. Выход эфирного масла из навески хвои был рассчитан с учетом влажности на массу абсолютно сухого сырья (а. с. с.).
Важными физико-химическими характеристиками любого эфирного масла является показатель преломления и плотность. Величину этих показателей оценивали согласно [14].
Качественный и количественный анализ состава масел осуществляли методами газо-жидкостной хроматографии (ГЖХ) без предварительного фракционирования и спектроскопии ЯМР.
Хроматографический анализ выполняли на хроматографе Кристалл 5000.1 с использованием кварцевой капиллярной колонки длиной 60 м с нанесенной фазой 100%-ным диметилсилоксаном. Условия хроматографирования: изотермический режим при 70 °С в течение 20 мин, затем программированный подъем температуры со скоростью 2 °С/мин до 150 °С с выдержкой при конечной температуре 40 мин. Температура испарителя 250 °С. Идентификацию отдельных компонентов осуществляли с использованием эталонных соединений, а также на основании известных литературных данных по индексам удерживания [15].
Запись спектров ЯМР проводили на спектрометре AVANCE-500 (Германия) с рабочими частотами для ядер 1Н и 13С – 500 и 125 МГц, соответственно. Для количественного анализа образцов готовили растворы эфирных масел определенной концентрации в СDCl3 (1–10%). Химические сдвиги сигналов протонов соединений определяли по сигналу хлороформа (СНСl3, δ = 7.27 м. д.), который присутствует в качестве примеси в дейтерированном растворителе. Для детального анализа интенсивностей сигналов отдельных соединений в спектре учитывали релаксацию протонов всех групп ядер входящих в состав соединений.
При записи спектров 13С в качестве реперного также использовали сигнал растворителя (δ = 77.7 м. д.). Для количественного анализа спектры записывали с подавлением взаимодействия с протонами с использованием импульсных последовательностей, исключающих проявление эффекта Оверхаузера, и с задержками между импульсами >5 Т1, где Т1 – время спин-решеточной релаксации наиболее медленно релаксирующих ядер. Для уменьшения времени спин-решеточной релаксации в растворы добавляли трис-ацетилацетонат хрома (стандартный релаксант, используемый для записи спектров 13С в количественном режиме) в количестве 5% от массы навески исследуемого образца. Поскольку релаксант незначительно изменяет химические сдвиги ядер 13С компонентов эфирных масел, для контроля были записаны спектры доступных индивидуальных соединений, присутствующих в этих маслах: α-пинен, Δ3-карен, β-пинен, α-терпинеол, камфен, лимонен, борнилацетат, п-цимол, мирцен, β-фелландрен, α-фелландрен, β-кариофиллен, борнеол, γ-терпинен, терпинолен, камфора.
Минерализацию образцов хвои выполняли на приборе микроволновой подготовки МС-6 по методике, описанной в инструкции к прибору. Содержание элементов Pb, Cd, Cu, Co, Ni, Mn, Cr в хвое определяли методом атомно-абсорбционного анализа [16]. Определение S проводили методом нефелометрии по стандартной методике [17].
Измерения содержания металлов, серы и компонентов эфирного масла проводили в трехкратной повторности. Статистический анализ проводили в соответствии с методиками, изложенными в [18]. Результаты трех независимых измерений представлены как среднее арифметическое значение. Относительное среднеквадратичное отклонение, рассчитанное по трем параллельным измерениям, не превышало 5%.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Хорошо известно, что состояние лесов, а также содержание и состав эфирного масла напрямую зависят от степени загрязненности территории произрастания промышленными полютантами [19]. Основными токсикантами, воздействующими на хвойные растения и накапливающимися в них, являются соединения серы, в основном диоксид серы, и тяжелые металлы [20]. В исследованных образцах в течение года наблюдалось среднее содержание серы (930 мг/кг а. с. с.) и свинца (0.62 мг/кг а. с. с.). Полученные результаты по содержанию серы, свинца и ряда других элементов хорошо согласуются с данными работ [21, 22] и позволяют утверждать, что изучаемые ели произрастают на достаточно загрязненной территории. Следует отметить, что в весенне-летний период несколько возрастает содержание в хвое серы и свинца (на 7–10%), что объясняется высокой запыленностью городских насаждений в данный период. Содержание Cd, Co, Cu, Ni, Mn, Cr достаточно низкое (на уровне фоновых значений) и скорее всего не оказывает влияния на состав масла. В целом изменения содержания токсичных элементов в течение года незначительны и находятся в пределах ошибки измерений.
При оценке перспективности сырья древесной зелени для промышленного использования, получения биологически активных веществ необходимо было оценить выход эфирного масла. Выделенное еловое масло представляло собой жидкость светло-желтого цвета с древесно-хвойным запахом и жгучим вкусом, плотностью 0.861 ± 0.002. Мажорный букет елового масла: свежий, яркий, древесно-хвойный, травяная нота аира. Как видно из табл. 1, выход масла составлял 1.2–1.6% от массы используемого сырья, что согласуется с данными работы [23]. При этом наблюдаются два максимума содержания масла в мае и декабре. Высокое содержание масла в мае объясняется тем, что в данный период процессы биосинтеза протекают с максимальной скоростью. При этом в последующие месяцы количество эфирного масла уменьшается в первую очередь за счет интенсивного выделения основных компонентов в атмосферу. В осенние и зимние месяцы процессы биосинтеза заторможены, а низкие температуры затрудняют испарение эфирных масел, что способствует их сохранению в хвое и тем самым увеличению содержания терпеноидов.
Следует отметить, что достаточно низкое общее содержание масла связано прежде всего с произрастанием растений на загрязненной территории, где биосинтез масла ингибируется токсичными элементами. В свою очередь выход масла из растений, произрастающих в экологически чистых районах, выше и достигает более 2.5% [22].
Средняя величина показателя преломления эфирного масла в течение года составила 1.4732 ± 0.0001. Следует отметить, что величина показателя преломления является интегральной характеристикой и незначительно зависит от времени отбора образцов. Незначительные изменения показателя наиболее вероятно связаны с колебаниями количества основных компонентов эфирного масла в течение года.
Таблица 1.
Изменение выхода и содержания основных компонентов эфирного масла ели канадской Picea glauca в течение года Table 1. Variation in Picea glauca essential oil yield and content of major components throughout the year
| № | Компонент Component |
Содержание основных компонентов, % Content of the major components, % |
|||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Январь January |
Февраль February |
Март March |
Апрель April |
Май May |
Июнь June |
Июль July |
Август August |
Сентябрь September |
Октябрь October |
Ноябрь November |
Декабрь December |
||
| Выход масла % а.с.с. Oil yield % |
1.3 | 1.3 | 1.4 | 1.5 | 1.5 | 1.3 | 1.2 | 1.3 | 1.3 | 1.4 | 1.5 | 1.6 | |
| 1 | α-пинен α-pinene |
3.1 | 2.9 | 3.8 | 3.9 | 3.5 | 5.1 | 5.8 | 3.1 | 2.2 | 3.2 | 3.4 | 2.4 |
| 2 | Камфен Camphene |
6.0 | 6.7 | 5.3 | 5.2 | 4.9 | 4.4 | 4.2 | 4.7 | 5.3 | 5.3 | 5.9 | 6.6 |
| 3 | Лимонен Limonene |
6.2 | 5.2 | 4.5 | 3.2 | 2.2 | 1.3 | 1.7 | 4.1 | 4.9 | 5.4 | 6.1 | 6.3 |
| 4 | 1,8-цинеол 1,8-cineole |
2.1 | 2.6 | 3.2 | 4.8 | 9.4 | 8.8 | 6.2 | 3.4 | 2.8 | 2.9 | 2.3 | 2.3 |
| 5 | Камфора Camphor |
20.9 | 21.3 | 24.5 | 23.1 | 27.5 | 28.0 | 27.0 | 27.9 | 21.0 | 21.8 | 20.8 | 20.2 |
| 6 | Борнеол Borneol |
2.5 | 2.6 | 2.4 | 3.1 | 4.8 | 4.1 | 3.9 | 3.7 | 2.4 | 2.5 | 2.8 | 2.2 |
| 7 | Борнилацетат Bornyl acetate |
21.3 | 22.4 | 23.6 | 25.9 | 29.1 | 30.7 | 29.7 | 31.3 | 30.1 | 25.6 | 24.5 | 21.1 |
| Неидентифицированные Unidentified |
6.9 | 6.1 | 4.6 | 4.7 | 8.0 | 4.9 | 4.1 | 7.4 | 5.7 | 8.6 | 6.7 | 8.6 | |
| Монотерпеноиды Monoterpenoids |
35.1 | 36.5 | 36.4 | 37.9 | 32.0 | 24.9 | 25.4 | 22.1 | 23.0 | 28.1 | 32.8 | 33.1 | |
| Кислородсодержащие терпены Oxygen-containing terpenes |
54.9 | 54.2 | 53.1 | 54.1 | 56.4 | 66.1 | 65.9 | 68.0 | 67.4 | 60.1 | 57.2 | 58.1 | |
| Сесквитерпеноиды Sesquiterpenoids |
3.1 | 3.2 | 3.4 | 3.3 | 3.6 | 4.1 | 4.6 | 4.3 | 3.9 | 3.2 | 3.3 | 3.2 | |
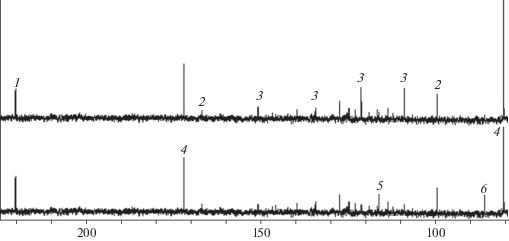
На рис. 1 представлены фрагменты спектров ЯМР 13С эфирных масел ели канадской, отобранные в декабре и июне месяце. Поскольку детальный анализ спектров ЯМР эфирного масла ели канадской с полным отнесением сигналов отдельных компонентов проводился ранее [24], на фрагментах показаны наиболее характеристичные сигналы атомов углерода веществ с высоким содержанием. Приведенные во фрагментах химические сдвиги 13С (δ, м. д.) атомов углерода камфоры – 220.2; камфена – 99.8; 166.9; лимонена – 109.1; 121.3; 134.3; 150.8; борнилацетата – 80.4; 171.9; α-пинена – 11.7; 145.2; 1,8-цинеола – 87.9. Как видно, качественно спектры подобны. Однако в спектре эфирного масла “зимнего” образца наблюдается значительно более интенсивный сигнал лимонена и камфена. В “летнем” образце наблюдается интенсивный сигнал 1,8-цинеола и α-пинена. Кроме того, основными соединениями, идентифицированными в спектре, были камфора и борнилацетат. Следует отметить, что интенсивности линий этих компонентов также отличаются.
Рис. 1.
Фрагмент спектра ЯМР 13С эфирного масла ели канадской Picea glauca, отогнанного в декабре (верхний спектр) и июле (нижний спектр) (Наиболее характеристичные сигналы). 1 – камфора, 2 – камфен, 3 – лимонен, 4 – борнилацетат, 5 – α-пинен, 6 – 1,8-цинеол. Fig. 1. Fragment of NMR-spectrum 13C of Picea glauca essential oil distilled in December (upper spectrum) and July (lower spectrum). 1 – camphor, 2 – camphene, 3 – limonene, 4 – bornyl acetate, 5 – α-pinene, 6 – 1,8-cineole.
В таблице представлены результаты хроматографического анализа выделенных масел. Как показано ранее, компонентный состав эфирного масла ели канадской весьма сложен и содержит около 130 компонентов [22]. Из них, используя эталонные соединения, было идентифицировано 45 индивидуальных веществ. Основными компонентами эфирных масел хвои ели канадской (содержание более 1%) являются: α-пинен, камфен, лимонен, 1.8-цинеол, камфора, борнилацетат, что согласуется с данными работы [25]. Как видно, содержание всех компонентов не постоянно и изменяется в течение года. Наиболее значительно меняется содержание таких компонентов как лимонен и 1,8-цинеол. Следует отметить изменения в групповом составе (см. табл. 1). В частности, в весенне-летний период содержание кислородсодержащих соединений и сесквитерпеновых углеводородов возрастает, а монотерпеновых – снижается. Такая картина, в целом, характерна для составов эфирных масел хвойных растений. Интенсивные процессы биосинтеза в сочетании с высокими среднесуточными температурами способствуют ускорению образованию в первую очередь кислородсодержащих соединений. Следует отметить, что в эфирном масле на протяжении всего года наблюдается высокое содержание камфоры и борнилацетата (порядка 40%). Такое высокое содержание данных компонентов позволяет использовать эфирное масло ели канадской в качестве источника биологически активных веществ и сырья для производства.
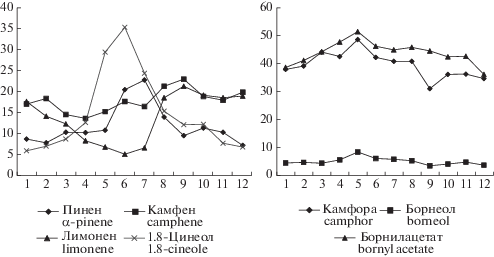
Согласно данным работы Э.Д. Левина [26], процесс биосинтеза терпенов для семейства Pinaceae не тормозится на стадии получения отдельного терпена. На рис. 2 представлена динамика изменения содержания основных компонентов масла внутри соответствующих групп. В весенне–летний период снижение содержания пинена и камфена и увеличение в это время содержания камфоры и борнилацетата может быть следствием взаимосвязи путей их биосинтеза, что согласуется с данными [27]. Как видно содержание лимонена резко снижается в весенне–летний период, а выход 1,8-цинеола напротив возрастает. Это также может указывать на то, что данные компоненты связаны между собой процессами биосинтеза. Активное участие лимонена в процессах биосинтеза подтверждается схемой образования терпеноидов [27].
Рис. 2.
Динамика изменения основных компонентов эфирного масла ели канадской Picea glauca в течение года. По горизонтали – месяцы; по вертикали – содержание, %. Fig. 2. Dynamics of Picea glauca essential oil major components throughout the year. X-axis – months; y-axis – containing, %.
ЗАКЛЮЧЕНИЕ
Таким образом, из всех образцов древесной зелени ели канадской Picea glauca (Moench) Voss. выделено эфирное масло, измерен его выход и физико-химические характеристики. Показано, что количество масла изменяется в течение года на величину около 30%. Методами газожидкостной хроматографии и ЯМР спектроскопии проведен детальный анализ динамики накопления камфоры, борнилацетата, лимонена, камфена, α-пинена и 1,8-цинеола в эфирном масле ели канадской, произрастающей на территории городских парков в течение года. Антибатное изменение содержания пинена, камфена и камфоры, борнилацетата, а также лимонена и 1,8-цинеола, вероятно, указывает на взаимосвязь реакций их биосинтеза. Высокое содержание камфоры и борнилацетата в эфирном масле в течение всего года позволяет использовать его в качестве сырья для получения биологически активных веществ.
Список литературы
Marie-Victorin F. 1964. Flore Laurentienne. Les Presses de l’Université de Montréal. Montréal. 925 p.
Farjon A., Page C.N. 1999. Conifers: Status survey and conservation action plan. Gland: IUCN. 133 p. https://portals.iucn.org/library/sites/library/files/documents/1999-024.pdf
Royer M., Houde R., Stevanovic T. 2013. Non-wood forest products based on extractives – A new opportunity for Canadian forest industry. P. 2. Softwood Forest Species. – J. Food Res. 2(5): 164–189. https://doi.org/https://doi.org/10.5539/jfr.v2n5p164
Охрана окружающей среды в Республике Беларусь: статистический сборник. 2007. Минск. 206 с.
Шкутко Н.В. 1991. Хвойные Белоруссии. Минск. 264 с.
Kıvanç A., Akgül A. 1986. Antibacterial activities essential oils from Turkish spices and citrus. – Flavour and fragrance Journal. 1(4–5): 175–179. https://doi.org/https://doi.org/10.1002/ffj.2730010409
Сидорович Е.А., Сергейчик С.А., Сергейчик А.А. 1990. Оптимизация промышленно-городской среды средствами озеленения. Минск. 63 с.
Teissedre P.L., Waterhouse A.L. 2000. Inhibition of oxidation of human low-density lipoproteins by phenolic substances in different essential oils varieties. – J. Agric. Food Chem. 48(9): 3801–3805. https://doi.org/https://doi.org/10.1021/jf990921x
Судачкова Н.Е., Шеин И.В., Романова Л.И. 1997. Биохимические индикаторы стрессового состояния древесных растений. Новосибирск. С. 129–134. http://www.rfbr.ru/rffi/ru/books/o_67633
Лобанов В.В., Степень Р.А. 2004. Влияние биоценотических факторов на содержание и состав пихтового масла. – Хвойные бореальной зоны. 2(2): 148–156.
Чернодубов А.И., Дерюжкин Р.И. 1990. Эфирные масла сосны: состав, получение, использование. Воронеж. 112 с.
Ткачев А.В., Королюк Е.А., Юсубов М.С., Гурьев А.М. 2002. Изменение состава эфирного масла при разных сроках хранения сырья. – Химия раст. сырья. 1: 19–30.
Orav A., Koel M., Kailas T., Müürisepp M. 2010. Comparative analys of the composition of essential oils and supercritical carbon dioxide extracts from the berries and needles of estonian juniper (Juniperus communis L.). – Proc. Chem. 2(1): 161–167. (In English). https://doi.org/https://doi.org/10.1016/j.proche.2009.12.023
Масла эфирные, вещества душистые и полупродукты их синтеза. Методы определения плотности и показателя преломления. 1978. ГОСТ 14618.10–78.
Mardarowicz M., Wianowska D., Dawidowicz A.L., Sawicki R. 2004. Comparison of terpen composition in Engelmann spruce (Picea Engelmann) using hydrodistillation. SPME and PLE. – Zeitschrift für Naturforschung C. 59(9–10): 641–648. (In English) https://doi.org/https://doi.org/10.1515/znc-2004-9-1006
Чудинов Э.Г. 1990. Аналитическая химия: Т. 2. Атомно-эмиссионный анализ с индукционной плазмой. С. 243–253.
Ринькис Г.Я., Рамане Х.К., Куницкая Т.А. 1987. Методы анализа почв и растений. Рига. С. 196.
Остакин А.И. и др. 1989. Применение методов в ЭВМ. Планирование и обработка результатов эксперимента. Минск. 218 с.
Derome J., Lindroos A.J. 1998. Effects of heavy metal contamination on macronutrient availability and acidification parameters in forest soil in the vicinity of the Harjavalta Cu–Ni Smelter, SW Finland. – Environ Pollut. 99(2): 225-232. https://doi.org/https://doi.org/10.1016/S0269-7491(97)00185-1
Сарнацкий В.В. 2009. Ельники: формирование, повышение продуктивности и устойчивости в условиях Беларуси. Минск. 334 с.
Логинов В.Ф. 2010. Состояние природной среды Беларуси. Экологический бюллетень. Минск. 10 с.
Ламоткин С.А., Владыкина Д.С., Скаковский Е.Д. 2012. Зависимость состава эфирного масла ели канадской Picea glauca (Moench) Voss. от экологической обстановки региона произрастания. – Химия раст. сырья. 2: 111–117.
Francezon N., Stefanovic T. 2017. Chemical composition of essential oil and Hydrosol from mariana bark residue. – Bioresources. 12(2): 2635–2645. https://doi.org/https://doi.org/10.15376/biores.12.2.2635-2645
Скаковский Е.Д., Тычинская Л.Ю., Гайдукевич О.А., Матвейчук С.В., Киселев В.П., Ламоткин С.А., Владыкина Д.С. 2012. Экологический мониторинг на основе анализа методом ЯМР состава эфирного масла хвои ели канадской. – Журн. прикл. спектроскопии. 79(3): 482–487.
Koçak A., Kılıç Ö. 2014. Identifiction of essential oil composition of four Picea Species from Canada. – J. Agric. Sci. Technol. B. 4: 209–214. http://www.davidpublisher.org/Public/uploads/Contribute/552f519a86fab.pdf
Левин Э.Д., Репях С.М. 1984. Переработка древесной зелени. М. 120 с. https://www.booksite.ru/fulltext/rusles/repah/text.pdf
Племенков В.В. 2005. Химия изопреноидов. Глава 3. Биосинтез изопреноидов. – Химия растит. сырья. 3: 91–108.
Дополнительные материалы отсутствуют.
Инструменты
Растительные ресурсы


