Растительные ресурсы, 2019, T. 55, № 3, стр. 293-316
Успехи в изучении компонентного состава и биологической активности Sanguisorba officinalis (Rosaceae)
А. Л. Буданцев 1, *, Л. М. Беленовская 1, Н. В. Битюкова 1
1 Ботанический институт им. В.Л. Комарова РАН
г. Санкт-Петербург, Россия
* E-mail: budantsev@binran.ru
Поступила в редакцию 21.03.2019
После доработки 25.03.2019
Принята к публикации 17.04.2019
Аннотация
Обзор составлен по результатам публикаций, посвященных изучению компонентного состава и биологический активности Sanguisorba officinalis. Наиболее подробно анализируется разнообразие тритерпеноидов (с приведением структурных формул), которые накапливаются как в подземных, так и в надземных органах и частях этого растения. В последние десятилетия обнаружено свыше 50 тритерпеноидов, относящихся к урсановому, олеанановому, лупановому и даммарановому типам. Также приведены сведения об обнаружении новых и известных фенольных соединений (фенолкарбоновых кислот и их производных, фенилпропаноидов, флавоноидов, лигнанов и других групп вторичных метаболитов). Результаты фармакологических исследований S. officinalis показали, что экстракты, их фракции, а также отдельные компоненты (некоторые тритерпеноиды, лигнаны, фенилпропаноиды и др.) проявляют разные типы биологической активности, в частности, цитотоксическую, антибактериальную, антивирусную, противовоспалительную, антиоксидантную, а также обладают гепатопротективными, нейропротективными, гиполипидемическими и другими свойствами.
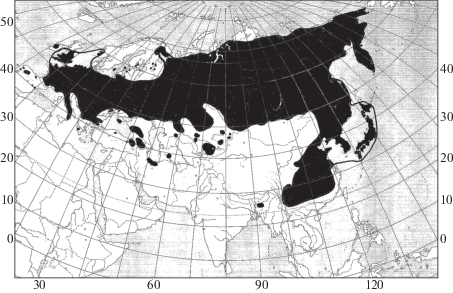
Род Sanguisorba L. – кровохлебка насчитывает около 30 видов, распространенных в умеренных областях Евразии и в Северной Америке. В России встречается около 6 видов этого рода в европейской части (в основном в центральных областях), в Западной и Восточной Сибири и на Дальнем Востоке. Наибольший ареал, практически совпадающий с ареалом рода, занимает S. officinalis L. – кровохлебка лекарственная, распространенная от Атлантической Европы до Восточной Азии (рис. 1), а также на западе и в качестве, вероятно, заносного растения на востоке Северной Америки. Произрастают виды кровохлебки на лугах, лесных опушках, сырых местах, болотах и горных склонах, поднимаясь до 3900 м над ур. моря (S. diandra (Hook. f.) Nordborg в Китае). На суходольных лугах в ряде районов Забайкалья S. officinalis принадлежит к числу доминирующих растений в составе кровохлебково-разнотравных ассоциаций. Нередко крупные заросли этот вид образует на пойменных лугах и по берегам водоемов. Виды рода Sanguisorba представляют собой многолетние травы с довольно мощным горизонтальным корневищем и непарно перисто-сложными листьями. Цветки у кровохлебок собраны в довольно плотные головчатые или колосовидные соцветия с простым околоцветником (чашечка отсутствует) красного, розоватого или белого цвета [111, 222, 333, 444, 555–8].
Рис. 1.
Распространение Sanguisorba officinalis в Евразии. Fig. 1. Distribution of Sanguisorba officinalis in Eurasia.
Некоторые виды рода Sanguisorba используются как лекарственные растения, в частности в Китае к ним относятся S. stipulata Rafin. и S. filiformis (J. D. Hooker) Handel-Mazz. Наибольшую же известность получила кровохлебка лекарственная. В традиционных медицинах восточных стран все части этого растения, особенно корни (фактически чаще всего корневища с корнями), используются как вяжущее средство, а также при внутренних кровотечениях (отсюда произошло и название рода от лат. sanguis – кровь, sorbere – поглощать), менопаузе, экземе. В Корее сухие корни применяют при аллергических кожных реакциях, в том числе при крапивнице, аллергических дерматитах [9, 10 ] . В России корневища и корни S. officinalis являются официнальным сырьем. Они в виде отвара используются в качестве вяжущего, антисептического и кровоостанавливающего средства при заболеваниях желудочно-кишечного тракта, маточных кровотечениях и воспалительных процессах полости рта [1166].
В химическом и фармакологическом отношениях S. officinalis изучали наиболее подробно. Так, в частности, известно, что в подземной и надземной частях этого растения накапливается богатый набор фенольных соединений (фенолкарбоновых кислот и их производных, флавоноидов, антоцианов, катехинов и др.). Одной из характерных особенностей S. officinalis (а может быть и рода Sanguisorba?) является присутствие разнообразных по структуре тритерпеноидов, что в общем не свойственно видам розоцветных умеренных широт [1277].
В недавнее время опубликовано несколько обзоров, в которых в той или иной степени подробности и полноты описано химическое разнообразие и результаты фармакологических исследований S. officinalis [10, 13, 14 ] . Тем не менее даже за последние два года появились новые данные о компонентном составе и биологической активности этого вида, также включенные в данный обзор.
КОМПОНЕНТНЫЙ СОСТАВ SANGUISORBA OFFICINALIS
Терпеноиды
Основными компонентами корневищ и корней S. officinalis, определяющими в значительной степени ее биологическую активность, являются тритерпеноиды. К настоящему времени из этого растения выделены и исследованы структуры более 50 соединений, относящихся к урсановому, олеанановому, даммарановому и лупановому структурным типам (см. табл. 1).
Таблица 1.
Тритерпеноиды, выделенные из Sanguisorba officinalis Table 1. Triterpenoids from Sanguisorba officinalis
| N | Name | Structure | References |
|---|---|---|---|
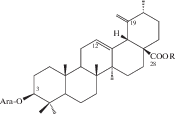
| 1 | Sanguisorbin | 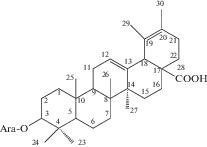 |
15–19 |
| 2 | Sanguisorbin B | 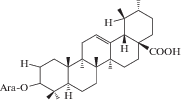 |
10, 20 |
| 3 | Sanguisorbin E | 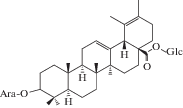 |
10, 20 |
| 4 | Ziyu-glycoside I | 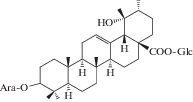 |
19, 21 |
| 5 | Ziyu-glycoside II | 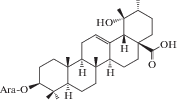 |
15, 16, 19, 22, 23 |
 |
|||
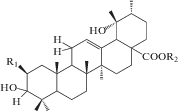
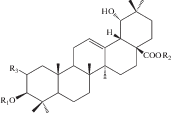
| 6 | Pomolic acid-28-O-β-D-glucopyranoside (28-O-β-D-glucopyranosyl-pomolic acid ester) | R1 = H; R2 = Glc | 22, 24 |
| 7 | 2α,3α,19α-Trihydroxyurs-12-en-28-oic acid | R1 = ОH; R2 = H | 22, 25 |
| 8 | 3-Oxo-19α-hydroxyurs-12-en-28-oic acid | 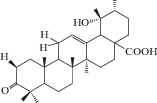 |
22 |
| 9 | 3,11-Dioxo-19α-hydroxyurs-12-en-28-oic acid | 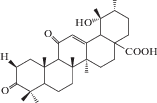 |
22 |
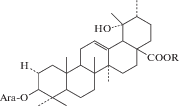 |
|||
| 10 | 3-O-α-L-Arabinopyranosylpomolic acid | R = OH | 26 |
| 11 | 3-O-α-L-Arabinopyranosyl-28-O-β-D-glucopyranosylpomolic acid | R = Glc | 26 |
 |
|||
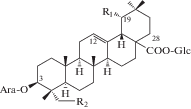
| 12 | 3β-[(α-L-Arabinopyranosyl)oxy]-19α-hydroxyolean-12-en-28-oic acid 28-β-D-glucopyranosyl ester | R1 = OH; R2 = H | 25 |
| 13 | 3β-[(α-L-Arabinopyranosyl)oxy]-23-hydroxyolean-12-en-28-oic acid 28-β-D-glucopyranosyl ester | R1 = H; R2 = OH | 25 |
 |
|||
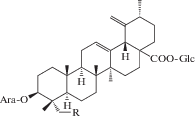
| 14 | 3β-[α-L-Arabinopyranosyl)oxy]-urs-12,19(20)-dien-28-oic acid 28-β-D-glucopyranosyl ester | R = H | 21, 25 |
| 15 | 3β-[(α-L-Arabinopyranosyl)oxy]-23-hydroxyurs-12,19(29)-dien-28-oic acid 28-β-D-glucopyranosyl ester | R = OH | 25 |
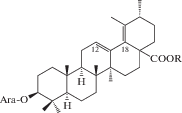 |
|||
| 16 | 3β-[(α-L-Arabinopyranosyl)oxy]-urs-12,18-dien-28-oic acid | R = H | 25, 27 |
| 17 | 3β-[(α-L-Arabinopyranosyl)oxy]-urs-12,18-dien-28-oic acid 28-β-D-glucopyranosyl ester | R = Glc | 27 |
|
|||
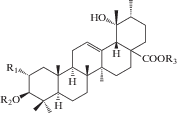
| 18 | 3β-[(α-L-Arabinopyranosyl)oxy]-19α-hydroxyurs-12-en-28-oic acid 28-[6-O-galloyl-β-D-glucopyranosyl] ester | R1 = H; R2 = Ara; R3 = (6-Galloyl)-Glc | 25 |
| 19 | 3β,19α-Dihydoxyurs-12-en-28-oic acid | R1 = R2 = R3 = H | 25 |
| 20 | 3β,19α-Dihydroxyurs-12-en-28-oic acid 28-β-D-glucopyranoside (3β,19α-Dihydroxyurs-12-en-28-oic acid 28-β-D-glucopyranosyl ester) |
R1 = R2 = H; R3 = Glc | 25, 28 |
| 21 | 2α,3β,19α-Trihydroxyurs-12-en-28-oic acid 28-β-D-glucopyranosyl ester | R1 = OH; R2 = H; R3 = Glc | 25 |
| 22 | 3β-[(α-L-Arabinopyranosyl)oxy]-19α-hydroxyurs-12-en-28-oic acid | R1 = H; R2 = Ara; R3 = H | 25 |
| 23 | 3β-[(α-L-Arabinopyranosyl)oxy]-19α-hydroxyurs-12-en-28-oic acid 28-β-D-glucopyranosyl ester | R1 = H; R2 = Ara; R3 = Glc | 25 |
|
|||
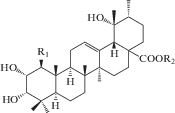
| 24 | 1β,2α,3α,19α-Tetrahydroxyurs-12-en-28-oic acid | R1 = OH; R2 = H | 25 |
| 25 | 2α,3α,19α-Trihydroxyurs-12-en-28-oic acid 28-β-D-glucopyranosyl ester | R1 = H; R2 = Glc | 25 |
|
|||
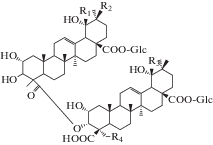
| 26 | Sanguidioside A | R1 = CH3; R2 = H; R3 = H; R4 = H; C-3 = βOH; C-4(S) | 23 |
| 27 | Sanguidioside B | R1 = CH3; R2 = H; R3 = CH3; R4 = H; C-3 = αOH; C-4(R) | 23 |
| 28 | Sanguidioside C | R1 = H; R2 = CH3; R3 = H; R4 = H; C-3 = βOH; C-4(S) | 23 |
| 29 | Sanguidioside D | R1 = H; R2 = CH3; R3= CH3; R4 = OH; C-3 = βOH; C-4(S) | 23 |
| 30 | 3β-[(α-L-Arabinopyranosyl)oxy]-19β-hydroxyurs-12,20(30)-dien-28-oic acid | 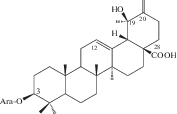 |
27 |
| 31 | 3β-[(α-L-Arabinopyranosyl)oxy]-urs-11,13(18)-dien-28-oic acid 28-β-D-glucopyranosyl ester | 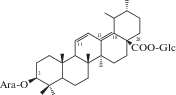 |
27 |
| 32 | 2α,3α,23-Trihydroxyurs-12-en-24,28-dioic acid 28-β-D-glucopyranosyl ester | 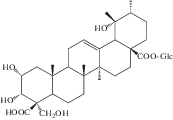 |
27 |
| 33 | 3β-[(α-L-Arabinopyranosyl)oxy]-urs-12,19(20)-dien-28-oic acid | 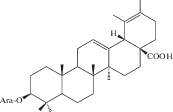 |
27 |
 |
|||
| 34 | 3β-[(α-L-Arabinopyranosyl)oxy]-urs-12,19(29)-dien-28-oic acid | R = H | 27 |
| 35 | 3β-[(α-L-Arabinopyranosyl)oxy]-urs-12,19(29)-dien-28-oic acid 28-β-D-glucopyranosyl ester | R = Glс | » |
|
|||
| 36 | 3β-[(α-L-Arabinopyranosyl)oxy]-19α-hydroxyolean-12-en-28-oic acid | R1 = Ara; R2 = H; R3 = H | 27 |
| 37 | 3β,19α-hydroxyolean-12-en-28-oic acid 28-β-D-glucopyranoside1 | R1 = OH; R2 = Glc; R3 = H | 28 |
| 38 | 2α,3α,19α-Trihydroxyolean-12-en-28-oic acid 28-β-D-glucopyranosyl ester | R1 = OH; R2 = Glc; R3 = OH | 21 |
| 39 | 2α,3β-Dihydroxy-28-norurs-12,17,19(20),21-tetraen-23-oic acid | 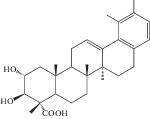 |
27 |
| 40 | Octanordammar-1,11,13,(17)-trien-17-ol-3,16-dione | 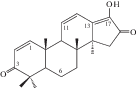 |
29 |
| 41 | Lup-12-en-15α,19β-diol-3,11-dioxo-28-oic acid | 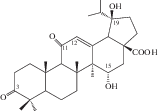 |
29 |
| 42 | 3β-O-α-L-Arabinopyranosyl-19-oxo-18,19-secours-11,13(18)-dien-28-oic acid 28-O-β-D-glucopyranosyl ester (sanguisoside A) | 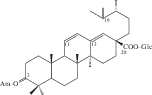 |
21 |
| 43 | 3β-[(α-L-Arabinopyranosyl)oxy]-19α,23-dihydroxyolean-12-en-28-oic acid 28-[(6-O-acetyl)-β-D-glucopyranosyl] ester | 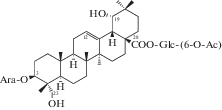 |
30 |
| 1Название приведено в соответствии с авторским (Sun W. et al., 2012). | |||
| 44 | 2α,3β,19α,23-Tetrahydroxyurs-12-en-28-oic acid 28-[6-O-acetyl-β-D-glucopyranosyl] ester | 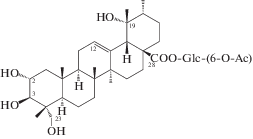 |
» |
| 45 | 3β-[(α-L-Arabinopyranosyl)oxy]-19α-hydroxyurs-12,20(30)-dien-28-oic acid 28-[6-O-acetyl-β-D-glucopyranosyl] ester | 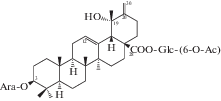 |
» |
| 46 | 12β-O-Acetyl-3β,22-dihydroxy-23,24,25,26,27-pentanordammarane | 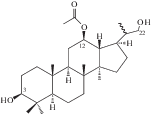 |
31 |
| 47 | 12β,22-Dihydroxy-3-oxo-23,24,25,26,27-pentanordammarane | 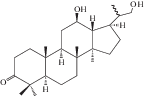 |
31 |
| 48 | 3β,12β-Dihydroxy-23,24,25,26,27-pentanordammarane-22-carbaldehyde | 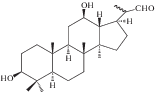 |
31 |
| 49 | 1β-Hydroxyeuscaphic acid | 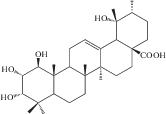 |
31 |
| 50 | (2α,3β,4β,19β)-Tetrahydroxyolean-12-en-28-oic acid 28-β-D-glucopyranosyl ester (sericoside) | 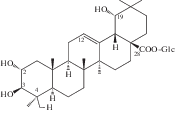 |
32 |
| 51 | 3β-[(α-L-Arabinopyranosyl)oxy]-urs-12,18-dien-28-oic acid β-D-glucopyranosyl ester | 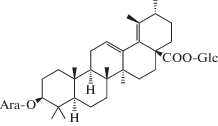 |
32, 33 |
В самых ранних исследованиях подземной части S. officinalis был выделен тритерпеновый сапонин сангвисорбин (1), агликон которого был назван сангвисорбигенином [15, 16 ] . Исследования структуры сангвисорбигенина показали, что это соединение идентично по cвоим химическим и физическим свойствам томентосоловой (19-дегидро-20-эпиурсоловой) кислоте [17, 34]. Структура сангвисорбина была определена как 3-L-арабинозид сангвисорбигенина. Кроме сангвисорбина был выделен моноацетилированный гликозид, названный варемоконином, который при щелочном гидролизе образовывал сангвисорбин. Были высказаны предположения о структуре этого соединения [18, 19 ] , однако его идентификация не была завешена полностью.
Российские исследователи обнаружили в корнях S. officinalis урсоловую и помоловую кислоты в свободном виде, а также выделили несколько гликозидов тритерпеновой природы, названных сангвисорбинами A, B, C, D, E и F. Было установлено, что их агликоном является урсоловая кислота. Структура сангвисорбина В (2) была установлена как β-L-арабинопиранозил-3-урсоловая кислота, а структура сангвисорбина Е (3) – как β-L-арабинопиранозил-3-урсано-28-β-(3-ацетил)-D-глюкопиранозид [20 ] (сведения о структуре остальных соединений авторами не приводятся).
Химическое исследование с применением метода бактериального гидролиза метанольного экстракта из корней и корневищ привело к обнаружению двух гликозидов помоловой кислоты, структуры которых были установлены как 3-О-α-L-арабинопиранозил-28-О-β-D-глюкопиранозилпомоловая кислота и 3-О-α-L-арабинопиранозилпомоловая кислота, которые были названы зию-гликозидом I (4) и зию-глюкозидом II (5) соответственно [19 ] . Дальнейшие исследования подземной части S. officinalis привели к выделению ряда других производных помоловой кислоты: эфира 28-О-β-D-глюкопиранозилпомоловой кислоты (6), 3-оксо- и 3,11-диоксо-производных (8, 9), гликозидированные в 3-м и 28-м положениях производные помоловой кислоты (10, 11), а также известные ранее кислоты урсанового типа структуры (7, 19, 24) [22, 24, 25 ] . Позднее были обнаружены другие известные свободные кислоты урсанового ряда (16, 30, 33, 34) и их 28-О-β-D-глюкопиранозиловые эфиры (12–15, 17, 20, 21, 23, 31, 32, 35) [27, 28, 32, 33]. В 2005 г. Х. Liu с соавторами сообщили о выделении нового 28-норурсанового тритерпеноида – 2α,3β-дигидрокси-28-норурс-12,17,19(20),21-тетраен-23-овой кислоты (39), содержащего ароматическое кольцо [27].
Почти в это же время китайские химики опубликовали результаты исследования состава корней (корневищ), законченные выделением некоторых тритерпеноидов урсанового типа, а именно сангвисозида А (42) – нового тритерпеноида 19-оксо-18,19-ceко-урсанового типа и новых ацетилглюкопиранозиловых эфиров: (6-O-ацетил)-β-D-глюкопиранозилового эфира 2α,3β,19α,23-тетрагидроксиурс-12-ен-28-овой кислоты (43) и (6-O-ацетил)-β-D-глюкопиранозилового эфира 3β-[(α-L-арабинопиранозил)окси]-19α-гидроксиурс-12,20(30)-диен-28-овой кислоты (44) [21, 30].
Большинство тритерпеноидов олеананового типа, выделенных из подземной части S. officinalis, являются производными 19α-гидроксиолеан-12-ен-28-овой кислоты. Помимо известных ранее глюкопиранозиловых эфиров олеананового типа структуры (13, 50) были обнаружены новые соединения: 3β-[(α-L-арабинопиранозил)окси]-19α-гидроксиолеан-12-ен-28-овая кислота (36) и ее β-D-глюкопиранозиловый эфир (12), а также β-D-глюкопиранозид 3β,19α-гидроксиолеан-12-ен-28-овой кислоты (37) и [(6-О-ацетил)-β-D-глюкопиранозиловый] эфир 3β-[(α-L-арабинопиранозил)окси]-19α,23-дигидроксиолеан-12-ен-28-овой кислоты (43) [25, 27, 28, 30].
В 2004 г. впервые в роде Sanguisorba были обнаружены четыре новых димерных тритерпеноида, названные сангвидиозидами A, B, C и D (26–29). Их мономерными единицами являются производные урсоловой и олеаноловой кислот, одно из которых оказалось новым (2α,3α,19α-тригидроксиурс-12-ен-24,28-диовая кислота) и было названо сангвиковой кислотой. Из продуктов щелочного гидролиза сангвидиозидов был также выделен тритерпеновый димер сангвидиогенин E [23 ] .
Наряду с соединениями урсанового и олеананового типа в корневищах и корнях кровохлебки лекарственной были обнаружены компоненты даммаранового – октанордаммар-1,11,13(17)-триен-17-ол-3,16-дион (40) и лупанового типов – луп-12-ен-5α,19β-диол-3,11-диоксо-28-овая кислота (41) [29]. В 2015 г. к известным ранее компонентам даммарановой природы добавились еще три: 12β-О-ацетил-3β,22-дигидрокси-23,24,25,26,27-пентанордаммаран (46), 12β,22-дигидрокси-3-оксо-23,24,15,26,27-пентанордаммаран (47) и 3β,12β-дигидрокси-23,24,25,26,27-пентанордаммаран(48) [31].
Кроме тритерпеноидов в подземной части S. officinalis содержатся монотерпеновые гликозиды, в частности цитронеллол-О-α-L-арабинофуранозил-(1 → 6)-β-D-глюкопиранозид, гераниол-1-О-α-L-арабинопиранозил-(1 → 6)-β-D-глюкопиранозид и гераниол-1-О-α-L-(α-L-арабинопиранозил-(1 → 6)-β-D-глюкопиранозид) [28].
Фенолкарбоновые кислоты и их производные
Из ацетонового экстракта свежей подземной части, наряду с галловой, эллаговой кислотами и ее производным эвгенином, были выделены новая фенольная кислота – дилактон сангвисорбовой кислоты и новые эллаготаннины, названные сангвиинами Н-1, Н-2 (структуры охарактеризованы предварительно) и Н-3. На основании данных химического и спектрального анализа показано, что дилактон сангвисорбовой кислоты является тримером галловой кислоты и структурным изомером дилактона валоновой кислоты. В результате исследования продуктов частичного гидролиза сангвиина Н-3 оказалось, что он имеет новую димерную структуру, содержащую 2,3-(гексагидроксидифеноил)глюкозу и сангвиин Н-2 [35]. Дальнейшие исследования G. Nonaka с коллегами привели к выделению других эллаготаннинов – сангвиина Н-6 с димерной структурой и нового тетрамерного таннина сангвиина Н-11, а также к обнаружению известных полифенолов гамбриинов А-1 и В-3 [36–38]. В корнях были также обнаружены новые галлоилпроизводные: 6-О-галлат, 6-О-дигаллат, 4,6-ди-О-галлат, 2,3,6-три-О-галлат, 3,4,6-три-О-галлат и 2,3,4,6-тетра-О-галлат метил-β-D-глюкопиранозида, а также 3-О-β-D-(6'-O-галлоил)глюкопиранозид галловой кислоты [39]. Среди фенольных компонентов S. officinalis встречаются также галлоилпроизводные углеводов. Так, в экстракте корней и корневищ было установлено наличие 1,2,6-три-О-галлоилглюкозы, 1,2,3,6-, 2,3,4,6-тетра-О-галлоилглюкозы и 1,2,3,4,6-пента-О-галлоилглюкозы [37]. Кроме них наряду с известной 2',5‑ди-О-галлоилхамамелозой (хамамелитаннином) впервые из подземной части была выделена 2',3,5-три-О-галлоилхамамелоза [40]. Из числа фенолкарбоновых кислот в подземной части S. officinalis были установлены в свободном виде феруловая, 3,4'-ди-О-метилэллаговая, 3,3',4-три-О-метилэллаговая и 3,4,4'- и 3,3',4'-три-О-метилэллаговая кислоты, а также их эфиры и гликозиды, в том числе новое соединение – метил-3-(β-D-глюкопиранозилокси)-4-гидрокси-5-метоксибензоат [41–44].
Фенилпропаноиды
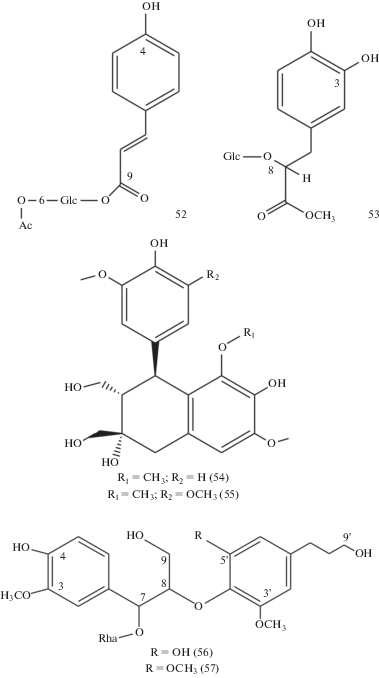
Из корней были выделены два новых фенилпропаноидных гликозида – 9-O-[(6-O-ацетил)-β-D-глюкопиранозил]-4-гидроксикоричная кислота (рис. 2, 52) и 8-O-β-D-глюкопиранозил-(R)-(+)-3,4,8-тригидрокси-метилфенилпропионат (рис. 2, 53), а также известный гликозид мииагенин [33, 45].
Рис. 2.
Некоторые фенилпропаноиды и лигнаны, выделенные из Sanguisorba officinalis L. Fig. 2. Some phenylpropanoids and lignans from Sanguisorba officinalis L. Phenylpropanoids: 52 – 9-O-[6-O-acetyl-β-D-glucopyranosyl]-4-hydroxycinnamic acid, 53 – 8-O-β-D-glucopyranosyl-(R)-(+)-3,4,8-trihydroxy-methyl-phenylpropionate; lignans: 54 – (+)-5-methoxyl-cycloolivil, 55 – (+)-5,5'-dimethoxyl-cycloolivil; neolignans: 56 – (7S,8R)-4,9,5',9'-tetrahydroxy-3,3'-dimethoxy-8-O-4'-neolignan-7-O-α-L-rhamnopyranoside, 57 – (7S,8R)-4,9,9'-trihydroxy-3,3'5'-trimetoxy-8-O-4'-neolignan-7-O-α-L-rhamnopyranoside.
Флавоноиды
Разнообразие флавоноидов S. officinalis не отличается оригинальностью. Так, в подземной части и в соцветиях (цветках) обнаружены катехин, (+)-катехин и эпикатехин, в корневищах и корнях – 7-О-галлоил-(+)-катехин, 3-О-галлоил-процианидин В3, в корнях – (+)-катехин, (+)-галлокатехин и физетидинол-(4α-8)-катехин [32, 35–37, 41, 42, 4688, 4799, 48]. В цветках было установлено наличие 3-глюкозида и 3,5-диглюкозида цианидина [47]. Компонентами корневищ и корней являются проантоцианидины В3, С2, P13, а также их галлоилпроизводные – 3'-О-галлоилпроцианидин В3 и 3-О-галлоилпроцианидин C2 [35, 36, 39 40, 49]. Флавонолы кверцетин, кемпферол, их гликозиды (рутин, кверцитрин, гиперин, 3,7-ди-О-рамнозид кемпферола, 3-галактозидо-7-глюкозид кверцетина и 3-О-D-глюкуронид изорамнетина) накапливаются как в подземной, так и в надземной частях кровохлебки лекарственной, в то время как флаванонол 3-O-β-D-глюкопиранозид таксифолина и флаванон –7-О-β-D-глюкопиранозид (2S)-гидроксинарингенина обнаружены пока только в корнях и корневищах [32, 47, 501010–53].
Лигнаны
Три лигнана арил-тетралинового типа: (+)-циклооливил и два его новых аналога – (+)-5-метоксил-циклооливил (рис. 2, 54) и (+)-5,5'-диметоксил-циклооливил (рис. 2, 55) –выделены из корней S. officinalis. Структуры двух последних соединений были установлены как (2S,3S,4S)-4-(4-гидрокси-3-метоксифенил)-2,3-бис(гидроксиметил)-5,7-диметокси-1,2,3,4-тетрагидронафталин-2,6-диол и (2S,3S,4S)-4-(4-гидрокси-3,5-диметоксифенил)-2,3-бис(гидроксиметил)-5,7-диметокси-1,2,3,4-тетрагидроксинафталин-2,6-диол [54]. Из корней были выделены также новые неолигнаны (7S,8R)-4,9,5',9'-тетрагидрокси-3,3'-диметокси-8-О-4'-неолигнан-7-О-рамнопиранозид (рис. 2, 56) и (7S,8R)-4,9,9'-тригидрокси-3,3',5'-триметокси-8-О-4'-неолигнан-7-О-α-L-рамнопиранозид (рис. 2, 57) наряду с известным (7S,8R)-4,7,9,9'-тетрагидрокси-3,3'-диметокси-8-О-4'-неолигнаном [55].
Другие группы природных соединений
В метанольном экстракте корней был обнаружен ряд алифатических компонентов, в том числе новое соединение – 7-гидрокси-3,7-диметилоктил-6-О-α-L-арабинофуранозил-β-D-глюкопиранозид и известные (2E)-3,7-диметил-2,6-октадиен-1-ил-6-O-α-L-арабинофуранозил-β-D-глюкопиранозид, (2E)-7-гидрокси-3,7-диметил-2-октенил-6-O-α-L-арабинофуранозил-β-D-глюкопиранозид, (2E)-7-гидрокси-3,7-диметил-2-октенил-β-D-глюкопиранозид, (2E)-7-гидрокси-3,7-диметил-2-октенил-6-O-α-L-арабинопиранозил-β-D-глюкопиранозид и (2E)-7-гидрокси-3,7-диметил-2-октенил-β-D-глюкопиранозид [44].
Из корней S. officinalis был выделен дисахарид 5-О-α-D-(3-C-гидроксметил)луксофуранозил-β-D-(2-С-гидроксиметил)арабинофураноза [56].
БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ S. OFFICINALIS
Цитотоксическая
Цитотоксическую активность тестировали как у экстрактов, так и у групп веществ или индивидуальных соединений. Водный экстракт (часть растения не указана) проявлял цитотоксическую и противоопухолевую активности в отношении клеток линий MCF-7 и MDA-MB-231 (рак молочной железы) in vitro и in vivo, блокируя деление клеток в S фазе клеточного цикла, индуцируя их апоптоз и ингибируя ангиогенез [57]. Водный экстракт (часть растения не указана) оказался активным в отношении клеток линий HSC4 и HN22 (рак ротовой полости) [58]. Метанольный экстракт (часть растения не указана) ингибировал рост клеток линии PC-3 (рак простаты) и вызывал их апоптоз (ID50 = 120 мкг/мл) [59]. Полисахарид SPR индуцировал апоптоз клеток линии HL-60 (лейкемия) через митохондриальный сигнальный путь [601111]. Лигнан (+)-5-метоксил-циклооливил (рис. 2, 53) проявлял умеренную цитотоксическую активность в отношении клеток линии MDA-MB-231 (IC50 = 15.8 мкM) [54]. Цитотоксическую активность проявляли также различные компоненты из числа тритерпеноидов. Так, например, зию-гликозид I (2) был активен в отношении клеток линии MDA-MB-231 [62] и в отношении клеток линии WERI-Rb-1 (ретинобластома) в концентрациях 5, 10 и 20 мкМ, 48 ч. [63]. Зию-гликозид II (3) индуцировал блокаду деления клеток линий MCF-7 и MDA-MB-231 в фазах G0/G1, G2/M и S фазы и их апоптоз (IC50 = 13.3 и 9.3 мкM соответственно) [64, 65]. Это же соединение индуцировало апоптоз клеток линии BGC-823 (карцинома желудка), модулируя экспрессию Bax/Bcl-2 и активируя каспазу-3 [66]. Показано, что зию-гликозид II обладал антиангиогенными свойствами, механизм которых связан с блокированием активности рецепторов фактора роста в эпителии сосудов (vascular endothelial growth factor receptor-2) и фактора роста фибробластов (fibroblast growth factor receptor-1) [67]. В ряде публикаций, посвященных изучению компонентного состава S. officinalis, сообщалось о цитотоксической активности in vitro отдельных тритерпеноидов. 28-β-D-Глюкопиранозиловый эфир 3β-[(α-L-арабинопиранозил)окси]-23-гидроксиурс-12,19(29)-диен-28-овой кислоты (15) и 28-β-D-глюкопиранозиловый эфир 3β-[(α-L-арабинопиранозил)окси]-23-гидроксиолеан-12-ен-28-овой кислоты (13) проявляли активность в отношении клеток линии HSC-2 (карцинома ротовой полости) (IC50 = 15 и 18 мг/мл) [25 ] ; 2α,3β-дигидрокси-28-норурс-12,17,19(20),21-тетраен-23-овая кислота (39) и β-D-глюкопиранозиловый эфир 3β-[(α-L-арабинопиранозил)окси]-урс-12,19(29)-диен-28-овой кислоты (34) – в отношении клеток линии SGC (рак желудка) (EC50 = 10.2 и 18.3 мкM соответственно) [27]; 28-[6-O-ацетил-β-D-глюкопиранозил]овые эфиры 3β-[(α-L-арабинопиранозил)окси]-19α,23-дигидлроксиолеан-12-ен-28-овой, 2α,3β,19α,23-тетрагидроксиурс-12-ен-28-овой и 3β-[(α-L-арабинопиранозил)окси]-19α-гидроксиурс-12,20(30)-диен-28-овой кислот (43–45) – в отношении клеток линий MCF-7, HeLa, HepG2, SGC-7901, NCI-H460 и BGC-823 (IC50 = 2.4–4.8 мкM, контроль доксорубицин, IC50 = 0.01–0.05) [30]. Эллаготаннин сангвиин H-6 ингибировал активность топоизомераз II типа [68].
Антибактериальная, антифунгальная и антивирусная
Экстракты из подземной и надземной частей S. officinalis проявляли антибактериальную активность в отношении широкого спектра как грамположительных, так и грамотрицательных бактерий, в том числе Propionbacterium acne, Salmonella typhimurium, S. anatum, Listeria monocytogenes, Vibrio vulnificus, Bacillus subtilis, Staphylococcus aureus, S. typhimutiumm, Escherichia coli, Helicobacter pyroli, Pseudomonas aeruginosa и P. aureus [32, 69–76]. Этанольный экстракт из корней – в том числе в отношении штаммов Staphylococcus aureus, устойчивых к метициллину [77].
Этанольные экстракты корней и надземной части проявляли антифунгальную активность в отношении Candida albicans [70].
Водный экстракт из корней оказался активным в отношении вируса гепатита В, связывая его с поверхностью антигена HBsAg и ингибируя активность вирусной ДНК-полимеразы [78–80]. Метанольный экстракт из корней ингибировал активность нейроаминидазы (поверхностного антигена вируса H1N1 [81], а также проявлял активность в отношении коронавируса, ингибируя синтез его протеина, не снижая уровень вирусной РНК [82]. Водный экстракт из надземной части был активен в отношении HIV-1 [83].
Противовоспалительная
Противовоспалительные свойства S. officinalis исследовали главным образом на моделях in vitro, а также с использованием известных провоспалительных факторов-мишеней. В частности, этанольный экстракт из корней блокировал синтез оксида азота и высвобождение простагландина PGE2 в LPS-активированных макрофагах RAW264.7 в концентрации 200–400 мкг/мл [84]. Алифатическое соединение (2Е)-7-гидрокси-3,7-диметил-2-октенил-6-О-α-L-арабинопиранозил-β-D-глюкопиранозид, фенилпропаноид мийагенин и β-D-глюкопиранозиловый эфир 3β[(α-L-арабинопиранозил)окси]урс-12,18-диен-28-овой кислоты (51) подавляли активность фактора NF-κB в макрофагах RAW264.7 [33]. Водный экстракт из корней ингибировал синтез оксида азота, оказывая также нефропротективное действие [85]. Аналогичное действие оказывали сангвиины H-6, H-11, 1,2,3,4,6-пента-O-галлоил-β-D-глюкоза, эллаготаннин эвгениин и полимерный проантоцианидин [86, 87], а полисахариды, наоборот, стимулировали синтез NO и высвобождение фактора некроза опухоли TNF-α [88]. Предполагалось, что противовоспалительные свойства полисахаридов корней связаны с ингибированием слипания (адгезии) лейкоцитов и воспалительных реакций [89]. Противовоспалительными свойствами обладал спиртовый экстракт из корней на модели кератиноцитов линии HaCaT [90]. На дендритных клетках костного мозга показано противовоспалительное действие метил-4-(β-D-глюкопиранозилокси)-3-гидрокси-5-метоксибензоата, метил-3-метокси-4,5-дигидробензоата, (+)-катехина, 3-O-β-D-глюкопиранозида таксифолина, (2E)-3,7-диметил-2,6-октадиен-1-ил-6-O-α-L-арабинофуранозил-β-D-глюкопиранозида, (2E)-7-гидрокси-3,7-диметил-2-октенил-6-O-α-L-арабинопиранозил-β-D-глюкопиранозида и (2E)-7-гидрокси-3,7-диметил-2-октенил-β-D-глюкопиранозида [33].
Противоаллергическая и противоастматическая
Водный экстракт из корней обладал антиаллергическими свойствами in vivo и in vitro, подавляя синтез TNF-α [91, 92]; спиртовый экстракт из корней подавлял симптомы атопического дерматита [93]. Дисахарид 5-O-α-D-(3-C-гидроксиметил)ликсофуранозил-β-D-(2-C-гидроксиметил)арабинофураноза обладал антиаллергическими свойствами in vivo и in vitro, стабилизируя высвобождение гистамина в тучных клетках [56]; спиртовой экстракт из корней – противоастматическими, стимулируя активность оксигеназы-1 [94].
Гемостатическая активность и гемопоэтические свойства
В клинике показано, что корневища с корнями S. officinalis, составляющие основу таблеток Diyu shengbai, являются профилактическим средством при миелосупрессии, вызванной химио- или радиотерапией (Li et al., 2005, Wang et al., 2005, Fu, 2014, Jiang et al., 2015; цит. по [95]). В эксперименте зию-гликозид I (2) и водный экстракт из корней обладали гемостатическими свойствами [96], в том числе экстракт на модели геморрагии in vivo, вызванной варфарином (Jeong et al., 2000; цит. по [14 ] , [28]). Зию-гликозид II (3) ингибировал активность тканевого фактора (tissue factor) и фактора некроза опухоли (TNF-α), участвующих в свертываемости крови [97]. Сапонины корней улучшали гемопоэз миелосупрессивных животных, активируя активность киназ FAK и Erk1/2 [95]. Полифенольные гликоконьюгаты соцветий оказывали антикоагулянтное действие, ингибируя активность тромбина [98]. 3,3',4-Три-O-метилэллаговая кислота и ее 4'-O-β-D-ксилозид обладали тромболитическими и гемопоэтическими свойствами, индуцируя дифференциацию мегакариоцитов в клетках линии HEL (эритролейкемия человека) [43]. Сапонины стимулировали пролиферацию и дифференциацию клеток предшественников мегакариоцитов [99].
Ранозаживляющая
Спиртовый экстракт (часть растения не указана) оказывал ранозаживляющее действие при ожоге второй степени, предотвращая при этом инфекционное заражение [100], а прием полисахаридов корней в дозах 50 и 200 мг/кг стимулировал заживление ран при ожоге и сокращал время эпителизации [101].
Дермо- и радиопротективная
Этанольный экстракт из корней предотвращал деградацию гиалуронана, вызванную белком HYBID в фибробластах кожи (с гиалуронаном связаны эластичность и упругость кожи) [102]. Зию-гликозид I (2) снижал морщинистость кожи, усиливая синтез коллагена I в фибробластах [9 ] , водно-спиртовой экстракт из корней подавлял синтез эндотелина-1 в кератиноцитах, что снижало пигментацию кожи при УФ-облучении [103]. Экстракт из подземной части ингибировал активность эластазы в фибробластах, оказывая протективное действие при УФ-облучении [104], полифенольные гликоконьюгаты цветков оказывали радиопротективное действие, предотвращая повреждение лимфоцитов при γ-облучении [105–107].
Гиполипидемическая
Водно-спиртовый экстракт из надземной части оказался эффективным при ожирении, регулируя транскрипцию факторов адипогенеза и липогенеза [108]. Показано, что водно-спиртовый экстракт всего растения может контролировать дифференциацию адипоцитов и остеобластов, в частности он уменьшал накопление межклеточных липидов, экспрессию факторов транскрипции адипогенеза (PPARγ, C/EBPα и SREBP-1c), поэтому рассматривается в качестве терапевтического агента при ожирении и остеопорозе [109]. 3-О-β-D-Глюкуронид изорамнетина и эллаговая кислота ингибировали накопление жиров (IC30 = 18.4 и 19.3 мкM соответственно) [53].
Антиоксидантная
Антиоксидантную активность S. officinalis связывают с полисахаридами [21 ] , а также с фенольными соединениями, в частности с (+)-катехином, фисетиниол-(4α-8)-катехином (IC50 = 38.2 и 12.3 мкг/мл соответственно) [42], (+)-галлокатехином и метил-6-O-галлоил-β-D-глюкопиранозидом (IC50 = 11.4 и 13 мкM соответственно; контроль аскорбиновая кислота IC50 = 50.3 мкM) [41] и экстрактами корней [71, 110–112].
Гепатопротективная
Установлено, что гепатопротективными свойствами обладал (+)-галлокатехин на клетках Hep G2, пораженных тарцином (IC50 = 91.8 мкM, контроль силибин, IC50 = 122.4 мкМ) [41], и метанольный экстракт из коры корней при поражении CCl4, ингибируя активность аланинаминотрансферазы [113].
Иммуномодулирующая и нейропротективная
Иммуномодулирующее действие оказывали полисахариды корней [114]. Водный экстракт из корней ингибировал активность инфламмасомы – белкового комплекса, запускающего воспалительную реакцию при взаимодействии клетки с микроорганизмом в системе врожденного иммунитета [115].
Нейропротективными свойствами обладали галловая кислота [116], а также метанольный экстракт из корней при ишемии коры головного мозга [117], подавляя синтез 6-гидроксидопамина [118].
Прочие виды биологической активности
В эксперименте этилацетатная фракция спиртового экстракта (часть растения не указана) была эффективна при язвенной болезни желудка и при нарушениях функций его слизистой [119]. Метанольный экстракт из корней ингибировал активность гиалуронидаз [120].
Таким образом, к настоящему времени накоплен богатый (но далеко, по всей видимости, не полный) набор сведений по компонентному составу и биологической активности S. officinalis. Наиболее интересными представляются дальнейшие исследования состава тритерпеноидов, лигнанов и компонентов других групп, для которых уже установлена разнообразная активность и которые могут быть использованы в медицине. Вполне вероятно, что изучение внутривидовой (географической, экологической, генетической, химической и др.) изменчивости позволит выявить ценные в практическом отношении формы, заслуживающие детального исследования как в природе, так и при выращивании в условиях интродукции.
Список литературы отсутствует.
Дополнительные материалы отсутствуют.
Инструменты
Растительные ресурсы


