Растительные ресурсы, 2019, T. 55, № 3, стр. 422-434
Содержание макро-, микроэлементов и антиоксидантов в лишайнике Dermatocarpon miniatum (Verrucariaceae)
Н. А. Голубкина 1, *, В. А. Лапченко 2, Е. В. Лапченко 2
1 ФГБНУ “Федеральный научный центр овощеводства”
Московская область, поселок ВНИИССОК, Россия
2 ФГБУН “Карадагская научная станция им. Т.И. Вяземского – природный заповедник РАН”
Республика Крым, Россия
* E-mail: segolubkina45@gmail.com
Поступила в редакцию 07.12.2018
После доработки 21.01.2019
Принята к публикации 17.04.2019
Аннотация
Целью работы явилась оценка уровней накопления макро-, микроэлементов и антиоксидантов Dermatocarpon miniatum и сравнение указанных показателей с соответствующими данными для эпигейных видов лишайников Cladonia convoluta, C. rangifornis, эпифитного лишайника Evernia prunastri и некоторых видов высших сосудистых растений Государственного природного заповедника “Карадагский”. Впервые установлена высокая аккумулирующая способность дерматокарпона красноватого для B, Cu, K, Р, I и Se (23–30; 15–19; 6300–7900; 1900–2400; 7–9 и 0.30–0.45 мг/кг с.м. соответственно). Показаны более высокие уровни антиоксидантной активности Dermatocarpon miniatum по сравнению с эпигейными видами: Cladonia convolute и C. rangifornis. Содержание полифенолов во всех исследованных образцах лишайников, включая образцы дерматокарпона красноватого, отличалось малой вариабильностью и было в 1.6–2.8 раз ниже, чем в образцах сосудистых растений из того же местообитания. Показано, что содержание фотосинтетических пигментов убывает в ряду: Evernia prunastri > Dermatocarpon miniatum > Cladonia rangifornis > C. convoluta. Полученные результаты открывают новые возможности практического использования дерматокарпона красноватого как в традиционной медицине, так и экологическом мониторинге.
Большинство лишайников представляют собой симбиоз гетеротрофных грибов – в основном представителей Ascomycota и цианобактерий или фотоавтотрофных водорослей (Chlorophyta, Xanthophyta и др.) [1]. В наземных экосистемах представлены практически все эколого-субстратные группы лишайников – эпифитные, эпигейные, эпиксильные. На скалах вдоль побережья моря зачастую поселяются эпилитные галофильные виды, а на камнях вблизи пресноводных водоемов, родников, рек, ручьев и озер [2] – эпилитные, гигро- или гидрофильные виды лишайников. Значительное число видов лишайников, связанных с водными экосистемами, относятся к семейству Verrucariacea и представлены в основном микролишайниками. Дерматокарпон красноватый Dermatocarpon miniatum (L.) W. Mann макролишайник из семейства веррукариевых (порядок Verrucariales, класс Eurotiomycetes, отдел Ascomycota) и рода Dermatocarpon, насчитывающему около 80 видов. Представители рода дерматокарпона, включая дерматокарпон красноватый, очень часто произрастают на скалах и валунах в непосредственной близости к водотокам.
Dermatocarpon miniatum встречается в северной части земного шара – в Европе, Азии, Сев. Африке, Сев. Америке и Гренландии [2]. В России дерматокарпон красноватый довольно распространенный представитель этого рода в горных регионах. Произрастает на гранитных и известняковых скалах от кальциевых сланцев до известняков и доломита во влажных местообитаниях. Это типичный эпилитный лишайник, у которого слоевище развивается на поверхности каменистого субстрата. Встречается на песчанике, заселяет вертикальные поверхности камней со значительным увлажнением (рис. 1).
Рис. 1.
Dermatocarpon miniatum (L.) W. Mann. на камне в 20–30 м от кромки моря около родника в Долине роз (Государственный природный заповедник “Карадагский”). Fig. 1. Dermatocarpon miniatum (L.) W. Mann. on a rock 20–30 m away from the sea edge near the spring in the Valley of Roses (Karadag nature reserve).

Из 80 известных видов дерматокарпона в традиционной медицине широко используется 52 вида [3]. В Китае дерматокарпон красноватый применяют при высоком артериальном давлении, в качестве диуретического, противоглистного средства. Используют для улучшения пищеварения, против вздутия живота и при плохом питании детей [4]. Выявлены антимикробные и антиоксидантные свойства метанольных экстрактов дерматокарпона красноватого [5]. Для оценки уровня загрязнения воздуха дерматокарпон красноватый до настоящего времени не использовали, а особенности содержания в нем макро- и микроэлементов практически не изучены.
Целью настоящей работы была оценка уровней накопления макро-, микроэлементов и антиоксидантов дерматокарпоном красноватым в сравнении с соответствующими показателями для эвернии сливовой, кладонии свернутой и кладонии оленерогой, а также некоторых видов сосудистых растений, произрастающих в Государственном природном заповеднике “Карадагский”.
МАТЕРИАЛ И МЕТОДЫ
Отбор проб и подготовка образцов для анализа
Образцы дерматокарпона красноватого, а также эвернии сливовой Evernia prunastri (L.) Ach, кладонии свернутой Cladonia convolute (Lam.) Anders и кладонии оленерогой Cladonia rangifornis Hoffm. собирали в Долине роз Государственного природного заповедника “Карадагский” между хребтом Магнитный и хребтом Хоба-Тепе в 20–30 м от моря в мае–первой декаде июня 2018 г. (44°93′61″ N, 35°23′33″ E). Определение лишайников выполнено по общепринятым лихенологическим методикам. Дополнительно для идентификации образцов использовали определители и справочную литературу [6–10]. Для проведения анализов образцы лишайников (по 5–8 талломов) очищали от частиц субстрата и высушивали при комнатной температуре до постоянного веса и гомогенизировали.
Cодержание селена
Содержание селена устанавливали микрофлуорометрически по методу, описанному ранее для биологических тканей и жидкостей [11]. Метод включает мокрое сжигание гомогенизированных образцов смесью хлорной и азотной кислот, последующее восстановление Se+6 до Se+4 действием 6 N HCl и образование комплекса между Se+4 и 2,3-диаминонафталином. Расчет содержания селена осуществляли по интенсивности флуоресценции пиазоселенола в гексане при λ эмиссии 519 нм и λ возбуждения 376 нм. В работе использовали трехкратную повторность каждого определения. Достоверность результатов устанавливали, используя референс-стандарт – образец лиофилизованной белокочанной капусты с регламентированным содержанием селена 150 мкг/кг с. м. (Институт питания, Россия).
Элементный состав
Содержание Al, As, B, Ca, Cd, Co, Cr, Cu, Fe, Hg, I, K, Li, Mg, Mn, Mo, Na, Ni, P, Pb, Si, Sn, Sr, V и Zn в гомогенизированных образцах лишайников устанавливали методом ИСП-МС на квадрупольном масс-спектрометре Nexion 300D (Perkin Elmer Inc., Shelton, CT 06484, США) в центре Биотической медицины (Москва).
В качестве внутреннего стандарта использовали 103Rh. Расчеты осуществляли с использованием внешнего стандарта (Merck IV, multi-element standard solution), а также иодистого калия для калибровки на иод и стандартные растворы Perkin-Elmer для P, Si и V. Все стандартные кривые строили с использованием пяти различных концентраций. В целях контроля качества определения внутренние стандарты и референс-стандарты тестировали одновременно с исследуемыми образцами. В связи со следовыми количествами Hg в исследованных образцах эти данные не включали в описание результатов.
Полифенолы и антиоксидантная активность
Для сравнения антиоксидантной активности лишайников и высших сосудистых растений, произрастающих в Долине роз, также собирали листья следующих видов: зопник крымский (Phlomis taurica Hartwiss ex Bunge), мачок желтый (Glaucium flavum Crantz), астрагал колючковый (Astragalus arnacantha Bieb), ломонос виноградолистный (Clematis vitalba L.), репейничек лекарственный (Agrimonia eupatoria L.), зверобой продырявленный (Hypericum perforatum L.), виноград культурный (Vítis vinífera L.), жасмин кустарниковый (Jasminum fruticans L.), ежевика таврическая (Rubus stauricus Schlecht.), тутовник белый (Morus alba L.), лох узколистный (Elaeagnus angustifolia L.), груша лохолистная (Pyrus elaeagnifolia Pall.), кизил обыкновенный (Cornus mas L.), фисташка туполистная (Pistacia mutica Fisch. Et Mey). Листья высушивали при комнатной температуре до постоянного веса и гомогенизировали.
Для определения уровня накопления полифенолов использовали колориметрический метод Фолина–Чиокалтеу [12]. Содержание полифенолов рассчитывали по калибровочной кривой, построенной по пяти концентрациям галловой кислоты (0–90 мкг/мл) в мг-эквивалентах галловой кислоты на 1 г сухой массы (мг-экв ГК/г с.м.).
Уровень антиоксидантной активности устанавливали по методу [13] титрованием 0.01 N раствора KMnО4 в кислой среде этанольным экстрактом образцов. Восстановление KMnO4 до бесцветного Mn+2 в этой реакции отражает количество антиоксидантов, растворенных в 70%-ном этаноле. Результаты выражали в мг-эквивалентах галловой кислоты/г сухой массы. Этот метод успешно использовали ранее для определения антиоксидантного потенциала Ocimum basilicum [14] и антиоксидантной активности сыворотки крови [15].
Фотосинтетические пигменты
Около 500 миллиграмм порошка лишайников (точная навеска) растирали в фарфоровой ступке с 10 мл этанола. Смесь количественно переносили в мерную колбу на 25 мл и доводили объем до метки этиловым спиртом. Экстракт перемешивали и фильтровали через складчатый фильтр. В полученном растворе определяли содержание фотосинтетических пигментов спектрофотометрически на спектрофотометре UNICO (USA). Расчет содержания хлорофиллов а и b, а также каротина определяли по формулам [16]:
Содержание хлорофилла, каротина выражали в мг/кг с.м. В работе использовали трехкратную повторность
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Государственный природный заповедник “Карадагский” (далее заповедник) расположен на юго-восточном побережье Крыма между поселками Коктебель, Курортное и Щебетовка. Разнообразие природных комплексов заповедника обусловлено его расположением на границе суши и моря, равнин и гор, на стыке умеренного и субтропического климатических поясов. Довольно длительное изучение лихенофлоры заповедника позволило выявить более 300 видов лишайников [7, 17, 18].Значительная доля эндемичных видов, наличие реликтовых растений, сохранившихся еще с доледниковой эпохи, свидетельствуют о высокой природоохранной ценности флоры заповедника. Заповедник включает в себя территорию палеовулкана, отличается многообразием почвообразующих пород – продуктов разрушения известняков, глинистых сланцев и вулканических пород.
Требовательность эпилитного вида дерматокарпона красноватого к сравнительно высокой влажности определило его предпочтительное местообитание в Долине роз, расположенной в заповеднике между хребтами Магнитный и Хоба-Тепе, в непосредственной близости от источника пресной воды и морской акватории. Фотография (рис. 1) дерматокарпона показывает типичный внешний облик этого вида лишайника, произрастащего на поверхности нависающей над родником скалы.
Тяжелые металлы
Данные элементного состава дерматокарпона выявили умеренные уровни накопления тяжелых металлов. Так, из табл. 1 видно, что по уровню накопления тяжелых металлов дерматокарпон сравнительно близок к эвернии сливовой. Содержание мышьяка, хрома, олова и стронция в этих лишайниках практически не различается, содержание кадмия, никеля в дерматокарпоне красноватом лишь незначительно превышает соответствующие концентрации в эвернии сливовой. В то же время отличительной особенностью дерматокарпона является более интенсивное накопление алюминия и ванадия по сравнению с эвернией сливовой и в полтора раза меньшее накопление свинца.
Таблица 1.
Содержание тяжелых металлов в некоторых лишайниках Карадага (мг/кг с.м.) Table 1. Content of heavy metals in several Karadag lichens (mg/kg d.w.)
| Дерматокарпон красноватый Dermatocarpon miniatum | Эверния сливовая Evernia prunastri |
Кладония свернутая Cladonia convoluta | Кладония оленерогая Cladonia rangifornis | |
|---|---|---|---|---|
| Al | 1324 ± 132d | 320 ± 32a | 5205 ± 520b | 1774 ± 177c |
| As | 0.58 ± 0.07a | 0.64 ± 0.07a | 5.28 ± 0.53b | 1.07 ± 0.11c |
| Cd | 0.200 ± 0.023c | 0.150 ± 0.018a | 0.120 ± 0.015ab | 0.090 ± 0.013b |
| Cr | 0.76 ± 0.09a | 0.71 ± 0.08a | 7.81 ± 0.78b | 2.25 ± 0.23c |
| Ni | 1.34 ± 0.13d | 1.01 ± 0.10a | 12.86 ± 1.29b | 3.45 ± 0.35c |
| Pb | 1.93 ± 0.19c | 2.84 ± 0.28a | 9.28 ± 0.93b | 3.12 ± 0.31a |
| Sn | 0.110 ± 0.013a | 0.120 ± 0.015a | 0.060 ± 0.009b | 0.070 ± 0.011b |
| Sr | 15.04 ± 1.50a | 15.19 ± 1.52a | 37.31 ± 3.73b | 10.53 ± 1.05c |
| V | 6.60 ± 0.66d | 1.07 ± 0.11a | 13.89 ± 1.39b | 4.33 ± 0.43c |
Эпигейные виды лишайников в этом отношении (кладония свернутая и кладония оленерогая) существенно больше аккумулируют тяжелые металлы (за исключением кадмия и олова): Al – в 1.3–3.9 раза; As – в 1.8–9.1; Cr – в 2.6–10.3; Ni – в 2.6–9.6; Pb – в 1.6–4.8; Sr – в 0.7–2.5; V – в 0.7–2.1. При этом кладония свернутая лидирует по способности накопления тяжелых металлов. Такие различия между исследованными видами лишайников могут быть связаны по крайней мере частично, с более интенсивным аккумулированием пыли эпигейными видами: кладонией свернутой и кладонией оленерогой.
Макроэлементы
Что касается макроэлементов, то из 4 исследованных видов лишайников дерматокарпон красноватый выделяется необычно высоким содержанием калия, фосфора и натрия, превосходящим соответствующие показатели для эвернии сливовой, кладонии свернутой и кладонии оленерогой в 2.2–2.8, в 3.1–3.9 и в 2.3–4.8 раза соответственно (табл. 2).
Таблица 2.
Содержание макроэлементов в некоторых лишайниках Карадага (мг/кг с.м.) Table 2. Content of macronutrients in several Karadag lichens (mg/kg d.w.)
| Дерматокарпон красноватый Dermatocarpon miniatum | Эверния сливовая Evernia prunastri |
Кладония свернутая Cladonia convoluta |
Кладония оленерогая Cladonia rangifornis | |
|---|---|---|---|---|
| Ca | 2628 ± 263 | 3726 ± 373 | 10028 ± 1003 | 4946 ± 495 |
| K | 7105 ± 711 | 2534 ± 253 | 3271 ± 327 | 2565 ± 256 |
| Na | 473 ± 47 | 207 ± 21 | 163 ± 16 | 99.0 ± 9.9 |
| Mg | 1964 ± 196 | 675 ± 67 | 2568 ± 257 | 1003 ± 100 |
| P | 2199 ± 220 | 608 ± 61 | 568 ± 57 | 701 ± 70 |
Фоновый уровень фосфора в лишайниках принят 200–2000 мкг/кг с.м. [19], Содержание этого элемента в дерматокарпоне красноватом несколько превышает верхний фоновый уровень, что может быть связано с высоким содержанием фосфатов в скальных субстратах [19].
Уровень накопления калия в лишайниках морских побережий повышен в связи с интенсивным переносом элемента с морскими аэрозолями, что находится в хорошем соответствии с полученными данными по содержанию этого элемента в дерматокарпоне красноватом, составившим более 7000 мг/кг с. м. при фоновых значениях, равных 500–5000 мг/кг [19].
Микроэлементы
Особый интерес представляют данные накопления микроэлементов дерматокарпоном красноватым. Данные табл. 3 свидетельствуют о необычно высокой способности этого вида лишайников накапливать бор, содержание которого превышает соответствующие показатели для других видов лишайников в 7–12 раз.
Таблица 3.
Содержание микроэлементов в некоторых лишайниках Карадага (мг/кг с.м.) Table 3. Content of micronutrients in several Karadag lichens (mg/kg d.w.)
| Дерматокарпон красноватый Dermatocarpon miniatum | Эверния сливовая Evernia prunastri |
Кладония свернутая Cladonia convoluta | Кладония оленерогая Cladonia rangifornis | |
|---|---|---|---|---|
| Co | 1.14 ± 0.11c | 0.23 ± 0.03a | 4.56 ± 0.46b | 1.11 ± 0.11c |
| B | 26.45 ± 2.65c | 3.76 ± 0.38a | 2.21 ± 0.22b | 2.31 ± 0.23b |
| Cu | 17.08 ± 1.71c | 3.74 ± 0.37a | 13.22 ± 1.32b | 4.52 ± 0.45a |
| Fe | 2793 ± 279c | 435 ± 44a | 12979 ± 1298b | 2646 ± 265c |
| I | 7.82 ± 0.78c | 10.89 ± 1.09a | 2.73 ± 0.27b | 2.44 ± 0.24b |
| Li | 1.07 ± 0.11d | 0.28 ± 0.03a | 6.51 ± 0.65b | 1.76 ± 0.18c |
| Mn | 125.0 ± 12.0d | 20.8 ± 2.1a | 328.0 ± 33.0b | 97.0 ± 9.7c |
| Mo | 0.200 ± 0.024c | 0.110 ± 0.013a | 0.290 ± 0.035b | 0.130 ± 0.015a |
| Si | 29.91 ± 2.99a | 29.08 ± 2.91a | 26.40 ± 2.64a | 29.31 ± 2.93a |
| Zn | 34.54 ± 3.45b | 23.85 ± 2.38a | 39.45 ± 3.94b | 20.38 ± 2.04a |
Известно, что извержение вулканов сопровождается значительным выбросом в окружающую среду бора, лития и селена. В связи с этим территории древних вулканов и прибрежные акватории морей и океанов, как правило, обогащены этими элементами. В прибрежных зонах значительная часть бора поступает в окружающую среду вместе с морскими аэрозолями. В меньшей степени бор освобождается при химическом и механическом выветривании осадочных пород (карбонатов) и в результате вулканической деятельности [20]. При извержении вулканов выделяется борная кислота и трифторид бора таким образом, что концентрация бора в воде в районах древних вулканов высокая [21]. Более того, при выделении бора для промышленных целей используют испарение морской воды закрытых водоемов [22]. Природное выветривание (химическое и механическое) является основным источником бора, поступающего в гидросферу [23]. При этом количество бора, поступающего в водные экосистемы, сильно варьирует в зависимости от особенностей геологии местности. Содержание бора в грунтовых водах Карадага соответствовало интервалу от 80 до 570 мкг/л [24]. Показательно, что из 6 исследованных источников 4 имели уровни бора, превышающие ПДК для питьевой воды (300 мкг/л); и только в роднике Лягушка, наиболее удаленном от моря, содержание бора достигало всего 80 мкг/л.
Следует отметить, что, по литературным данным, уровень бора в лишайниках крайне низок [19], и содержание в 17 мг/кг с.м., обнаруженное в лишайниках Нью-Мексико, рассматривалось как высокое [25]. Полученные нами данные свидетельствуют о том, что дерматокарпон красноватый способен накапливать более 26 мг/кг с.м. этого микроэлемента. Результаты исследования показывают также, что дерматокарпон красноватый отличается высоким содержанием меди и иода, а также селена.
Cелен, йод
Перенос йода и селена с поверхности моря в виде аэрозолей и летучих метилированных форм микроэлементов составляет важный источник этих природных антиоксидантов для растений прибрежных зон [26].
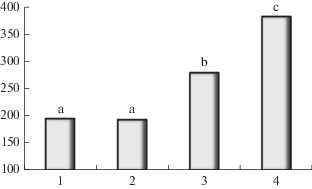
Как видно из данных рис. 2, уровни накопления селена снижались в ряду: дерматокарпон красноватый > эверния сливовая > кладония оленерогая = кладония свернутая. Очевидно, что аэрозольный перенос селена с поверхности моря играет более существенную роль для дерматокарпона красноватого и эвернии сливовой, чем для эпигейных видов лишайников. Интересно в связи с этим отметить, что среди родников Государственного природного заповедника “Карадагский” вода родника в Долине роз, где произрастает дерматокарпон красноватый, содержит наибольшее количество селена [24].
Так же как и для селена, более низкие уровни аккумулирования йода были характерны для эпигейных видов лишайников (кладония свернутая и кладония оленерогая), в то время как уровни накопления йода дерматокарпоном красноватым были в 2.9–3.2 раза выше при максимальных концентрациях, установленных для эвернии сливовой. Накопление иода и селена указанными видами лишайников ранее не исследовалось и представляет интерес как с позиций физиологии лишайников, так и в отношении возможного вклада указанных элементов в общую биологическую активность лишайников.
Антиоксиданты
Наиболее мощными природными антиоксидантами в растительном мире считаются полифенолы [27]. В данной работе образцы лишайников собирали весной – в начале лета, поскольку известно, что наибольшее количество полифенолов накапливается лишайниками именно в этот период [28]. Высокий антиоксидантный статус лишайников и высокие концентрации полифенолов, отмечаемые в ряде работ [28], могут быть непосредственно связаны с широкой экофизиологической пластичностью лишайников, позволяющей им выживать в различных экологических условиях, включая экстремальные уровни нагрузки. На содержание полифенолов в лишайниках влияют различные стрессовые факторы, в том числе интенсивность питания, повышенный уровень УФ-излучения, уровень озона в атмосфере [29], температура.
Рис. 2.
Содержание селена в лишайниках. По горизонтали: 1 – Cladonia rangifornis, 2 – Cladonia convoluta, 3 – Evernia prunastri, 4 – Dermatocarpon miniatum; по вертикали: содержание селена, мкг/кг с.м. Значения с одинаковыми индексами статистически не различаются в соответствии с тестом Дункана при P < 0.05. Fig. 2. Selenium content in lichens. X-axis: lichen species: 1 – Cladonia rangifornis, 2 – Cladonia convoluta, 3 – Evernia prunastri, 4 – Dermatocarpon miniatum; Y-axis: Se content, µg/kg d.w. Values with similar indexes are not statistically different according to Duncan test at P ≤ 0.05.
Как видно из данных рис. 3, уровень антиоксидантной активности и содержание полифенолов в дерматокарпоне красноватом достоверно выше, чем в кладонии оленерогой и кладонии свернутой, собранных на открытой местности с высоким уровнем инсоляции. С другой стороны, уровень антиоксидантной активности эпифитного лишайника эвернии сливовой оказался в 3 раза выше, чем содержание антиоксидантов в дерматокарпоне красноватом при одинаковом уровне полифенолов. Интересно в связи с этим отметить, что межвидовые вариации в накоплении полифенолов значительно ниже и для растений, чем соответствующие вариации в антиоксидантной активности. Так, для растений, собранных в Долине роз, коэффициент вариации в содержании полифенолов составил 10.0%, в то время как CV для показателя антиоксидантной активности достигал 34.6% (табл. 4). Представленные данные свидетельствуют о том, что как уровень антиоксидантной активности, так и содержание полифенолов в исследованных видах лишайников в целом значительно ниже, чем в наземных видах растений. Для дерматокарпона красноватого эти различия составили 1.8–8.2 и 1.6–2.8 раз соответственно.
Рис. 3.
Антиоксидантная активность и содержание полифенолов в лишайниках. По горизонтали – вид лишайника: 1 – Dermatocarpon miniatum, 2 – Evernia prunastri, 3 – Cladonia convoluta, 4 – Cladonia rangifornis; по вертикали – антиоксидантная активность и содержание полифенолов, мг-экв ГК/г с.м. Значения с одинаковыми индексами статистически не различаются в соответствии с тестом Дункана при P < 0.05. Строчные буквы соответствуют данным для АОА, заглавные буквы – данным для полифенолов. Fig. 3. Lichens antioxidant activity and phenolic content. X-axis – lichen species: 1 – Dermatocarpon miniatum, 2 – Evernia prunastri, 3 – Cladonia convoluta, 4 – Cladonia rangifornis; Y-axis – antioxidant activity, polyphenol content, mg-eq GA/g d.w. Values with similar indexes are not statistically different according to Duncan test at P ≤ 0.05. The lowercase letters refer to AOA values; capital letters refer to polyphenol content.
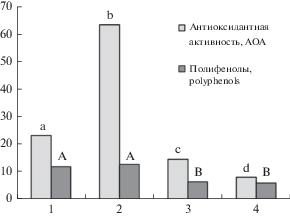
Таблица 4.
Показатели антиоксидантной активности (АОА) и содержания полифенолов в некоторых видах сосудистых растений Карадага (мг-экв ГК/г с.м) Table 4. Antioxidant activity (АОА) and polyphenol content in several Karadag vascular plants (mg-eq GA/g d.w.)
| Наименование Species |
Полифенолы Polyphenols |
АОА |
|---|---|---|
| Зопник крымский Phlomis taurica Hartwiss ex Bunge |
23.7 ± 1.1b | 42.3 ± 2.2a |
| Лох узколистный Elaeagnu sangustifolia L. | 18.8 ± 0.9a | 44.6 ± 2.1ab |
| Тутовник белый Morus alba L. | 24.3 ± 1.0bc | 48.3 ± 2.0b |
| Мачок желтый Glaucium flavum Crantz | 22.0 ± 1.0b | 60.0 ± 3.1c |
| Астрагал колючковый Astragalusarnacantha Bieb |
26.9 ± 1.2c | 61.6 ± 3.2c |
| Ежевика таврическая Rubus tauricus Schlecht | 22.0 ± 1.0b | 65.5 ± 3.2cd |
| Ломонос виноградолистный Clematis vitalba L. | 24.3 ± 1.1b | 67.4 ± 3.1de |
| Жасмин кустарниковый Jasminum fruticans L. | 23.0 ± 1.1b | 73.4 ± 3.7ef |
| Груша лохолистная Pyrus elaeagnifolia Pall. | 24.7 ± 1.2bc | 76.2 ± 3.5f |
| Репейничек лекарственный Agrimonia eupatoria L. |
26 ± 1.2cd | 98.0 ± 5.7h |
| Кизил обыкновенный Cornus mas L. | 28.6 ± 1.3d | 107.0 ± 7.8h |
| Виноград культурный Vítis vinífera L. | 27.7 ± 1.3d | 110.0 ± 7.5hg |
| Зверобой продырявленный Hypericum perforatum L. |
32.3 ± 1.5e | 125.0 ± 8.8g |
| Фисташка туполистная Pistacia mutica Fisch. et Mey |
27.5 ± 1.4d | 188.0 ± 10.5j |
| M ± SD | 25.0 ± 2.5 | 82.7 ± 28.6 |
| Интервал концентраций Concentration range |
18.8–32.3 | 42.3–188 |
| CV, % | 10.0 | 34.6 |
Фотосинтетические пигменты
В литературе большое внимание уделяется уровню накопления фотосинтетических пигментов лишайниками, определяемому в первую очередь видом водоросли-симбионта. Отмечается, что эти показатели отражают разный уровень устойчивости к воздействию абиотических факторов, а также специфическую адаптацию данного вида для Карадага, расположенного в средиземноморской климатической зоне [18].
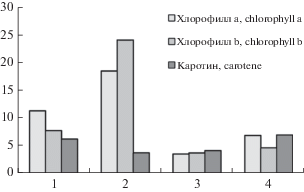
Фотобионтом дерматокарпона красноватого является зеленая водоросль Hyalococcus dermatocarponis [30, 31]. Данные рис. 4 свидетельствуюто том, что, несмотря на низкий уровень инсоляции в местообитании дерматокарпона, накопление в этом виде лишайника хлорофиллов а и b выше, чем в эпигейных видах – кладонии оленерогой и кладонии свернутой, произрастающих на открытой местности, в отличие от эвернии сливовой, для которой характерны высокие уровни накопления хлорофилла. Что касается интенсивности биосинтеза каротиноидов, то дерматокарпон красноватый имеет сходные уровни каротина с кладонией оленерогой, превышающие соответствующие показатели для эвернии сливовой и кладонии свернутой.
Рис. 4.
Содержание фотосинтетических пигментов в лишайниках. По горизонтали – 1 – Dermatocarpon miniatum, 2 – Evernia prunastri, 3 – Cladonia convolute, 4 – Cladonia rangifornis; по-вертикали – содержание фотосинтетических пигментов, мг/кг с.м. Fig. 4. Lichens photosynthetic pigments X-axis – 1 – Dermatocarpon miniatum, 2 – Evernia prunastri, 3 – Cladonia convoluta, 4 – Cladonia rangifornis; Y-axis – photosynthetic pigments content, mg/kg d.w.
ЗАКЛЮЧЕНИЕ
В целом выявленные особенности накопления макро- и микроэлементов, а также антиоксидантов Dermatocarpon miniatum (L.) W. Mann представляют собой первую биохимическую характеристику этого вида лишайников и позволяют выделить этот вид по сравнению с эпигейными видами лишайников (Cladonia convoluta, Cladonia rangifornis) и эпифитным лишайником Evernia prunastri, как индикатор повышенных концентраций в окружающей среде бора, меди, калия, фосфора и селена.
Список литературы
Nash T.H. III, Sommerfeld M.R. 1981. Elemental concentrations in lichens in the area of the Four Corners Power Plant, New Mexico. – Environ. Exp. Bot. 21: 153–162.
Nascimbene J., Thüs H., Marini L., Nimis P.L. 2007. Freshwater lichens in springs of the eastern Italian Alps: Floristics, ecology and potential for bioindication. – Ann. Limnol. Int. J. Lim. 43(4): 285–292. https://doi.org/10.1051/limn:2007006
Crawford S.D. 2015. Lichens used in traditional medicine. – In: Lichen secondary metabolites: Bioactive properties and pharmaceutical potential. Springer, Cham. P. 27-80. https://doi.org/10.1007/978-3-319-13374-4_2
Wang L.S., Qian Z.G. 2013. Illustrated medicinal lichens of China. Yunnan kejichu ban she, China. 176 p.
Aslan A., Güllüce M., Sökmen M., Özkan H. 2008. Antioxidant and Antimicrobial Properties of the Lichens Cladonia foliacea, Dermatocarpon miniatum, Everinia divaricata. Evernia prunastri, and Neofuscella pulla. – Pharmac. Biol. 44(4): 247–252 https://doi.org/10.1080/13880200600713808
Окснер А.М. 1956. Флора лишайників України. Київ.1; 495 с.
Копачевская Е.Г. 1986. Лихенофлора Крыма и ее анализ. Киев.295 с.
Poelt J., Vězda A. 1981. Bestimmungsschlüssel europäischer Flechten. Ergänzungsheft II. – Bibliotheca Lichenologica 16. 390 p.
Purvis O.W., Coppins B.J., Hawksworth D.L., James P.W., Moore D.M. 1993.The Lichen Flora of Great Britain and Ireland. London. 710 p.
Dobson F. 2000. Lichens: An Illustrated Guide to the British and Irish species. Slough, England. 326 p.
Alfthan G.A. 1984. A micromethod for the determination of selenium in tissues and biological fluids by single-test-tube fluorimetry. – Anal. Chim. Acta. 65: 187–194. https://doi.org/10.1016/S0003-2670(00)85199-5
Голубкина Н.А., Кекина Е.Г., Молчанова А.В., Антошкина М.С., Надежкин С.М., Солдатенко А.В. 2018. Антиоксиданты растений и методы их определения. М. 48 с.
Максимова Т.В., Никулина И.Н., Пахомов В.П., Шкарина Е.И., Чумакова З.В., Арзамасцев А.П. 2001. Способ определения антиокислительной активности: Пат РФ 2170930 C1, № 2000111126/14; Заявл. 05.05.2000; Опубл. 20.07.2001.
Srivastava S., Adholeya A., Conlan X.A., Cahill D.M. 2015. Acidic potassium permanganate chemiluminescence for the determination of antioxidant potential in three cultivars of Ocimum basilicum. – Plant Foods Hum. Nutr. 71(1): 72-80. https://doi.org/10.1007/s11130-016-0527-8
Zhang X., Zarbl H. 2008. Chemopreventive doses of methylselenocysteine alter circadian rhythm in rat mammary tissue. – Cancer Prev. Res (Phila). 1(2): 119–127. https://doi.org/10.1158/1940-6207.CAPR-08-0036
Dere Ş., Günes T., Sivaci R. 1998. Spectrophotometric determination of chlorophyll a, b and total carotenoid contents of some algae species using different solvents. – Turk. J. Bot. 22(1): 13–17. http://journals.tubitak.gov.tr/botany/issues/bot-98-22-1/bot-22-1-3-96040.pdf
Khodosovtsev A.Y. 2003. An annotated list of the lichen forming fungi of the Karadag Natural Reserve. News of Biosphere Reserve Askania-Nova 5: 31–43.
Voytsekhovich A., Beck A. 2016. Lichen photobionts of the rocky outcrops of Karadag massif (Crimean Peninsula). – Symbiosis. 68(1–3): 9–24. https://doi.org/10.1007/s13199-015-0346-y
Nieboer E., Richardson D.H.S., Tomassini F.D. 1978. Mineral uptake and release by lichens: An overview. – The Bryologist. 81(2): 226–246. https://www.jstor.org/stable/3242185
Guidelines for Canadian Drinking Water Quality: Guideline Technical document – Boron. https://www.canada.ca/en/health-canada/services/publications/healthy-living/guidelines-canadian-drinking-water-quality-guideline-technical-document-boron.html
Drinking Water Health Advisory for Boron. 2008. Washington. 53 p. https://www.epa.gov/sites/production/files/2014-09/documents/drinking_water_health_advisory_for_boron.pdf
Durocher N.L. 1969. Preliminary air pollution survey of boron and its compounds. A literature review prepared under Contract No. PH 22-68-25, Public Health Service, National Air Pollution Control Administration, U.S. Department of Health, Education and Welfare, Raleigh, NC.
Butterwick L., De Oude N., Raymond K. 1989. Safety assessment of boron in aquatic and terrestrial environments. – Ecotoxicol. Env. Safety. 17(3): 339–371. https://doi.org/10.1016/0147-6513(89)90055-9
Голубкина Н.А., Лапченко В.А. 2018. Химический и элементный состав грунтовых вод Карадагского природного заповедника. Микроэлементы в медицине.4:20–30.
Nash T.H. 1996. Lichen Biology, 2nd ed. Cambridge, UK. 303 p. https://doi.org/10.1017/CBO9780511790478
Winkel L.H.E., Vriens B., Jones G.D., Schneider L.S., Pilon-Smits E., Bañuelos G.S. 2015. Selenium Cycling Across Soil-Plant-Atmosphere Interfaces: A Critical Review. – Nutrients. 7(6): 4199–4239. https://doi.org/10.3390/nu7064199
Kasote D.M., Katyare S.S., Hegde M.V., Bae H. 2015.Significance of Antioxidant Potential of Plants and its Relevance to Therapeutic Applications. – Int. J. Biol. Sci. 11(8): 982–991. https://doi.org/10.7150/ijbs.12096
Aoussar N., Rhallabi N., Mhand R.A., Manzali R., Bouksaim M., Douira A., Mellouki F. 2018. Seasonal variation of antioxidant activity and phenolic content of Pseudevernia furfuracea, Evernia prunastri and Ramalina farinacea from Morocco. – J. Saudi Soc. Agr. Sci. In press. https://doi.org/10.1016/j.jssas.2018.03.004
Peltonen P., Vapaavuori E., Julkunen-Tiitto R. 2005. Accumulation of phenolic compounds in birch leaves is changed by elevated carbon dioxide and ozone. – Global Change Biol. 11(8): 1305–1324. https://doi.org/10.1111/j.1365-2486.2005.00979.x
Stocker-Wörgötter E., Türk R. 1989.The Resynthesis of Thalli of Dermatocarpon miniatum under Laboratory Conditions. – Symbiosis. 7: 37–50.
Fontaine K.M., Beck A., Stocker-Wörgötter E., Piercey-Normore M.D. 2012. Photobiont Relationships and Phylogenetic History of Dermatocarpon luridum var. luridum and Related Dermatocarpon Species – Plants. 1(2): 39–60. https://doi.org/10.3390/plants1020039
Дополнительные материалы отсутствуют.
Инструменты
Растительные ресурсы


