Растительные ресурсы, 2021, T. 57, № 1, стр. 89-95
Содержание циклосиверсиозидов в образцах Astragalus pterocephalus (Fabaceae) разного географического происхождения (Республика Узбекистан)
М. А. Агзамова 1, Р. П. Закирова 1, *
1 Институт химии растительных веществ им. акад. С.Ю. Юнусова АН РУз
г. Ташкент, Республика Узбекистан
* E-mail: ranozakirova@mail.ru
Поступила в редакцию 04.05.2020
После доработки 24.10.2020
Принята к публикации 10.12.2020
Аннотация
Исследовано содержание циклоартановых соединений Astragalus pterocephalus Bunge в зависимости от места произрастания, а также изучена их ростостимулирующая активность. Выявлено, что содержание веществ в корнях со стеблями зависит от места произрастания растения А. рterocephalus. Максимальный выход циклосиверсиозидов F и Е оказался в образцах, собранных в Самаркандской и Сурхандарьинской обл. Республики Узбекистан. В этих же образцах содержится циклосиверсиозид C и только в растительном материале, собранном в Сурхандарьинской обл. обнаружен циклосиверсиозид А. Все исследуемые тритерпеновые гликозиды содержат в своем составе по два сахарных остатка. В циклосиверсиозидах А, С и Е – два остатка ксилозы, в циклосиверсиозиде С имеется одна ацетатная группа в молекуле ксилопиранозного остатка при С-3 генина, а в циклосиверсиозиде А – два ацильных заместителя при той же ксилозе. Циклосиверсиозид F характерен двумя разными остатками сахаров, в виде ксилозы при С-3 и глюкозы при С-6. Исследована ростостимулирующая активность основных гликозидов данного вида – циклосиверсиозидов F и Е. Сравнительное изучение ростостимулирующей активности показало, что при воздействии на семена однодольного растения пшеницы вещества не оказывали значительного действия, тогда как на культуре хлопчатника, представителя двудольных, активность была высокой, что говорит о специфичности их действия.
Одной из актуальных проблем современной фитофизиологии является изучение влияния биотических и абиотических факторов на синтез вторичных метаболитов. Эти факторы выступают в качестве экологических сигналов, обеспечивающих биохимическую адаптацию растений к существованию в биоценозах [1, 2]. Компонентный состав биологически активных низкомолекулярных соединений может быть специфичным на уровне различных таксономических групп (порядков, семейств, родов, видов), а также зависит от многих факторов – климатических условий региона, географического положения, состава и свойств почвы [3–5].
В Институте химии растительных веществ им. акад. С.Ю. Юнусова Академии наук Республики Узбекистан (ИХРВ АН РУз) в растениях рода Astragalus были впервые обнаружены циклоартановые гликозиды [6, 7]. Гликозиды циклоартанового ряда имеют в молекуле циклопропановое кольцо. В спектре ПМР в высоком поле наблюдают сигналы двух протонов в виде дублетов системы АВ при δ 0.36 и 0.70, характерные циклопропановому кольцу и сигналы семи метильных групп, что позволяет отнести соединение к тритерпеноидам циклоартанового ряда. Сигналы четвертичных углеродных атомов при δ 19.99, 28.14 и метиленового углеродного атома при δ 31.00 в спектре ЯМР С13 также характерны для 9,19-трехчленного цикла циклоартановых гликозидов. В ИК-спектре при 3040 см–1 наблюдается полоса поглощения, отнесенная к валентным колебаниям СН2-группы циклопропанового кольца. Общим генином для всех соединений является циклосиверсигенин.
Тритерпеновые гликозиды ряда циклоартана обладают гипохолестеринемической, гипотензивной, кардиотонической активностями, ингибируют процессы окисления липидов, проявляют седативную и противовоспалительную активности [8–10].
Astragalus pterocephalus Bunge является источником ряда тритерпеноидов циклоартанового ряда. В растении обнаружены гликозиды – циклосиверсиозиды А, С, Е и F [11, 12]. Этот вид растения распространен по всей территории Республики Узбекистан, в большей степени Кашкадарьинской и Сурхандарьинской областях, растет на щебнистых, каменистых и мелкоземистых склонах гор на высоте 1500–3000 м [13].
Целью настоящей работы было изучение содержания циклоартановых соединений в растениях A. pterocephalus в зависимости от места произрастания и их ростостимулирующей активности.
МАТЕРИАЛ И МЕТОДЫ
Образцы растений собирали и заготавливали в июле месяце в фазу цветения. Экстракция растительного сырья (корни со стеблями) проводилась 96%-ным метиловым спиртом при комнатной температуре четырехкратно. При проведении каждой экстракции на 1 кг сырья использовали 4 л растворителя. Метанол, предварительно очищенный путем перегонки, заливали в емкость с измельченным сухим растительным сырьем, экстрагировали в течение трех суток путем мацерации и извлекали сумму экстрактивных веществ.
Колоночную хроматографию проводили на силикагеле марки КСК, размер зерен 50–100 мкм при элюировании системой растворителей хлороформ–метанол–вода (70 : 12 : 1), (70 : 23 : 4).
Чистоту полученных соединений определяли методом ТСХ на пластинках Silufol (Merck, Германия) в системах 1–3: система № 1 – хлороформ–метанол (20 : 1), система № 2 –хлороформ–метанол–вода (70 : 12 : 1), система № 3 – хлороформ–метанол–вода (70 : 23 : 4). Гликозиды на ТСХ обнаруживали опрыскиванием 20%-ным раствором фосфорновольфрамовой кислоты в этаноле с последующим нагреванием при температуре 100–110 °С в течение 5–7 мин. При проявлении наблюдали пятна коричневого цвета, присущие гликозидам циклоартанового ряда. Подвижной фазой также являлась система растворителей хлороформ–метанол–вода (70 : 12 : 1), (70 : 23 : 4).
Все выделенные соединения были идентифицированы на основании данных спектров ИК, ЯМР Н1 и С13, а также непосредственным сравнением с истинными образцами. Спектры ЯМР Н1 снимали на приборе UNITY plus 400 (Varian) для растворов соединений в дейтеропиридине (δ, м.д., 0-ГМДС) и ЯМР С13 – на том же спектрометре при полном подавлении С-Н взаимодействий, а также в условиях DEPT.
Для изучения ростостимулирующей активности циклосиверсиозидов F и Е были использованы соединения, полученные ранее из растения A. pterocephalus [12]. Были приготовлены исходные растворы в концентрации 100 мкг/мл каждого гликозида в отдельности. Навеску веществ по 5 мг растворяли в нескольких каплях 96%-ного этилового спирта, слегка нагревая на водяной бане до полного их растворения, затем добавляли 5 мл дистиллированной воды, нагретой до 70 °С, после чего вливали 45 мл воды комнатной температуры. Для замачивания семян полученные растворы разводили до концентраций 1.0 и 0.1 мкг/мл.
Семена пшеницы Triticum aestivum L. сорта Татьяна и хлопчатника Gossypium hirsutum L. сорта Султан замачивали в растворах исследуемых гликозидов в течение 18 ч, после чего помещали в чашки Петри на двойной слой фильтровальной бумаги и инкубировали в термостате при температуре 25 °С [14]. На 5 сутки определяли среднюю длину корней и стеблей проростков. В качестве эталона использовался регулятор роста Учкун. Препарат представляет собой сумму биологически активных веществ (α-токоферол, полиизопреноидные спирты, фитостеролы и высшие алифатические спирты и др.) [15]. Полученные результаты исследований анализировали с использованием программного обеспечения OriginPro.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Климатические и почвенные условия горных и предгорных зон в пределах Республики Узбекистан значительно отличаются. Экологические различия определяются наличием горных отрогов Тянь-Шаня и Памиро-Алая, различно ориентированных относительно влажных западных и холодных северных воздушных течений. Горные условия определяют своеобразие водного и теплового режимов. С высотой закономерно увеличивается солнечная радиация, уменьшается атмосферное давление, снижается температура воздуха, увеличивается количество осадков и, как следствие, уменьшается продолжительность вегетационного периода растений. Также с высотой изменяется структура и свойства почвы [16]. Известны различия по составу почв горных систем Западного Тянь-Шаня и Гиссара. В горах западного Тянь-Шаня материнские породы и почвы имеют более тонкодисперсный состав, отличаются выщелоченностью от водорастворимых солей, гипса и карбонатов и более высоким содержанием органического вещества, а также азота и других биогенных элементов [17].
Для проведения фитохимических исследований растения А. pterocephalus заготавливали в трех различных географических точках: в предгорных районах в бассейне р. Ангрен Ташкентской обл.; в районе перевала Тахтакарачи на высоте 1630 м над ур. моря между Самаркандской и Кашкадарьинской обл.; в окрестностях высокогорного п. Нилу, расположенного на высоте 1700 м над ур. моря между юго-западными отрогами Гиссарского хребта в Сурхандарьинской обл. Для сравнительного анализа использован материал, собранный в 1983 г. на горном перевале Шахристан Республики Таджикистан [11]. Перевал проходит на высоте 3378 м через Туркестанский хребет Гиссаро-Алайской системы.
Изучение компонентного состава растений А. рterocephalus, собранных в различных регионах показало, что основными гликозидами во всех образцах являются циклосиверсиозиды F и Е. Максимальный выход этих веществ был в растениях, собранных в Сурхандарьинской области и составлял 1.45 и 0.95% соответственно (табл. 1). Следует отметить, что только в образцах 3 из Сурхандарьинской и 2 – из Самаркандской области, был обнаружен циклосиверсиозид С в количестве 0.09 и 0.015% соответственно. Циклосиверсиозид А (0.0018%) в небольших количествах найден только в образце 3 из Сурхандарьинской области [12]. В образце 2 растительного сырья, собранного в Самаркандской обл., содержание циклосиверсиозида F составляет 1.35%, на перевале Шахристан – 0.93%, и самое низкое – в растительном материале образца 1, собранного в Ташкентской обл. (0.009%).
Таблица 1.
Содержание циклоартановых гликозидов в А. рterocephalus из различных областей Узбекистана, (%) Table 1. Content of cycloartane glycosides in A. pterocephalus from different regions of Uzbekistan, (%)
| Соединения Compounds |
Ташкентская область, Июль, 2009 Tashkent region of Uzbekistan, July 2009 |
Самаркандская область, Июль, 2009 Samarkand region of Uzbekistan, July 2009 |
Сурхандарьинская обл., Июль, 2010 Surkhandarya region of Uzbekistan July 2010 |
Туркестанский хребет, Шахристан, Таджикистан май, 1983 Turkestan Range, Tadzhikistan, May 1983 |
|---|---|---|---|---|
| номера образцов растений sample number |
||||
| 1 | 2 | 3 | 4 | |
| Циклосиверсиозид F Cyclosiversioside F |
0.009 | 1.35 | 1.45 | 0.93 |
| Циклосиверсиозид Е Cyclosiversioside E |
0.003 | 0.84 | 0.95 | 0.23 |
| Циклосиверсиозид С Cyclosiversioside C |
– | 0.015 | 0.09 | – |
| Циклосиверсиозид А Cyclosiversioside A |
– | – | 0.0018 | – |
Выход циклосиверсиозида Е во всех образцах был ниже по сравнению с циклосиверсиозидом F. В растительном сырье образца 3, собранном в Сурхандарьинской обл., и образца 2 из Самаркандской обл. его содержание остается практически на одном уровне – 0.95 и 0.84% соответственно, а в Ташкентской обл. (образец 1) – всего 0.003%. По ранее полученным данным, в растительном материале образца 4, заготовленном в высокогорной зоне Туркестанского хребта (Таджикистан), содержание циклосиверсиозида Е составляет 0.23%.
Таким образом, изучение химического состава растений А. рterocephalus, произрастающих в различных регионах, показало, что качественный состав основных гликозидов – циклосиверсиозидов Е и F сохраняется. Высокий выход этих гликозидов наблюдается в растениях, произрастающих в Самаркандской и Сурхандарьинской областях.
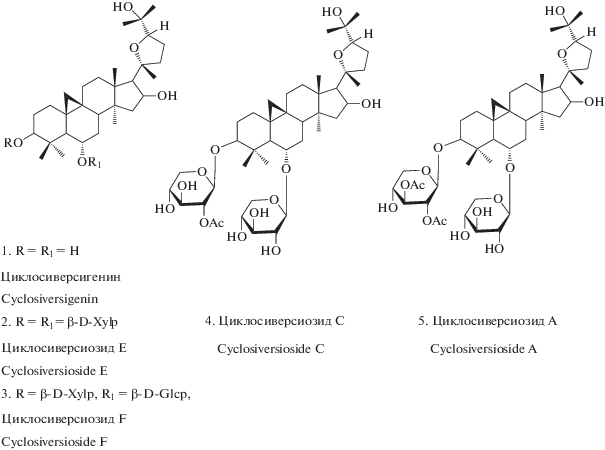
Все исследуемые тритерпеновые гликозиды содержат в своем составе по два сахарных остатка. В циклосиверсиозидах А, С и Е в виде двух остатков ксилозы. В циклосиверсиозиде С имеется одна ацетатная группа в молекуле кислопиранозного фрагмента при атоме С-3, а в циклосиверсиозиде А – два ацильных заместителя при той же ксилозе. Циклосиверсиозиде F содержит два разных остатка, в виде ксилозы при С-3 и глюкозы при С-6 (рис. 1).
Рис. 1.
Структурные формулы гликозидов растения А. рterocephalus. Fig. 1. Structural formulas of glycosides from А. рterocephalus.
Ранее нами была выявлена ростостимулирующая активность циклосиверсиозида F [18]. В настоящей работе проведено сравнительное изучение ростостимулирующей активности циклосиверсиозидов F и Е на культурах пшеницы и хлопчатника. Было выявлено, что при воздействии на семена пшеницы гликозидов в концентрациях 1.0 и 0.1 мкг/мл существенного стимулирующего эффекта на рост проростков не наблюдалось (рис. 2). В опытах на культуре хлопчатника вещества проявили достаточно высокую активность. При обработке семян циклосиверсиозидом F в дозе 1.0 мкг/мл длина корней достигала 4.8 см и превышала контрольные значения (4.1 см) на 16.7% (рис. 3). Более активной оказалась концентрация 0.1 мкг/мл: при воздействии на семена этой дозой наблюдался активный рост корней (5.8 см), превышающий значения контрольного варианта на 42.1% и эталонные (5.5 см) на 6.9%.
Рис. 2.
Влияние обработки семян пшеницы циклоартановыми гликозидами на рост (a) корней, (b) колеоптилей. 1 – контрольный вариант (без обработки); 2 – Учкун 1 мкг/мл; 3 – циклосиверсиозид F 1 мкг/мл; 4 – циклосиверсиозид F 0.1 мкг/мл; 5 – циклосиверсиозид Е 1 мкг/мл; 6 – циклосиверсиозид Е 0.1 мкг/мл. По горизонтали – варианты опытов; по вертикали – длина, см. Fig. 2. Effect of wheat seed treatment with cycloartan glycosides on (a) root growth, (b) coleoptile growth. 1 – control (no treatment); 2 – Uchkun 1 µ/ml; 3 – cyclosiversioside F 1 µ/ml; 4 – cyclosiversioside F 0.1 µ/ml; 5 – cyclosiversioside E 1 µ/ml; 6 – cyclosivercyoside E 0.1 µ/ml. X-axis – treatments; y-axis – length, cm.
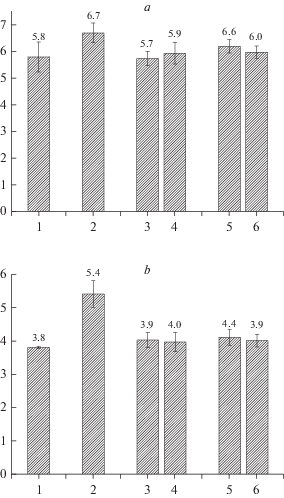
Рис. 3.
Влияние обработки семян хлопчатника циклоартановыми гликозидами на рост (a) корней, (b) стеблей. 1 – контрольный вариант (без обработки); 2 – Учкун 1 мкг/мл; 3 – циклосиверсиозид F 1 мкг/мл; 4 – циклосиверсиозид F 0.1 мкг/мл; 5 – циклосиверсиозид Е 1 мкг/мл; 6 – циклосиверсиозид Е 0.1 мкг/мл. По горизонтали – варианты опытов; по вертикали – длина, см. Fig. 3. Effect of cotton seed treatment with cycloartan glycosides on (a) root growth, (b) stem growth. 1 – control (no treatment); 2 – Uchkun 1 µ/ml; 3 – cyclosiversioside F 1 µ/ml; 4 – cyclosiversioside F 0.1 µ/ml; 5 – cyclosiversioside E 1 µ/ml; 6 – cyclosivercyoside E 0.1 µ/ml. X-axis – treatments; y-axis – length, cm.
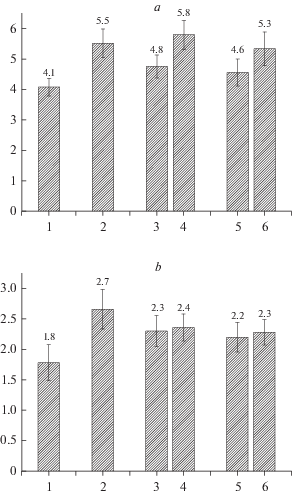
Обе исследуемые концентрации циклосиверсиозида Е также проявили стимулирующее действие. При обработке семян циклосиверсиозидом Е в концентрации 1.0 мкг/мл длина корней (4.6 см) превышала соответствующие контрольные значения на 11.8%. Активность дозы 0.1 мкг/мл была значительно выше, длина корней (5.3 см) превышала контрольные значения на 30.9%.
Установлено, что гликозиды в меньшей степени оказали воздействие на рост надземной части проростков и уступали препарату Учкун, который стимулировал рост стеблей на 49.4% (2.7 см). Следует также отметить, что активность двух исследуемых концентраций циклосиверсиозидов F и Е была практически на одном уровне. При обработке циклосиверсиозидом F в концентрации 1.0 мкг/мл длина стеблей (2.3 см) превышала контрольные величины на 29.2%, в концентрации 0.1 мкг/л (2.4 см) – на 32.6% (рис. 3). Длина стеблей проростков, обработанных циклосиверсиозидом Е в этих дозах, составляла 2.2 и 2.3 см и превышала контрольные значения на 23.6 и 28.1% соответственно.
ЗАКЛЮЧЕНИЕ
В результате проведенных исследований была выявлена зависимость содержания циклоартановых гликозидов в растительном сырье A. рterocephalus от места произрастания. Высокий выход основных гликозидов – циклосиверсиозидов F и Е, обнаружен в растениях, собранных в Сурхандарьинской и Самаркандской областях. В этих же образцах содержится циклосиверсиозид C, и только в образце 3 (Сурхандарьинская область) обнаружен циклосиверсиозид А.
Сравнительное изучение ростостимулирующей активности циклоартановых гликозидов показало, что они не оказывали значительного действия на семена однодольного растения – пшеницы, тогда как активность воздействия на представителя двудольных – хлопчатник, была высокой, особенно в отношении корней, что говорит о специфичности их действия.
Список литературы
Лукнер М. 1979. Вторичный метаболизм у микроорганизмов, растений и животных. М. 237.
Благовещенский A.B. 1966. Биохимическая эволюция цветковых растений. М. 328 с.
Поводыш М.Н. 2006. Разнообразие иридоидов в семействе Lamiaceae и их биологическая активность. – Растительные ресурсы. 42(2): 131–149.
Высочина Г.И. 1999. Биохимические подходы в познании биоразнообразия растительного мира. – Сибирский экологический журн. (3): 207–211. https://www.sibran.ru/upload/iblock/f80/f80a6e3ff1ba0a2b6533e9af1002ff3c.PDF
Кузьмина С.С. 2002. О зависимости накопления флавоноидов в растениях Якутии от климатических факторов. – В сб.: Флора, растительность и растительные ресурсы Забайкалья. Улан-Удэ. 87–90.
Свечникова А.Н., Умарова Р.У., Горовиц М.Б., Абубакиров Н.К. 1982. Тритерпеновые гликозиды Astragalus и их генины. IV. Циклосиверсиозид E – новый дигликозид из Astragalus sieversianus. Химия природных соединений. 2: 204–208.
Свечникова А.Н., Умарова Р.У., Горовиц М.Б., Абдуллаев Н.Д., Абубакиров Н.К. 1982. Тритерпеновые гликозиды Astragalus и их генины. V. Строение циклосиверсиозида F. Химия природ, соедин. 2: 208–211.
Хушбактова З.А., Агзамова М.А., Сыров В.Н., Мирсалихова Н.М., Умарова Ф.Т., Исаев М.И. 1994. Влияние циклоартанов растений рода Astragalus и их синтетических аналогов на сократительную функцию миокарда и активность Na, K-ATФазы. – Химия природных соединений. 4: 510–514.
Царук А.В., Хушбактова З.А., Сыров В.Н., Агзамова М.А., Касимова Г.М. 2008. Фармакокоррекция нарушений липидного обмена у кроликов с атеросклерозом циклоартановым гликозидом – циклосиверсиозидом F. – Фармацевтический журнал. 1: 72–76.
Царук А.В., Искендеров Д.А., Агзамова М.А., Хушбактова З.А., Сыров В.Н., Исаев М.И. 2010. Выделение и изучение циклоартановых гликозидов циклоорбикозида G и циклосиверсиозида А на метаболические процессы в миокарде крыс.– Химико-фармацевтический журнал. 44(1): 12–15. http://chem.folium.ru/index.php/chem/article/view/117
Агзамова М.А., Исаев М.И., Горовиц М.Б., Абубакиров Н.К. 1986. Тритерпеновые гликозиды Astragalus и их генины. XIX. Циклоартановые соединения и стерины из растений Astragalus pamirensis и A. pterocephalus. – Химия природных соединений. 1: 45–49.
Агзамова М.А, Исаев И.М. 2016. Компоненты растения Astragalus pterocephalus. – Химия природных соединений. 3: 433.
Коровин Е.П., Введенский А.Н. 1955. Флора Узбекской ССР, III. Ташкент. 684 с.
Ракитин Ю.В., Рудник В.Е. 1968. Первичная биологическая оценка химических соединений в качестве регуляторов роста растений и гербицидов. – В кн. Методы определения регуляторов роста и гербицидов. М. С. 182–197.
Khidirova N.K., Mamatkulova N.M., Kurbanova E.P., Ismailova K., Zakirova R.P., Khodjaniyazov Kh.U. 2016. Influence of an Uchkun preparation to some agricultural crops which are grown under unfavorable conditions. – Int. J. Environ. Agric. Res. 2(1): 102–108. https://ijoear.com/issue-detail/issue-January-2016
Генусов А.З. 1983. Почвы и земельные ресурсы Средней Азии. Ташкент. 134 с.
Горбунов Б.В., Кимберг Н.В., Конобеева Г.М., Морозова П.А. 1972. Сравнительная характеристика почв Северного и Южного Узбекистана. Ташкент. 17 с.
Закирова Р.П., Исаев И.М., Агзамова М.А. 2019. Исследования ростстимулирующих свойств циклоартанового гликозида растения Astragalus kuhitangi. – XI Всероссийская научная конференция “Химия и технология растительных веществ”. Сыктывкар. С. 94. https://chemi.komisc.ru/content/news/157/HTRV-2019.pdf
Дополнительные материалы отсутствуют.
Инструменты
Растительные ресурсы


