Растительные ресурсы, 2021, T. 57, № 2, стр. 158-167
Воздействие выбросов цементного завода на содержание метаболитов в хвое Larix cajanderi (Pinaceae) на территории Республики Саха (Якутия)
И. В. Слепцов 1, *, С. М. Рожина 1, В. В. Михайлов 1
1 Институт биологических проблем криолитозоны СО РАН
г. Якутск, Россия
* E-mail: neroxasg@mail.ru
Поступила в редакцию 10.07.2020
После доработки 28.08.2020
Принята к публикации 07.03.2021
Аннотация
Исследовано влияние выбросов Мохсоголлохского цементного завода (Республика Саха (Якутия)) на содержание метаболитов в хвое Larix cajanderi Mayr. Показано, что по мере приближения к цементному заводу наблюдалось повышение содержания элементов-поллютантов в хвое L. cajanderi – кремния, кальция, железа, алюминия, титана, цинка, хрома, никеля и ванадия. В результате их воздействия происходило повышение интенсивности перекисного окисления липидов в хвое, что приводило к ответной биохимической реакции, выражающейся в повышении содержания флавоноидов, жирных кислот, моносахаридов, дисахаридов, пинитола, дитерпеновых смоляных кислот, активности супероксиддисмутазы и снижении концентрации фосфорной и органических кислот. Техногенное загрязнение выбросами цементного завода привело к повышению уровня перекисного окисления липидов, активации антиоксидантных систем, ингибированию процессов клеточного дыхания, утолщению клеточной стенки и повышению содержания смоляных кислот в хвое L. cajanderi.
В настоящее время, вследствие интенсивного развития промышленности, одной из актуальных проблем является антропогенное загрязнение атмосферы, почв, водных ресурсов и растений. Загрязнение пылью составляет примерно 10% от общего антропогенного загрязнения [1]. Одним из основных источников пылевого загрязнения является цементная промышленность [2]. Выбросы цементного завода воздействуют на достаточно обширную территорию. В аэрозольные выбросы завода входят оксиды азота, серы, углерода, органические продукты сгорания топлива и значительное количество цементной, шламовой, клинкерной пыли [3]. Цементная пыль, которая является продуктом пережигания известняка с цементообразующими добавками, содержит CaO, SiO2, K2O, SO3, Al2O3, MgO, Fe2O3, MnO, в меньшем количестве соединения Mn, Zn, Cu, Cr, V, As, Ba, Pb и т.д. [4, 5]. Выбросы цементного завода оказывают влияние на биоту, в результате этого в организмах протекают приспособительные физиолого-биохимические реакции. Показано, что вблизи цементного завода наблюдается усыхание деревьев с характерным вершинно-периферическим типом повреждения кроны, дехромация хвои, уменьшение количества молодых побегов [6]. Установлено также изменение биохимических параметров, вследствие повышения уровня активных форм кислорода (АФК) и свободных радикалов, в результате чего изменяется прооксиданто-антиоксидантное стационарное равновесие в клетках растений [7–9]. Основной древесной породой и наиболее подверженной техногенному загрязнению Мохсоголлохским цементным заводов является лиственница Каяндера Larix cajanderi Mayr. Однако изучение влияния выбросов цементного завода на первичные и вторичные метаболиты хвои L. сajanderi ранее не проводилось.
Цель данного исследования – изучить воздействие хронического загрязнения цементной пылью на первичные и вторичные метаболиты в хвое Larix cajanderi.
МАТЕРИАЛЫ И МЕТОДЫ
Объектом исследования являлась лиственница Каяндера Larix cajanderi Mayr, относящаяся к семейству Pinaceae Lindl. Сбор хвои проводили с деревьев высотой 2–3 м в лиственничниках брусничных, в конце июля 2019 г. Точки отбора проб находились на расстоянии 1 (61°24′ с.ш., 128°58′ в.д.), 2 (61°25′ с.ш., 128°59′ в.д.), 3 (61°25′ с.ш., 129°00′ в.д.), 4 (61°25′ с.ш., 129°01′ в.д.) и 8 км (61°28′ с.ш., 129°04′ в.д. – условно чистая зона) от Мохсоголлохского цементного завода (Республика Саха (Якутия)) в северо-восточном направлении, в котором, согласно результатам, полученным В.А. Соромотиным [6], регистрируется преимущественное пылевое загрязнение. Отбор проб хвои для каждой аналитической повторности производили с 5 разных деревьев.
Для определения элементного состава отобранных образцов хвои L. cajanderi, предварительно промытых дистиллированной водой, использовался атомно-эмиссионный спектрометр с индуктивно связанной плазмой (АЭС ИСП) iCAP DUO 6500 фирмы Thermo Scientific (США) с программным обеспечением iTEVA. Используемая методика заключается в кислотном разложении навески 100 мг измельченной пробы. Навески помещали в полипропиленовые пробирки системы HotBlock фирмы Environmental Express (США), добавляли по 1 мл 40%-ной фтористоводородной кислоты. Пробирки помещали в систему HotBlock и выдерживали при 130 °C в течение 60 мин. После 30 мин остывания в пробирки добавляли по 2 мл 70%-ной азотной кислоты и 8 мл 37%-ной соляной кислоты. Пробирки выдерживали с закрытой крышкой при 130 °С в течение 60 мин в системе HotBlock. После 30 мин остывания пробирок на воздухе в каждую добавляли по 5 мл 37%-ной соляной кислоты и 20 мл 4%-ной борной кислоты. В качестве внутреннего стандарта для учета качества разбавления полученного раствора и различных эффектов матрицы при определении методом АЭС использовалась добавка 1 мл раствора нитрата индия с массовой концентрацией In3+ 1.25 мг/л. Полученный раствор разбавляли до 50 мл и фильтровали через бумажный фильтр марки “синяя лента”. Далее в фильтрате проводили определение концентраций Si, Ca, Fe, Al, Ti, Zn, Cr, Ni, V методом АЭС ИСП.
Определение активности супероксиддисмутазы (СОД, КФ 1.15.1.1; мкмоль/г мин) проводили по измерению величины молярного коэффициента экстинкции бисформазановых комплексов [10]. Интенсивность перекисного окисления липидов определяли по методике, основанной на реакции между малоновым диальдегидом (МДА, мкмоль/г) и тиобарбитуровой кислотой [11]. Концентрацию флавоноидов в хвое определяли в метанольных экстрактах на ВЭЖХ Милихром А-02 фирмы ЭкоНова (Россия) [12].
Для метаболомного анализа 10 мг воздушно-сухой хвои L. cajanderi экстрагировали в 1 мл метанола. Полученный экстракт выпаривали при 40° С на роторном испарителе, сухой остаток растворяли в 50 мкл пиридина. Для получения летучих триметилсилил-производных (ТМС) проводили дериватизацию с использованием 50 мкл N,O-бис-(триметилсилил)трифторацетамида (BSTFA) в течение 15 мин при 100 °С. Анализ проводили методом газовой хромато-масс-спектрометрии (ГХ-МС) на хроматографе “Маэстро” (Россия) с квадрупольным масс-спектрометром Agilent 5975С (США), колонка HP-5MS, 30 м × 0.25 мм. Для хроматографии использовали линейный градиент температуры от 70 до 320 °C со скоростью 4 °C/мин при потоке газа (гелий) 1 мл/мин. Сбор данных осуществляли с помощью программного обеспечения Agilent ChemStation. Количественную интерпретацию хроматограмм проводили методом внутренней стандартизации по углеводороду С23 [13]. Обработка и интерпретация масс-спектрометрической информации проводилась с использованием стандартной библиотеки NIST 2011. Для статистического анализа полученных метаболомных данных была создана матрица, на которой отражены метаболомные профили хвои L. cajanderi на исследованных участках. Построенный профиль включал 15 наблюдений по 124 метаболитам. Полученный массив данных был обработан методом дискриминантного анализа частичных наименьших квадратов (PLS-DA) в программе MetaboAnalyst (www.metaboanalyst.ca).
Все аналитические измерения выполнены в трех повторностях. Полученные результаты представлены в виде средней арифметической величины и ее стандартного отклонения (M ± SD). Сравнение средних значений выборок проводили методом ANOVA. Значимость отличий от контроля определяли, используя критерий Ньюмена–Кейлса для множественных сравнений при уровне P < 0.05. Для установления статистической взаимосвязи между биохимическими параметрами и суммарным содержанием элементов-поллютантов использовали коэффициент корреляции Пирсона. Расчет проводился с помощью пакета AnalystSoft, StatPlus – программа статистического анализа, Vol.2007.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Проведенные исследования показали, что по мере удаления от источника загрязнения содержание кремния, кальция, железа, алюминия, титана, цинка, хрома, никеля и ванадия статистически достоверно уменьшалось в хвое L. cajanderi (табл. 1). Следует отметить очень высокое содержание титана в хвое L. cajanderi вблизи цементного завода, которое превышало условно фоновое содержание в 37 раз, что согласуется с ранее проведенными исследованиями [6, 7]. Это может быть связано с высокой концентрацией титана в перерабатываемой породе.
Таблица 1.
Содержание элементов-поллютантов в хвое Larix cajanderi на разном удалении от цементного завода Table 1. Content of pollutants in Larix cajanderi needles at different distances from the cement plant
| Расстояние, км Distance, km |
Si, г кг–1 g kg–1 |
Ca, г кг–1 g kg–1 |
Fe, г кг–1 g kg–1 |
Al, г кг–1 g kg–1 |
Ti, мг кг–1 g kg–1 |
Zn, мг кг–1 g kg–1 |
Cr, мг кг–1 g kg–1 |
Ni, мг кг–1 g kg–1 |
V, мг кг–1 g kg–1 |
Сумма, мг кг–1 Sum, g kg–1 |
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 20 ± 2a | 17 ± 1a | 1.0 ± 0.1a | 0.91 ± 0.06a | 296 ± 37a | 44 ± 4a | 7.0 ± 0.5a | 3.6 ± 0.2a | 1.5 ± 0.2a | 39 ± 3a |
| 2 | 16 ± 1b | 12 ± 1b | 0.8 ± 0.1a | 0.56 ± 0.05b | 108 ± 13b | 41 ± 3a | 6.5 ± 0.5a | 3.2 ± 0.2a | 1.3 ± 0.2a | 30 ± 2b |
| 3 | 12 ± 1c | 11 ± 1b | 0.4 ± 0.0b | 0.40 ± 0.05c | 15 ± 3c | 26 ± 2b | 4.9 ± 0.3b | 1.6 ± 0.1b | 0.9 ± 0.1b | 24 ± 1c |
| 4 | 10 ± 1c | 12 ± 1b | 0.4 ± 0.1b | 0.23 ± 0.03d | 16 ± 4c | 23 ± 3b | 5.2 ± 0.4b | 1.6 ± 0.1b | 0.6 ± 0.1c | 23 ± 1c |
| 8 | 8 ± 0d | 9 ± 1c | 0.2 ± 0.0c | 0.15 ± 0.03d | 8 ± 1d | 26 ± 2b | 4.2 ± 0.3c | 1.4 ± 0.1b | 0.4 ± 0.0d | 17 ± 1d |
Примечание. Средние значения с разными буквенными надстрочными индексами внутри столбца статистически различаются при р ≤ 0.05 по критерию Ньюмена–Кейлса, n = 3. Note. Different superscript letters within the column indicate statistical differences of the means at p ≤ 0.05 according to the Newman–Keuls test, n = 3.
Известно, что в результате пылевого загрязнения происходит проникновение поллютантов внутрь растительных клеток, приводящее к повышению генерации активных форм кислорода (АФК) и интенсификации перекисного окисления мембранных полиненасыщенных жирных кислот, ведущее к повышению содержания малонового диальдегида [8, 14]. Результаты наших исследований показали, что по мере приближения к цементному заводу наблюдалось статистически достоверное увеличение в хвое L. cajanderi концентрации МДА на 29–86% (табл. 2). Выявлена прямая корреляция между концентрацией МДА в клетках и суммарным содержанием исследованных элементов-поллютантов (r = 0.92; P = 0.02), что может свидетельствовать об увеличении генерации АФК и свободных радикалов при действии техногенного загрязнения цементной пылью.
Таблица 2.
Активность супероксиддисмутазы, концентрация малонового диальдегида, рутина и дигидрокверцетина в хвое Larix cajanderi на разном удалении от цементного завода Table 2. Superoxide dismutase activity, concentration of malondialdehyde, rutin and dihydroquercetin in Larix cajanderi needles at different distances from the cement plant
| Расстояние, км Distance, km | СОД, мкмоль г–1 мин–1 SOD, µmol g–1 min–1 |
МДА, мкмоль г–1 MDA, µmol g–1 |
Рутин, мг г–1 Rutin, mg g–1 |
ДКВ, мг г–1 DHQ, mg g–1 |
|---|---|---|---|---|
| 1 | 3.4 ± 0.3a | 0.26 ± 0.02a | 0.91 ± 0.07a | 0.86 ± 0.10a |
| 2 | 2.9 ± 0.3a,b | 0.26 ± 0.02a | 1.02 ± 0.12a | 0.51 ± 0.03b |
| 3 | 2.6 ± 0.2b | 0.19 ± 0.01b | 0.71 ± 0.05b | 0.46 ± 0.05b,c |
| 4 | 1.7 ± 0.2c | 0.18 ± 0.01b | 0.62 ± 0.03b,c | 0.37 ± 0.02c |
| 8 | 0.3 ± 0.0d | 0.14 ± 0.01c | 0.58 ± 0.02c | 0.29 ± 0.02d |
Примечание. Средние значения с разными буквенными надстрочными индексами внутри столбца статистически различаются при р ≤ 0.05 по критерию Ньюмена–Кейлса, n = 3. Note. Different superscript letters within the column indicate statistical differences of the means at p ≤ 0.05 according to the Newman–Keuls test, n = 3.
Для инактивации АФК и свободных радикалов в растениях развиты сложные антиоксидантные системы защиты [15]. Одним из важнейших их составляющих является фермент супероксиддисмутаза, который катализирует дисмутацию супероксида с образованием кислорода и пероксида водорода [16]. По мере приближения к цементному заводу наблюдалось увеличение активности СОД в хвое L. cajanderi в 3.4–6.5 раз (табл. 2). Выявлена прямая взаимосвязь между активностью СОД и суммарным содержанием исследованных элементов-поллютантов (r = 0.89; P = 0.04), что может свидетельствовать о повышении концентрации супероксид радикалов. Флавоноиды также являются важнейшими низкомолекулярными антиоксидантами растений, которые вносят существенный вклад в защиту организма [17]. Известно, что низкомолекулярные антиоксиданты, в том числе и флавоноиды, участвуют в инактивации свободных радикалов, некоторые из них способны также образовывать с тяжелыми металлами нерастворимые соединения [18]. В хвое L. cajanderi зафиксировано увеличение концентрации рутина и дигидрокверцетина (ДКВ) в 1.2–1.7 и 1.3–3.0 раза соответственно по мере приближения к цементному заводу (табл. 2), что, по-видимому, вызвано повышением содержания свободных радикалов и элементов-поллютантов в клетках. Подтверждением этого может служить прямая связь между содержанием рутина (r = 0.80; P = 0.05) и ДКВ (r = 0.97; P = 0.01) в хвое L. cajanderi и суммарным содержанием элементов-поллютантов.
Таким образом, показано, что при действии цементного загрязнения в хвое L. cajanderi повышается генерация АФК и свободных радикалов, вызванная проникновением в клетки элементов-поллютантов. В результате этого происходит усиление интенсивности перекисного окисления липидов и наблюдается ответная защитная реакция организма, которая заключается в активации супероксиддисмутазы и увеличении концентрации флавоноидов. Вместе с тем, полученные результаты указывают на то, что повышение активности антиоксидантных систем оказывается недостаточным для компенсации повышения интенсивности ПОЛ в результате техногенного загрязнения цементной пылью.
По результатам метаболомного анализа установлено, что точки, являющиеся отражением метаболома хвои L. cajanderi, объединились в 5 групп, соответствующих расстоянию от цементного завода (рис. 1). Следует отметить, что полученные группы не перекрываются друг с другом, что может быть вызвано различной техногенной нагрузкой на исследованных участках. Исключением является небольшое перекрытие двух групп метаболомов хвои, собранной на расстоянии 3 и 4 км.
Рис. 1.
Распределение метаболомов в хвое Larix cajanderi на разном расстоянии от цементного завода, рассчитанное методом дискриминантного анализа частичных наименьших квадратов. Модель построена на основе анализа концентраций 124 метаболитов. Fig. 1. Distribution of metabolomes in the needles of Larix cajanderi at different distances from the cement plant calculated by partial least squares discriminant analysis. The model is based on the analysis of concentrations of 124 metabolites.
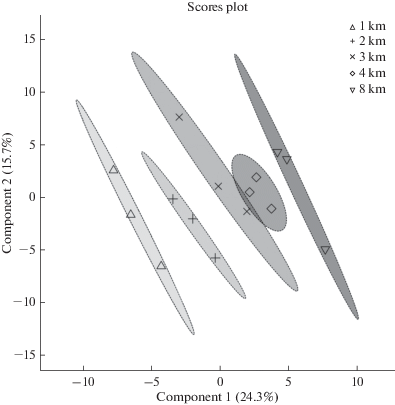
Основными метаболитами, которые оказывали наибольший вклад в разделение групп метаболомов, являлись моносахариды, дисахариды, полиолы, неорганические, органические, жирные и дитерпеновые кислоты. Показано, что по мере приближения к цементному заводу наблюдалось уменьшение содержания янтарной, фумаровой и яблочной кислот на 30–58, 22–44 и 21–29% соответственно (табл. 3) что, вероятно, вызвано образованием растворимых комплексов исследуемых веществ с металлами [19]. Выявлена обратная корреляция между содержанием янтарной (r = –0.93; P = 0.02), фумаровой (r = –0.99; P = 0.01) и яблочной кислот (r = –0.97; P = 0.01) в хвое L. cajanderi и суммарным содержанием элементов-поллютантов. Наблюдаемые эффекты могут свидетельствовать о снижении интенсивности клеточного дыхания при загрязнении цементной пылью, в результате закупоривания устьиц [20]. Вследствие этого, возможно, нарушались энергетические процессы в растительном организме, которые отражались в уменьшении концентрации фосфорной кислоты в хвое L. cajanderi на 17–32%. (r = –0.88; P = 0.04) по мере приближения к цементному заводу.
Таблица 3.
Содержание органических, неорганических и свободных жирных кислот в хвое Larix cajanderi на разном удалении от цементного завода Table 3. Content of organic, inorganic and free fatty acids in Larix cajanderi needles at different distances from the cement plant
| Расстояние, км Distance, km |
Фосфорная
кислота, мг г–1 Phosphoricacid, mg g–1 |
Янтарная
кислота, мг г–1 Succinicacid, mg g–1 |
Фумаровая кислота, мг г–1 Fumaric acid, mg g–1 |
Яблочная
кислота, мг г–1 Malic acid, mg g–1 |
Аскорбиновая кислота, мг г–1 Ascorbic acid, mg g–1 |
Олеиновая кислота, мг г–1 Oleic acid, mg g–1 |
Линолевая кислота, мг г–1 Linoleic acid, mg g–1 |
|---|---|---|---|---|---|---|---|
| 1 | 6.0 ± 0.1a | 0.22 ± 0.02a | 0.23 ± 0.03a | 0.75 ± 0.04a | 2.3 ± 0.1a | 0.39 ± 0.01a | 0.35 ± 0.01a |
| 2 | 6.6 ± 0.4b | 0.37 ± 0.02b | 0.32 ± 0.03b | 0.83 ± 0.06a | 2.2 ± 0.1a | 0.36 ± 0.01c,b | 0.11 ± 0.01b |
| 3 | 6.8 ± 0.5b | 0.38 ± 0.02b | 0.35 ± 0.03b,c | 0.98 ± 0.04b | 3.4 ± 0.1b | 0.34 ± 0.01b | 0.10 ± 0.01b |
| 4 | 7.2 ± 0.4b | 0.37 ± 0.05b | 0.36 ± 0.02b,c | 1.01 ± 0.09b | 3.5 ± 0.2b | 0.28 ± 0.02c | 0.09 ± 0.01b |
| 8 | 8.8 ± 0.4c | 0.53 ± 0.02c | 0.41 ± 0.02c | 1.05 ± 0.09b | 4.0 ± 0.4b | 0.17 ± 0.02d | 0.09 ± 0.02b |
Примечание. За 1 мг принят 1 мг TMS-производных идентифицированных соединений. Средние значения с разными буквенными надстрочными индексами внутри столбца статистически различаются при р ≤ 0.05 по критерию Ньюмена–Кейлса, n = 3. Note. As 1 mg of a compound, 1 mg of its TMS-derivative is taken. Different superscript letters within the column indicate statistical differences of the means at p ≤ 0.05 according to the Newman–Keuls test, n = 3.
С приближением к источнику загрязнения наблюдалось достоверное уменьшение (на 12–43%) содержания аскорбиновой кислоты в хвое L. cajanderi (табл. 3). Выявлена обратная связь между содержанием аскорбиновой кислоты и суммарным содержанием исследованных элементов-поллютантов (r = –0.91; P = 0.03), что может быть связано с повышением уровня перекисного окисления липидов. Так, известно, что аскорбиновая кислота способствует инактивации АФК и свободных радикалов [21]. По мере приближения к цементному заводу, концентрация в хвое свободных ненасыщенных жирных кислот, таких как олеиновая и линоленовая, увеличивалось в 1.6–2.3 и 1.2–3.9 раза соответственно. Выявлена прямая связь между содержанием олеиновой (r = 0.87; P = 0.05) и линоленовой (r = 0.87; P = 0.05) кислот и суммарным содержанием исследованных элементов-поллютантов. Такие эффекты могут быть вызваны активацией десатураз жирных кислот, возникающих в результате компенсаторных биохимических адаптационных реакций в ответ на повышение интенсивности перекисного окисления липидов [22].
Известно, что клеточная стенка играет важную роль в защите организма при техногенном загрязнении [23]. При интоксикации тяжелыми металлами наблюдается утолщение клеточной стенки [24], так как она предотвращает поступление тяжелых металлов в клетки растения [25, 26]. Наши исследования показали прямую корреляцию между суммарным содержанием элементов-поллютантов и концентрацией галактозы (r = 0.82; P = 0.05), фруктозы (r = 0.92; P = 0.02), глюкозы (r = 0.90; P = 0.03), маннозы (r = 0.98; P = 0.01), сахарозы (r = 0.87; P = 0.05), трегалозы (r = 0.98; P = 0.01) и пинитола (r = 0.99; P = 0.00) в хвое L. cajanderi (табл. 4). Повышение содержания моносахаридов, дисахаридов и пинитола в хвое L. cajanderi в результате пылевого загрязнения выбросами цементного завода может быть вызвано утолщением клеточной стенки.
Таблица 4.
Содержание моносахаридов, дисахаридов и полиолов в хвое Larix cajanderi на разном удалении от цементного завода Table 4. Content of monosaccharides, disaccharides and polyols in Larix cajanderi needles at different distances from the cement plant
| Расстояние, км Distance, km | Галактоза,
мг г–1 Galactose, mg g–1 |
Фруктоза,
мг г–1 Fructose, mg g–1 |
Глюкоза,
мг г–1 Glucose, mg g–1 |
Манноза,
мг г–1 Mannose, mg g–1 |
Сахароза,
мг г–1 Sucrose, mg g–1 |
Трегалоза,
мг г–1 Trehalose, mg g–1 |
Пинитол,
мг г–1 Pinitol, mg g–1 |
|---|---|---|---|---|---|---|---|
| 1 | 11 ± 1a | 40 ± 2a | 50 ± 1a | 34 ± 2a | 53 ± 2a | 0.27 ± 0.01a | 73 ± 4a |
| 2 | 11 ± 0a | 39 ± 3a | 48 ± 3a,b | 31 ± 2a | 47 ± 2a | 0.22 ± 0.01a | 62 ± 3b |
| 3 | 11 ± 1a | 33 ± 1b | 45 ± 1b | 26 ± 1b | 29 ± 2b | 0.17 ± 0.01b | 55 ± 1c |
| 4 | 10 ± 1a | 28 ± 1c | 37 ± 1c | 27 ± 1b | 31 ± 1b | 0.14 ± 0.01b | 55 ± 2c |
| 8 | 8 ± 1b | 26 ± 1c | 34 ± 1d | 24 ± 1b | 33 ± 1b | 0.08 ± 0.01c | 47 ± 2d |
Примечание. За 1 мг принят 1 мг TMS-производных идентифицированных соединений. Средние значения с разными буквенными надстрочными индексами внутри столбца статистически различаются при р ≤ 0.05 по критерию Ньюмена–Кейлса, n = 3. Note. As 1 mg of a compound, 1 mg of its TMS-derivative is taken. Different superscript letters within the column indicate statistical differences of the means at p ≤ 0.05 according to the Newman–Keuls test, n = 3.
Одними из важнейших метаболитов, участвующих в защите хвойных растений при воздействии абиотических и биотических факторов среды, являются дитерпеновые смоляные кислоты [27, 28]. Наши исследования показали, что по мере приближения к цементному заводу в хвое L. cajanderi наблюдалось повышение содержания таких дитерпеновых смоляных кислот, как изопимаровая и дегидроабиетиновая в 2.5–4.2 и 1.7–2.7 раз соответственно (табл. 5). Выявлена прямая корреляция между содержанием изопимаровой (r = 0.97; P = 0.01) и дегидроабиетиновой (r = 0.94; P = 0.01) кислот и суммарным содержанием элементов-поллютантов. Повышение содержания смоляных кислот в хвое при воздействии выбросов цементного завода обусловлено тем, что они могут участвовать в связывании тяжелых металлов за счет наличия карбоксильных групп. Так, известно, что лимонная, винная, щавелевая, янтарная, аспарагиновая и глутаминовая кислоты образуют растворимые комплексы с металлами, которые способствуют увеличению их подвижности в организме [19].
Таблица 5.
Содержание изопимаровой и дегидроабиетиновой кислот в хвое Larix cajanderi на разном удалении от цементного завода Table 5. Content of isopimaric and dehydroabietic acids in Larix cajanderi needles at different distances from the cementplant
| Расстояние, км Distance, km |
Изопимаровая кислота, мг г–1 Isopimaric acid, mg g–1 |
Дегидроабиетиновая кислота, мг г–1 Dehydroabietic acid, mg g–1 |
|---|---|---|
| 1 | 0.34 ± 0.02a | 0.35 ± 0.03a |
| 2 | 0.24 ± 0.03b | 0.22 ± 0.02b |
| 3 | 0.21 ± 0.02b | 0.23 ± 0.02b |
| 4 | 0.20 ± 0.02b | 0.22 ± 0.01b |
| 8 | 0.08 ± 0.02c | 0.13 ± 0.01c |
Примечание. Значения представлены в виде среднего ± стандартное отклонение (M ± σ). За 1 мг принят 1 мг TMS-производных идентифицированных соединений. Средние значения с одинаковыми буквенными надстрочными индексами внутри столбца статистически неразличимы при р ≤ 0.05 по критерию Ньюмена–Кейлса, n = 3. Note. Values are represented as mean ± standard deviation (M ± σ). As 1 mg of a compound, 1 mg of its TMS-derivative is taken. Means with same superscript letters within the column indicate no statistical difference at p ≤ 0.05 according to the Newman–Keuls test, n = 3.
ЗАКЛЮЧЕНИЕ
Установлено, что выбросы Мохсоголлохского цементного завода (Республика Саха (Якутия)) приводят к повышению содержания кремния, кальция, железа, алюминия, титана, цинка, хрома, никеля и ванадия в хвое Larix cajanderi Mayr. В результате антропогенного загрязнения цементной пылью в хвое L. cajanderi наблюдалось повышение интенсивности ПОЛ, активация механизмов антиоксидантной защиты, синтеза ненасыщенных жирных кислот и ингибирование клеточного дыхания. Проникновение поллютантов в хвою L. cajanderi способствовало ответной биохимической реакции, проявляющейся в утолщении клеточной стенки и увеличении содержания дитерпеновых смоляных кислот, которые, возможно, способствовали их связыванию и выведению из растения. Результаты исследования показывают, что техногенное загрязнение окружающей среды, вызванное деятельностью цементного завода, приводит к существенным изменениям биохимических процессов в хвое L. cajanderi.
Список литературы
Азаров В.Н., Маринин Н.А., Барикаева Н.С., Лопатина Т.Н. 2013. О загрязнении мелкодисперсной пылью воздушной среды городских территорий – Биосферная совместимость: человек, регион, технологии. (1): 30–34. http://biosfera.swsu.ru/archive/bs(1).pdf
Mutlu S., Atici Ö., Kaya Y. 2009. Effect of cement dust on the diversity and the antioxidant enzyme activities of plants growing around a cement factory. – Fres. Environ. Bull. 18(10): 1823–1827. https://www.researchgate.net/publication/257727064
Щелчкова М.В., Жерготова М.С. 2014. Влияние пылевыбросов цементного завода ОАО ПО “Якутцемент” на химические и микробиологические свойства мерзлотных почв. – Проблемы региональной экологии. (5): 31–36. https://www.elibrary.ru/item.asp?id=22927353
Mandre M., Tuulmets L. 1997. Pigment changes in Norway spruce induced by dust pollution. – Wat. Air Soil Poll. 94(3–4): 247–258. https://doi.org/10.1023/A:1026499523741
Mandre M., Ots K. 2012. Monitoring of heavy metals uptake and allocation in Pinus sylvestris organs in alkalised soil. – Environ. Monit. Assess. 184(7): 4105–4117. https://doi.org/10.1007/s10661-012-2878-4
Соромотин В.А. 2008. Влияние выбросов цементного завода на растительный покров Центральной Якутии (на примере Мохсоголлохского цементного завода): Автореф. дис. … канд. биол. наук. Якутск. 21 с
Шашурин М.М., Журавская А.Н. 2007. Изучение адаптивных возможностей растений в зоне техногенного воздействия. – Экология. 2: 93–98. https://www.elibrary.ru/item.asp?id=9479221
Erdal S., Demirtas A. 2010. Effects of cement flue dust from a cement factory on stress parameters and diversity of aquatic plants. – Toxicol. Indust. Health. 26(6): 339–343. https://doi.org/10.1177/0748233710369235
Yakovleva A.I., Okhlopkova E.D., Olesova L.D., Krivoshapkina Z.N., Konstantinova L.I., Grigorieva A.A., Semenova E.I., Efremova A.V., Mironova G.E. 2019. Influence of cement plant emissions on medicinal properties of medicinal plants in Central Yakutia. – Yakut Medical Journal. 66(2): 38–41. https://doi.org/10.25789/YMJ.2019.66.11
Giannopolitis C.N., Ries S.K. 1977.Superoxide Dismutases: I. Occurrence in Higher Plants. – Plant Physiol. 59(2): 309–314. https://doi.org/10.1104/pp.59.2.309
Владимиров Ю.А., Арчаков А.И. 1972. Перекисное окисление липидов в биологических мембранах. М. 252 с.
Слепцов И.В., Журавская А.Н. 2016. Динамика накопления флавоноидов в листьях Amaranthus retroflexus, Agastache rugosa и Thlaspi arvense собранных в Центральной Якутии. – Химия растительного сырья. (3): 67–72. https://doi.org/10.14258/jcprm.2016031241
Петрова Н.В., Сазанова К.В., Медведева Н.А., Шаварда А.Л. 2018. Особенности метаболомного профиля на разных стадиях онтогенеза Prunella vulgaris (Lamiaceae) при выращивании в климатической камере. – Химия растительного сырья. (3): 139–147. https://doi.org/10.14258/jcprm.2018033798
Прокопьев И.А., Филиппова Г.В., Шеин А.А., Габышев Д.В. 2014. Влияние городского техногенного загрязнения на морфологические, биохимические характеристики и семенную продуктивность ромашки аптечной. – Экология. 1: 22–29. https://www.elibrary.ru/item.asp?id=21092702
Blokhina O., Virolainen E., Fagerstedt K.V. 2003. Antioxidants, oxidative damage and oxygen deprivation stress: a review. – Ann. Botan. 91(2): 179–194. https://doi.org/10.1093/aob/mcf118
Gill S.S., Tuteja N. 2010. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants. – Plant Physiol. Biochem. 48(12): 909–930. https://doi.org/10.1016/j.plaphy.2010.08.016
Sytar O., Kumar A., Latowski D., Kuczynska P., Strzałka K., Prasad M.N.V. 2013. Heavy metal-induced oxidative damage, defense reactions, and detoxification mechanisms in plants. – Acta Physiol. Plant. 35(4): 985–999. https://doi.org/10.1007/s11738-012-1169-6
Michalak A. 2006. Phenolic compounds and their antioxidant activity in plants growing under heavy metal stress. – Pol. J. Environ. Stud. 15(4): 523–530. http://www.pjoes.com/Phenolic-Compounds-and-Their-Antioxidant-Activity-in-Plants-Growing-under-Heavy-Metal,87899,0,2.html
Yang R.B., Zeng Q.R., Zhou X.H., Tie B.Q., Liu S.Y. 2000. The activated impact of plant root exudates on heavy metals in soils contaminated by tailing of lead-zinc ore. – Agro Environ. Protec. 19(3): 152–155.
Ильин В.Б. 1991. Тяжелые металлы в системе почва–растение. Новосибирск. 151 с.
He Y.Y., Häder D.P. 2002. UV-B-induced formation of reactive oxygen species and oxidative damage of the cyanobacterium Anabaena sp.: protective effects of ascorbic acid and N-acetyl-L-cysteine. – J. Photochem. Photobiol. B: Biology. 66(2): 115–124. https://doi.org/10.1016/S1011-1344(02)00231-2
Hochachka P.W., Somero G.N. 1984. Biochemical adaptation. New Jersey. 537 p. https://doi.org/10.1515/9781400855414
Macfie S.M., Welbourn P.M. 2000. The cell wall as a barrier to uptake of metal ions in the unicellular green alga Chlamydomonas rienhardtii (Chlorophyceae). – Arch. Environ. Contam. Toxicol. 39(4): 413–419. https://doi.org/10.1007/s002440010122
Wierzbicka M. 1998.Lead in apoplast of Allium cepa L. root tips – ultrastructural studies. – Plant Sci. 133(1): 105–119. https://doi.org/10.1016/S0168-9452(98)00023-5
Титов А.Ф., Казнина Н.М., Таланова В.В. 2012. Устойчивость растений к кадмию. Петрозаводск. 54 с.
Regvar M., Vogel-Mikuš K. 2008. Recent advances in understanding of plant responses to excess metals: exposure, accumulation, and tolerance. – In: Sulfur Assimilation and Abiotic Stress in Plants. Berlin, Heidelberg. P. 227–251. https://link.springer.com/chapter/10.1007%2F978-3-540-76326-0_11
Langenheim J.H. 1994. Higher plant terpenoids: a phytocentric overview of their ecological roles. – J. Chem. Ecol. 20(6): 1223–1280. https://doi.org/10.1007/BF02059809
Keeling C.I., Bohlmann J. 2006. Diterpene resin acids in conifers. – Phytochemistry. 67(22): 2415–2423. https://doi.org/10.1016/j.phytochem.2006.08.019
Дополнительные материалы отсутствуют.
Инструменты
Растительные ресурсы


