Растительные ресурсы, 2021, T. 57, № 4, стр. 291-307
Вторичные метаболиты и фармакологические свойства Agrimonia pilosa (Rosaceae)
А. Л. Буданцев 1, *, Л. М. Беленовская 1
1 Ботанический институт им. В.Л. Комарова РАН
Санкт-Петербург, Россия
* E-mail: abudantsev@mail.ru
Поступила в редакцию 05.03.2021
После доработки 14.04.2021
Принята к публикации 12.09.2021
Аннотация
В результате обобщения литературных источников показано, что как в подземной, так и в надземной частях A. pilosa синтезируются разнообразные фенольные соединения (простые фенолы, фенольные кислоты, флавоноиды, катехтины, изокумарины и др.), терпеноиды и представители других групп вторичных метаболитов. Для новых соединений, выделенных из A. pilosa, приведены структурные формулы. Экстракты, их фракции, а также индивидуальные компоненты, в частности агримонолид, агримониин, некоторые флавоноиды и тритерпеноиды обладают гипогликемическими, антиоксидантными, цитотоксическими и другими свойствами. Пилозанолы, экстракты и эфирное масло проявляют антибактериальную активность. Обзор составлен на основе публикаций, размещенных в библиометрических системах PubMed, Scopus, Web of Science, Google Scholar, Chemical Abstracts и в других сводках.
Род Agrimonia L. – репешок, репейничек – представляет собой многолетние травы с ползучими корневищами и непарно перисторассеченными листьями. Цветки обычно желтые, собраны в верхушечные колосовидные соцветия, 5-мерные, с многочисленными тычинками. Одним из характерных признаков этого рода является конусовидный гипантий, покрытый снаружи в верхней части крючковидными шипиками, напоминающими крючочки репейника (отсюда, вероятно, и произошло русское название рода). К роду Agrimonia относятся от 10 до 17 видов, распространенных в умеренной зоне Евразии, в Африке (на севере, в горных тропических районах и на юге) и в Северной Америке [1, 2 ] . В России встречаются 7 видов репешка, среди которых A. pilosa Ledeb. (syn. A. japonica (Miq.) Koidz) – р. волосистый – распространен в европейской части, на Кавказе, в Сибири и на Дальнем Востоке. За пределами России он встречается в Западной и Восточной Европе, в Средней и Восточной Азии. Произрастает A. pilosa, как и большинство других видов рода, в лесах, на суходольных лугах, лесных полянах и опушках, по краям дорог [311, 422, 533].
В традиционных медицинах стран Восточной Азии A. pilosa издавна использовалась в качестве вяжущего, противопаразитарного, противовоспалительного и кровоостанавливающего средства, а также при заболеваниях кожи, печени и почек [6 ] .
Химические исследования A. pilosa привели к обнаружению большого числа веществ, относящихся к разным классам природных соединений, среди которых довольно разнообразно представлены флавоноиды, изокумарины и тритерпеноиды. Для некоторых из них, наряду с экстрактами и их фракциями, установлены разные виды биологической активности. Компонентному составу и фармакологическим свойствам репешка волосистого посвящен предлагаемый обзор. Для его составления использованы публикации, размещенные в библиометрических системах PubMed, Scopus, Web of Science, Google Scholar, Chemical Abstracts и в других сводках.
КОМПОНЕНТНЫЙ СОСТАВ AGRIMONIA PILOSA
Простые фенолы и их производные
Большая часть из ранних химических исследований A. pilosa связана с изучением фенольных компонентов. Одним из первых новых соединений стал агримофол (рис. 1a ), выделенный из надземной части. По своей структуре он является карбоциклическим эфиром флороглюцина [7 ] . Наряду с агримофолом, из стеблей и листьев был выделен ряд новых производных ацилфлороглюцина – агримолов А–Е (рис. 1b–f ), различающихся алкильными радикалами в фенольном фрагменте [8–13 ] . К числу новых производных флороглюцина, обнаруженных в 1989 г. в A. pilosa, принадлежат агримолы F и G (рис. 1g, h ) [11 ] . В этом же году были опубликованы сведения о содержании в корневище как известного димера флороглюцина – псевдоаспидина, так и нового компонента, названного (R)-(–)-агримолом B [10 ] . Другие димеры, новые производные ацилфлороглюцина – агрипинолы А–С (рис. 1i–k ), а также известные компоненты – α-козин и 6-О-β-D-глюкопиранозид 1-бутаноил-3,5-диметилфлороглюцина были обнаружены в надземной части этого растения [14, 15 ] . Изучение структур агрипинолов позволило установить, что главным их различием является положение ацильной группы при фенольной части молекулы [15 ] . В 2017 г. были опубликованы результаты исследований надземной части A. pilosa, в которых приведены структуры новых фенольных гликозидов, производных резорцина, а именно, агримопилозидов А и В (рис. 1l, m ) [16 ] . В составе эфирного масла из целого растения был обнаружен 4-пропениланисол [17 ] .
Рис. 1.
Новые фенольные соединения, выделенные из Agrimonia pilosa. а – агримофол; b – агримол А; c – агримол B; d – агримол С; e – агримол D; f – агримол Е; g – aгримол F; h – aгримол G; i – aгрипинол А; j – агрипинол B; k – агрипинол C; l – агримопилозид А; m – агримопилозид B. Fig. 1 . New phenolic compounds isolated from Agrimonia pilosa. a – agrimophol; b – agrimol А; c – agrimol B; d – agrimol C; e – agrimol D; f – agrimol E; g – agrimol F; h – agrimol G; i – agripinol A; j – agripinol B; k – agripinol C; l – agrimopiloside A; m – agrimopiloside B.

Фенолкарбоновые и ароматические карбоновые кислоты и их производные
Разнообразие фенолкарбоновых кислот, которые накапливаются как в надземной, так и в подземной частях A. pilosa, не отличается оригинальностью. Оно представлено п-гидроксибензойной, протокатеховой, изованилиновой, n-кумаровой, транс-п-кумаровой, ванилиновой, эллаговой и галловой кислотами [13, 18, 19, 2044], а также вновь открытыми эфирами транс-n-гидроксикоричной кислоты [21 ] . В подземной части довольно разнообразно представлены эллаготаннины – новые компоненты – агримоновые кислоты А и В (рис. 2a, b), известные педункулагин, казуариктин, а также новые таннины, этерифицированные фенольными кислотами – потентиллин (рис. 2c) и его димер – агримониин55 [22, 23 ] . Среди производных эллаговой кислоты новыми оказались агританнин (рис. 2d), обнаруженный в надземной части, структура которого установлена как α-1-О-галлоил-2,3-гексагидроксидифеноил-D-глюкозид [24 ] и 4-О-β-D-ксилопиранозид эллаговой кислоты из корневищ (рис. 2е) [19 ] .
Рис. 2.
Новые эллаготаннины, выделенные из Agrimonia pilosa. a – агримоновая кислота А; b – агримоновая кислота В; с – потентиллин; d – агританнин; е – 4-О-β-D-ксилопиранозид эллаговой кислоты. Fig. 2. New ellagitannins isolated from Agrimonia pilosa. a – agrimonic acid A; b – agrimonic acid B; c – potentillin; d – agritannin; e – ellagic acid-4-O-β-D-xylopyranoside.

Анализ летучих компонентов, полученных гидродистилляцией образцов из разных регионов Китая, установил наличие известных эфиров ароматических кислот – дибутилфталата и диизобутилфталата [17 ] .
Флавоны и флавонолы
Бóльшая часть обнаруженных в A. pilosa флавонов и флавонолов также представляют собой широко распространенные в растительном мире соединения. К ним относятся апигенин, 7-О-β-D-глюкозид и 7-О-глюкуронид апигенина, кемпферол и его гликозиды (3-О-α-L-арабинозид, 3-О-β-D-глюкопиранозид, 3-О-(6"-О-ацетил)-β-D-глюкопиранозид, 3-О-β-D-глюкозид, 7-О-β-D-глюкозид, 7-О-β-D-глюкуронид и 3-О-α-L-рамнопиранозид), лютеолин и его гликозиды (3'-О-β-D-глюкозид, 7-О-β-D-глюкозид, 7-О-β-D-глюкуронид, 7-О-β-D-глюкопиранозид), метиловый и бутиловый эфиры 7-О-β-D-глюкуронида, кверцетин и его гликозиды (3-О-β-D-галактопиранозид, 3-О-β-D-глюкопиранозид, 3-О-β-D-глюкозид, 3-О-α-L-рамнопиранозид, 3-О-α-L-рамнопиранозид, 3-О-β-D-глюкопиранозид, 3-рамнозид и 3-О-рутинозид), изокверцитрин, кверцитрин, рутин, гиперозид, тилирозид, нарингенин, лютеолозид, астрагалин, афзелин и флавоновые С-гликозиды – витексин и изовитексин. Материалами для исследования этих соединений служили растения целиком [13, 25, 26], кора корневищ [27], надземная часть [14, 24, 28–34], листья [35], а также листья и соцветия [20 ] . При этом определенную специфичность состава флавонов и флавонолов отдельных органов и частей растения по этим данным выявить не удается. Тем не менее, новыми соединениями оказались 3-О-[(S)-3-гидрокси-3-метилглутарил)-(1 → 6)]-β-D-глюкозид кемпферола и агрифлавон (рис. 3a, b), выделенные из надземной части [24 ] .
Рис. 3.
Новые флавоноиды, выделенные из Agrimonia pilosa. a – 3-О-[(S)-3-гидрокси-3-метилглутарил(1 → 6)]-β-D-глюкозид кемпферола; b – агрифлавон; c – 3-О-β-D-глюкопиранозид (–)-аромадендрина; d – 3-О-β-D-глюкозид (2R,3S)-дигидрокемпферола; e – 3-О-β-D-глюкозид (2S,3R)-дигидрокемпферола; f – 3-O-β-D-глюкопиранозид (2S,3S)-(–)-таксифолина. Fig. 3. New flavonoids isolated from Agrimonia pilosa. a – kaempferol-3-O-[(S)-3-hydroxy-3-methylglutaryl(1 → 6)]-β-D-glucoside; b – agriflavone; c – (–)-aromadendrin-3-O-β-D-glucopyranoside; d – (2R,3S)-dihydrokaempferol-3-O-β-D-glucoside; e – (2S,3R)-dihydrokaempferol-3-O-β-D-glucoside; f – (2S,3S)-(–)-taxifolin-3-O-β-D-glucopyranoside.

Флаваноны и флаванолы
Группа флаванонов и флаванолов A. pilosa представлена как известными, так и новыми соединениями. К известным относятся аромадендрин, 3-О-β-D-глюкопиранозид (2S,3S)-аромадендрина, пиноцембрин [13, 16, 35], 3-О-β-D-глюкозиды дигидрокемперола и его изомеров (2R,3S)-дигидрокемпферола и (2S,3S)-дигидрокемпферола, выделенные из надземной части [31], (2S,3S)-глюкодистилин [16 ] , таксифолин, (2S,3S)-(–)-таксифолин, 3-О-β-D-глюкозид таксифолина и ряд гликозидов его стереоизомеров: 3-О-β-D-глюкозиды (2R,3S)-таксифолина, (2R,3R)-таксифолина, (2S,3R)-таксифолина, (2S,3S)-таксифолина, а также 4'-O-β-D-глюкозид и 7-O-β-D-глюкозид (2R,3R)-таксифолина, присутствующие как в подземной, так и в надземной частях растения [18, 31–33]. Новыми компонентами являются 3-О-β-D-глюкопиранозид (–)-аромадендрина (рис. 3c) [36], 3-О-β-D-глюкозиды (2R,3S)-дигидрокемпферола и (2S,3R)-дигидрокемпферола [31] обнаруженные в надземной части (рис. 3d, e) и 3-O-β-D-глюкопиранозид (2S,3S)-(–)-таксифолина (рис. 3f), который впервые был найден в корнях и корневище [37], а затем и в надземной части A. pilosa [14 ] .
Катехины
Химическое исследование корневищ, а позднее и всего растения, привело к выделению трех новых катехиновых производных, получивших название пилозанолов A, B и C (рис. 4a–c) [38, 41]. При этом оказалось, что пилозанолы В и С являются бутаноил- и 2-метилпропаноил-гомологами пилозанола А соответственно [38]. Пилозанол С был обнаружен и в надземной части, наряду с (+)-катехином [14 ] . Из листьев был извлечен новый катехин, содержащий в своей структуре фенилэтаноидную группу и названный пилозанолом N (рис. 4d) [40]. Результатом последующего изучения растения в целом послужило обнаружение ряда новых катехинов, а именно изопилозанолов А–С, структуры которых содержат ацилфлороглюциновый фрагмент (рис. 4e–g) и пилозанидинов А и В, имеющих димерную структуру с С4 → С8 межфлавановой связью (рис. 4h, i). Они фактически являются процианидинами В-типа, различающимися по структуре алкильных радикалов [41]. Исследование целого растения, предпринятое китайскими учеными во главе с W. Liu, завершилось обнаружением известных флаван-3-олов – дегидродикатехина А и фенилпропаноидного производного катехина – (+)-катехин-(5,6-b,c)-4β-(4"-гидроксифенил)дигидро-(2Н)-пиранона [13 ] . Сам же катехин фиксировался в различных частях A. pilosa [14, 26, 27, 30, 32, 33, 42].
Рис. 4.
Новые катехины, выделенные из Agrimonia pilosa. a – пилозанол A; b – пилозанол B; c – пилозанол C; d – пилозанол N; e – изопилозанол А; f – изопилозанол B; g – изопилозанол C; h – пилозанидин А; i – пилозанидин В. Fig. 4. New catechins isolated from Agrimonia pilosa. a – pilosanol A; b – pilosanol B; c – pilosanol C; d – pilosanol N; e – isopilosanol А; f – isopilosanol B; g – isopilosanol C; h – pilosanidin А; i – pilosanidin В.
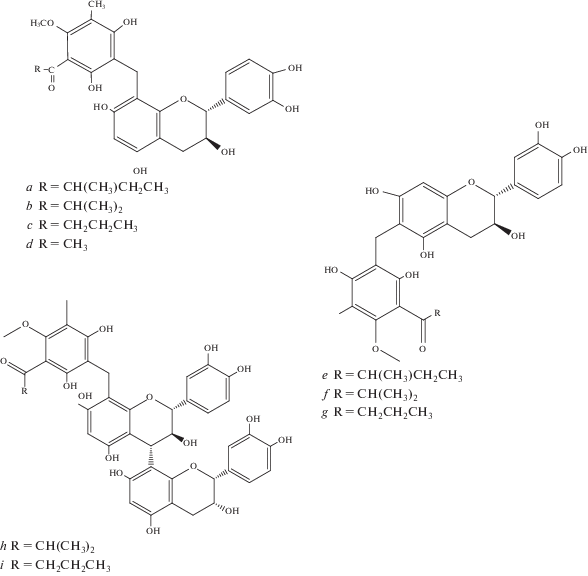
Изокумарины и другие гетероциклические соединения
Разнообразие изокумаринов A. pilosa обусловлено главным образом производными агримонолида (рис. 5а). Сам фенольный лактон агримонолид был выделен M. Yamato в конце 50-х годов прошлого столетия из свежих корневищ, а его структура была определена как 3-(п-метоксифенетил)-6,8-дигидрокси-3,4-дигидроизокумарин [18 ] . Впоследствии он был найден не только в подземной, но и в надземной части репешка волосистого [14, 19, 34, 41, 42]. Из подземной части был выделен 6-О-β-D-глюкопиранозид агримонолида (рис. 5b) [21 ] , присутствие которого неоднократно фиксировалось не только в подземной, но и в надземной частях [13, 14, 34, 36, 41, 42]. В метанольном экстракте всего растения обнаружены новые производные агримоноида: 6-O-β-D-глюкопиранозид (3S,4R)-4'-гидроксиагримонолида (рис. 5g), 6-O-α-L-арабинфуранозил-(1 → 6)-β-D-глюкопиранозид (3S)-агримонолида (рис. 5f) [41], подтвержденный H. Li с соавторами в 2020 г. [33]. Этот же коллектив представил сведения о присутствии в стеблях и листьях A. pilosa нового фенилэтилизокумаринового гликозида – 6-(6"-галлоил)-O-β-D-глюкопиранозид (3S)-агримонолида (рис. 5d). К новым соединениям в надземной части этого вида относятся 6-O-β-D-глюкопиранозид дезметилагримонолида (рис. 5c) [36] и 4′-O-β-D-глюкопиранозид (3S)-дезметилагримонолида (рис. 5e) [41]. Таким образом, состав изокумаринов, по-видимому, определяет специфичность фенольного комплекса A. pilosa.
Рис. 5.
Новые изокумарины и хромоны, выделенные из Agrimonia pilosa. a – агримонолид; b – 6-O-β-D-глюкопиранозид агримонолида; c – 6-O-β-D-глюкопиранозид дезметилагримонолида; d – 6-(6"-галлоил)-О-β-D-глюкопиранозид (3S)-агримонолида; e – 4'-О-β-D-глюкопиранозид (3S)-дезметилагримонолида; f – 6-O-α-L-арабинофуранозил-(1 → 6)-β-D-глюкопиранозид (3S)-агримонолида; g – 6-O-β-D-глюкопиранозид (3S,4R)-4'-гидроксиагримонолида; h – 7-О-β-D-глюкопиранозид 5,7-дигидрокси-2-пропилхромона. Fig. 5. New isocoumarins and chromones isolated from Agrimonia pilosa. a – agrimonolide; b –agrimonolide 6-O-β-D-glucoside; b – (3S,4R)-4-hydroxyagrimonolide-6-O-β-D-glucopyranoside; c – desmethylagrimonolide-6-O-β-D-glucopyranoside; d – (3S)-agrimonolide-(6"-galloyl)-O-β-D-glucopyranoside; e – (3S)-desmethylagrimonolide-4'-О-β-D-glucopyranoside; f – (3S)-agrimonolide-6-O-α-L-arabinofuranosyl-(1 → 6)-β-D-glucopyranoside; g – (3S,4R)-4-hydroxyagrimonolide-6-O-β-D-glucopyranoside; h – 5,7-dihydroxy-2-propylchromon-7-O-β-D-glucopyranoside.
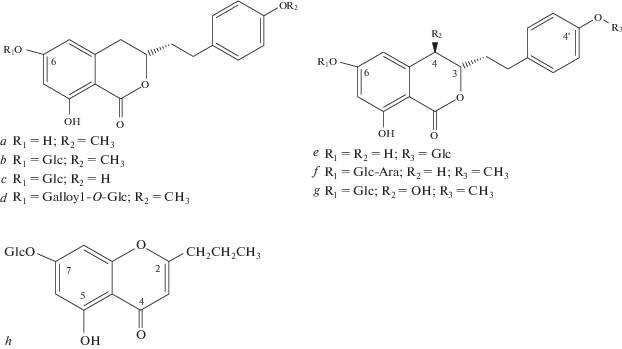
В надземной части A. pilosa, вместе с известными хромонами, такими как петиолин Е, таканехромон С, норэугенин и производным бензофурана лолиолидом [13, 33, 35, 36], в 2010 г. H. Kato с соавторами был обнаружен новый алкилированный гликозид – 7-О-β-D-глюкопиранозид 5,7-дигидрокси-2-пропилхромона (рис. 5h) [36].
ТЕРПЕНОИДЫ
Моно-, сескви- и дитерпеноиды
В составе эфирного масла надземной части были идентифицированы моно- и сесквитерпеноиды: α-туйон, камфен, α-пинен, мирцен, лимонен, линалоол, α-камфоленаль, транс-вербенон, миртеналь, ацетат линалоола, метилмиртенат, миртенилацетат, метилпериллат, α-цингиберен и (Е, Е)-α-фарнезен [43]. В образцах эфирных масел целых растений обнаружены β-пинен, β-фелландрен, эвкалиптол, борнеол, ментол, α-терпинеол, 4-терпиненол, нерол, борнилацетат, ацетат нерола, ацетат гераниола, геранилацетон, L-камфора, β-кубебен, кариофиллен, β-фарнезен, фарнезилацетат и фарнезилацетон, α-цедрен, цедрол, эпи-цедрол, α-лонгипинен, δ-кадинен, гермакрен D, α-селинен, (–)-α-селинен, β-селинен, γ-селинен, α-куркумен, δ-гвайен, β-сесквифелландрен, β-бизаболен, α-бизаболол, транс-неролидол, α-кадинол, пачулол, спатуленол, гвайол, 1-эпи-кубенол, эудесма-3,7(11)-диен, β-эудесмол, γ-эудесмол, транс-вербенол, оксид кариофиллена и пачули-спирт [17, 44–46].
Тритерпеноиды и стероиды
В 1988 г. J. Kouno с соавторами опубликовали результаты обнаружения новых тритерпеноидов, выделенных из целого растения в виде метиловых эфиров. Ими оказались 1β,2α,3β,19α-тетрагидроксиурс-12-ен-28-овая и 1β,2β,3β,19α-тетрагидроксиурс-12-ен-28-овая кислоты (рис. 6a, b). Кроме того, из корневищ был выделен известный тритерпеновый гликозид розамультин [47]. Новым тритерпеноидом из надземной части стал (1S,3R,17R,18R,19R,20R,22R)-1,3,19,22-тетрагидрокси-28-норурс-12-ен-2-он (рис. 6c) [48]. Исследованиями разных авторов набор тритерпеноидов, выделенных из подземных и надземных побегов A. pilosa, был дополнен урсоловой, помоловой, 1β-гидрокси-2-оксопомоловой, торментовой, эпиторментовй, корозоловой, маслиновой и олеаноловой кислотами [13, 48, 49]. На материале A. рilosa, выращенном в ботаническом саду университета г. Daegu (Южная Корея), показано накопление в надземной части известных в растительном мире тритерпеноидов: 19α-гидроксиурсоловой, 2β-гидроксипомоловой, 3-О-ацетилпомоловой, 18α-олеаноловой, 1β,3α,19α-тригидрокси-2-оксоурс-12-ен-28-овой, 1β,2α,19α-тригидрокси-3-оксоурс-12-ен-28-овой и 1β,2β,3β,19α-тетрагидроксиурс-12-ен-28-овой кислот, а также розамультина и зию-глюкозида II [50]. Из подземной части и из целого растения A. pilosa выделены также β-ситостерин, даукостерин, стигмаст-5-ен-3β,7α-диол, стигмаст-5-ен-3β,7β-диол и стигмастан-3β,6α-диол [10, 51].
Рис 6.
Новые тритерпеноиды, выделенные из Agrimonia pilosa. a – 1β,2α,3β,19α-тетрагидроксиурс-12-ен-28-овая кислота; b – 1β,2β,3β,19α-тетрагидроксиурс-12-ен-28-овая кислота; c – (1S,3R,17R,18R,19R20R,22R)-1,3,19,22-тетрагидрокси-28-норурс-12-ен-2-он. Fig. 6. New triterpenoids isolated from Agrimonia pilosa. a – 1β,2α,3β,19α-тetrahydroxyurs-12-en-28-oic acid; b – 1β,2β,3β,19α-tetrahydroxyurs-12-en-28-oic acid; c – (1S,3R,17R,18R,19R20R,22R)-1,3,19,22-Tetrahydroxy-28-norurs-12-en-2-one.

ДРУГИЕ ГРУППЫ СОЕДИНЕНИЙ
В корневище обнаружены высшие жирные кислоты – пальмитиновая, олеиновая, линолевая, додекановая, тетрадекановая, пентадекановая, гексадекановая, гексадец-9-еновая, (Е)-октадец-9-еновая и эфиры жирных кислот – метиловый эфир линоленовой кислоты, метилоктадека-9,12-диеноат и метил-2-гидрокситрикозаноат [13, 17, 37, 45, 46, 52, 53], а в целом растении – тианшевая кислота [13 ] . Из экстракта целого растения выделен известный церамид 1-О-β-D-глюкопиранозил-(2S,3S,4R,8E)-2-[2'(R)-2'-(2)-гидроксилигноцероиламино]-8-октадецен-1,3,4-триол [13], а также 2-октадеканаль и 6,10,14-триметилпентадекан-2-он, а из корневищ – н-нонакозан [10, 13, 17, 44].
ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА AGRIMONIA PILOSA
Гипогликемически и гиполипидемические свойства
Водный экстракт в составе диеты и тилирозид обладает гипогликемическими свойствами [54–56]. Урсоловая кислота, агримонолид и дезметилагримонолид увеличивали уровень гликогена в инсулин-устойчивых клетках линии HepG2 [57], а тритерпеноид и флавоноид (названия не указаны) стимулировал дифференциацию преадипоцитов линии 3T3-L1 [58, 59]. 1β-Гидрокси-2-оксопомоловая кислота ингибирует адипогенез в клетках линии 3Т3-L1 [60]. 7-O-β-D-Глюкуронид апигенина, эллаговая, торментовая и 2β-гидроксипомоловая кислоты ингибируют активность протеинтирозинфосфатазы (PTP1B), регулирующей действие инсулина [24, 50]. Водный экстракт (10 мг/мл) ингибирует активность α-глюкозидазы [61]. Активность этого фермента подавлялась смесью флавоноидов, в которую входили витексин, рутин, гиперозид, 7-O-β-D-глюкопиранозид лютеолина, кверцетин, кверцитрин, тилирозид, лютеолин, апигенин и кемпферол. При этом наибольший эффект наблюдался в комплексе из смесей флавоноидов и тритерпеноидов в соотношении (4 : 1), тогда как фракция тритерпеноидов, куда входили 1β,2β,3β,19α-тетрагидрокси-12-ен-28-овая, корозоловая, маслиновая, урсоловая, торментовая и олеаноловая кислоты, оказалась неактивной [26]. Ингибировали активность α-глюкозидазы также 7-O-β-D-глюкозид кверцетина, 3-O-β-D-глюкозид кверцетина, 3-О-α-L-рамнозид кемпферола и торментовая кислота [53], а также агримонолид и его производные (дезметилагримонолид, 6-(6"-галлоил)-O-β-D-глюкопиранозид (3S)-агримонолида, 6-O-глюкозид (3S)-агримонолида и 6-O-α-L-арабинофуранозил-(1 → 6)-β-D-глюкопиранозид (3S)-агримонолида), тилирозид, 3-O-β-D-глюкозид дигидрокемпферола, 3-O-β-D-глюкозид таксифолина, нарингенин, катехин и норэугенин. У всех этих соединений IC50 был ниже по сравнению с контролем акарбозой [33, 34]. 7-О-Глюкуронид лютеолина, кверцетин, лютеолин и афзелин ингибировали активность альдозоредуктазы [27], которая играет ключевую роль в возникновении гипергликемических патологий, в том числе диабетической катаракты [6266]. Этилацетатный экстракт обладает гиполипидемическими свойствами, ингибируя дифференциацию адипоцитов [63].
Тромболитические и коагулянтные свойства
Водный экстракт надземной части обладает антикоагулянтными [64] и тромболитическими свойствами [65]. В 1987 г. было высказано предположение о том, что водный экстракт может оказаться эффективным для лечения легочного тромбоэмболизма в силу тромболитических свойств [66]. Позднее было показано, что водный экстракт надземной части (4 г/л) увеличивал время свертываемости крови, продолжительность активности тромбопластина, снижая время действия протромбина, активность факторов коагуляции VII, IX и XI и коагулянтными, усиливая активность фактора коагуляции VII [67].
Антиоксидантные и противовоспалительные свойства
Антиоксидантными свойствами обладают водный экстракт, его этилацетатная и бутанольная фракции [68–71], этанольные экстракты подземной и надземной частей [72, 73], этанольный и метанольные экстракты листьев [74, 75], а также агримонолид, дезметилагримонолид [76], катехин, лютеолин, кверцетин, кверцитрин, гиперозид, рутин и 7-O-β-глюкозид лютеолина [59]. Противовоспалительное действие оказывают водный экстракт в составе диеты [56], спиртовой экстракт листьев [75] и метанольные экстракты подземной и надземной частей [35, 77]. Метанольный экстракт всего растения снижал синтез медиаторов воспаления и провоспалительных цитокинов в макрофагах и in vivo оказывал противоастматическое действие [78], этанольный экстракт листьев и его бутанольная фракция подавляли синтез оксида азота макрофагами RAW 264.7, но не ингибировали при этом активность циклооксигеназы-2 [79]. Установлен также противовоспалительный эффект этанольного экстракта и агримонолида на модели макрофагов линии RAW264.7, стимулированных липополисахаридом [80, 81], тилирозида и пилозанола N, которые снижали синтез оксида азота в макрофагах [40, 82]. Водный экстракт листьев может оказаться эффективным для лечения воспалительных заболеваний кожи, таких как псориаз и атопический дерматит [83].
Противоопухолевая цитотоксическая активность
Метанольный экстракт подземной части и агримониин проявляют противоопухолевую активность на клетках саркомы S180, фибросаркомы Meth-A и карциномы молочной железы MM-2 in vivo [84, 85]. Водный экстракт надземной части дозозависимо оказался активным в отношении саркомы S180 in vivo и in vitro; доля ингибирования составила от 25 до 67%, контроль – циклофосфамид – 81% [86], этанольный экстракт – в отношении карциномы легких Льюиса [87]. Полисахарид APP активен в отношении клеток остеосаркомы линии U-2 OS, индуцируя активацию каспаз 3 и 9, а также подавлял рост клеток перевиваемой опухоли [88]. Агримониин индуцирует секрецию интерлейкина-1 (цитокина, медиатора воспаления и иммунитета) [89], этанольный экстракт надземной части – апоптоз клеток линии HepG2 (гепатоцеллюлярная карцинома) [90]. Агримониин проявляет цитотоксическую активность в отношении клеток линий ММ2 и МН134 (гепатома) [91, 92], SGC7901 (рак желудка) [93], агрипинолы А–С – в отношении клеток линий HCT-116, MDA-MB-231 и PC-3 [15 ] , зию-глюкозид II и олеаноловая кислота – в отношении клеток линии HeLa (аденокарцинома), отвар и 1β,2α,19α-тригидрокси-3-оксоурс-12-ен-28-овая кислота – в отношении клеток линий HL-60 (лейкемия) и MCF-7 (аденокарцинома молочной железы) [50, 94], этанольный экстракт – в отношении клеток рака желудка [87], клеток линии А549 (аденокарцинома легких) [73], водный экстракт – в отношении клеток линии SMMC-7721 (гепатоцеллюлярная карцинома) [95].
Антибактериальная и антивирусная активность
Антибактериальную активность проявляют спиртовой экстракт надземной части и пилозанолы A–C в отношении Staphylococcus aureus [38, 96], водный экстракт надземной части – в отношении Listeria monocytogensis и Escherichia coli [97, 98], метанольный экстракт в отношении Pseudomonas syringae pv. lacrymans, Ralstonia solanacearum и Pseudomonas syringae pv. tabaci [12 ] , петролейно-эфирный экстракт – в отношении Pseudomonas aeruginosea [99], спиртовой экстракт надземной части – в отношении Micrococcus luteus [96] и эфирное масло из надземной части в отношении Klebsiella pneumoniae, Pseudomonas aeruginosea и Salmonella typhimurium [43], спиртовой экстракт (часть растения не указана) – в отношении Helicobacter pylori [100]. Противовирусная активность обнаружена у метанольного экстракта всего растения в отношении ВИЧ-1 [101], этанольного экстракта всего растения в отношении вирусов гриппа H1N1, H3N2, группы B [102], а также у водного экстракта в отношении вируса герпеса 1 [103].
Другие виды активности
На модели болезни Альцгеймера водный экстракт листьев улучшает когнитивную функцию и углеводный обмен [104]. Агримофол ингибирует дифференциацию остеокластов, которые являются ключевым звеном в заболеваниях костной ткани, таких как ревматоидный артрит и остеопороз [105]. Водный экстракт надземной части обладает эстрогеноподобными свойствами на различных моделях [106, 107], этанольный экстракт (часть растения не указана) и 7-O-β-D-глюкуронид апигенина – аналгезирующими in vivo [108, 109], бутанольный экстракт – сосудорасширяющими [110]. Полисахарид APP-AW надземной части в концентрациях 50 и 100 мг/мл оказывает цитопротективное действие, снижая апоптоз остеобластов, вызванный дексаметозоном [111–113], экстракт оказывает протективное действие на клетки фибробластов линии NIH3T3 при их поражении, вызванном бихроматом калия [114]. Аргимонолид обладает гепатопротективными свойствами в отношении производных Hep G2 клеток на моделях их поражений тарцином и (трет)-бутилгидропероксидом [42]. Фракции водного и спиртового экстрактов снижают образование морщин [116], метанольный экстракт эффективен при акне [117], водный и этанольный экстракты ингибировали синтез меланина в клетках меланомы линии B16F10, и могут быть эффективны для отбеливания кожи в косметике [117, 118]. Пальмитиновая, урсоловая и торментовая кислоты ингибируют активность протеинтирозинфосфатазы 1В [53]. Водный экстракт надземной части, тилирозид, 3‑метоксикверцетин, кверцетин, гликозиды кемпферола, апигенина, кверцетина, лютеолина дигидрокемпферола и таксифолина ингибируют активность ацетилхолинэстеразы [24, 25, 31, 72]. Этанольный экстракт надземной части усиливает инсектицидную активность гриба Isaria javanica (Ascomycota, Hypocreales) в отношении белокрылки Bemisia tabaci (Hemiptera, Aleyrodoidea) [119].
Таким образом, к настоящему времени имеется достаточно разнообразная информация о наборе вторичных метаболитов A. pilosa, часть из которых, наряду с экстрактами и их фракциями, обладают важными фармакологическими и иными ценными для практики свойствами. Все это свидетельствует о перспективности дальнейших химических исследований и фармакологических испытаний этого вида. Не менее интересным (и важным) может оказаться и изучение свойств A. pilosa на фактическом материале из различных частей его широкого ареала.
Список литературы
cм. REFERENCES
Дополнительные материалы отсутствуют.
Инструменты
Растительные ресурсы


