Растительные ресурсы, 2022, T. 58, № 1, стр. 100-108
Разработка и валидация методики количественного определения флавоноидов в листьях Lithospermum officinale (Boraginaceae)
Н. Ю. Адамцевич 1, *, Е. И. Закржевская 1, Е. В. Феськова 1, В. Н. Леонтьев 1, В. В. Титок 2
1 Белорусский государственный технологический университет
г. Минск, Республика Беларусь
2 Центральный ботанический сад Национальной академии наук Беларуси
г. Минск, Республика Беларусь
* E-mail: natallia.adamtsevich@mail.ru
Поступила в редакцию 24.05.2021
После доработки 23.07.2021
Принята к публикации 03.12.2021
- EDN: UIEUBR
- DOI: 10.31857/S0033994622010034
Аннотация
Воробейник лекарственный (Lithospermum officinale L.) – ценное лекарственное растение, которое используется в народной медицине с давних времен. В данной работе разработана методика количественного определения флавоноидов в листьях воробейника лекарственного методом дифференциальной спектрофотометрии по реакции флавоноидов с хлоридом алюминия. Определены оптимальные продолжительность реакции и отношение объема водно-спиртового экстракта листьев воробейника лекарственного к объему 2%-го водно-спиртового раствора хлорида алюминия. В качестве образца сравнения для расчета содержания флавоноидов выбран рутин. Разработанная методика оценена по валидационным характеристикам: специфичность, линейность, прецизионность, правильность и является пригодной для использования в аналитических целях. Установлено, что в листьях воробейника лекарственного различного года культивирования содержание флавоноидов в пересчете на рутин составляет более 2% от массы абсолютно сухого сырья.
Среди биологически активных веществ (БАВ) одним из наиболее многочисленных классов являются флавоноиды, на основе которых возможно создание новых эффективных лекарственных препаратов, обладающих противовоспалительным, антиканцерогенным, антибактериальным, ранозаживляющим и др. действиями [1–4].
Огромные запасы лекарственных растений очень важно рационально использовать, так как многие являются охраняемыми и занесены в Красную книгу. Воробейник лекарственный (Lithospermum officinale L.) является одним из видов, применяемых в народной медицине с давних времен в качестве мочегонного, слабительного, обезболивающего, противопростудного и ранозаживляющего средства. Этот вид двудольных растений семейства Бурачниковые (Boraginaceae), произрастает на большей части территории Европы (кроме севера), на Кавказе, Дальнем Востоке, в Западной и Восточной Сибири, Средней и Малой Азии, занесен в Северную Америку [5–7]. Воробейник лекарственный – многолетнее травянистое растение, цветет в июне–июле. Стебли прямостоячие, жестко шероховатые, достигают высоты 30–80 см; листья ланцетовидные, шероховатые, сверху темно-зеленые, снизу более светлые; цветки мелкие, желтовато-белые, пятичленные, длиной 6–8 мм, собраны в пазухах верхушечных листьев; плоды белые орешкообразные. С целью сохранения, распространения и введения данного вида в культуру в качестве лекарственного и медоносного растения, воробейник лекарственный культивируется в Центральном ботаническом саду (ЦБС) НАН Беларуси.
В листьях воробейника лекарственного содержатся флавоноиды, которые представлены гликозидами кверцетина (рутин и изокверцитрин) [8, 9]. Данные флавоноиды применяются в медицине для профилактики и лечения сердечно-сосудистых заболеваний, бронхиальной астмы, сахарного диабета, а также в качестве антиоксидантов, гепатопротекторов, противовоспалительных и противоопухолевых средств [10]. Рутин обладает Р-витаминной активностью [10], изокверцитрин является одним из ключевых флавоноидов, обладающих свойством регенерации тканей [11, 12].
Возможность использования воробейника лекарственного в фармацевтике, а также требования к стандартизации лекарственного растительного сырья вызывают необходимость количественной оценки содержания БАВ.
Для определения содержания флавоноидов в растительном сырье применяют разнообразные методы анализа. Наиболее простым и доступным является метод дифференциальной спектрофотометрии. Для этого используют комплексообразующие добавки (чаще всего хлорид алюминия), при реакции с которыми флавоноиды образуют окрашенные комплексы, в результате чего происходит батохромный сдвиг первой полосы поглощения флавоноидов с 330–350 до 390–430 нм [1–3].
Цель работы – разработка и валидация методики количественного определения флавоноидов в листьях воробейника лекарственного методом дифференциальной спектрофотометрии.
МАТЕРИАЛЫ И МЕТОДЫ
Объектом исследования являлись воздушно-сухие листья воробейника лекарственного из коллекции ЦБС НАН Беларуси. Экстракцию листьев воробейника лекарственного проводили при ранее подобранных оптимальных условиях [13]. Для исследования, навеску массой 5 ± 0.01 г воздушно-сухих листьев воробейника лекарственного (влажность 9.95%) помещали в термостойкую коническую колбу и добавляли 100 мл 50%-го этилового спирта. Колбу выдерживали на водяной бане в течение 40 мин при 70 °С. Полученное извлечение листьев воробейника лекарственного охдаждали и фильтровали через бумажный фильтр.
При разработке методики количественного определения флавоноидов в экстрактах листьев воробейника лекарственного методом дифференциальной спектрофотометрии руководствовались методиками, приведенными в Государственной Фармакопее Республики Беларусь (ГФ РБ).
В листьях воробейника лекарственного содержится рутин, поэтому данный флавоноид был выбран в качестве образца сравнения для расчета содержания флавоноидов. В работе применяли стандартный образец (СО) коммерческого препарата рутина (Sigma-Aldrich, безводный, индекс CAS – 153-18-4). Навеску СО рутина массой 0.050 ± 0.001 растворяли в 100 мл 50%-го этилового спирта.
С водно-спиртовым экстрактом листьев воробейника лекарственного и раствором рутина проводили реакцию комплексообразования с хлоридом алюминия (шестиводный, CAS 7784-13-6). Для количественного определения флавоноидов чаще всего применяют раствор хлорида алюминия с концентрацией 2–5%. Согласно литературным данным, для получения наиболее стабильных результатов предпочтительно использование 2%-го спиртового раствора хлорида алюминия. Это связано с тем, что при высоких концентрациях реагента существует риск возникновения опалесценции и выпадения осадка [14, 15]. Для исследований готовили 2%-й раствор хлорида алюминия в 50%-ном этиловом спирте.
При определении содержания флавоноидов в растительном экстракте реакцией комплексообразования с хлоридом алюминия добавляют растворы уксусной либо соляной кислот для лучшей воспроизводимости результатов [16]. В методиках, приведенных в ГФ РБ, применяют соляную кислоту концентрацией 73 г/л (хлористоводородная кислота разведенная, ГФ РБ II, Т.1, стр. 723) [17].
На первом этапе исследований определяли оптимальную продолжительность комплексообразования с хлоридом алюминия и отношение объема водно-спиртового экстракта к объему раствора хлорида алюминия. Оптимальной продолжительностью комплексообразования являлась та, при которой достигался максимальный показатель оптической плотности и, соответственно, рассчитанное содержание флавоноидов. Измерения выполняли каждые 10 мин в течение часа. Для выбора отношения “экстракт : раствор хлорида алюминия” в каждой пробе варьировали объем раствора хлорида алюминия и измеряли оптическую плотность.
Метод дифференциальной спектрофотометрии при количественном определении флавоноидов в экстракте заключается в том, что в качестве раствора сравнения при измерении оптической плотности используют раствор экстракта без добавления хлорида алюминия с целью исключения возможного влияния сопутствующих соединений на ход количественного анализа. Поэтому в растворе сравнения хлорид алюминия был заменен на 50%-й этиловый спирт.
Далее измеряли оптическую плотность раствора рутина с добавлением раствора хлорида алюминия при определенных оптимальных параметрах для экстракта листьев воробейника лекарственного и рассчитывали содержание суммы флавоноидов (Х, % от абсолютно сухого сырья) по следующей формуле:
Оптическую плотность растворов измеряли на спектрофотометре SPECORD 200 (Analytik Jena, Германия) в кювете с толщиной слоя 1 см. Электронные спектры растворов экстрактов регистрировали в диапазоне длин волн 250–500 нм.
Валидацию разработанной методики проводили согласно техническому кодексу установившейся практики (ТКП 432-2012) [18]. Определяли следующие валидационные характеристики: специфичность, линейность, прецизионность, правильность.
Статистическую обработку полученных результатов выполняли с помощью компьютерной программы Microsoft Office Excel 2007.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
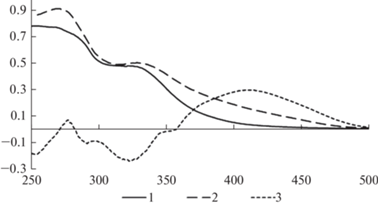
С целью выбора аналитической длины волны, предварительно получены электронные спектры водно-спиртового экстракта листьев воробейника лекарственного с добавлением и без добавления хлорида алюминия. Спектры поглощения представлены на рис. 1, из которого следует, что при добавлении хлорида алюминия к экстракту листьев воробейника лекарственного наблюдается батохромный сдвиг длинноволновой полосы поглощения. На дифференциальном спектре наблюдается максимум при длине волны 411 нм.
Рис. 1.
Электронные спектры водно-спиртового экстракта листьев воробейника лекарственного (Lithospermum officinale L.) без добавления (1) и с добавлением (2) хлорида алюминия и дифференциальный спектр (3). По горизонтали – длина волны, нм.; по вертикали – оптическая плотность, усл. ед. Fig. 1. Electronic spectra of an aqueous-alcoholic extract of Lithospermum officinale L. leaves without (1) and with (2) addition of aluminum chloride and differential spectrum (3). X-axis – wavelength, nm; y-axis – optical density, conv. units.
Результаты определения оптимальной продолжительности комплексообразования представлены на рис. 2.
Рис. 2.
Зависимость содержания флавоноидов в экстракте листьев воробейника лекарственного (Lithospermum officinale L.) от продолжительности реакции комплексообразования с хлоридом алюминия. По горизонтали – продолжительность реакции, мин; по вертикали – содержание флавоноидов в экстракте листьев воробейника лекарственного, %. Fig. 2. Dependence of flavonoids content in Lithospermum officinale L. leaf extract on the duration of the complexing reaction with aluminum chloride. X-axis – duration of the reaction, min; y-axis – content of flavonoids in L. officinale leaf extract, %.

Согласно полученным результатам, максимум оптической плотности достигается через 40 мин, далее наблюдается снижение оптической плотности и, соответственно, рассчитанный выход флавоноидов.
На рис. 3 представлены результаты определения оптимального отношения объема экстракта к объему раствора хлорида алюминия, из которого следует, что для количественного определения флавоноидов в экстракте листьев воробейника лекарственного методом дифференциальной спектрофотомерии целесообразно использовать отношение “экстракт : раствор хлорида алюминия” как 1 : 2.
Рис. 3.
Зависимость содержания флавоноидов в экстракте листьев воробейника лекарственного (Lithospermum officinale L.) от отношения объема экстракта к объему раствора хлорида алюминия. По горизонтали – отношение объема экстракта к объему раствора хлорида алюминия; по вертикали – содержание флавоноидов в экстракте листьев воробейника лекарственного, %. Fig. 3. Dependence of the content of flavonoids in Lithospermum officinale L. leaf extract on the ratio of extract volume to aluminum chloride solution volume. X-axis – ratio of extract volume to aluminum chloride solution volume; y-axis – content of flavonoids in L. officinale leaf extract, %.

Таким образом, для определения содержания флавоноидов в экстракте листьев воробейника лекарственного методом дифференциальной спектрофотометрии предложена следующая методика: в колбу вместимостью 25 мл помещают 1 мл водно-спиртового экстракта, добавляют 2 мл 2%-го раствора хлорида алюминия и 5 капель кислоты хлористоводородной разведенной. Объем раствора доводят до метки 50%-ным этиловым спиртом, интенсивно перемешивают и оставляют на 40 мин в темном месте. Оптическую плотность полученного раствора измеряют при длине волны 411 нм в кювете с толщиной слоя 1 см против контрольной пробы, в которой раствор хлорида алюминия заменен 50%-ным этиловым спиртом. Параллельно измеряют оптическую плотность пробы с раствором рутина, приготовленной аналогично испытуемой пробе с экстрактом.
Расчет содержания флавоноидов в экстракте выполняют по формуле, указанной выше.
Разработка методики количественного определения предусматривает проведение валидации. Специфичность (селективность) методики определяли путем анализа дифференциальных спектров экстракта листьев воробейника лекарственного и раствора СО рутина (рис. 4).
Рис. 4.
Дифференциальные спектры раствора рутина (1) и водно-спиртового экстракта листьев воробейника лекарственного (Lithospermum officinale L.) (2). По горизонтали – длина волны, нм; по вертикали – оптическая плотность, усл. ед. Fig. 4. Differential spectra of a solution of rutin (1) and an aqueous-alcoholic extract of Lithospermum officinale L. leaves (2). X-axis – wavelength, nm; y-axis – optical density, conv. units.

При анализе дифференциальных спектров водно-спиртового экстракта листьев воробейника лекарственного и раствора рутина установлено, что их максимумы поглощения совпадают при длине волны 411 нм. Следовательно, в качестве сравнительного образца для расчета суммы флавоноидов можно использовать рутин, а в качестве аналитической длины – значение 411 нм.
Определение линейности выполняли на пяти уровнях концентрации флавоноидов в пересчете на рутин. Для этого готовили растворы путем изменения объема аликвоты экстракта: 1-й уровень – объем аликвоты экстракта составлял 50% от принятого, т.е. 1.0 мл; 2-й уровень – 75%, т.е. 1.5 мл; 3-й уровень – 100%, т.е. 2.0 мл; 4-й уровень – 125%, т.е. 2.5 мл; 5-й уровень – 175%, т.е. 3.0 мл. Измеряли оптическую плотность и определяли содержание флавоноидов в полученных растворах. Результаты исследований определения линейности представлены на рис. 5.
Рис. 5.
График зависимости оптической плотности от содержания флавоноидов в пробе. По горизонтали – содержание флавоноидов, мг/мл; по вертикали – оптическая плотность, усл. ед. Fig. 5. Dependence of the optical density on the content of flavonoids. X-axis – flavonoid content, mg/ml; y-axis – optical density, conv. units.

Показано, что зависимость оптической плотности от содержания флавоноидов в пробе имеет линейный характер. Значение коэффициента корреляции стремиться к единице, что свидетельствует о выполнении закона Бугера–Ламберта–Бера.
Аналитическая область методики определяется диапазоном значений, соответствующих области линейности. Согласно техническому кодексу [18], данный диапазон должен составлять от 80 до 120% от принятого опорного значения. Аналитическая область разработанной методики количественного определения флавоноидов в листьях воробейника лекарственного находится в диапазоне 50–175% и удовлетворяет требованиям.
Прецизионность методики оценивали на двух уровнях: повторяемость (сходимость) и внутрилабораторная воспроизводимость (табл. 1).
Таблица 1.
Результаты определения прецизионности Table 1. Results of the determination of the precision
| № опыта Experiment number |
Содержание флавоноидов
в листьях воробейника лекарственного, % The content of flavonoids in L. officinale leaves, % |
Метрологические характеристики Metrological characteristics |
|---|---|---|
| Повторяемость (сходимость) | ||
| Repeatability | ||
| 1 | 1.98 | Р = 95%; n = 6; f = 5; t(P, f) = 2.57; $\bar {Х}$ = 2.01%; $\bar {Х} \pm \Delta х$ = 2.01 ± 0.03%; ε = 1.49% |
| 2 | 2.02 | |
| 3 | 2.01 | |
| 4 | 2.02 | |
| 5 | 1.96 | |
| 6 | 2.03 | |
| Внутрилабораторная воспроизводимость | ||
| Intra-laboratory reproducibility | ||
| 1 | 2.03 | Р = 95%; n = 6; f = 5; t(P, f) = 2.57; $\bar {Х}$ = 2.01%; $\bar {Х} \pm \Delta х$ = 2.02 ± 0.02%; ε = 0.99% |
| 2 | 1.99 | |
| 3 | 2.02 | |
| 4 | 2.02 | |
| 5 | 2.02 | |
| 6 | 2.03 | |
Из табл. 1 видно, что относительная погрешность составляет менее 2%, а именно 1.49% при оценке повторяемости и 0.99% при оценке внутрилабораторной воспроизводимости, что свидетельствует о прецизионности методики.
Правильность методики устанавливали определением содержания флавоноидов в пересчете на рутин в пробах, полученных путем добавления 0.5, 1.0, 1.5 мл раствора СО образца рутина к исследуемому экстракту листьев воробейника лекарственного. Оценку правильности выполняли относительно среднего процента восстановления – процента полученного значения содержания флавоноидов в пробе от ожидаемого, средняя величина которого должна находится в пределах 100 ± 3% [18]. На каждом уровне выполняли по три параллельных опыта. Результаты представлены в табл. 2.
Таблица 2.
Результаты определения правильности методики Table 2. Results of the determination of the method’s accuracy
| № опыта Experiment number |
Исходное содержание
флавоноидов, мг Initial content of flavonoids, mg |
Добавлено
СО рутина, мг Added rutin standard solution, mg |
Ожидаемое содержание, мг Expected content, mg |
Полученное содержание, мг Obtained content, mg |
Открываемость, % Recovery, % |
Метрологические
характеристики Metrological characteristics |
|---|---|---|---|---|---|---|
| 1 | 0.916 | 0.204 | 1.120 | 1.108 | 98.9 | Р = 95%; n = 9; f = 8; t(P, f) = 2.31; $\bar {Х}$ = 99.4%; $\bar {Х} \pm \Delta х$ = 99.4 ± 0.5%; ε = 0.5%. |
| 2 | 0.204 | 1.120 | 1.102 | 98.4 | ||
| 3 | 0.204 | 1.120 | 1.108 | 98.9 | ||
| 4 | 0.408 | 1.324 | 1.321 | 99.7 | ||
| 5 | 0.408 | 1.324 | 1.318 | 99.5 | ||
| 6 | 0.408 | 1.324 | 1.326 | 100.2 | ||
| 7 | 0.612 | 1.528 | 1.514 | 99.1 | ||
| 8 | 0.612 | 1.528 | 1.531 | 100.2 | ||
| 9 | 0.612 | 1.528 | 1.519 | 99.4 |
Показано, что процент восстановления составляет от 98.4 до 100.2%. Средний процент восстановления составляет 99.4%. Следовательно, предложенная методика анализа флавоноидов отвечает критерию правильности.
Таким образом, валидируемая методика количественного определения флавоноидов в экстрактах листьев воробейника лекарственного имеет приемлемую степень специфичности, линейности, прецизионности и правильности.
По разработанной методике проанализированы листья воробейника лекарственного различного года культивирования. Результаты исследований представлены в табл. 3.
Таблица 3.
Содержание флавоноидов в листьях воробейника лекарственного в разные годы культивирования (% от массы абсолютно сухого сырья) Table 3. Flavonoids content in Lithospermum officinale L. leaves over different years of cultivation (% on dry weight basis)
| Год культивирования Year of cultivation |
Метрологические характеристики Metrological characteristics (n = 3; P = 95%; t(P, f) = 4.30) |
||
|---|---|---|---|
| Х ± Δх | Sx | ɛ, % | |
| 1-й (урожай 2019 г.) First year (harvest 2019) |
2.02 ± 0.03 | 0.012 | 1.47 |
| 2-й (урожай 2020 г.) Second year (harvest 2020) |
2.53 ± 0.05 | 0.020 | 1.98 |
Из табл. 3 следует, что для воробейника лекарственного второго года культивирования (урожай 2020 г.) характерно увеличение содержания флавоноидов.
ЗАКЛЮЧЕНИЕ
Разработана методика количественного определения флавоноидов в экстракте листьев воробейника лекарственного методом дифференциальной спектрофотометрии по реакции образования окрашенного комплекса флавоноидов с хлоридом алюминия. Установлено, что оптимальная продолжительность комплексообразования составляет 40 мин, а отношение “экстракт : раствор хлорида алюминия” – 1 : 2. В качестве образца сравнения для расчета суммы флавоноидов выбран рутин.
При проведении валидации разработанной методики определены специфичность, линейность, прецизионность и правильность методики.
Установлена линейная зависимость между показателем оптической плотности и содержанием флавоноидов в пробе в диапазоне 50–175% от принятого опорного значения. Определено, что относительная погрешность при изучении прецизионности составляет менее 2%, что свидетельствует о приемлемости методики. При изучении правильности разработанной методики выявлено, что данная методика анализа флавоноидов отвечает критерию правильности. Следовательно, разработанная методика количественного определения флавоноидов в экстрактах листьев воробейника лекарственного может быть использована в аналитической лаборатории.
Определено содержание флавоноидов в листьях воробейника лекарственного разного года культивирования и установлено, что сумма флавоноидов достигает более 2% от массы абсолютно сухого сырья.
Список литературы
Тараховский Ю.С., Ким Ю.А., Абдрасилов Б.С., Музафаров Е.Н. 2013. Флавоноиды: биохимия, биофизика, медицина. Пущино. 310 с.
Куркина А.В. 2012. Флавоноиды фармакопейных растений: монография. Самара. 290 с.
Brown, J.E., Andersen M., Markham R. 2006. Flavonoids: chemistry, biochemistry and applications. Boca Raton. 1197 p. https://doi.org/10.1201/9781420039443
Зверев Я.Ф. 2017. Флавоноиды глазами фармаколога. Особенности и проблемы фармакокинетики. – Обзоры по клинической и лекарственной терапии. 15(2): 4–11.
Baczyńska B., Lityńska-Zając M. 2005. Application of Lithospermum officinale L. in early Bronze Age medicine. – Vegetation History and Archaeobotany. 14(1): 77–80. https://doi.org/10.1007/s00334-004-0054-7
Алиева А.М. 2017. Некоторые виды двудольных семейств Boraginaceae Juess., распространенных в Нахичеванской автономной Республике, имеющих важное промышленное значение. – Вестник Алтайского государственного аграрного университета. 9: 112–115. http://www.asau.ru/vestnik/2017/9/112-115.pdf
Amiri Z.M., Tanideh N., Seddighi A., Mokhtari M., Amini M., Partovi A.S., Manafi A., Hashemi S.S., Mehrabani D. 2017. The Effect of Lithospermum officinale, Silver Sulfadiazine and Alpha Ointments in Healing of Burn Wound Injuries in Rat. – World J. Plast. Surg. 6(3): 313–318. http://wjps.ir/article-1-358-en.html
Dresler S., Szymczak G., Wójcik M. 2017. Comparison of some secondary metabolite content in the seventeen species of the Boraginaceae family. – Pharmaceutical Biology. 55(1): 691–695. https://doi.org/10.1080/13880209.2016.1265986
Феськова Е.В., Леонтьев В.Н., Игнатовец О.С., Адамцевич Н.Ю., Бесараб А.Ю. 2019. Условия экстракции и идентификации флавоноидов, стимулирующих регенерацию тканей. – Труды БГТУ. Сер. 2. Химические технологии, биотехнологии, геоэкология. 1(217): 49–53. https://elib.belstu.by/bitstream/123456789/28372/1/Feskova_uslovija.pdf
Patil S.L., Mallaiah S.H., Patil R.K. 2013. Antioxidative and radioprotective potential of rutin and quercetin in Swiss albino mice exposed to gamma radiation. – J. Med. Phys. 38(2): 87–92. https://doi.org/10.4103/0971-6203.111321
Bhatia N., Singh A., Sharma R., Singh A., Soni V., Singh G., Bajaj J., Dhawan R., Singh B. 2014. Evaluation of burn wound healing potential of aqueous extract of Morus alba based cream in rats. – The J. Phytopharmacology. 3(6): 378–383. http://www.phytopharmajournal.com/Vol3_Issue6_01.pdf
Stimulation of neuroregeneration by flavonoid glycosides. 2012. www.google.com/patents/US20120087980
Адамцевич Н.Ю., Болтовский В.С., Титок В.В. 2020. Влияние параметров экстракции на выход флавоноидов из листьев воробейника лекарственного (Lithospermum officinale L.). – Вес. Нац. aкад. навук Беларусі. Сер. біял. навук. 65(4): 402–411. https://doi.org/10.29235/1029-8940-2020-65-4-402-411
Кузьменко А.Н., Нестерова О.В., Сулейманова Ф.Ш., Матюшин А.А., Краснюк И.И. (мл.). 2019. Модификация методики количественного определения флавоноидов в траве золотарника канадского (Solidago canadensis L.). – Вестник Московского университета. Сер. 2. Химия. 60(1): 49–54. http://www.chem.msu.su/rus/vmgu/191/49.pdf
Проценко М.А., Костина М.А. 2015. Разработка и валидация методики количественного анализа фенольных соединений и флавоноидов в экстрактах из высших грибов. – Химия растительного сырья. 3: 117–126. https://doi.org/10.14258/jcprm.201503822
Марахова А.И., Сорокина А.А., Станишевский Я.М. 2016. Применение принципа сквозной стандартизации в анализе флавоноидов травы пустырника и препаратов на его основе. – Разработка и регистрация лекарственных средств. 1(14): 150–154. https://www.pharmjournal.ru/jour/article/view/233/230
Государственная фармакопея Республики Беларусь II. 2012. Т 1. Общие методы контроля лекарственных средств. Минск. 1220 с.
Технический кодекс установившейся практики. 2012. Производство лекарственных средств. Валидация методик испытаний. ТКП 432-2012 (02041). Минск. 18 с.
Дополнительные материалы отсутствуют.
Инструменты
Растительные ресурсы


