Растительные ресурсы, 2022, T. 58, № 1, стр. 69-83
Результаты реинтродукции Trapa natans (Trapaceae) из низовий реки Волги в водоемы Саратовской области
А. С. Пархоменко 1, А. С. Кашин 1, *, Л. В. Гребенюк 1, А. В. Богослов 1, А. О. Кондратьева 1, И. В. Шилова 1, В. М. Пархоменко 1, А. В. Денисов 1
1 Саратовский национальный исследовательский государственный университет им. Н.Г. Чернышевского
г. Саратов, Россия
* E-mail: kashinas2@yandex.ru
Поступила в редакцию 03.06.2021
После доработки 05.10.2021
Принята к публикации 03.12.2021
- EDN: RIYJMO
- DOI: 10.31857/S0033994622010101
Аннотация
Trapa natans L. s.l. (Trapaceae) занесен в Красные Книги многих регионов России. На территории Саратовской обл. вид считается исчезнувшим и нуждается в реинтродукции. Авторами в 2018 г. осуществлен посев плодов водяного ореха, собранных в низовьях р. Волги (Астраханская обл.) в реках Хопер, Медведица и Волга в пределах Саратовской обл. Всего высеяно 1678 плодов чилима в 23-х наиболее подходящих местах. Мониторинговые исследования мест посева, проведенные в 2019–2020 гг., показали, что в ряде из них попытки воссоздания оказались малоудачными. Из 23 мест посева в 2019 г. розетки растений отмечены лишь в 10 местах, а в 2020 г. – лишь в 5 местах, в трех из них было лишь по 1–3 розетки. Только в одном месте посева T. natans на р. Хопер в 2020 г. произошло незначительное увеличение количества розеток чилима по сравнению с предыдущим годом. В донорных популяциях по совокупности морфометрических параметров в целом образцы более крупные, чем в реинтродукционных популяциях, что, вероятно, связано с температурным фактором. В местах посева T. natans развившиеся растения изменили форму листовых пластинок от широкояйцевидной на более вытянутую, ромбовидную, что может быть обусловлено адаптационной реакцией растений на новые условия существования.
Сокращение биоразнообразия является одной из актуальных экологических проблем современности. Для ее решения часто предпринимаются попытки сохранения и восстановления генофонда редких и исчезающих видов. К настоящему времени накоплен богатый опыт по реинтродукции11 таких видов во флоры регионов, в которых они раньше произрастали [1–6].
Одним из них является водяной орех (чилим) (Trapa natans L., Trapaceae) – реликт четвертичного периода, однолетний аэрогидатофит с дизъюнктивным, неуклонно сокращающимся ареалом [7–9]. Произрастает водяной орех в пойменных озерах и старицах, заводях рек, в местах, хорошо прогреваемых солнцем на глубине 0.5–2.5 м. Предпочитает хорошо аэрируемую воду с нейтральным pH. Вид образует чистые заросли или встречается вместе с другими растениями – кувшинковыми, роголистником, урутью, водяной гречихой и др. [14–16]. Лимитирующими факторами для вида считаются изменение гидрологического режима и загрязнение водоемов, усыхание озер из-за разбора воды на полив, мелиоративные работы, строительство гидросооружений, сбор плодов населением, заготовка зеленой массы на корм скоту. Большой ущерб зарослям чилима наносит ловля рыбы сетями [17].
Вид включен в Приложение 1 к Бернской конвенции об охране дикой фауны и флоры и природных сред обитания в Европе, Европейский Красный список МСОП, а также в Красные книги стран Восточной Европы и ряда регионов Российской Федерации. На территории Саратовской области T. natans считается исчезнувшим [8, 18].
Восстановление популяций и расселение водяного ореха предпринимались в ряде регионов страны [19–23]. В большинстве случаев эксперименты были неудачными или носили случайный характер. Успешной реинтродукция оказалась в водоемы Самарской, Воронежской и Пензенской областей, граничащих с Саратовской обл. [20, 21, 23, 24], а также в Республике Башкортостан [25].
Авторами данной статьи, начиная с 2012 г., проводятся работы по реинтродукции водяного ореха в Саратовскую обл. в реки Волжского (Волга, Терешка) и Донского (Хопер, Медведица) бассейнов. В качестве донорных были использованы популяции пойменных озер р. Дон на территории Волгоградской обл. (Иловлинский и Кумылженский р-ны). Мониторинговые исследования реинтродукционных популяций, проведенные в период 2014–2020 гг., показали, что вид либо закрепляется на новом месте, либо количество розеток постепенно уменьшается по сравнению с предыдущими годами. В ряде мест попытки реинтродукции оказались неудачными. В ходе проведенных исследований было выяснено, что наиболее благоприятные условия для реинтродукции T. natans в Саратовскую обл. обеспечиваются в заливах р. Хопер [8, 18].
Целью данной работы был анализ результатов реинтродукции T. natans из природных популяций низовий реки Волги (Астраханская обл.) в реки Хопер, Медведица и Волга в пределах Саратовской обл.
МАТЕРИАЛ И МЕТОДЫ
В продолжение работ по мониторингу состояния естественных популяций T. natans, авторами в конце августа–начале сентября 2018 г. были исследованы 7 популяций T. natans в Астраханской обл. Одна из исследованных популяций произрастает в озере волжского острова в окрестностях с. Черный Яр (№ 1). Остальные шесть популяций произрастают в дельте Волги: три – на р. Хурдун (№ 2–4), по одной популяции – на р. Старая Волга (№ 5), р. Сухой Рычан (№ 6) и на ерике Кривой банк (№ 7) (рис. 1).
Рис. 1.
Местонахождение исследованных естественных популяций Trapa natans в низовьях реки Волги (Астраханская область). Fig. 1. Location of the studied natural populations of Trapa natans in the Volga River delta (Astrakhan region).

Во всех 7 исследованных естественных популяциях T. natans в 2018 г. были собраны плоды в количестве 1678 шт. В сентябре того же года они были высеяны на территории Саратовской обл. в 23-х наиболее подходящих местах в реках Медведица (Аткарский р-н) и Хопер (Ртищевский р-н), а также в одном из заливов Волги (Марксовский р-н). В зависимости от площади, в каждом из выбранных мест высевали от 16 до 200 плодов (табл. 1). На участке р. Медведица от с. Приречного до с. Лопуховки было выбрано 8 мест, представляющих собой заводи с замедленным течением, в которые было высеяно 322 плода (от 16 до 100 шт. в каждое). На р. Хопер в 14 точках высеяно 1327 плодов: на участке от с. Бельщино до с. Потьмы (№ 9–19), у хут. Ободный (№ 20) и в старичном озере у с. Красная Звезда (№ 21, 22).
Таблица 1.
Результаты мониторинга мест посева плодов T. natans в пределах Саратовской области Table 1. Results of monitoring of T. natans sowing locations within the Saratov region
| № исходной популяци/ № of original population | № места посева/ Sowing site number | Координаты места посева/ Coordinates of sowing site | Число высеянных в 2018 г. плодов, шт./ Number of nuts sown in 2018, pcs. | Число розеток, шт./ Number of rosettes, pcs. | ||
|---|---|---|---|---|---|---|
| N | E | 2019 год/2019 | 2020 год/2020 | |||
| р. Медведица/Medveditsa River | ||||||
| 3 | 1 | 51.719552 | 44.92472 | 56 | 0 | 0 |
| 6 | 2 | 51.71448 | 44.92695 | 21 | 0 | 0 |
| 5 | 3 | 51.70531 | 44.90913 | 26 | 0 | 0 |
| 7 | 4 | 51.70288 | 44.90306 | 33 | 0 | 0 |
| 4 | 5 | 51.68564 | 44.88737 | 16 | 0 | 0 |
| 2 | 6 | 51.68638 | 44.88258 | 35 | 0 | 0 |
| 2 | 7 | 51.67852 | 44.88077 | 35 | 0 | 0 |
| 3, 5 | 8 | 51.67271 | 44.88971 | 100 | 0 | 0 |
| р. Хопер/Khopyer River | ||||||
| 3, 5 | 9 | 52.33493 | 43.36329 | 100 | 3 | 0 |
| 5 | 10 | 52.33349 | 43.35778 | 200 | 73 | 0 |
| 6 | 11 | 52.33011 | 43.36145 | 200 | 0 | 0 |
| 12 | 52.32286 | 43.36077 | 100 | 0 | 0 | |
| 13 | 52.32157 | 43.35574 | 50 | 0 | 0 | |
| 14 | 52.29456 | 43.36144 | 77 | 1 | 0 | |
| 1 | 15 | 52.291667 | 43.361389 | 100 | 21 | 2 |
| 16 | 52.286667 | 43.358889 | 50 | 12 | 0 | |
| 17 | 52.279167 | 43.363611 | 50 | 112 | 1 | |
| 18 | 52.275833 | 43.367222 | 50 | 0 | 0 | |
| 19 | 52.275556 | 43.368056 | 50 | 11 | 15 | |
| 20 | 52.202137 | 43.329719 | 100 | 47 | 3 | |
| 21 | 52.193611 | 43.419444 | 100 | 0 | 0 | |
| 22 | 52.193056 | 43.418333 | 100 | 1 | 0 | |
| р. Волга/Volga River | ||||||
| 1 | 23 | 51.802913 | 46.956998 | 29 | 24 | – |
Одно место для посева водяного ореха (№ 23) было выбрано на Волге, в Марксовском р-не, в окрестностях с. Баскатовка. Посев плодов производился в начале июня 2019 г. после стратификации на холоде в течение 8 мес. Из 29 плодов, собранных в Астраханской обл. (популяция № 1), ко времени посева у 17 шт. семена оказались проросшими, у 12 шт. – не проросшими.
Места произрастания природных популяций и места высева плодов T. natans отличаются, прежде всего, температурным режимом. В летние месяцы на территории Саратовской обл. температура воздуха и воды заметно ниже, чем на территории Астраханской обл. На р. Волга у г. Маркс температура воздуха ниже, чем в Астраханской обл. на 3–4 °C, воды – на 3–6 °C; на р. Медведица температура воздуха ниже на 5–6 °C, воды – на 7–10 °C; на р. Хопер температура воздуха и воды ниже на 5–7 °C (табл. 2) [26–28].
Таблица 2.
Температурные условия в местах исследования природных или реинтродукционных популяций T. natans по данным ближайших метеостанций и гидропостов Table 2. Temperature in the study areas of natural and reintroduced populations of T. natans according to the nearest weather stations and hydro posts
| Месяц Month | Температура воздуха, °C* Air temperature, °C* | Температура воды, °C** Water temperature, °C** | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ртищево Rtishchevo | Аткарск Atkarsk | Маркс Marx | Астрахань Astrakhan | Ртищево Rtishchevo | Аткарск Atkarsk | Маркс Marx | Астрахань Astrakhan | |||||||||||||
| Река Хопер Khopyer River | Река Медведица Medveditsa River | Река Волга Volga River | Река Волга Volga River | Река Хопер Khopyer River | Река Медведица Medveditsa River | Река Волга Volga River | Река Волга Volga River | |||||||||||||
| средняя mean | 2019 | 2020 | средняя mean | 2019 | средняя mean | 2019 | 2020 | средняя mean | 2018 | средняя *** mean*** | 2019 | 2020 | средняяmean | 2019 | средняя*** mean*** | 2019 | 2020 | средняя*** mean*** | 2018 | |
| Январь January | –9.8 | –10.0 | –2.3 | –9.5 | –10.4 | –9.1 | –10.3 | –1.6 | –4.5 | –5.9 | 3.0 | 3.0 | 0.7 | 1.7 | 1.0 | 3.0 | 5.1 | 1.8 | 3.0 | 10.7 |
| Февраль February | –8.5 | –6.1 | –3.1 | –8.3 | –6.6 | –8.2 | –6.2 | –2.2 | –4.6 | –2.4 | 3.0 | 3.4 | 4.4 | 3.5 | 3.8 | 3.1 | 2.1 | 3.6 | 3.0 | 5.1 |
| Март March | –2.6 | –1.5 | 3.1 | –2.6 | –1.7 | –1.6 | –0.6 | 4.1 | 2.9 | 1.0 | 3.3 | 4.3 | 7.0 | 5.1 | 5.6 | 4.0 | 2.4 | 5.9 | 4.0 | 5.4 |
| Апрель April | 7.5 | 8.6 | 5.8 | 7.5 | 8.1 | 8.7 | 9.3 | 7.5 | 11.5 | 11.1 | 6.6 | 7.9 | 5.5 | 6.6 | 6.0 | 6.7 | 10.0 | 6.5 | 9.0 | 14.6 |
| Май May | 16.0 | 17.0 | 13.0 | 16.0 | 17.3 | 17.4 | 18.5 | 15.4 | 19.3 | 21.2 | 14.7 | 12.3 | 12.6 | 11.9 | 11.4 | 14.0 | 13.4 | 13.0 | 19.0 | 17.1 |
| Июнь June | 19.0 | 20.9 | 19.2 | 19.5 | 21.6 | 21.5 | 22.9 | 20.7 | 24.2 | 23.8 | 19.4 | 18.7 | 20.1 | 18.1 | 19.2 | 21.6 | 17.4 | 21.0 | 25.0 | 17.6 |
| Июль July | 21.0 | 18.4 | 21.4 | 21.8 | 19.8 | 23.9 | 21.7 | 24.8 | 27.6 | 28.7 | 21.4 | 19.7 | 18.2 | 18.5 | 18.0 | 23.3 | 22.0 | 19.6 | 28.0 | 25.3 |
| Авгус August | 20.1 | 16.9 | 17.8 | 20.3 | 17.8 | 22.2 | 19.6 | 19.8 | 25.6 | 24.2 | 21.2 | 19.7 | 20.1 | 19.2 | 18.6 | 20.1 | 21.8 | 21.0 | 26.0 | 25.5 |
| Сентябрь September | 13.3 | 10.9 | 14.0 | 13.8 | 11.7 | 9.4 | 13.3 | 15.5 | 19.6 | 19.4 | 16.1 | 21.9 | 21.1 | 20.1 | 21.3 | 15.8 | 21.5 | 23.2 | 21.0 | 20.8 |
| Октябр October | 6.0 | 8.7 | 8.5 | 6.4 | 9.2 | 7.6 | 10.5 | 9.3 | 12.0 | 12.6 | 8.5 | 15.1 | 14.7 | 14.5 | 14.2 | 11.0 | 16.3 | 15.0 | 13.0 | 19.8 |
| Ноябрь November | –0.6 | –0.9 | –1.1 | –0.5 | –1.4 | 0.5 | –0.9 | –0.5 | 3.7 | 2.2 | 3.5 | 9.0 | 10.0 | 9.3 | 8.7 | 4.0 | 9.9 | 9.6 | 6.0 | 15.2 |
| Декабрь December | –5.4 | –3.1 | –9.7 | –5.7 | –3.3 | –5.4 | –2.8 | –10.9 | –0.5 | –0.9 | 3.0 | 9.1 | 7.6 | 7.4 | 8.4 | 3.0 | 8.4 | 9.0 | 3.0 | 9.4 |
| За год Per year | 6.3 | 6.7 | 7.2 | 6.6 | 6.8 | 7.2 | 7.9 | 8.5 | 11.4 | 11.3 | 10.3 | 12.0 | 11.8 | 11.3 | 11.4 | 10.8 | 12.5 | 12.4 | 13.3 | 15.5 |
Примечание: * – по данным сайта www.pogodaiklimat.ru [26]; ** – по данным сайта www.pogoda1.ru [27]; *** – средняя температура воды за последние 10 лет по данным сайта www.travel.org.ua [28]. Note: * – according to data from www.pogodaiklimat.ru [26]; ** – according to data from www.pogoda1.ru [27]; *** – average water temperature over the past 10 years according to data from www.travel.org.ua [28].
В конце августа и начале сентября 2019 и 2020 гг. проведен мониторинг мест посадки T. natans в водоемах Саратовской обл. При проведении исследований в качестве учетной единицы принималась розетка. В каждой реинтродукционной популяции определялись морфометрические показатели 30 розеток. Если розеток чилима в месте посева оказывалось мало, производилось измерение всех розеток. В каждом месте посева отмечались общая численность розеток, число листьев в розетке, число цветков и плодов (зрелых, незрелых, следов от опавших плодов), измерялся диаметр розетки.
Измерения производились с помощью линейки и электронного штангенциркуля Mechanic 150 PRO. Каждая из 30 розеток фотографировалась в естественных условиях с масштабной линейкой и затем, при камеральной обработке, определялась площадь каждого листа и всей розетки с использованием компьютерной программы ImageJ. Кроме того, гербаризировалось по одному листу из “среднего пояса” каждой розетки. В камеральных условиях на них измерялись признаки, приведенные на рис. 2.
Рис. 2.
Измеряемые параметры листа Trapa natans: 1 – длина черешка до пузыря, 2 – длина черешка от пузыря, 3 – длина пузыря, 4 – ширина пузыря, 5 – ширина листовой пластинки между нижними зубцами, 6 – ширина листовой пластинки, 7 – длина листовой пластинки, 8 – ширина третьего от основания зубца листовой пластинки, 9 – высота третьего от основания зубца листовой пластинки, 10 – среднее количество зубцов на боковой стороне листовой пластинки, 11 – длина черешка. Fig. 2. Measured Trapa natans leaf traits: 1 – length of petiole to bladder, 2 – length of petiole from bladder, 3 – length of petiole bladder, 4 – width of petiole bladder, 5 – width of leaf blade between the lower teeth, 6 – leaf blade width, 7 – leaf blade length, 8 – width of the third from the base tooth of the leaf blade, 9 – height of the third from the base tooth of the leaf blade, 10 – the average number of teeth on the leaf blade edge, 11 – petiole length.
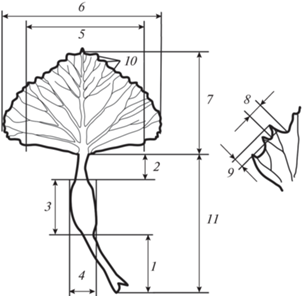
Потенциальная семенная продуктивность определялась суммированием показателей числа плодов, следов от плодов и числа цветков. При определении реальной семенной продуктивности суммировалось количество зрелых плодов и следов от опавших плодов.
Анализ межпопуляционной изменчивости морфологических показателей проводили с использованием описательной статистики (средняя арифметическая величина и ее ошибка). Ординация точек, соответствующих особям разных популяций, выполнена методом главных компонент (PCA). Перед этим количественные признаки были стандартизированы с целью компенсации различия единиц измерения путем вычитания из каждого наблюдения среднего значения и деления на стандартное отклонение [29, 30]. Статистическую обработку данных осуществляли с помощью программ Statistica 12.0 и Past 3.26.
Изучение изменчивости формы листовых пластинок проводилось с привлечением методов геометрической морфометрии, в частности эллиптического анализа формы с использованием гармоник Фурье (EFA) [31, 32], представленного в пакете Momocs [33] среды статистического программирования R [34]. Листовые пластинки были отсканированы с разрешением 300 dpi. Полученные изображения были бинаризованы, т.е. переведены из цветных в монохромные. В качестве входных данных использовались автоматически прослеженные контуры объектов – аутлайны [35]. Достоверность различий при сравнении естественных популяций с искусственными проверялась многомерным дисперсионным анализом (MANOVA) с использованием критерия Хотеллинга–Лоули. Результаты статистических процедур были использованы для объективной оценки состояния редкого вида на территории Саратовской обл.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Состояние природных популяций T. natans. Исследованные природные популяции в большинстве случаев (№ 1–3 и 6) были многочисленными, плотными, занимающими широкую полосу (до 15 м) вдоль берегов водоемов. Местообитание популяции № 1 представляет собой озеро размером 100 × 300 м, расположенное на одном из островов р. Волги. Водоем практически не подвергается антропогенному воздействию. Остальные местообитания находятся вблизи небольших населенных пунктов (№ 2 и 3 в окр. с. Боркино Икрянинского р-на, № 4 – с. Икряное Икрянинского р-на, № 5 – с. Самосделка Камызякского р-на, № 6 – с. Бирюковка Приволжского р-на, № 7 – с. Каралат Камызякского р-на). Практически все популяции развиваются в условиях хорошей освещенности и слабого течения. Лишь популяция № 3, находящаяся в окр. с. Боркино, в некоторой степени подвержена затенению растущими на берегу деревьями.
Глубина водоемов в местах произрастания водяного ореха составляет от 10 до 150 см. Грунт дна илистый или илисто-глинистый. На момент исследования в популяциях 50% розеток находилось в высохшем состоянии на обнажившемся ложе водоемов из-за понижения уровня воды в реках. Исключением являлись популяция № 5 (10% высохших розеток) и № 1 (без высохших розеток). В соответствии с Докладом об экологической ситуации в Астраханской обл. [36], с июля 2018 г. сброс воды Волгоградской ГЭС начал уменьшаться, вследствие чего ее уровень по водотокам снижался. По гидропосту в г. Астрахани в июле среднемесячный уровень воды был на 121 см, а в августе – на 123 см ниже, чем в 2017 г. Температура воздуха в июле была выше средней, что также способствовало обмелению водоемов (табл. 2).
Мониторинг мест посева плодов T. natans. На р. Медведица в 2019 г. ни в одном из мест посева плодов T. natans розеток не было обнаружено (табл. 1). Как указано выше (табл. 2), условия в р. Медведица в наибольшей степени отличаются от условий произрастания вида в дельте р. Волга. По-видимому, температурные условия в р. Медведица явились критическими для прорастания семян T. natans. Имеются сведения о том, что прорастание семян водяного ореха возможно при температуре воды 15–20 °С [37]. О температуре воды, как одном из основных факторов, лимитирующих прорастание семян T. natans, сообщали и другие исследователи [25].
На р. Хопер в 2019 г. розетки T. natans обнаружены в девяти из 14-ти мест посева: единичные розетки выявлены в местах посева № 14, 22 (по 1 розетке) и № 9 (3 розетки); малочисленные розетки – в местах посева № 16 и 19 (12 и 11 розеток соответственно); среднее число розеток – в местах посева № 15 и 20 (21 и 47 розеток соответственно); многочисленные розетки – в местах посева № 10 (73 розетки) и 17 (112 розеток). В 2020 г. численность розеток водяного ореха практически во всех местах высева на р. Хопер резко снизилась вплоть до полного отсутствия в некоторых из них. Розетки были обнаружены лишь в четырех местах посева (№ 15, 17, 19 и 20). В трех из них количество розеток составило 1–3 шт. Лишь в одном месте (№ 19) численность розеток увеличилась с 11 в 2019 г. до 15 шт. (табл. 1).
В месте посева плодов T. natans на р. Волге (№ 23) в сентябре 2019 г. было зафиксировано 24 розетки, для 11 из которых были определены морфометрические параметры. Остальные розетки, из-за поднятия уровня воды в Волге, оказались в притопленном состоянии и находились под водой на глубине до 0.5 м. Измерить такие экземпляры, не отделяя их от стебля, не представилось возможным. На исследованных розетках выполненных плодов и следов от плодов не отмечено. На четырех розетках присутствовали единичные незрелые плоды (2–5 шт.). Число цветков варьировало от 3 до 7 шт. на каждой розетке.
Таким образом, из 23 мест посева плодов чилима, собранных в дельте р. Волги, в 2019 г. розетки отмечены лишь в десяти, а в 2020 г. число мест, в которых вид сохранился уменьшилось до пяти, при этом в трех местах было обнаружено лишь по 1–3 розетки. Только в одном месте посева (№ 19) T. natans на р. Хопер в 2020 г. произошло незначительное увеличение количества розеток по сравнению с предыдущим годом.
Результаты проведенного мониторинга показывают, что более низкая температура воды в водоемах Саратовской обл., по сравнению с температурой в водоемах Астраханской обл., не способствует прорастанию и дальнейшему успешному развитию чилима. Практически во всех местах реинтродукции T. natans в Саратовской области, в которых было зафиксировано достаточно большое количество розеток в 2019 г. и сохранение части из них до 2020 г., для посева использовались плоды, собранные в самой северной естественной популяции в Астраханской обл. – в одном из озер на острове р. Волги в окрестностях с. Черный Яр (№ 1). Климатические условия этого района наиболее близки к условиям на территории Саратовской обл. Единственным исключением была точка № 10, в которой высевались плоды, собранные в естественной популяции № 5 из протоки Старой Волги у с. Самосделка.
Результаты морфометрического анализа розеток T. natans из естественных донорных популяций и мест высева плодов на р. Хопер и в заливе р. Волга в 2019 и 2020 гг. представлены в табл. 3. В большинстве реинтродукционных популяций T. natans на р. Хопер в 2019 г. основные размерные показатели (длина, ширина и площадь листовой пластинки, длина черешка от пузыря, среднее число зубцов на боковой стороне листовой пластинки) уступали таковым растений их донорных популяций. Самые крупные по диаметру розетки зафиксированы в местах посева № 10, 17 и 19. Максимальные площади розеток отмечены в двух местах посева – № 17 и 19. В 2020 г. в тех реинтродукционных популяциях, в которых имелись розетки T. natans, отмечалось уменьшение их морфометрических показателей: площади и диаметра розетки, площади листовой пластинки, длины черешка листа по сравнению со значениями, зафиксированными в 2019 г.
Таблица 3.
Морфометрические параметры T. natans в природных популяциях низовий реки Волги (Астраханская область) и в реинтродукционных популяциях в р. Хопер и р. Волга на территории Саратовской области Table 3. Morphometric parameters of T. natans in natural populations of the Volga River delta (Astrakhan region) and in reintroduced populations of the Khopyer and Volga Rivers in the Saratov region
| Параметр Parameter | Номер популяции Population number | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 5 | 10 | 15 | 16 | 17 | 19 | 20 | 23 | 19 | 23 | |
| 2018 год 2018 | 2019 год 2019 | 2020 год 2020 |
|||||||||
| Площадь розетки, см2 Rosette area, cm2 | 700 ± 40 | 580 ± 20 | – | 550 ± 40 | 560 ± 60 | 600 ± 30 | 710 ± 80 | 550 ± 40 | 250 ± 50 | 560 ± 90 | 350 ± 40 |
| Длина листовой пластинки, см Leaf blade length, cm | 4.7 ± 0.1 | 4.2 ± 0.1 | 4.5 ± 0.1 | 4.2 ± 0.1 | 4.2 ± 0.1 | 4.4 ± 0.1 | 4.3 ± 0.1 | 3.9 ± 0.1 | 3.4 ± 0.2 | 4.2 ± 0.1 | 3.8 ± 0.2 |
| Ширина листовой пластинки, см Leaf blade width, cm | 5.9 ± 0.1 | 5.5 ± 0.1 | 5.1 ± 0.1 | 4.8 ± 0.1 | 5.0 ± 0.2 | 5.2 ± 0.1 | 5.0 ± 0.1 | 4.6 ± 0.1 | 4.2 ± 0.2 | 5.0 ± 0.2 | 4.5 ± 0.2 |
| Ширина листовой пластинки между нижними зубцами, см The width of the leaf blade between the lower teeth, cm | 5.3 ± 0.1 | 4.9 ± 0.1 | 4.9 ± 0.1 | 4.6 ± 0.1 | 4.7 ± 0.2 | 5.0 ± 0.1 | 4.8 ± 0.2 | 4.5 ± 0.1 | 4.0 ± 0.2 | 4.3 ± 0.2 | 3.0 ± 0.2 |
| Площадь листовой пластинки, см2 Leaf area, cm2 | 24.0 ± 1.0 | 18.6 ± 0.5 | – | 19.9 ± 1.3 | 21.6 ± 1.5 | 18.5 ± 0.6 | 21.2 ± 1.2 | 15.5 ± 0.9 | 9.4 ± 0.8 | 17.5 ± 1.5 | 10.5 ± 0.7 |
| Длина черешка листа, см Leaf petiole length, cm | 8.2 ± 0.2 | 7.6 ± 0.2 | 8.0 ± 0.3 | 7.0 ± 0.4 | 6.9 ± 0.5 | 8.2 ± 0.4 | 8.1 ± 0.5 | 8.8 ± 0.5 | 6.1 ± 0.5 | 6.8 ± 0.5 | 5.5 ± 0.4 |
| Длина черешка до пузыря, см Length of petiole to bladder, cm | 4.3 ± 0.2 | 4.3 ± 0.2 | 4.1 ± 0.2 | 3.8 ± 0.3 | 3.6 ± 0.3 | 4.6 ± 0.3 | 4.6 ± 0.4 | 5.3 ± 0.4 | 3.2 ± 0.4 | 3.8 ± 0.4 | 3.0 ± 0.3 |
| Длина черешка от пузыря, см Length of petiole from bladder, cm | 1.5 ± 0.1 | 1.2 ± 0.0 | 1.0 ± 0.0 | 1.0 ± 0.0 | 1.0 ± 0.1 | 1.1 ± 0.0 | 0.9 ± 0.1 | 1.0 ± 0.0 | 0.9 ± 0.1 | 0.8 ± 0.1 | 1.0 ± 0.0 |
| Длина пузыря, см Length of bladder, cm | 2.4 ± 0.1 | 2.1 ± 0.1 | 3.0 ± 0.1 | 2.3 ± 0.1 | 2.4 ± 0.1 | 2.5 ± 0.1 | 2.6 ± 0.2 | 2.4 ± 0.1 | 2.0 ± 0.1 | 2.1 ± 0.1 | 1.6 ± 0.0 |
| Ширина пузыря, см Width of bladder, cm | 0.6 ± 0.0 | 0.4 ± 0.0 | 0.8 ± 0.0 | 0.5 ± 0.0 | 0.5 ± 0.0 | 0.5 ± 0.0 | 0.4 ± 0.0 | 0.6 ± 0.0 | 0.5 ± 0.0 | 0.6 ± 0.0 | 0.4 ± 0.0 |
| Ширина третьего от основания зубца листовой пластинки, см Width of the third from the base tooth, cm | 0.4 ± 0.0 | 0.4 ± 0.0 | 0.4 ± 0.0 | 0.4 ± 0.0 | 0.4 ± 0.0 | 0.4 ± 0.0 | 0.4 ± 0.0 | 0.4 ± 0.0 | 0.3 ± 0.0 | 0.4 ± 0.0 | 0.4 ± 0.0 |
| Высота третьего от основания зубца листовой пластинки, см Height of the third from the from the base tooth, cm | 0.2 ± 0.0 | 0.2 ± 0.0 | 0.2 ± 0.0 | 0.3 ± 0.0 | 0.3 ± 0.0 | 0.2 ± 0.0 | 0.2 ± 0.0 | 0.2 ± 0.0 | 0.2 ± 0.0 | 0.3 ± 0.0 | 0.3 ± 0.0 |
| Среднее количество зубцов на боковой стороне листовой пластинки, шт. Average number of teeth on the edge of leaf blade, pcs. | 13.6 ± 0.2 | 14.8 ± 0.2 | 10.6 ± 0.3 | 10.9 ± 0.3 | 11.7 ± 0.4 | 11.7 ± 0.2 | 10.9 ± 0.4 | 11.3 ± 0.2 | 11.6 ± 0.4 | 12.0 ± 0.5 | 12.0 ± 0.5 |
| Диаметр розетки, см Rosette diametre, cm | 41.2 ± 1.3 | 39.9 ± 0.8 | 49.8 ± 1.7 | 40.7 ± 1.8 | 39.7 ± 2.3 | 48.8 ± 1.8 | 45.0 ± 3.2 | 43.7 ± 2.1 | 28.8 ± 2.8 | 34.9 ± 3.1 | 35.4 ± 1.3 |
| Количество листьев, шт. Number of leaves, pcs. | 33.2 ± 1.4 | 41.7 ± 1.1 | 37.3 ± 1.4 | 33.6 ± 0.7 | 33.3 ± 1.7 | 38.8 ± 1.0 | 39.4 ± 2.6 | 36.8 ± 1.4 | 30.0 ± 3 | 34.0 ± 2.6 | 36.8 ± 1.4 |
| Число незрелых плодов, шт. Number of unripe fruits, pcs. | 4.7 ± 0.4 | 7.6 ± 0.3 | 3.7 ± 0.4 | 2.6 ± 0.4 | 3.0 ± 0.4 | 5.3 ± 0.7 | 7.1 ± 1.6 | 6.7 ± 0.6 | 0.8 ± 0.5 | 2.3 ± 0.5 | 7.2 ± 1.2 |
| Число следов от опавших плодов, шт. Number of scars from abscised fruits, pcs. | 5.2 ± 0.4 | 0.3 ± 0.1 | 0 | 0.4 ± 0.2 | 1.5 ± 0.5 | 0.1 ± 0.1 | 0 | 0.3 ± 0.1 | 0 | 0.2 ± 0.1 | 0 |
| Число цветков, шт. Number of flowers, pcs. | 1.1 ± 0.2 | 3.5 ± 0.2 | 4.0 ± 0.3 | 3.0 ± 0.4 | 2.7 ± 0.3 | 3.1 ± 0.2 | 4.7 ± 0.5 | 3.4 ± 0.3 | 3.9 ± 0.3 | 3.9 ± 0.4 | 1.8 ± 0.5 |
| Реальная семенная продуктивность, шт. Realized seed production, pcs. | 7.4 ± 0.5 | 1.2 ± 0.2 | 0 | 0.4 ± 0.2 | 1.6 ± 0.6 | 0.1±0.1 | 0 | 0.3 ± 0.1 | 0 | 0.2 ± 0.1 | 0 |
| Потенциальная семенная продуктивность, шт. Potential seed production, pcs. | 13.2 ± 0.8 | 12.3 ± 0.4 | 7.7 ± 0.4 | 6.0 ± 0.5 | 7.2 ± 0.7 | 8.5±0.6 | 11.8±1.6 | 9.8 ± 0.8 | 4.7 ± 0.5 | 6.5 ± 0.5 | 9.0 ± 1.2 |
Потенциальная семенная продуктивность в местах высева также была несколько ниже (6–12 шт. на розетку), чем в естественных популяциях (12–13 шт. на розетку). Максимальная потенциальная семенная продуктивность отмечена в местах посева № 17, 19 и 20. Максимальная реальная семенная продуктивность отмечена в месте посева № 16: 5 шт. – на одной розетке, от 1 до 4 шт. – на пяти розетках, на шести розетках плоды отсутствовали, т.е. на всю популяцию из 12 розеток приходилось 19 плодов. В остальных местах зрелых плодов не обнаружено или их общая численность не превышала 10 шт. на всех сформировавшихся розетках. Незрелых плодов в розетке в местах посева встречалось несколько меньше (3–7 шт.), чем в естественных популяциях (5–10 шт.), то же касалось и числа цветков (1–4 шт. против 3–5 шт. соответственно).
Известно, что не все семена чилима прорастают на следующий год, они могут находиться в состоянии покоя, не теряя всхожести, и прорастать в течение нескольких лет. Это может являться одной из причин резкой пульсации численности T. natans по годам, как в природных, так и в воссозданных популяциях [21]. В нашем случае, кроме того, велика вероятность влияния температурных условий на прорастание семян и дальнейшее развитие растений чилима. Вероятно, в связи с более низкой температурой воды в р. Хопер, по сравнению с температурой в дельте Волги (на 2–7 °С, табл. 2) в 5 из 14 мест посева в 2019 г. розетки не появились, а образовавшиеся розетки поздно зацвели из-за более позднего прогревания воды и плоды не успели вызреть. Показано, что цветение T. natans возможно только при температуре не ниже 20 °С [16, 37]. Очевидно, что при позднем цветении плоды либо не завязываются вообще, либо не вызревают. Вероятно, это и сказалось в следующем году (табл. 1), когда количество розеток в точках высева плодов водяного ореха на р. Хопер уменьшилось, а в половине мест они исчезли. Лишь в одной точке посева (№ 19) количество розеток в 2020 г. увеличилось с 11 до 15 шт. На розетках зрелых плодов не обнаружено, но на двух розетках остались единичные следы от опавших плодов. На большинстве розеток присутствовали от 1 до 5 незрелых плодов (35 шт. во всей реинтродукционной популяции). На всех розетках было значительное число цветков – от 2 до 7 (59 шт. в совокупности). Таким образом, в 2020 г. потенциальная семенная продуктивность в данной реинтродукционной популяции (№ 19) снизилась почти в 2 раза по отношению к показателям предыдущего года, а реальная семенная продуктивность практически отсутствовала.
Ординация результатов морфологического анализа методом PCA по первым двум главным компонентам демонстрирует полную обособленность облака рассеяния точек, соответствующих особям природной популяции № 1 из Черного Яра, которая является донорной для реинтродукционных популяций № 15–17, 19, 20 и 23 (рис. 3а). Облако занимает правую нижнюю часть области ординации. Точки, соответствующие образцам реинтродукционных популяций № 15–17, 19, 20 и 23 по результатам обоих лет наблюдения образуют в пространстве главных компонент единое рыхлое облако рассеяния. Природная популяция № 5, являющаяся донорной для реинтродукционной популяции № 10, также образует обособленное облако и занимает правую часть области ординации (рис. 3b). Точки, соответствующие особям реинтродукционной популяции № 10, образуют обособленное облако в левой части области ординации.
Рис. 3.
Ординация методом главных компонент (PCA) изученных популяций Trapa natans на основе результатов морфологического анализа. a – Донорная природная популяция № 1 и реинтродукционные популяции № 15–17, 19, 20 и 23. Условные обозначения: черный круг – популяция № 1, синий круг – № 15, зеленый круг – № 16, красный круг – № 17, фиолетовый круг – № 20, черный квадрат – № 19 (исследование 2019 г.), белый квадрат – № 19 (исследование 2020 г.), синий треугольник – № 23 (исследование 2019 г.), белый треугольник – №23 (исследование 2020 г.). b – Донорная природная популяция № 5 и реинтродукционная популяция № 10. Условные обозначения: черный круг – популяция № 5, красный круг – № 10. Fig. 3. Principal component analysis (PCA) of the studied populations of Trapa natans based on the results of morphological analysis. a – Donor natural population № 1 and reintroduced populations № 15–17, 19, 20 and 23 propagated from seeds of population №1. Legend: black circle – population № 1, blue circle – № 15, green circle – № 16, red circle – № 17, purple circle – № 20, black square – № 19 (observation of 2019), white square – № 19 (observation of 2020), blue triangle – № 23 (observation of 2019), white triangle – № 23 (observation of 2020). b – Donor natural population № 5 and reintroduced population № 10. Legend: black circle – population № 5, red circle – № 10.
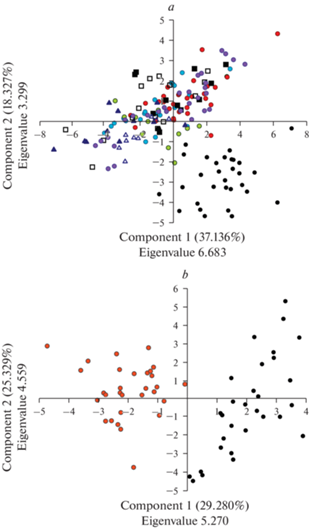
Таким образом, реципиентные реинтродукционные популяции по комплексу морфологических параметров достоверно отличаются от донорных популяций. При этом в целом исследованные образцы в донорных популяциях более крупные, чем в рецепиентных. Это, вероятно, также связано с температурным фактором.
Фенотипическая изменчивость является одной из ключевых составляющих адаптационного потенциала растений. Изменение формы листовой пластинки может быть важным показателем, так как факторы внешней среды, воздействуя на развивающиеся листья, оказывают существенное влияние на становление особенностей их окончательной структуры и формы [38]. При сравнении природных популяций с реинтродукционными по форме листовой пластинки показано, что их области точек рассеяния хорошо разделяются (рис. 4). При этом первые две главные компоненты объясняют 71% общей изменчивости формы листовых пластинок. Установлено, что формы листовых пластинок достоверно различаются при сравнении популяций естественного происхождения с искусственными (p < 2.2e–16). Таким образом, форма листовых пластинок реинтродукционных популяций T. natans под действием факторов окружающей среды изменилась по отношению к естественным популяциям. Основной тенденцией в изменении формы листовой пластинки является переход от широкояйцевидной, по большей части характерной для природных популяций, к более вытянутой, ромбовидной, характерной для реинтродукционных популяций.
Рис. 4.
Распределение листовых пластинок особей Trapa natans из природных и реинтродукционных популяций в пространстве двух главных компонент. Фигуры на заднем плане соответствуют реконструированным формам листовых пластинок, расположенным согласно их позициям в пространстве первых двух главных компонент. Красным цветом обозначены естественные популяции, синим – реинтродуцированные. Fig. 4. Distribution of sampled leaf blades from natural and reintroduced populations Trapa natans over two principal components. Figures in the background show reconstructed leaf blade shapes according to their position in the space of the first two principal components. Natural populations are shown in red, reintroduced – in blue.
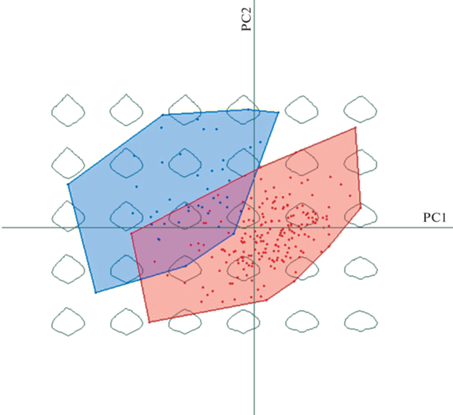
ЗАКЛЮЧЕНИЕ
Попытка реинтродукции водяного ореха Trapa natans в реки Саратовской обл. с использованием донорного посевного материала из низовий Волги оказались малоудачными. Вероятно, это обусловлено тем, что в реках Саратовской обл. в период вегетации температура воздуха на 3–7 °C, а температура воды на 5–10 °C ниже, чем в Астраханской обл. Для плодов чилима, происходящих из естественных популяций дельты р. Волги с хорошо прогреваемой водой, места посева в более северных широтах оказались неблагоприятными.
В донорных популяциях по совокупности морфологических параметров в целом образцы более крупные, чем в реинтродукционных популяциях. Это, вероятно, также связано с температурным фактором. В местах посева плодов T. natans развившиеся растения изменили форму листовых пластинок от широкояйцевидной на более вытянутую, ромбовидную, что, возможно, является адаптационной реакцией растений на новые условия существования.
Полученные результаты подтверждают ранее сформировавшееся представление о том, что работы по реинтродукции T. natans необходимо проводить, используя для посева плоды водяного ореха, произрастающего в условиях, приближенных к условиям мест воссоздаваемых популяций. Для реинтродукции водяного ореха необходимо выбирать места, однотипные по гидрологическому и температурному режиму с теми, в которых он обитает. Гидрологический режим р. Волги на территории Саратовской обл. из-за частого сброса больших объемов воды через плотины гидроэлектростанций очень нестабилен, что затрудняет воссоздание в данном водоеме популяций T. natans.
Список литературы
Соболевская К.А. 1990. Реинтродукция в свете сохранения генофонда природной флоры. – Бюлл. ГБС АН СССР. 157: 51–55.
Тихонова В.Л., Беловодова Н.Н. 2002. Реинтродукция дикорастущих травянистых растений; состояние проблемы и перспективы. – Бюллетень Главного ботанического сада. 183: 90–106.
Горбунов Ю.Н., Дзыбов Д.С., Кузьмин З.Е., Смирнов И.А. 2008. Методические рекомендации по реинтродукции редких и исчезающих видов растений (для ботанических садов). Тула. 56 с.
Мулдашев А.А., Галеева А.Х., Маслова Н.В. 2009. Реинтродукция как способ сохранения редких видов флоры Республики Башкортостан. – Аграрная Россия. Спец. вып. 13: 13. https://doi.org/10.30906/1999-5636-2009-1-I-13
Maschinski J., Albrecht M.A. 2017. Center for Plant Conservation’s Best Practice Guidelines for the reintroduction of rare plants. – Plant Diversity. 39(6): 390–395. https://doi.org/10.1016/j.pld.2017.09.006
Елисафенко Т.В., Дорогина О.В. 2019. Терминология, используемая в описании восстановления природных популяций. – Растительные ресурсы. 55(2): 284–290. https://doi.org/10.1134/S0033994619020122
Цвелев Н.Н. 1964. О способе распространения водяного ореха Trapa L. в прошлом и вымирании его в историческое время. – Бот. журн. 49(9): 1338–1340.
Кашин А.С., Петрова Н.А., Шилова И.В., Куликова Л.В. 2016. Перспективы реинтродукции Trapa natans (Trapaceae) в Саратовской области. – Растительные ресурсы. 4: 47–62.
Кулуев Б.Р., Артюхин А.Е., Шевченко А.М., Михайлова Е.В. 2017. Водяной орех плавающий Trapa L.: биология, ареал распространения и исследование его изолированных популяций в озерах Нуримановского района Республики Башкортостан. – Биомика. 9(2): 101–118.
Akeroyd J., Jackson P.W. 1995. A handbook for botanic gardens on the reintroduction of plants to the wild. Botanical Gardens Conservation International and IUCN. Richmond Surrey. UK. 32 p.
Maunder M. 1992. Plant reintroduction: an overview. – Biodiversity and Conservation. 1(1): 51–61. https://doi.org/10.1007/BF00700250
Maschinski J., Albrecht M.A. 2017. Center for Plant Conservation’s Best Practice Guidelines for the reintroduction of rare plants. – Plant Diversity. 39(6): 390–395. https://doi.org/10.1016/j.pld.2017.09.006
Maschinskia J., Duquesnelb J. 2007. Successful reintroductions of the endangered long-lived Sargent’s cherry palm, Pseudophoenix sargentii, in the Florida Keys. – Biological Conservation. 134 (1): 122–129. https://doi.org/10.1016/j.biocon.2006.07.012
Hummel M., Findlay S. 2006. Effects of Water Chestnut (Trapa natans) Beds on Beds on Water Chemistry in the Tidal Freshwater Hudson River. – Hydrobiologia. 559(1): 169–181. https://doi.org/10.1007/s10750-005-9201-0
Dement’eva S.M., Petushkova T.P. 2010. On the ecology and distribution of Trapa natans L. in lakes of the Tver Region. – Russian J. Ecology. 41(5): 440–444. https://doi.org/10.1134/S1067413610050139
Lim T.K. 2013. Trapa natans L. – In: Edible Medicinal and Non-Medicinal Plants. Volume 5. Fruits. P. 195–201. https://doi.org/10.1007/978-94-007-5653-3_11.
Литвинская С.А., Тильба А.П., Филимонова Р.Г. 1983. Редкие и исчезающие растения Кубани. Краснодар. 159 с.
Кашин А.С., Пархоменко А.С., Богослов А.В., Шилова И.В., Куликова Л.В., Гребенюк Л.В., Петрова Н.А. 2019. Результаты реинтродукции Trapa natans L. в р. Хопер на территории Саратовской области. – Научные труды национального парка “Хвалынский”. 11: 67–72.
Каршина Л.Е., Трофимов М.М. 1951. О возможности культуры чилима в дельте р. Волги. – Бюллетень МОИП. Отд. биологии. 56(1): 94–96.
Матвеев В.И., Шилов М.П. 1996. Водяной орех: проблемы восстановления ареала вида. Самара. 184 с.
Печенюк Е.В., Радькова Н.А. 1998. Восстановление численности Trapa natans (Trapaceae) в пойменном водоеме реки Хопер. – Бот. журн. 83 (9): 70–75. http://arch.botjournal.ru/?t=issues&id=19980909&rid=pdf_0005041
Лесков А.П. 2010. Экология и биология Trapa natans L. (восточное Забайкалье). – Ученые записки Забайкальского государственного гуманитарно-педагогического университета. Серия: Естественные науки. 1: 140–146.
Агаева И.В. 2016. Опыт реинтродукции рогульника плавающего (Trapa natans L.) в Пензенской области как перспективного объекта для введения в культуру. – Нива Поволжья. 3: 2–8. https://elibrary.ru/item.asp?id=29233267
Соловьева В.В. 2009. Адвентивная флора естественных и искусственных водоемов Самарской области. – Известия Самарского научного центра РАН. 11(1–4): 611–616.
Михайлова В.Е., Артюхин А.Е., Панфилова М.А., Кулуев Б.Р. 2021. Особенности произрастания водяного ореха Trapa natans L. на северной границе ареала. – Биология внутренних вод. 1: 85–90. https://doi.org/10.31857/S0320965221010083
Справочно-информационный портал “Погода и климат”. http://www.pogodaiklimat.ru/
Пoгoдa 1. https://pogoda1.ru/
Туристический клуб “Mangup”. Температура воды. https://travel.org.ua/water.php
Finot V.L., Soreng R.J., Giussani L.M., Muñoz R.G. 2018. A multivariate morphometric delimitation of species boundaries in the South American genus Nicoraepoa (Poaceae: Pooideae: Poeae). – Pl. Syst. Evol. 304(5): 679–697. https://doi.org/10.1007/s00606-018-1499-y
Torrecilla P., Acedo C., Marques I., Díaz-Pérez A.J., López-Rodríguez J.A., Mirones V., Sus A., Llamas F., Alonso A., Pérez-Collazos E., Viruel J., Sahuquillo Sancho M.D., Komac B., Manso J.A., Segarra-Moragues J.G., Draper D., Villar L., Catalán P. 2013. Morphometric and molecular variation in concert: taxonomy and genetics of the reticulate Pyrenean and Iberian alpine spiny fescues (Festuca eskia complex Poaceae). – Botanical J. Linnean Society. 173(4): 676–706. https://doi.org/10.1111/boj.12103
Kuhl F.P., Giardina C.R. 1982. Elliptic Fourier features of a closed contour. – Computer Graphics and Image Processing. 18(3): 236–258. https://doi.org/10.1016/0146-664X(82)90034-X
Claude J. 2008. Morphometrics with R. New York. 316 p. https://doi.org/10.1007/978-0-387-77789-4
Bonhomme V., Picq S., Gaucherel C., Claude J. 2014. Momocs: Outline Analysis Using R. – J.f Statistical Software. 56(13): 1–24. https://doi.org/10.18637/jss.v056.i13
R Core Team, 2020. R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. http://www.r-project.org/index.html
Васильев А.Г., Васильева И.А., Шкурихин А.О. 2018. Геометрическая морфометрия: от теории к практике. Москва. 471 с.
Доклад об экологической ситуации в Астраханской области в 2018 году. Служба природопользования и охраны окружающей среды Астраханской области. 2019. Астрахань. 232 с.
Васильев В.Н. 1960. Водяной орех и перспективы его культуры в СССР. М.; Л. 97 с.
Штирц Ю.А. 2020. Оценка изменчивости формы листовой пластинки Polygonum monspeliense Thiе́baut ex Pers. методами геометрической морфометрии при выращивании на почвенных субстратах техногенных территорий. – Проблемы ботаники Южной Сибири и Монголии. 19(2): 225–228. https://doi.org/10.14258/pbssm.2020108
Дополнительные материалы отсутствуют.
Инструменты
Растительные ресурсы


