Растительные ресурсы, 2022, T. 58, № 2, стр. 152-160
Компонентный состав растений Erodium stephanianum (Geraniaceae), произрастающих в Республике Бурятия
Л. П. Ильина 1, *, Д. Н. Оленников 2, Т. П. Анцупова 3
1 Бурятская государственная сельскохозяйственная академия им. В.Р. Филиппова
г. Улан-Удэ, Россия
2 Институт общей и экспериментальной биологии СО РАН
г. Улан-Удэ, Россия
3 Восточно-Сибирский государственный университет технологий и управления
г. Улан-Удэ, Россия
* E-mail: larisap11@mail.ru
Поступила в редакцию 01.07.2021
После доработки 17.08.2021
Принята к публикации 02.12.2021
- EDN: MTRIFH
- DOI: 10.31857/S0033994622010058
Аннотация
В статье приводятся результаты экспериментальных исследований по изучению суммарного содержания дубильных веществ, макро- и микроэлементов, а также качественного фенольного состава надземных и подземных органов Erodium stephanianum Willd. Содержание дубильных веществ в растительном материале, собранном в фазу цветения, составляет 13 мас. % в корневой системе и 22 мас. % в надземной части. Для качественного определения индивидуальных фенольных соединений был применен метод ВЭЖХ, с помощью которого выявлено 14 соединений из водной вытяжки надземной части и 10 соединений из водной вытяжки подземной части E. stephanianum. Десять соединений встречаются как в надземной части растений, так и в корневой системе, четыре вещества – только в надземной части. В надземных и подземных органах выявлено 22 макро- и микроэлемента.
Территория Бурятии отличается разнообразием растительного покрова, в котором представлены лесные сообщества, кустарниковые заросли, степи и луга. Здесь произрастает более 2000 видов сосудистых растений, из них около 200 видов относятся к лекарственным, известным как в научной, так и в народной медицине [1, 2]. Представители семейства гераниевые Geraniaceae Juss. не являются фармакопейными видами, поэтому степень изученности их незначительна. Виды рода журавельник Erodium L’Her. относятся к лекарственным растениям, применяемым в народной медицине при внутренних кровотечениях, простудных заболеваниях, пневмонии, для лечения кожных сыпей; препараты из них оказывают гемостатическое действие, снижают сосудистую проницаемость, положительно влияют центральную нервную систему, кроме того, они используются в ветеринарии [3]. В республике встречаются два вида рода Erodium: журавельник цикутовый E. cicutarium (L.) L’Her. и журавельник Стефана E. stephanianum Willd. Для представителей семейства Geraniaceae характерно противогрибковое и противомикробное действие, что непосредственно связано с содержанием дубильных веществ (танидов, танинов) [4, 5]. В литературных источниках имеется информация о компонентном составе журавельника цикутового [3], но нам не встречались сообщения о компонентном составе журавельника Стефана. Работа с этим видом проводится нами с 2011 года [6, 7].
Целью данной работы явилось изучение суммарного содержания дубильных веществ, макро- и микроэлементов и качественного фенольного состава надземных и подземных органов E. stephanianum, произрастающего на территории Бурятии.
МАТЕРИАЛ И МЕТОДЫ
Объект исследования – Erodium stephanianum Willd.11 – двулетнее, реже многолетнее растение до 60 см высотой. Листья черешковые, дважды перистые, пластинки широкояйцевидные, 3–8 см длиной, 2.5–6.5 см шириной, с 2–3 парами низбегающих на стержень долей, которые в свою очередь более или менее глубоко рассечены на неравные ланцетные, цельные или зубчатые дольки. Зонтики из 2–4 цветков. Лепестки одинаковой длины, лиловато-синие. Встречается в песчаных и каменистых степях, на южных степных склонах, по высохшим руслам ручьев, по долинам рек, нередко как сорное растение вдоль дорог и на залежах. Произрастает повсеместно на территории Бурятии [2, 8].
Для определения суммарного содержания дубильных веществ и элементного состава брали высушенный, измельченный растительный материал E. stephanianum, для анализа фенольного состава использовали дубильные вещества, полученные путем водной экстракции из надземных и подземных органов вида. Растение было собрано в период цветения в окрестностях с. Кучегэр Курумканского района республики Бурятия. Растительная ассоциация – разнотравно-злаково-полынно-лапчатковая. Доминирующие виды: Potentilla flagellaris Willd. ex Schlecht., Artemisia scoparia Waldst. et Kit., Agropyron cristatum (L.) Beauv. Сопутствующие виды: Elytrigia repens (L.) Nevski, Galium verum L., Sanguisorba officinalis L., Thermopsis lanceolata R. Br. и др. Видовую принадлежность устанавливали по Определителю растений Бурятии [2].
Определение содержания танидов проводили по общепринятой методике методом перманганатометрического титрования [10, 11]. Оставшееся после титрования водное извлечение нагревали на водяной бане, в результате чего происходило испарение воды. Концентрированный раствор высушивали в сушильном шкафу при температуре 60 ± 2 °C до сухого состояния и оставляли для дальнейшего изучения.
Для определения фенольного состава растений брали 10 мг высушенного материала (дубильных веществ), растворяли в 1 мл 80%-ного раствора ацетонитрила, после чего центрифугировали (6000 g, 20 мин). Полученный раствор фильтровали через мембранный фильтр (0.45 мкм) и использовали для анализа (1 мкл). Анализ осуществляли на жидкостном хроматографе LCMS-8050 (Shimadzu, Columbia, MD, USA), соединенном с диодно-матричным детектором (ДМД) и 3Q детектором с ионизацией электрораспылением (ИЭР/МС; electrospray ionization, ESI), используя колонку GLC Mastro C18 (150 × 2.1 мм, размер частиц сорбента 3 мкм; Shimadzu, Kyoto, Japan). Условия ВЭЖХ: подвижная фаза, элюент A – вода, элюент В – ацетонитрил; программа градиента – 0–10 мин 5–12% B, 10–20 мин 12–45% B, 20–40 мин 45–100% B; инжектируемый объем – 1 мкл; скорость потока – 200 мкл/мин, температура колонки – 30 °C; диапазон сканирования спектров поглощения – 200–600 нм. Условия ДМД: 270 нм. Условия ИЭР-МС: режим ионизации – электрораспыление; температура интерфейса ИЭР – 300 °C; температура линии десольватации – 250 °C; температура нагревательного блока – 400 °C; скорость газа-распылителя (N2) – 3 л/мин; скорость газа-нагревателя (воздух) – 10 л/мин; давление газа, используемого для диссоциации, индуцируемой соударением (CID, газ, Ar) – 270 кПa; расход Ar – 0.3 мл/мин; напряжение на капилляре – 3 кВ; диапазон сканирования масс (m/z) 100–1900.
В работе использованы образцы веществ сравнения (каталожный номер, содержание основного вещества) следующих производителей: ChemFaces (Wuhan, Hubei, PRC) – дегидрогераниин (CFN90259, ≥ 98%), кверцетин-3-О-галлоилглюкозид (CFN91064, ≥ 98%), эродиол (CFN99851, ≥ 98%); MCE MedChemExpress (Monmouth, NJ, USA) – 5-О-галлоилхинная кислота (HY-122921, ≥ 98%); Sigma-Aldrich (St. Louis, MO, USA) – галловая кислота (G7384, ≥ 98%), гераниин (PHL80994, ≥ 95%), корилагин (G0424, ≥ 98%), эллаговая кислота (E2250, ≥ 95%), кверцетин (Q4951, ≥ 95%), кверцетин-3-О-глюкозид (16654, ≥ 98%), кверцетин-3-О-галактозид (83388, ≥ 97%).
Элементный состав растительного сырья определяли недеструктивным методом рентгенофлуоресценции на волновом рентгеновском спектрометре S4 Pioneer (Bruker AXS, Germany) с рентгеновской трубкой мощностью 4 кВт и Rh-анодом. Из каждого образца брали 2 навески по 0.5 г растительного материала, прессованного в виде таблеток. Условия измерения: при определении элементов от Na до K напряжение на трубке составляет 30 кВ, сила тока 60 мА; при определении элементов от Ca до Pb – 50 кВ и 40 мА соответственно. Время набора импульсов изменялось от 10 до 100 с в зависимости от содержания элемента [12].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Суммарное содержание дубильных веществ в растительном материале E. stephanianum составило 22 мас. % в надземной части и 13 мас. % в корневой системе. Высокое содержание дубильных веществ в видах семейства Geraniaceae, в частности в надземных и подземных органах Geranium pratense L., G. sylvaticum L., G. palustre L., произрастающих на Северо-Западе России, подтверждают литературные данные [3–5, 13, 14].
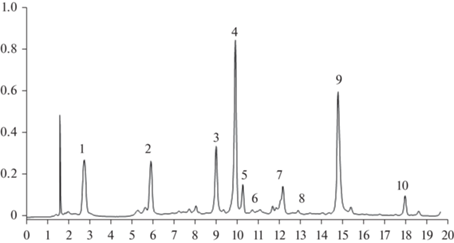
С помощью метода ВЭЖХ было выявлено 14 фенольных соединений из водной вытяжки надземной части (рис. 1) и 10 соединений из водной вытяжки подземной части (рис. 2) журавельника Стефана. При анализе компонентного состава (по результатам, представленным на рис. 1 и 2) установлено, что число фенольных соединений в надземных органах растения больше, чем в подземных. Суммарное содержание дубильных веществ также является более высоким в надземной части по сравнению с подземной частью. Десять соединений (галловая, 5-О-галлоилхинная, эллаговая кислоты, дегидрогераниин, гераниин, корилагин, эродиол, кверцетин, два изомера три-галлоилглюкозы со временем удерживания 12.21 и 12.92 мин соответственно) встречаются как в надземной части растения, так и в корневой системе. Только в надземной части обнаружены четыре вещества: кверцетин-3-О-глюкозид, кверцетин-3-О-галактозид, кверцетин-3-О-галлоилглюкозид и третий изомер три-галлоилглюкозы со временем удержания 13.73 минуты.
Рис. 1.
Хроматограмма (ВЭЖХ) водного извлечения из надземной части растений Erodium stephanianum. По горизонтали – время удерживания, мин; по вертикали – оптическая плотность при 270 нм. Соединения: 1 – галловая кислота, 2 – 5-О-галлоилхинная кислота, 3 – дегидрогераниин, 4 – гераниин, 5 – корилагин, 6 – эродиол, 7 – три-галлоилглюкоза (изомер), 8 – три-галлоилглюкоза (изомер), 9 – три-галлоилглюкоза (изомер), 10 – эллаговая кислота, 11 –кверцетин-3-О-глюкозид, 12 – кверцетин-3-О-галактозид, 13 – кверцетин-3-О-галлоилглюкозид, 14 – кверцетин. Fig. 1. Chromatogram (HPLC) of an aqueous extract from the above ground parts of Erodium stephanianum. X-axis – retention time, min; y-axis – optical density at 270 nm. Compounds: 1 – gallic acid, 2 – 5-O-galloylquinic acid, 3 – dehydrogeraniin, 4 – geraniin, 5 – corylagin, 6 – erodiol, 7 – tri-galloylglucose (isomer), 8 – tri-galloylglucose (isomer), 9 – tri-galloylglucose (isomer), 10 – ellagic acid, 11 – quercetin-3-O-glucoside, 12 – quercetin-3-O-galactoside, 13 – quercetin-3-O-galloylglucoside, 14 – quercetin.

Рис. 2.
Хроматограмма (ВЭЖХ) водного извлечения из корней растений Erodium stephanianum. По горизонтали – время удерживания, мин; по вертикали – оптическая плотность при 270 нм. Соединения: 1 – галловая кислота, 2 – 5-О-галлоилхинная кислота, 3 – дегидрогераниин, 4 – гераниин, 5 – корилагин, 6 – эродиол, 7 – три-галлоилглюкоза (изомер), 8 – три-галлоилглюкоза (изомер), 9 – эллаговая кислота, 10 – кверцетин. Fig. 2. Chromatogram (HPLC) of the aqueous extract from roots of Erodium stephanianum. X-axis – retention time, min; y-axis – optical density at 270 nm. Compounds: 1 – gallic acid, 2 – 5-O-galloylquinic acid, 3 – dehydrogeraniin, 4 – geraniin, 5 – corylagin, 6 – erodiol, 7 – tri-galloylglucose (isomer), 8 – tri-galloylglucose (isomer), 9 – ellagic acid, 10 – quercetin.
Выделение вторичных метаболитов проводили с помощью жидкостной хроматографии водной вытяжки из растительного сырья, используя следующие методы идентификации: 1) путем сравнения с известными веществами; 2) по наличию в дубильных веществах фенольного кольца и хромофоров (метод УФ-спектрофотометрии); 3) методом масс-спектрометрии (наиболее удобный и информативный). Полученные результаты представлены в табл. 1 и 2.
Таблица 1.
Идентификация и время удерживания соединений 1–14 из надземных органов Erodium stephanianum Table 1. Identification and retention time of compounds 1–14 from the above-ground parts of Erodium stephanianum
| Идентификация Identification |
Соединения Compounds |
Время удерживания, мин Retention time, min |
|---|---|---|
| Сравнение с известным веществом Comparison with a known substance |
1, 2, 3, 4, 5, 6, 10, 11, 12, 13, 14 | 3.05; 6.18; 9.10; 10.04; 10.22; 10.67; 14.89; 15.04; 15.39; 17.20; 17.85 |
| По данным УФ- и масс-спектров* By UV- and mass- spectra* |
7, 8, 9, 13 | 12.21; 12.92; 13.73; 17.20 |
Примечание. * УФ-спектры: λmax 277 (± 2), 300 плечо (± 4) нм. Масс-спектры: 635 [M-H]-, 483 [(M-H)-галлоил]-, 331 [(M-H)-2 × галлоил]-, 179 [(M-H)-3 × галлоил]- Note. * UV: λmax 277 (± 2), shoulder 300 (± 4) nm. Mass spectra: 635 [M-H]-, 483 [(M-H)-galloyl]-, 331 [(M-H)-2 × galloyl]-, 179 [(M-H)-3 × galloyl]-.
Таблица 2.
Идентификация и время удерживания соединений 1–10 из подземных органов Erodium stephanianum Table 2. Identification and retention time of compounds 1–10 from underground parts of Erodium stephanianum
| Идентификация Identification |
Соединения Compounds |
Время удерживания, мин Retention time, min |
|---|---|---|
| Сравнение с известным веществом Comparison with a known substance |
1, 2, 3, 4, 5, 6, 9, 10 | 3.05; 6.18; 9.10; 10.04; 10.22; 10.67; 14.89; 17.85 |
| По данным УФ- и масс-спектров* By to UV- and mass- spectra* |
7, 8 | 12.21; 12.92 |
Примечание. * УФ-спектры: λmax 277 (± 2), 300 плечо (± 4) нм. Масс-спектры: 635 [M-H]-, 483 [(M-H)-галлоил]-, 331 [(M-H)-2 × галлоил]-, 179 [(M-H)-3 × галлоил]- Note. * UV: λmax 277 (± 2), 300 shoulder (± 4) nm. Mass spectra: 635 [M-H]-, 483 [(M-H)-galloyl]-, 331 [(M-H)-2 × galloyl]-, 179 [(M-H)-3 × galloyl]-
Данные табл. 1 и 2 показывают, что идентификацию фенольных соединений проводили преимущественно на основе сравнения с известными веществами: это соединения 1–6, 10, 11, 12, 14, выделенные из надземных органов и соединения 1–6, 9, 10, выделенные из подземных органов журавельника Стефана (расшифровка соединений приведена в подписях к рис. 1 и 2). Идентификацию некоторых соединений подтверждали с помощью УФ- и масс-спектрометрии: это соединения 7–9, 13 из вытяжки надземной части и соединения 7, 8 из вытяжки подземной части растения.
Анализ литературных данных о фенольном составе видов семейства Geraniaceae, произрастающих в других регионах, показал, что в траве Geranium sibiricum L. из Курской области также содержатся галловая кислота [15]; в траве того же вида из Узбекистана – галовая и эллаговая кислоты, гераниин и кверцетин [13]. В надземной и подземной части Geranium pratense, G. sylvaticum, G. palustre, произрастающих на Северо-Западе Европейской России содержатся галловая и эллаговая кислоты [16]. Другие соединения, обнаруженные у E. stephanianum, не встречаются у перечисленных видов, что вероятно указывает на видовую и территориальную специфику.
Состав и содержание элементов в растительном материале E. stephanianum представлены в табл. 3. Из определявшихся 22 элементов 8 относятся к макроэлементам (Na, Mg, P, S, Cl, K, Ca, Fe), остальные 14 – к микроэлементам (Al, Si, Ti, Sr, Ba, Cr, Mn, Ni, Cu, Zn, Br, Rb, Zr, Pb). Из макроэлементов наиболее высокое содержание отмечено для K (10 100 мкг/г в надземной части и 7500 мкг/г в подземной) и Ca (24 400 и 8000 мкг/г соответственно), которые относятся к биофилам [17, 18]. Наиболее низким содержанием отличается Na (640 мкг/г в надземных и 450 мкг/г в подземных органах). Информация о низком содержании натрия в Hypericum perforatum представлена в работе Т.И. Сиромля и Ю.В. Загурской [19].
Таблица 3.
Элементный состав Erodium stephanianum, мкг/г воздушно-сухого сырья Table 3. Elemental composition of Erodium stephanianum, µ/g air-dry weight
| Элемент Element |
Надземные органы Above-ground plant parts |
Подземные органы Underground plant parts |
Элемент Element |
Надземные органы Above-ground plant parts | Подземные органы Underground plant parts |
|---|---|---|---|---|---|
| Na | 640 | 450 | Sr | 4.4 | <2 |
| Mg | 6200 | 7800 | Ba | 40 | 16 |
| P | 2050 | 1860 | Cr | 16.2 | 4.3 |
| S | 2080 | 1250 | Mn | 82 | 31 |
| Cl | 1230 | 1940 | Ni | 6.3 | 4.2 |
| K | 10 100 | 7500 | Cu | 7.9 | 7.4 |
| Ca | 24 400 | 8000 | Zn | 28 | 40 |
| Fe | 2010 | 240 | Br | 21 | 25 |
| Al | 3390 | 290 | Rb | 52 | 40 |
| Si | 9360 | 940 | Zr | 4.4 | <2 |
| Ti | 226 | 19 | Pb | 2 | <2 |
Из микроэлементов относительно высокое содержание в образцах журавельника Стефана отмечено для Si (9360 мкг/г в надземной части и 940 мкг/г в подземной части) и Al (3390 и 290 мкг/г соответственно), значительно меньшее – для Ti и Mn (соответственно 226 и 82 мкг/г в надземной части; 19 и 31мкг/г в корнях) и наиболее низкое – для Sr, Zr и Pb (соответственно 4.4, 4.4 и 2 мкг/г в надземных органах и менее 2 мкг/г в подземных органах). Низкое содержание стронция, циркония и свинца в корневой системе, вероятно, свидетельствует об экологически чистом местопроизрастании вида. В литературе имеется информация о содержании 3 макро- и 5 микроэлементов в надземной и подземной частях Geranium palustre, G. pratense и G. sylvaticum, при этом отмечено значительное накопление Ca, Mg, Zn и Mn [20], что совпадает с нашими данными.
Данные табл. 3 свидетельствуют, что наблюдается заметное различие в накоплении элементов в подземных и надземных органах E. stephanianum, особенно четко это заметно при расчете коэффициента корневого барьера (ККБ), т.е. отношения содержания элементов в корневой системе к концентрации их в надземной части (табл. 4).
Таблица 4.
Коэффициент корневого барьера (ККБ) вида Erodium stephanianum в порядке возрастания Table 4. Translocation factor (TF) of the Erodium stephanianum species in ascending order
| Элемент Element |
ККБ RBI |
Элементы Elements |
ККБ RBI |
|---|---|---|---|
| Ti | 0.08 | Ni | 0.67 |
| Al | 0.09 | Na | 0.70 |
| Si | 0.10 | K | 0.74 |
| Fe | 0.12 | Rb | 0.77 |
| Cr | 0.27 | P | 0.91 |
| Ca | 0.33 | Cu | 0.94 |
| Mn | 0.38 | Pb | ≥ 0.95 |
| Ba | 0.40 | Br | 1.19 |
| Zr | 0.43 | Mg | 1.26 |
| Sr | 0.43 | Zn | 1.43 |
| S | 0.60 | Cl | 1.58 |
Как видно из табл. 4, для 18 элементов (Ti, Al, Si, Fe, Cr, Ca, Mn, Ba, Zr, Sr, S, Ni, Na, K, Rb, P, Cu, Pb) коэффициент корневого барьера ниже единицы, что указывает на безбарьерный переход элементов из подземных органов в надземные. Для остальных 4 элементов (Br, Mg, Zn, Cl) существует препятствие перехода (ККБ от 1.2 до 1.6), т.е. указанные элементы концентрируются в большей степени в надземной, чем в подземной части. Таким образом, информация о преимущественном содержании элементов в корнях растений, поскольку их основным источником их является почва [21], на примере E. stephanianum не подтверждается.
Компонентный состав и содержание макро- и микроэлементов в растительном материале исследуемого вида вероятнее всего зависит от ряда факторов: природы биологически активных веществ и элементов, видовой специфики, особенностей условий местообитания, химических и физических свойств почвы.
ЗАКЛЮЧЕНИЕ
Исследовано суммарное содержание дубильных веществ, макро- и микроэлементов, а также качественный фенольный состав надземных и подземных органов Erodium stephanianum Willd. на территории Республики Бурятия (Курумканский р-н). Установлено, что суммарное содержание дубильных веществ в надземных органах является более высоким, чем в подземных (22 и 13 мас. % соответственно).
Компонентный состав фенольного комплекса, установленный с помощью ВЭЖХ при сравнении с известными веществами, а также на основе УФ- и масс-спектрометрии, указывает на различие фенольного состава надземной части и корневой системы E. stephanianum. В надземной части растений E. stephanianum обнаружено и идентифицировано 14 фенольных соединений, в подземной части – 10 соединений.
Определено содержание 8 макро- и 14 микроэлементов в подземной и надземной частях E. stephanianum. Более высокое содержание в надземной части растений по сравнению с подземной выявлено для 18 элементов (Ti, Al, Si, Fe, Cr, Ca, Mn, Ba, Zr, Sr, S, Ni, Na, K, Rb, P, Cu, Pb), что указывает на их безбарьерное передвижение. Остальные 4 элемента (Br, Mg, Zn, Cl) в большей степени концентрируются в корневой системе, чем в надземной части.
Список литературы
Анцупова Т.П., Дашиева Ж.Д., Ендонова Г.Б., Жапова О.И., Ильина Л.П., Павлова Е.П. 2015. Лекарственные растения Бурятии в науке и практике. Улан-Удэ. 150 с.
Определитель растений Бурятии. 2001. Улан-Удэ. 672 с.
Растительные ресурсы СССР: Цветковые растения, их химический состав, использование. Семейства Rutaceae – Elaeagnaceae. 1988. Л. 357 с.
Минаева В.Г. 1991. Лекарственные растения Сибири. Новосибирск. 431 с.
Телятьев В.В. 1985. Полезные растения Центральной Сибири. Иркутск. 384 с.
Ильина Л.П., Анцупова Т.П. 2016. Дубильные вещества представителей семейства Geraniaceae Бурятии. – Междунар. науч.-иссл. журн. 5(47): 73–74. https://doi.org/10.18454/IRJ.2016.47.083
Ильина Л.П., Анцупова Т.П. 2017. Содержание макро- и микроэлементов растений рода Erodium L’Her. – В сб.: Теоретические и практические вопросы интеграции химической науки, технологии и образования: Матер. II науч.-практ. конф. с межд. участием. Улан-Удэ. С. 58–62.
Флора Центральной Сибири. 1979. Т. 2. Новосибирск. 513 с.
Черепанов С.К. 1995. Сем. Geraniaceae Juss. – В кн.: Сосудистые растения России и сопредельных государств (в пределах бывшего СССР). СПб. С. 520–521.
Государственная Фармакопея Российской Федерации. Т. 1. М. 2015. 1469 с. https://docs.rucml.ru/feml/pharma/v13/vol1/
Гринкевич Н.И., Сафронич Л.Н. 1983. Химический анализ лекарственных растений. М. 176 с.
Чупарина Е.В., Мартынов А.М. 2011. Применение недеструктивного РФА для определения элементного состава лекарственных растений. – Журн. аналит. химии. 66(4): 399–405. https://elibrary.ru/item.asp?id=16311412
Жамалова Д.Н., Пулатов С.О., Курбаниязова Г.Т., Жабборов А.М., Тажиева Ф.А. 2019. Виды рода Geranium L. во флоре Узбекистана: распространение, химический состав и биологическая активность. – Universum: химия и биология: электрон. научн. журн. 10(64). http://7universum.com/ru/nature/archive/item/7865
Разаренова К.Н., Жохова Е.В. 2011. Сравнительная оценка содержания дубильных веществ в некоторых видах рода Geranium L. флоры Северо-Запада.– Химия растит. cырья. 4: 187–192. https://elibrary.ru/item.asp?id=17289491
Бубенчиков Р.А., Позднякова Т.А. 2014. Изучение состава фенольных соединений герани сибирской методом ВЭЖХ. – В сб.: Медико-социальная экология личности: состояние и перспективы: Матер. XII Междунар. конф. Минск. С. 13–15. https://elib.bsu.by/handle/123456789/94625
Разаренова К.Н., Сипкина Н.Ю., Жохова Е.В. 2012. Динамика накопления некоторых фенольных соединений в надземной и подземной частях Geranium prаtense L. – Бутлеров. сообщ. 31(7): 93–97. https://butlerov.com/stat/reports/details.asp?lang=ru&id=10505
Битюцкий Н.П. 1999. Микроэлементы и растение. СПб. 232 с.
Ловкова М.Я., Рабинович А.М., Пономарева С.М., Бузук Г.Н., Соколова С.М. 1990. Почему растения лечат. М. 256 с.
Сиромля Т.И., Загурская Ю.В. 2019. Элементный химический состав Hypericum perforatum – ненормируемые элементы. – Химия растит. сырья. 2: 179–187. https://doi.org/10.14258/jcprm.2019023965
Разаренова К.Н., Жохова Е.В., Беляева А.И. 2013. Минеральный состав некоторых видов рода Geranium (Geraniaceae). – Растит. ресурсы. 49(1): 118–124. https://elibrary.ru/item.asp?id=18762307
Кабата-Пендиас А., Пендиас Х. 1989. Микроэлементы в почвах и растениях. Пер. с англ. М. 439 с.
Дополнительные материалы отсутствуют.
Инструменты
Растительные ресурсы


