Растительные ресурсы, 2023, T. 59, № 3, стр. 217-227
Препараты из Sorbus aucuparia (Rosaceae) в экспериментальной терапии злокачественных новообразований: открывающиеся возможности
О. Ю. Рыбалкина 1, 2, *, Т. Г. Разина 1, Е. П. Зуева 1, Е. Н. Амосова 1, Г. И. Калинкина 2, М. Ю. Минакова 1, В. В. Жданов 1
1 Томский национальный исследовательский медицинский центр РАН, Научно-исследовательский институт фармакологии и регенеративной медицины им. Е.Д. Гольдберга
г. Томск, Россия
2 Федеральное государственное бюджетное образовательное учреждение высшего образования
“Сибирский государственный медицинский университет”
г. Томск, Россия
* E-mail: olgatomsk87@gmail.com
Поступила в редакцию 31.03.2023
После доработки 03.04.2023
Принята к публикации 03.05.2023
- EDN: RKGEOE
- DOI: 10.31857/S0033994623030111
Аннотация
В обзоре представлены сведения из литературных источников и собственные данные о некоторых фармакологических свойствах Sorbus aucuparia L. (Rosaceae). Особое внимание уделено исследованиям в области экспериментальной онкологии.
Несмотря на достижения в области разработки и внедрения в клиническую практику синтетических средств, препараты из природных источников продолжают завоевывать свою нишу в лечении различных заболеваний благодаря широкому спектру фармакологических эффектов. С каждым годом на мировом фармацевтическом рынке возрастает количество препаратов, производимых из комплексного растительного сырья и из отдельных выделенных биологически активных соединений. Не ослабевает внимание специалистов-онкологов и фармакологов к поиску новых высокоэффективных средств с противоопухолевой, антиметастатической активностью с улучшенным профилем безопасности. Одним из подходов к решению проблемы повышения эффективности цитостатической терапии и снижения ее токсичности является использование в схемах лечения природных соединений, которые в большинстве случаев могут сочетать в себе высокую антипролиферативную активность по отношению к опухолевым клеткам и низкую токсичность для нормальных клеток [1]. Исследованиями многих научных коллективов установлены противоопухолевые, антиметастатические свойства, показана возможность использования в комплексной терапии злокачественных новообразований флавоноидов, алкалоидов, гликозидов, полисахаридов. Настоящий обзор призван обратить внимание на рябину обыкновенную (Sorbus aucuparia L.) – представителя семейства Розовых (Rosaceae), как потенциальный источник веществ для создания препаратов, используемых в онкологии [2].
ХИМИЧЕСКИЕ КОМПОНЕНТЫ СЫРЬЯ РЯБИНЫ
Рябина обыкновенная – листопадное дерево высотой до 20 м, реже кустарник с неплотной кроной и гладкой серой корой. Цветет рябина в мае–июне. Плоды созревают в августе–сентябре и остаются на дереве до глубокой зимы [3]. Рябина обыкновенная широко распространенный вид [4, 5]. Одно растение может дать до 80–100 кг плодов, в которых содержатся макро- и микроэлементы, витамины, дубильные вещества, полифенолы, фосфолипиды и полисахариды [6–8]. Сырье “Рябины обыкновенной плоды” включено в Государственную фармакопею Российской Федерации XIV издания (ФС.2.5.0093.18).
Макро- и микроэлементы. Рябина обыкновенная содержит 8 основных минералов (в мг/100 г): калий – 154.0; фосфор – 12.3; кальций – 29.9; магний – 27.84; железо – 2.42; медь – 0.294; цинк – 0.861; марганец – 0.503 [9].
Витамины. В основном рябина содержит следующие витамины: аскорбиновая кислота, витамины Е и А. Согласно данным Z.O. Mrkonjić с соавт. (2017), в S. aucuparia содержится приблизительно 0.1 мг/г (сухой вес) аскорбиновой кислоты [10]. Содержание витамина Е в рябине в пересчете на α-токоферол, δ-токоферол и γ-токоферол составляет соответственно 4.89, 0.58, 1.71 мкг/г сух. массы [11]. Витамин А в плодах S. aucuparia представлен его предшественником – β-каротином. Показано, что плоды рябины содержат 2.5 мг/100 г общих каротиноидов [12]. Гостищев И.А. и др. [13] установили, что в плодах, выращенных в условиях Белгорода, содержание общих каротиноидов (в пересчете на β-каротин) составляет 17.8 мг/100 г.
Дубильные вещества. Содержание дубильных веществ в плодах рябины обыкновенной составляет 2.29%. Следует учесть, что процент содержания этих веществ зависит от места произрастания растений [14].
Фосфолипиды. В маслах семян S. aucuparia сумма линолевой и олеиновой кислот превышает 90% от общего количества жирных кислот [15].
Полисахариды. Суммарный выход полисахаридов из плодов рябины обыкновенной составляет 4.2%. Показано, что в их состав в качестве основного компонента входят остатки галактуроновой кислоты. В составе водорастворимых полисахаридов плодов рябины обыкновенной обнаружены нейтральные моносахариды: арабиноза, галактоза, глюкоза, ксилоза, рамноза, манноза [6].
Полифенолы. Рябина обыкновенная является одним из самых богатых источников полифенолов среди других растений и отличается высоким содержанием процианидинов, антоцианидинов, фенольных кислот и флавоноидов [7].
Основными фенольными кислотами, входящими в состав рябины обыкновенной, являются хлорогеновые, состоящие в основном из двух изомеров (3- и 5-кофеоилхинных кислот). Их общее содержание составляет 26.1 мг/100 г [15]. Известно, что кофеоилхинные кислоты составляют 56–80% от общего количества фенолов, при этом плоды культивируемых растений содержат меньше кофеоилхинных кислот, чем плоды дикой рябины [16].
В качестве основных флавоноидов в образцах плодов, листьев и соцветий рябины обыкновенной обнаружены кверцетин, кемпферол, изокверцетин, рутин, гиперозид и изорамнетин. Кверцетин является преобладающим флавоноидом в соцветиях и листьях S. aucuparia (1.11% сух. массы) [17, 18]. Количество кверцетина в плодах рябины – 0.51 мг/г [19].
Содержание антоцианов в плодах рябины обыкновенной составляет 13.6 мг/100 г свежих плодов, причем основными компонентами являются производные цианидина: 3-O-галактозида, 3-O-глюкозида, 3-O-арабинозида [20, 21].
ВОЗМОЖНЫЕ МЕХАНИЗМЫ ПРОТИВООПУХОЛЕВОГО ДЕЙСТВИЯ ПОЛИФЕНОЛЬНЫХ СОЕДИНЕНИЙ
В связи с широким спектром биологически активных веществ (БАВ), для части из которых известны свойства ингибировать развитие опухолей, это растение представляет большой интерес в качестве объекта исследования в экспериментальной онкологии с целью создания на его основе средств для дополнительной терапии пациентов со злокачественными новообразованиями.
Многочисленные исследования продемонстрировали противоопухолевую активность S. aucuparia. Так, использование этанольного экстракта из рябины оказывает значительное цитотоксическое действие в отношении клеток аденокарциномы толстого кишечника Caco-2. Выявлено, что водный экстракт, полученный из S. aucuparia, дозозависимо снижает жизнеспособность клеток Сасо-2 в МТТ-тесте при концентрациях >100 мкг/мл, тогда как в тесте SRB на сульфатредуцирующих бактериях такой же эффект можно наблюдать при концентрациях >500 мкг/мл [22]. Показано, что богатый полифенолами экстракт рябины снижает жизнеспособность клеток HeLa, полученных из опухоли шейки матки, примерно до 50% [23]. В экспериментах на мышах-самках линии С57ВL/6 с карциномой легких Льюис выявлено уменьшение массы первичной опухоли под влиянием фенолсодержащих комплексов плодов и листьев S. aucuparia, вводимых в дозах 1 и 5 мл/кг: торможение роста опухоли составило 12–27% [24].
Механизмом, приводящим к ингибиции роста опухолевых клеток, является нарушение их пролиферации и запуск апоптоза под действием БАВ, содержащихся в рябине. Так, фенольные соединения S. aucuparia способны модулировать многочисленные клеточные процессы путем повышения или понижения уровня ключевых белков, участвующих в клеточных сигнальных путях, которые контролируют пролиферацию, дифференцировку и апоптоз, что может обуславливать их противоопухолевый эффект [25, 26].
Снижение клеточной пролиферации обычно является результатом остановки клеточного цикла. Контроль клеточного цикла регулируется взаимодействиями между циклинами А, В и циклинзависимыми киназами (CDK), которые, в свою очередь, контролируются ингибиторами CDK (CDKIs), такими как p21, WAF1 и p27KIP1. Связывание циклинов с CDK приводит к образованию активного комплекса, который способствует прохождению клеточного цикла через различные стадии. CDKIs могут связываться с этим комплексом и дезактивировать его, тем самым останавливая клеточный цикл. Известно, что фенольные соединения вызывают повышенную экспрессию генов p21WAF1 и p27KIP1, а также снижают экспрессию генов циклина A и B, что приводит к снижению пролиферации и остановке клеточного цикла опухолевых клеток в G0/Gl и G2/S фазах [27]. Антоцианиды также способны регулировать клеточный цикл. Так, использование этих веществ прерывает клеточный цикл в G1 или G2 фазах, что может способствовать индукции апоптоза и ингибиции пролиферации [28].
Блокирование клеточной дифференцировки является одним из важных свойств неопластических клеток. Индукция дифференцировки опухолевых клеток представляет собой явление, при котором злокачественные трансформируются в нормальные и зрелые клетки под действием индукторов дифференцировки [29]. Природные антоцианы могут индуцировать терминальное созревание опухолевых клеток и блокировать онкогенез. Показано, что цианидин-3-O-β-глюкопиранозид может индуцировать дифференцировку клеточной линии острого промиелоцитарного лейкоза человека HL-60 дозозависимым образом, активируя PI3K и PKC сигнальные пути [30].
Антоцианидиновые гликозиды (антоцианины), такие как дельфинидиновые и цианидиновые гликозиды, также индуцируют апоптоз в клетках HL-60 [31]. При исследовании соотношения “структура–активность” показано, что гидроксильные группы в кольце B придают молекуле антоцианидина более высокую проапоптотическую активность [32].
Основным механизмом действия антоцианов, выделенных из рябины обыкновенной, приводящим к запуску апоптоза опухолевых клеток, может быть влияние на окислительный JNK-опосредованный каспазный путь. Использование антоцианов может приводить к повышению уровня внутриклеточных активных форм кислорода, которые могут быть сенсором для активации JNK-пути, что приводит к экспрессии гена c-jun и активации каспазы-3. Таким образом, антоцианы могут запускать программу апоптотической смерти в опухолевых клетках через опосредованные окислительным стрессом сигнальные каскады JNK [32] (рис. 1).
Рис. 1.
Схема механизмов антиканцерогенного, противоопухолевого и противометастатического действия антоцианов. Примечание: АФК-активные формы кислорода; AP-1 – белок активатор 1; ERK – внеклеточная сигнально-регулируемая киназа; JNK – c-Jun NH2-концевая киназа; P38MAPK – p38 митоген-активируемая протеинкиназа; VEGF-R – рецептор фактора роста эндотелия сосудов; HIF-1α – фактор, индуцируемый гипоксией 1-альфа; ↓ – активация; ┴ – блокировка (по данным анализируемых литературных источников) [32, 38, 40]. Fig. 1. Scheme of the anticarcinogenic, antitumor and antimetastatic action of anthocyanins. Note: Канцероген – cancirogene; АФК – reactive oxygen species; AP-1 – protein activator 1; ERK – extracellular signal-regulated kinase; JNK – c-Jun N-H2‑terminal kinase; P38MAPK – p38 mitogen-activated protein kinases; Клеточная трансформация – cell transformation; Каспаза – caspase; Апоптоз – apoptosis; VEGFR, vascular endothelial growth factor receptor; гипоксия – hypoxia; HIF‑1α – hypoxia inducible factor 1-alpha; Ангиогенез – angiogenesis; Антиканцерогенное действие – anticancer activity; Противоопухолевое действие – antitumor activity; Противометастатическое действие – antimetastatic activity; ↓ – activation; ┴ – blocking (according to the analyzed literary sources) [32, 38, 40].
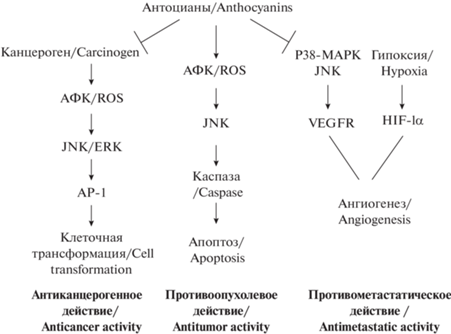
Белок-активатор 1 (AP-1) является фактором транскрипции и играет важную роль в стимулировании канцерогенеза [33]. Известно, что индукторами активности AP-1 могут быть эпидермальный фактор роста (EGF) и фактор некроза опухоли (TNF) альфа, которые активируют внеклеточную киназу, регулируемую сигналом (ERK), JNK или киназу р38. В результате включения AP-1 запускается неопластическая трансформация клеток путем активации MAPK [31]. В работе D.X. Hou с соавт. [34] показано, что антоцианы ингибируют транскрипционную активность AP-1 и клеточную трансформацию. Кроме того, авторами при изучении структурной активности данных БАВ выявлено, что для ингибирующего действия необходима орто-дигидроксифенильная структура на B-кольце антоцианидинов. Результаты анализа передачи клеточного сигнала показали, что антоцианы блокируют фосфорилирование ERK в ранние сроки и фосфорилирование JNK – в более поздние сроки [34], блокируют фосфорилирование киназы MAPK/ERK (MEK, киназа ERK), киназы SAPK/ERK (SEK, киназа JNK) и c-Jun (мишень фосфорилирования ERK и JNK) (рис. 1).
Помимо опухолевого роста, фенольные соединения, содержащиеся в рябине обыкновенной, могут ингибировать процесс инвазии и метастазирования опухолей. Так, при введении мышам с карциномой легких Льюис растительного комплекса плодов рябины в дозе 1 мл/кг количество метастазов в легких и их площадь оказались меньше в 1.8 и 3.3 раза при сравнении с показателями в группе нелеченых животных. При использовании фенолсодержащего комплекса цветков S. aucuparia число метастатических узлов достоверно снизилось в 2.4 (1 мл/кг) и 2.2 (5 мл/кг) раза, при этом площадь метастатического поражения уменьшилась в 5.8 и 3.6 раза соответственно. Экстракт листьев в дозе 5 мл/кг оказывал тормозящее влияние на развитие метастазов, уменьшая их количество (в 2.3 раза) и площадь (в 6.8 раза) по сравнению с показателями у мышей контрольной группы [24].
Ангиогенез является основным процессом, способствующим росту и метастазированию злокачественных новообразований. Процесс ангиогенеза контролируется многими цитокинами, из которых наиболее важным регуляторным фактором является фактор роста эндотелия сосудов VEGF. Следовательно, ингибирование рецептора ангиогенеза VEGF (VEGFR) может эффективно угнетать метастазирование опухолей [35, 36]. Известно, что фенольные соединения, в частности антоцианы способны ингибировать экспрессию VEGF в гладкомышечных клетках сосудов путем блокирования путей p38-MAPK и JNK [37] (рис. 1).
Гипоксия является общей патофизиологической характеристикой солидных злокачественных новообразований, способствующей индукции ангиогенеза в опухоли. Этот процесс в основном осуществляется при участии сигнального пути VEGF, опосредованного индуцируемым гипоксией фактором-1α (HIF-1α). Таким образом, ингибирование уровня белка HIF-1α может привести к снижению транскрипционной активности генов-мишеней HIF-1α, включая VEGF [38]. В экспериментах на крысах с индуцированным раком пищевода показано, что использование лиофилизированных антоцианов снижает экспрессию HIF-1α и VEGF и, следовательно, приводит к ингибированию ангиогенеза в опухоли [39] (рис. 1).
Инвазия и метастазирование являются главными проявлениями прогрессии опухоли, характерными для злокачественных новообразований, которые угрожают здоровью и жизни пациентов. Показано, что фенольные соединения могут эффективно ингибировать инвазию и метастазирование клеток рака молочной железы (BT474, MDA-MB231 и MCF-7) с высокой экспрессией ErbB2 путем блокирования пути ErbB2/cSrc/FAK [40, 41]. Обнаружено, что антоцианы могут снижать мембранную транслокацию PKCα и фосфорилирование STAT3 в клеточных линиях MCF-10 A, опосредованное фактором роста гепатоцитов, ингибировать ядерную транслокацию NF-κB/p65 и, таким образом, ингибировать инвазию клеток [35].
В табл. 1 представлены обобщенные данные о влиянии извлечений из S. aucuparia на пролиферацию опухолевых клеток in vitro и развитие перевиваемых опухолей in vivo.
Таблица 1.
Влияние извлечений из Sorbus aucuparia L. на пролиферацию опухолевых клеток in vitro и развитие перевиваемых опухолей in vivo Table 1. The effect of extracts from Sorbus aucuparia L. on the proliferation of tumor cells in vitro and the development of passaged tumors in vivo
| Вид извлечения Type of extraction |
Линия опухолевых клеток или штамм перевиваемой опухоли Tumor cell line or strain of the passaged tumor |
Примечание Note |
Ссылка
на литературу Reference |
|---|---|---|---|
| Водный экстракт Water extract |
Caco-2 | Дозозависимое цитотоксическое действие Dose-dependent cytotoxic effect |
23 |
| Этанольный экстракт, обогащенный полифенолами Ethanol extract enriched with polyphenols |
Hela | Снижение жизнеспособности клеток Reduction of cell viability |
24 |
| Этанольный экстракт Ethanol extract |
LLC | Противоопухолевое, антиметастатическое действие, повышение противометастатического
действия циклофосфана Antitumor, antimetastatic effect, increased anti-metastatic effect of cyclophosphane |
25 |
| Антоцианы Anthocyanins |
MCF-7, HCT-116 и HT-29, HL-60 | Запуск апоптоза Triggering of apoptosis |
26, 27, 32, 33 |
| Антоцианиды Anthocyanides |
Колоректальный рак Colorectal cancer |
Остановка клеточного цикла Blocking the cell cycle |
28 |
| Антоцианы Anthocyanins |
HL-60 | Индукция дифференцировки клеток Induction of cell differentiation |
31 |
| Антоцианы Anthocyanins |
BT474, MDA-MB231, MCF-7 | Блокировка инвазии и метастазирования Blocking invasion and metastasis |
41, 42 |
ЭКСПЕРИМЕНТАЛЬНЫЕ ДАННЫЕ О ВЛИЯНИИ РАСТИТЕЛЬНЫХ ЭКСТРАКТОВ ИЗ S. AUCUPARIA НА РАЗВИТИЕ ПЕРЕВИВАЕМЫХ ОПУХОЛЕЙ И ЭФФЕКТНОСТЬ ЦИТОСТАТИЧЕСКОЙ ТЕРАПИИ
В НИИФиРМ им. Е.Д. Гольдберга Томского НИМЦ выполнен цикл работ по исследованию комбинированного использования рябины обыкновенной совместно с цитостатическими препаратами с целью создания на ее основе средств для повышения эффективности и/или снижения токсического действия цитостатиков. Опубликованы данные результатов изучения химического состава фенолсодержащих комплексов из плодов, листьев, а также цветков S. aucuparia, полученных на кафедре фармацевтического анализа ФГБОУ ВО “Сибирский государственный медицинский университет” (г. Томск). Экстракты получали 95%-ным подкисленным этанолом методом динамической дробной мацерации. В эксперименте на животных растительные комплексы использовались в дозах 1 и 5 мл/кг per os. Показано, что лидирующим по содержанию суммы фенольных соединений является фенолсодержащий комплекс из плодов: содержание этих БАВ в сухом остатке превышало таковое в растительных комплексах листьев и цветков в 2.2 и 1.6 раза соответственно. Максимальное количество антоцианидинов и фенолокислот также регистрировалось в фенолсодержащем комплексе плодов, хотя в комплексе листьев и цветков они присутствовали в достаточном количестве для проявления фармакологических эффектов [24].
При оценке эффективности комбинированного использования трех растительных комплексов S. aucuparia из различных частей растения (листья, цветки, плоды) совместно с циклофосфаном отмечено существенное повышение противометастатического действия цитостатика. Так, у животных с карциномой легких Льюис, получавших фенолсодержащие комплексы плодов, листьев или цветков на фоне цитостатической терапии наблюдалось снижение количества и площади метастазов в легких. Включение в схему химиотерапии растительных комплексов плодов и цветков в дозах 1 и 5 мл/кг привело к достоверному снижению частоты метастазирования. При совместном использовании растительного комплекса из плодов с циклофосфаном частота метастазирования составила 20–38% против 90% у мышей группы монохимиотерапии, индекс ингибирования метастазирования достигал 99%. Если же совместно с цитостатиком вводили комплекс листьев в дозе 1 мл/кг, метастазы в легких мышей полностью отсутствовали [24]. Следует подчеркнуть, что наиболее эффективным оказалось применение в схеме химиотерапии экстракта на 95%-ном подкисленном этаноле. При изолированном назначении животным экстракта на 40%-ном этаноле ингибирующего влияния на развитие карциномы легких Льюис не отмечено, в то время как при использовании экстракта на 95%-ном подкисленном этаноле проявилось достоверное торможение роста первичной опухоли и метастазов [42].
Аналогичные результаты были получены на другой экспериментальной модели – рак легкого-67. При использовании фенолсодержащего комплекса плодов и листьев S. aucuparia совместно с циклофосфаном достоверно меньше оказались такие показатели процесса диссеминации, как количество и площадь метастазов в легких, частота метастазирования. Анализ индекса ингибирования метастазирования в % – интегрального показателя угнетения процесса диссеминации, позволил выстроить ряд его значений по мере увеличения противометастатического эффекта: 31 (листья, 1 мл/кг) < 38 (цветки, 5 мл/кг) < 53 (листья, 5 мл/кг) < 55 (плоды, 5 мл/кг) < 67 (цветки, 1 мл/кг) < 77 (плоды, 1 мл/кг) [24].
При изучении влияния оригинального высоконасыщенного антоцианами экстракта плодов S. aucuparia на развитие меланомы В-16 и эффективность лечения циклофосфаном показано его выраженное противоопухолевое действие при изолированном назначении. Важная роль в развитии этого эффекта принадлежит стимулирующему влиянию экстракта в отношении стромальных клеток-предшественников, что способствует повышению уровня организации опухолевой ткани в результате развития ее стромы. Так, отмечено существенное увеличение содержания стромальных (фибробластных) предшественников в опухолевом узле В-16 под воздействием разрабатываемого средства [43].
Известно, что у онкологических пациентов активированы процессы перекисного окисления липидов (ПОЛ), еще более возрастающие в процессе цитостатического лечения. Описанные эффекты растительных комплексов из S. aucuparia, скорее всего, связаны с антиоксидатным действием фенольных соединений: благодаря фенольной структуре и наличию гидроксильных групп в углеродных кольцах они напрямую связывают активные кислородные радикалы, вступая во взаимодействие с ними и приводя к стабилизации молекул, тем самым защищая ДНК здоровых клеток от повреждающего воздействия интермедиантов и продуктов перекисного окисления липидов [44, 45]. Напротив, в опухолевых клетках некоторые флавоноиды снижают активность антиоксидантных ферментов, что приводит к развитию окислительного стресса и способствует их апоптозу [46].
Помимо применения экстрактов из рябины обыкновенной для повышения эффективности противоопухолевой терапии известно их использование в качестве препаратов-корректоров с целью снижения побочных эффектов химиотерапии, в частности анемического синдрома.
В наших экспериментах на животных с опухолью обнаружено, что назначение антоциансодержащих комплексов из плодов S. aucuparia совместно с доксорубицином приводит к стимуляции процессов восстановления костномозгового кроветворения, в особенности эритроидного ростка. Так, на протяжении всего эксперимента наблюдалось повышение общей клеточности костного мозга, преимущественно за счет увеличения содержания эритроидных клеток. Кроме того, отмечено достоверное увеличение выхода КОЕ-Э под действием растительного комплекса в 5.4, 1.8 и 3.2 раза на 3, 5 и 10 сут соответственно после введения доксорубицина [47].
Таким образом, совокупность вышеперечисленных данных позволяет говорить о том, что S. aucuparia является перспективным сырьевым источником для создания на ее основе лекарственных средств дополнительной терапии пациентов со злокачественными новообразованиями, а богатая сырьевая база и низкая стоимость растительного сырья делают такого рода препараты экономически доступными для большинства нуждающихся больных.
Список литературы
Majolo F., de Oliveira Becker Delwing L.K., Marmitt D.J., Bustamante-Filho I.C., Goettert M.I. 2019. Medical plants and bioactive natural compounds for cancer treatment: Important advances for drag discovery. – Phytochem. Lett. 31: 196–207. https://doi.org/10.1016/j.phytol.2019.04.003
Singh J., Metrani R., Shivanagoudra S.R., Jayaprakasha G.K., Patil B.S. 2019. Review on bile acids: Effects of the gut microbiome, interactions with dietary fiber, and alterations in the bioaccessibility of bioactive compounds. – J. Agric. Food Chem. 67: 9124–9138. https://doi.org/10.1021/acs.jafc.8b07306
Fomenko S.E., Kushnerova N.F., Sprygin V.G., Drugova E.S., Momot T.V. 2016. Chemical composition and biological action of rowanberry extract. – Russ. J. Bioorg. Chem. 42: 764–769. https://doi.org/10.1134/S1068162016070074
Государственный реестр лекарственных средств. 2013. Т. 1. М.: Минздрав России, Фонд фармацевтической информации.
Государственная Фармакопея российской федерации. 2018. Т. IV. 14-е изд. М. 7019 с.
Злобин А.А., Мартинсон Е.А., Литвинец С.Г., Овечкина И.А., Дурнев Е.А., Оводова Р.Г. 2011. Пектиновые полисахариды рябины обыкновенной Sorbus aucuparia L. – Химия растит. сырья. 1: 39–44. https://www.elibrary.ru/item.asp?id=15859168
Sarv V., Venskutonis P.R., Bhat R. 2020. The Sorbus spp. – underutilised plants for foods and nutraceuticals: review on polyphenolic phytochemicals and antioxidant potential. – Antioxidants (Basel). 9(9): 813. https://doi.org/10.3390/antiox9090813
Никифорова А.Г., Скочилова Е.А., Мухаметова С.В. 2022. Содержание органических кислот и каротиноидов в плодах рябины (Sorbus). – Сельское хозяйство. 1: 1–9. https://doi.org/10.7256/2453-8809.2022.1.37915
Aslantas R., Pirlak L., Güleryüz M. 2007. The nutritional value of wild fruits from the North Eastern Anatolia region of Turkey. – Asian J. Chem. 19(4): 3072–3078. https://asianjournalofchemistry.co.in/user/journal/viewarticle.aspx?ArticleID=19_4_87
Mrkonjić Z.O., Nađpal J., Beara I., Sabo V.A, Četojević-Simin D., Mimica-Dukić N., Lesjak M. 2017. Phenolic profiling and bioactivities of fresh fruits and jam of Sorbus species. – J. Serbian Chemical. Soc. 82(6): 651–664. https://doi.org/10.2298/JSC170202049M
Yang B., Ahotupa M., Määttä P., Kallio H. 2011. Composition and antioxidative activities of supercritical CO2-extracted oils from seeds and soft parts of northern berries. – Food Research. International. 44(7): 2009–2017. https://doi.org/10.1016/j.foodres.2011.02.025
Berņa E., Kampuse S. 2011. The Marmalades of Sweet Rowanberries As an Example of a Functional Food. – In Proceedings of the 7th International Congress of Food Technologists, Biotechnologists and Nutritionists, Opatija, Croatia, 20–23 September: 112–120. https://www.bib.irb.hr/658329/download/658329.PROCEEDINGS_2011.pdf
Гостищев И.А., Дейнека В.И., Анисимович И.П., Третьяков М.Ю., Мясникова П.А., Дейнека Л.А., Сорокопудов В.Н. 2010. Каротиноиды, хлорогеновые кислоты и другие природные соединения плодов рябины. – Научные ведомости БелГУ. Естественные науки. 3(74): 83–92. https://www.elibrary.ru/item.asp?id=17423762
Абдуллина Р.Г., Пупыкина К.А., Денисова С.Г., Пупыкина В.В. 2021. Биохимический состав плодов некоторых представителей рода Sorbus L. коллекции Южно-Уральского ботанического сада. – Химия растит. сырья. 3: 235–243. https://doi.org/10.14258/jcprm.2021037601
Olszewska M.A., Presler A., Michel P. 2012. Profiling of phenolic compounds and antioxidant activity of dry extracts from the selected Sorbus species. – Molecules. 17: 3093–3113. https://doi.org/10.3390/molecules17033093
Kylli P., Nohynek L., Puupponen-Pimiä R., Westerlund-Wikström B., Steawart D., Heinonen M. 2010. Rowanberry phenolics: Compositional analysis and bioactivities. – J. Agric. Food Chem. 58(22): 11985–11992. https://doi.org/10.1021/jf102739v
Olszewska M. 2008. Separation of quercetin, sexangularetin, kaempferol and isorhamnetin for simultaneous HPLC determination of flavonoid aglycones in inflorescences, leaves and fruits of three Sorbus species. – J. Pharm. Biomed. Anal. 48(3): 629–635. https://doi.org/10.1016/j.jpba.2008.06.004
Olszewska M.A., Nowak S., Michel P., Banaszczak P., Kicel A. 2010. Assessment of the content of phenolics and antioxidant action of inflorescences and leaves of selected species from the genus Sorbus sensu stricto. – Molecules. 15(12): 8769–8783. https://doi.org/10.3390/molecules15128769
Olszewska M.A., Michel P. 2009. Antioxidant activity of inflorescences, leaves and fruits of three Sorbus species in relation to their polyphenolic composition. – Nat. Prod. Res. 23(16): 1507–1521. https://doi.org/10.1080/14786410802636177
Koponen J.M., Happonen A.M., Mattila P.H., Törrönen A.R. 2007. Contents of anthocyanins and ellagitannins in selected foods consumed in Finland. – J. Agric. Food Chem. 55(4): 1612–1619. https://doi.org/10.1021/jf062897a
Hukkanen A.T., Pölönen S.S., Kärenlampi S.O., Kokko H.I. 2006. Antioxidant capacity and phenolic content of sweet rowanberries. – J. Agric. Food Chem. 54(1): 112–119. https://doi.org/10.1021/jf051697g
Bobinaitė R., Grootaert C., Van Camp J., Šarkinas A., Liaudanskas M., Žvikas V., Viškelis P., Venskutonis P.R. 2020. Chemical composition, antioxidant, antimicrobial and antiproliferative activities of the extracts isolated from the pomace of rowanberry (Sorbus aucuparia L.). – Food Res. Int. 136: 109310. https://doi.org/10.1016/j.foodres.2020.109310
Sołtys A., Galanty A., Podolak I. 2020. Ethnopharmacologically important but underestimated genus Sorbus: A comprehensive review. – Phytochem. Rev. 19(2): 491–526. https://doi.org/10.1007/s11101-020-09674-9
Рыбалкина О.Ю., Разина Т.Г., Киселева Е.А., Калинкина Г.И., Исайкина Н.В., Зуева Е.П., Жданов В.В. 2022. Оценка эффективности использования фенолсодержащих комплексов из различных частей рябины обыкновенной (Sorbus aucuparia L.) в онкологическом эксперименте. – Биомедицина. 18(4): 74–85. https://doi.org/10.33647/2074-5982-18-4-74-85
Ramos S. 2007. Effects of dietary flavonoids on apoptotic pathways related to cancer chemoprevention. – J. Nutr. Biochem. 18(7): 427–442. https://doi.org/10.1016/j.jnutbio.2006.11.004
Surh Y.J. 2003. Cancer chemoprevention with dietary phytochemicals. – Nat. Rev. Cancer. 3(10): 768–780. https://doi.org/10.1038/nrc1189
Brown E.M., Gill C.I., McDougall G.J., Stewart D. 2012. Mechanisms underlying the anti-proliferative effects of berry components in in vitro models of colon cancer. – Curr. Pharm. Biotechnol. 13(1): 200–209. https://doi.org/10.2174/138920112798868773
Cooke D., Steward W.P., Gescher A.J., Marczylo T. 2005. Anthocyans from fruits and vegetables does bright color signal cancer chemopreventive activity? – Eur. J. Cancer. 41(13): 1931–1940. https://doi.org/10.1016/j.ejca.2005.06.009
Charepalli V., Reddivari L., Radhakrishnan S., Vadde R., Agarwal R., Vanamala J.K.P. 2015. Anthocyanin-containing purple-fleshed potatoes suppress colon tumorigenesis via elimination of colon cancer stem cells. – J. Nutr. Biochem. 26(12): 1641–1649. https://doi.org/10.1016/j.jnutbio.2015.08.005
Fimognari C., Berti F., Nusse M., Cantelli-Forti G., Hrelia P. 2004. Induction of apoptosis in two human leukemia cell lines as well as differentiation in human promyelocytic cells by cyanidin-3-O-β-glucopyranoside. – Biochem. Pharmacol. 67(11): 2047–2056. https://doi.org/10.1016/j.bcp.2004.02.021
Hou D.X., Fujii M., Norihiko Terahara N., Yoshimoto M. 2004. Molecular mechanisms behind the chemopreventive effects of anthocyanidins. – J. Biomed. Biotechnol. 5: 321–325. https://doi.org/10.1155/S1110724304403040
Hou D.X., Ose T., Lin S., Harazoro K., Imamura I., Kubo M., Uto T., Terahara N., Yoshimoto M., Fujii M. 2003. Anthocyanidins induce apoptosis in human promyelocytic leukemia cells: structure–activity relationship and mechanisms involved. – Int. J. Oncol. 23(3): 705–712. https://doi.org/10.3892/ijo.23.3.705
Hsu T.C., Young M.R., Cmarik J., Colburn N.H. 2000. Activator protein 1 (AP-1)- and nuclear factor kappa B (NF-kappaB)-dependent transcriptional events in carcinogenesis. – Free Radic. Biol. Med. 28(9): 1338–1348. https://doi.org/10.1016/s0891-5849(00)00220-3
Hou D.X., Kai K., Li J.J., Lin S., Terahara N., Wakamatsu M., Fujii M., Young M.R., Colburn N. 2004. Anthocyanidins inhibit activator protein 1 activity and cell transformation: structure-activity relationship and molecular mechanisms. – Carcinogenesis. 25(1): 29–36. https://doi.org/10.1093/carcin/bgg184
Chen X.Y., Zhou J., Luo L.P., Han B., Li F., Chen J.Y., Zhu Y.F., Chen W., Yu X.P. 2015. Black rice anthocyanins suppress metastasis of breast cancer cells by targeting RAS/RAF/MAPK pathway. – Biomed. Res. Int. 2015: 414250. https://doi.org/10.1155/2015/414250
Lin B.W., Gong C.C., Song H.F., Cui Y.Y. 2017. Effects of anthocyanins on the prevention and treatment of cancer. – Br. J. Pharmacol. 174(11): 1226–1243. https://doi.org/10.1111/bph.13627
Oak M.H., Bedoui J.E., Madeira S.V., Chalupsky K., Schini-Kerth V.B. 2006. Delphinidin and cyanidin inhibit PD-GFAB-induced VEGF release in vascular smooth muscle cells by preventing activation of p38 MAPK and JNK. – Br. J. Pharmacol. 149(19): 283–290. https://doi.org/10.1038/sj.bjp.0706843
Huang L., Zhang Z., Zhang S., Ren J., Zhang R., Zeng H., Li Q., Wu G. 2011. Inhibitory action of Celastrol on hypoxia-mediated angiogenesis and metastasis via the HIF-1α pathway. – Int. J. Mol. Med. 27(3): 407–415. https://doi.org/10.3892/ijmm.2011.600
Wang L.S., Hecht S.S., Carmella S.G., Yu N., Larue B., Henry C., McIntyre C., Rocha C., Lechner J.F., Stoner G.D. 2009. Anthocyanins in black raspberries prevent esophageal tumors in rats. – Cancer Prev. Res. (Phila). 2(1): 84–93. https://doi.org/10.1158/1940-6207.CAPR-08-0155
Li X., Xu J., Tang X., Liu Y., Yu X., Wang Z., Liu W. 2016. Anthocyanins inhibit trastuzumab-resistant breast cancer in vitro and in vivo. – Mol. Med. Rep. 13(5): 4007–4013. https://doi.org/10.3892/mmr.2016.4990
Xu M., Bower K.A., Wang S., Frank J.A., Chen G., Ding M., Wang S., Shi X., Ke Z., Luo J. 2010. Cyanidin-3-glucoside inhibits ethanol-induced invasion of breast cancer cells overexpressing ErbB2. – Mol. Cancer. 9: 285. https://doi.org/10.1186/1476-4598-9-285
Исайкина Н.В., Калинкина Г.И., Разина Т.Г., Зуева Е.П., Рыбалкина О.Ю., Ульрих А.В., Федорова Е.П., Шилова А.Б. 2017. Плоды рябины обыкновенной (Sorbus aucuparia) как источник средства для повышения эффективности химиотерапии опухолей. – Химия растит. сырья. 4: 165–173. https://www.elibrary.ru/item.asp?id=30755121
Разина Т.Г., Зуева Е.П., Ульрих А.В., Рыбалкина О.Ю., Чайковский А.В., Исайкина Н.В., Калинкина Г.И., Жданов В.В., Зюзьков Г.Н. 2016. Противоопухолевые эффекты оригинального высоконасыщенного антоцианами экстракта рябины обыкновенной и механизмы их развития. – Бюл. экспериментальной биологии и медицины. 162(7): 107–112. https://elibrary.ru/item.asp?id=26330283
Heim K.E., Tagliaferro A.R., Bobilya D.J. 2002. Flavonoid antioxidants: chemistry, metabolism and structure-activity relationships. – J. Nutr Biochem. 13(10): 572–584. https://doi.org/10.1016/S0955-2863(02)00208-5
Wang S.Y., Jiao H. 2000. Scavenging capacity of berry crops on superoxide radicals, hydrogen peroxide, hydroxyl radicals and singlet oxygen. – J. Agric. Food Chem. 48(11): 5677–5684. https://doi.org/10.1021/jf000766i
Тараховский Ю.С., Ким Ю.А., Абдрасилов Б.С., Музафаров Е.Н. 2013. Флавоноиды: биохимия, биофизика, медицина. Пущино. С. 310.
Рыбалкина О.Ю., Федорова Е.П., Чайковский А.В., Разина Т.Г., Калинкина Г.И., Исайкина Н.В., Киселева Е.А., Зуева Е.П., Жданов В.В. 2022. Эритропоэзстимулирующие свойства антоциансодержащего комплекса из Sorbus aucuparia L. при цитостатическом анемическом синдроме у мышей с карциномой легких Льюис. – Бюл. экспериментальной биологии и медицины. 2022. 173(2): 171–176. https://doi.org/10.47056/0365-9615-2022-173-2-171-176
Дополнительные материалы отсутствуют.
Инструменты
Растительные ресурсы


