Записки Российского минералогического общества, 2021, T. 150, № 3, стр. 114-129
Условия формирования сульфидной минерализации месторождения Бодороно (Южная Якутия): термодинамический аспект
д. члены В. Н. Кардашевская 1, *, Н. И. Пономарева 2
1 Институт геологии алмаза и благородных металлов СО РАН
677980 Якутск, просп. Ленина, 39, Республика Саха (Якутия), Россия
2 Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Университетская наб., 7/9, Россия
* E-mail: kardashevskaya92@mail.ru
Поступила в редакцию 07.09.2020
После доработки 19.03.2021
Принята к публикации 14.04.2021
Аннотация
В статье приведены оценки параметров среды минералообразования золоторудного месторождения Бодороно (Южная Якутия), выполненные с использованием расчетных методов химической термодинамики. Расчеты произведены для каждой выделенной на месторождении минеральной ассоциации с учетом температур, давлений и состава флюидных включений, полученных в результате термобарогеохимических исследований кварца.
Месторождение Бодороно расположено в верховьях руч. Алгома в пределах Нерюнгринского района Республики Саха (Якутия) и является новым и малоизученным объектом на территории Алдано-Станового щита. Прогнозные ресурсы месторождения по оценке АО “Якутскгеология” составляют 60 т (Р1 + Р2 + Р3).
Геологическое строение, минералогия руд и условия их образования были охарактеризованы в ранее опубликованных работах (Анисимова, Соколов, 2014; Кардашевская и др., 2020). Проведенные исследования позволили установить, что руды месторождения относятся к убого-сульфидному золото-кварцевому типу с совмещенной теллуридно-висмутовой минерализацией в ассоциации с самородным золотом. Необходимость дальнейшего детального изучения месторождения обусловлена тем, что выявленный тип оруденения является нетрадиционным для Алдано-Станового щита. В предлагаемой статье приводятся новые данные о физико-химических параметрах процессов рудообразования.
Месторождение Бодороно приурочено к стыку Тыркандинской тектонической зоны и зоны Станового разлома (Анисимова, Соколов, 2014). Территория месторождения сложена толщей переслаивания архейских основных кристаллических сланцев, гранито-гнейсов, гнейсов (метабазитов), диопсидовых кальцифиров и гранат-кварц-полевошпатовых пород (гранулитов). Толща прорывается раннемеловыми дайками долеритов-диоритовых порфиритов, лампрофиров. В местах наибольшей тектонической подвижности наблюдается милонитизация и рассланцевание вмещающих пород в контакте с вмещающими пучками разлинзованных даек, встречаются хлорит-кварцевые, карбонат-хлорит-кварцевые жилы.
На месторождении выделены три рудные зоны, которые представлены кварцевыми жилами и прожилками и различаются по вещественному составу руд. Во всех трех рудных зонах встречается прожилково-вкрапленная висмут-теллуровая минерализация (тетрадимит, лиллианит, хедлейит). Рудные тела имеют линзовидную форму. Размеры жил составляют 0.1–1.2 м, протяженность – до 2 км.
МИНЕРАЛЬНЫЕ АССОЦИАЦИИ
Изучение текстурно-структурных особенностей, взаимоотношений и пересечений минеральных агрегатов в кварцевых жилах и прожилках позволило выделить три рудные ассоциации: пирит-пирротиновую, золото-полиметаллическую (галенит-сфалерит) и золото-теллур-висмутовую (Кардашевская и др., 2020).
Главный жильный минерал – кварц. В ходе детального петрографического изучения было выделено 3 разновидности этого минерала. Кварц I – рыжевато-белый, крупнозернистый, непрозрачный с налетами гидроокислов железа. С кварцем I связана пирит-пирротиновая ассоциация. Кварц II – серо-белый, крупно-среднезернистый, образует аллотриоморфнозернистые полупрозрачные агрегаты, с ним связана золото-полиметаллическая ассоциация. Кварц III – желтоватый, сахаровидный, местами друзовидный, полупрозрачный. С кварцем III связана золото-теллур-висмутовая ассоциация.
Пирит-пирротиновая ассоциация встречается во всех трех рудных зонах. Основным минералом ассоциации является пирит I. Кроме того, присутствуют пирротин, халькопирит, гематит, в небольшом количестве установлены глаукодот и кобальтин. Пирит I образует в кварце катаклазированные и корродированные кристаллы в ассоциации с идиоморфными выделениями пирротина (рис. 1, а). Пирротин представлен скелетными формами выделений и реже срастается с халькопиритом. Гематит образует мелкие выделения в кварце I, иногда замещает пирит.
Рис. 1.
Характер выделения минералов в рудах месторождения Бодороно. а – пирит-пирротиновая ассоциация. Метакристалл пирита в срастании со скелетным агрегатом пирротина и халькопирита в кварце I; б – золото-полиметаллическая ассоциация. Взаимоотношение галенита, сфалерита и самородного золота в кварце II; в, г – золото-теллур-висмут-кварцевая ассоциация: замещение теллуровисмутита смитсонитом в кварце III (в), пористое самородное золото в кварце III (г). Py – пирит, Po – пирротин, Ccp – халькопирит, Gn – галенит, Sp – сфалерит, Tb – теллуровисмутит, Sm – смитсонит, Au – самородное золото, Qz – кварц. Fig. 1. Minerals in ores of the Bodorono deposit. а – pyrite-pyrrhotite association. Metacrystal of pyrite, inter-growing with skeletal pyrrhotite-chalcopyrite aggregate, in quartz I; б – gold-polymetallic association, relationship of galena, sphalerite and native gold in quartz II; в, г – gold-tellurium-bismuth-quartz association. Q – quartz, Py – pyrite, Po – pyrrhotite, Gn – galena, Sp – sphalerite, Tb – tellurobismuthite, Tdm – tetradimite, Hed – hedleyite, Plz – pilsenite, Au – native gold.

Золото-полиметаллическая (галенит-сфалеритовая) ассоциация развита в 1-й и 3-й рудных зонах. Минералы данной ассоциации представлены галенитом, сфалеритом, самородным золотом, реже встречаются халькопирит, пирит II. Пирит II наблюдается в виде почковидных агрегатов. Он встречается совместно с халькопиритом, который образует редкие идиоморфные выделения. Галенит в срастании со сфалеритом и реже с пиритом II образуют скопления в кварце. Вокруг галенита отмечены каемки англезита и церуссита. Эти же минералы присутствуют в кварце в качестве минеральных включений. В рудной зоне 1 в кварце II выявлен анкерит. Самородное золото в этой ассоциации образует выделения неправильной формы в галените (рис. 1, б). Пробность его находится в интервале 853–861‰.
Золото-теллур-висмутовая ассоциация встречается во всех трех рудных зонах. Она приурочена к кварцу III, который образует прозрачные и полупрозрачные желто-белые сахаровидные кристаллы. Минералы данной ассоциации представлены теллуровисмутитом, висмутином, самородным висмутом, самородным золотом, реже лиллианитом, тетрадимитом, пильзенитом и хедлейитом. Теллуровисмутит встречается в виде идиоморфных выделений в кварце III, местами замещается хедлейитом и смитсонитом, иногда в нем встречаются включения самородного висмута (рис. 1, в). Для тетрадимита характерны ксеноморфные выделения в ассоциации с хедлейитом, образующим вокруг него каемки. Лиллианит образует совместные срастания с самородным золотом, реже встречается самостоятельно и замещается смитсонитом. Самородное золото чаще всего образует самостоятельные выделения в кварце III (рис. 1, г). Пробность золота варьирует в пределах 663–993‰.
ОЦЕНКА ФИЗИКО-ХИМИЧЕСКИХ ПАРАМЕТРОВ ОБРАЗОВАНИЯ РУД
Результаты исследования флюидных включений. Изучение флюидных включений (ФВ) проводилось на кафедре минералогии СПбГУ в термокамере, установленной на микроскопе ПОЛАМ Р-211, а также в РЦ “Геомодель” на оптическом микроскопе Olympus BX53F в комплекте с термостоликом THMSG-600-ec.
Флюидные включения изучались в кварце из золото-полиметаллической и золото-теллур-висмутовой ассоциаций. Поскольку кварц I, к которому приурочена пирит-пирротиновая ассоциация, непрозрачен, в нем не удалось обнаружить ФВ.
Кварц II из золото-полиметаллической ассоциации содержит флюидные включения, температура гомогенизации которых варьирует в интервале от 270–300 °С. Оценки давления, полученные по углекислотно-водным включениям, составляют 0.8–1 кбар (рис. 2).
Рис. 2.
Температуры гомогенизации флюидных включений в кварцах из золотоносных ассоциаций месторождения Бодороно. Fig. 2. Temperatures of homogenization of fluid inclusions in quartz from gold-bearing associations of the Bodorono deposit.
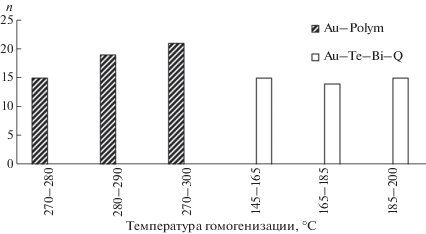
В кварце III из золото-теллур-висмутовой ассоциации температура гомогенизации ФВ составила 145‒200 °С (рис. 2). Давление, оцененное по углекислотно-водным включениям, лежит в интервале 0.4‒0.6 кбар.
Состав газовой фазы флюидных включений в кварце из двух продуктивных ассоциаций анализировался на рамановском спектрометре Horiba LabRam Jobin-Yvon HR800 (РЦ СПбГУ “Геомодель”, аналитик В.Н. Бочаров). В составе газовой фазы включений в кварце золото-полиметаллической ассоциации определены CН4 и CO2, а жидкая фаза представлена H2O.
Во флюидных включениях в кварце золото-теллур-висмутовой ассоциации в газовой фазе присутствуют CO2, N2 и CH4. Идентификация состава газовых фаз производилась по рамановским спектрам, приведенным в работе M. Фрезотти и соавторов (Frezotti at al., 2012).
Анализ минеральных равновесий. Оценка параметров среды минералообразования выполнена на основе расчетных методов химической термодинамики (Николаев, Доливо-Добровольский, 1961; Гаррелс, Крайст, 1968; Говоров, 1977; Булах, Кривовичев, 1985) с помощью оригинальной программы, написанной одним из авторов в Visual Basic for Application.
Оценка кислотности–щелочности и окислительно-восстановительного потенциала минералообразующих растворов проведена для минералов пирит-пирротиновой, золото-полиметаллической и золото-теллур-висмутовой ассоциаций с учетом установленного температурного режима, давления и данных по составу минеральных и флюидных включений.
В литературных источниках приведены расчеты параметров среды минералообразования для аналогичных месторождений (Некрасов, 1991; Бортников и др., 1996; Журавкова и др., 2019; Плотинская и др., 2020), однако они выполнены для реакций с участием газообразного теллура и газообразной серы. Следует отметить, что Те2 (газ) и S2 (газ) не обнаружены в наших исследованиях; они также отсутствуют и в многочисленных анализах флюидных включений в опубликованных работах (Прокофьев и др., 2020). Кроме того, ни в одной из указанных выше работ не определены щелочность–кислотность и окислительно-восстановительный потенциал минералообразующих растворов.
Рассматриваемые нами реакции протекают в водной среде с участием простых и сложных ионов, в том числе и теллурсодержащих компонентов, при этом учитываются возможные их формы нахождения.
Принятые при составлении уравнений химических реакций допущения обоснованы в опубликованных ранее работах (Пономарева, Гордиенко, 1991; Пономарева, Кривовичев, 2004). Термодинамические константы минералов и компонентов гидротермальных растворов, использованные при расчетах изобарных потенциалов химических реакций, взяты из справочников (Наумов и др., 1971; Robie, Hemingway, 1995), а также рассчитаны по известным методикам (Ермолаев, 1966; Наумов и др., 1971; Говоров, 1977).
Оценка условий формирования минералов пирит-пирротиновой ассоциации выполнена для 300 °С и 1 кбар (Кардашевская и др., 2020). Уравнения реакций и их окислительно-восстановительные потенциалы приведены в табл. 1. На рис. 3 показаны построенные Eh–pН диаграммы с полями устойчивости пирита, пирротина и гематита, зависящими от активности суммарной серы. Поле устойчивости пирита лежит в довольно широком интервале рН и в области значений Еh = ~0.1–0.5 В при рН = 0 и Еh = ~(–0.4)...(–0.6) В при рН = 7. Таким образом, оно заметно сужается с уменьшением кислотности среды. Точка тройного равновесия пирит–пирротин–гематит соответствует pH = ~7.8 при активности суммарной серы, равной 10–2, и рН = 6.8 при активности суммарной серы, равной 10–3 . Сравнение рис. 3, а и 3, б свидетельствует о том, что уменьшение активности суммарной серы приводит к смещению точки тройного равновесия в сторону уменьшения рН и к заметному сокращению области существования пирита. Следует отметить, что дальнейшее уменьшение активности суммарной серы обусловливает существование только оксидов железа.
Таблица 1.
Уравнения реакций и их окислительно-восстановительные потенциалы в зависимости от pH водного раствора для пирит-пирротиновой ассоциации при 300 °С Table 1. Chemical equations and their redox potential (Eh) depending on pH of water solution for the pyrite-pyrrhotite-quartz assemblage at 300 °С
| pH | ||||
|---|---|---|---|---|
| Уравнения реакций | Eh, В | |||
| 0 | 5.8 | 6.8 | 13 | |
| H2S + 4H2O = ${\text{SO}}_{4}^{{2 - }}$+ 10H+ + 8e | 0.521 | 0.237 | –0.303 | –0.442 |
| H2S + 4H2O = ${\text{HSO}}_{4}^{ - }$ + 9H+ + 8e | 0.439 | 0.180 | –0.303 | –0.428 |
| HS– + 4H2O = ${\text{SO}}_{4}^{{2 - }}$ + 9H+ + 8e | 0.425 | 0.169 | –0.317 | –0.442 |
| FeS + H2S = FeS2 + 2H+ + 2e | 0.192 | –0.036 | –0.468 | –0.579 |
| FeS + HS– = FeS2 + H++ 2e | –0.193 | –0.310 | –0.523 | –0.579 |
| 2FeS2 + 19H2O = Fe2O3 + ${\text{4HSO}}_{4}^{ - }$ +34H++ 30e | 0.454 | 0.197 | –0.293 | –0.419 |
| Fe2O3 + 4HS– + 2H+ = 2FeS2 + 3H2O + 2e | –1.330 | –1.103 | –0.671 | –0.559 |
| 2FeS2 + 19H2O = Fe2O3 + ${\text{4SO}}_{4}^{{2 - }}$ +38H++30e | 0.542 | 0.254 | –0.293 | –0.434 |
| 2FeS + 3H2O = Fe2O3 + 4H + 2HS– + 2e | 0.943 | 0.489 | –0.376 | –0.599 |
| 3FeS + 4H2O = FeFe2O4+3H2S + 2H+ + 2e | 0.255 | 0.027 | –0.405 | –0.516 |
| 3FeS + 4H2O = FeFe2O4+3HS– + 5H++2e | 1.410 | 0.842 | –0.238 | –0.517 |
| 2FeFe2O4 + H2O = 3Fe2O3+2H+ + 2e | 0.009 | –0.218 | –0.650 | –0.762 |
| Уравнения реакций и их рН, не зависящие от Eh | ||||
| ${\text{HSO}}_{4}^{ - }$= ${\text{SO}}_{4}^{{2 - }}$+ H+ | 5.8 | |||
| H2S = HS– + Н+ | 6.8 | |||
Рис. 3.
Eh–pH диаграммы с полями устойчивости пирита, пирротина и гематита при 300 °С и различной суммарной активности серы: аΣS = 10–2 (а), аΣS = 10–3 (б). Кружком обведена точка тройного равновесия пирит–пирротин–гематит. Fig. 3. Eh–pH plots with fields of stability of pyrite, pyrrhotite, and hematite at 300 °C and different summary activity of sulfur: аΣS = 10–2 (а), аΣS = 10–3 (б). Circle marks the point of triple equilibrium of pyrite–pyrrhotite–hematite.
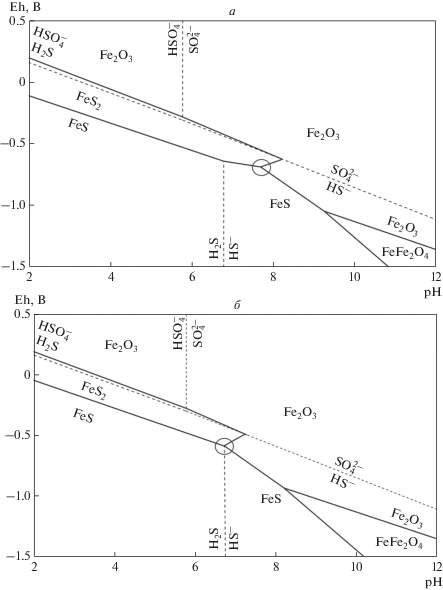
Таким образом, формирование пирит-пирротиновой ассоциации происходит при рН = 6.8–7.8, Еh = (–0.5)...(–0.7) В и аΣS = 10–3–10–2.
Расчет равновесий минералов золото-полиметаллической ассоциации выполнен для тех же условий (300 °С, 1 кбар). Как отмечалось выше, эта ассоциация представлена галенитом, сфалеритом, самородным золотом, реже халькопиритом и пиритом. При анализе минеральных равновесий было учтено, что газовая фаза обогащена СО2 и содержит СН4, а в виде минеральных включений в кварце установлены церуссит, англезит и анкерит. Уравнения реакций минералов этой ассоциации и их окислительно-восстановительные потенциалы приведены в табл. 2. Соотношение полей их устойчивости показано на рис. 4–6, при этом диаграмма на рис. 4 иллюстрирует поля существования минералов свинца и цинка, на рис. 5 дана диаграмма для минералов железа и меди, а на рис. 6 приведена сводная диаграмма для минералов золото-полиметаллической ассоциации.
Таблица 2.
Уравнения реакций и их окислительно-восстановительные потенциалы в зависимости от pH раствора для золото-полиметаллической ассоциации при 300 °С Table 2. Chemical equations and their redox potential (Eh) depending on pH of water solution for the gold-polymetallic assemblage at 300 °С
| pH | ||||
|---|---|---|---|---|
| Уравнения реакций | Eh, В | |||
| 0 | 5 | 7 | 9 | |
| PbS + 4H2O = PbSO4 + 8H+ + 8e | 0.420 | 0.192 | –0.149 | –0.376 |
| PbS + 4H2O = Pb2+ + 7H+ + ${\text{HSO}}_{4}^{ - }$ + 8e | 0.375 | 0.176 | –0.123 | –0.322 |
| PbS + H2CO3 + 4H2O = PbCO3 + 9H+ + ${\text{HSO}}_{4}^{ - }$+ 8e | 0.515 | 0.259 | –0.125 | –0.381 |
| PbS + H2CO3 + 4H2O = PbCO3 + 10H+ + ${\text{SO}}_{4}^{{2 - }}$+ 8e | 0.597 | 0.313 | –0.114 | –0.398 |
| ZnS + H2CO3 + 4H2O = ZnCO3 + ${\text{HSO}}_{4}^{ - }$ + 9H+ + 8e | 0.522 | 0.266 | –0.117 | –0.373 |
| ZnS + H2CO3 + 4H2O = ZnCO3 + ${\text{HSO}}_{4}^{ - }$+ 9H+ + 8e | 0.522 | 0.266 | –0.117 | –0.373 |
| ZnS + 4H2O = Zn2+ + 7H+ + ${\text{HSO}}_{4}^{ - }$+ 8e | 0.372 | 0.173 | –0.126 | –0.325 |
| 9.5H2O + CuFeS2 = 0.5Cu2O + FeOH + ${\text{2HSO}}_{4}^{ - }$+ 16H + 15e | 0.444 | 0.201 | –0.163 | –0.405 |
| 9.5H2O + CuFeS2 = 15e + 18H + 0.5Cu2O + FeOH + 2SO4 | 0.531 | 0.258 | –0.151 | –0.424 |
| Cu + FeOH+ + 2H2S = H2O + CuFeS2 + 3H+ + 2e | 0.416 | 0.075 | –0.437 | –0.778 |
| Cu + FeOH+ + 2HS = H2O + CuFeS2 + H + 2e | –0.354 | –0.468 | –0.639 | –0.752 |
| Cu + FeOH + 2HS = H2O + CuFeS2 + H + 2e | –0.354 | –0.468 | –0.639 | –0.752 |
| FeS + HS– = FeS2 + H+ + 2e | –0.193 | –0.310 | –0.523 | –0.579 |
| FeS + H2S = FeS2 + 2H+ + 2e | 0.192 | –0.036 | –0.468 | –0.579 |
| 2FeS2 + 19H2O = Fe2O3 + ${\text{4HSO}}_{4}^{ - }$ + 34H+ + 30e | 0.454 | 0.197 | –0.293 | –0.419 |
| Fe2O3 + 4HS– + 2H+ = 2FeS2 + 3H2O + 2e | –1.330 | –1.103 | –0.671 | –0.559 |
| 2FeS2 + 19H2O = Fe2O3 + $4{\text{SO}}_{4}^{{2 - }}$+ 38H+ + 30e | 0.542 | 0.254 | –0.293 | –0.434 |
| 2FeS + 3H2O = Fe2O3 + 4H+ + 2HS– + 2e | 0.943 | 0.489 | –0.376 | –0.599 |
| Ca(Mg0.5Fe0.5)(CO3)2 + H2S + 2H+ = = 0.5FeS2 + 2H2CO3 + Ca2+ + 0.5Mg2+ + e | –1.748 | –1.294 | –0.611 | –0.157 |
| Ca(Mg0.5Fe0.5)(CO3)2 + 2.5H+ + 0.75H2O = = 0.25Fe2O3 + Ca2+ + 0.5Mg2++ 2H2CO3 + 0.5e | –3.935 | –2.798 | –1.092 | 0.045 |
| СН4 + 2H2O = СО2 + 8H++ 8e | 0.373 | –0.195 | –0.423 | –0.650 |
| CH4 + 3H2O = ${\text{HCO}}_{3}^{ - }$+ 9H++ 8e | 0.429 | –0.210 | –0.466 | –0.722 |
| Уравнения реакций и их рН, не зависящие от Eh | ||||
| ZnS + 2H+= Zn2++ H2S | 2.4 | |||
| Zn2+ + H2CO3 = ZnCO3 + 2H+ | 5.3 | |||
| PbS + 2H+ = Pb2+ + H2S | 2.3 | |||
| PbSO4 + H+ = Pb2++ ${\text{HSO}}_{4}^{ - }$ | 3.2 | |||
| PbSO4 + H2CO3 = PbCO3 + ${\text{SO}}_{4}^{{2 - }}$ + 2H+ | 6.2 | |||
| Ca(Mg0.5Fe0.5)(CO3)2 + 0.5H2S + 3H+ = 0.5FeS + 2H2CO3 + Ca2++ 0.5Mg2+ | 5.8 | |||
| СO2 + H2O = ${\text{HCO}}_{3}^{ - }$ + H+ | 3.4 | |||
Рис. 4.
Eh–pH диаграмма с полями устойчивости минералов Pb и Zn из золото-полиметаллической ассоциации при 300 °С и активности компонентов углекислоты и суммарной активности серы, равных 10–3; активности ионов свинца и цинка соответствуют 10–4. Фугитивности СО2 и СН4 приняты равными 10 бар и 10–7 соответственно. Штриховыми линиями показаны равновесия между серосодержащими компонентами. Тонкими линиями – равновесия между метаном, углекислым газом и компонентами углекислоты. Fig. 4. Eh–pH plot with fields of stability of Pb and Zn minerals in the gold-polymetallic assemblage (at 300 °C, the activity of carbonic acid and sulfur components equal to 10–3, and activity of lead and zinc ions equal to 10–4). CO2 and CH4 fugacities are considered to be 10 and 10–7 bar, respectively. Dashed lines indicate the equilibrium between sulfur-bearing components. Thin lines indicate the equilibrium of methane, carbon dioxide and other components of the carbonic acid.
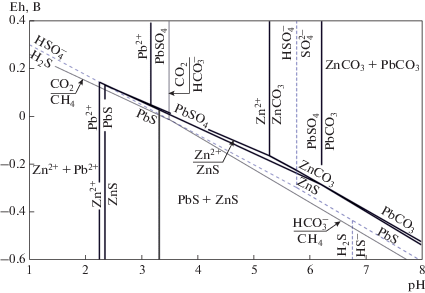
Рис. 5.
Eh–pH диаграмма с полями устойчивости минералов Fe и Cu из золото-полиметаллической ассоциации при 300 °С и активности компонентов углекислоты и суммарной активности серы, равных 10–3. Жирными линиями показаны равновесия между железосодержащими минералами, тонкими – равновесия между медьсодержащими минералами. Пунктиром обозначены линии равновесия между серосодержащими компонентами. Ank – анкерит Ca(Mg0.5Fe0.5)(CO3)2. Fig. 5. Eh–pH plot with fields of stability of Fe and Cu minerals in the gold-polymetallic assemblage (at 300 °C, the activity level of the carbonic acid components and sulfur equal to 10–3). Thick lines indicate the equilibrium between ferriferous minerals, thin lines indicate the equilibrium between copper-bearing ones. Dashed lines show the equilibrium between sulfur-bearing components. Ank – ankerite Ca(Mg0.5Fe0.5)(CO3)2.
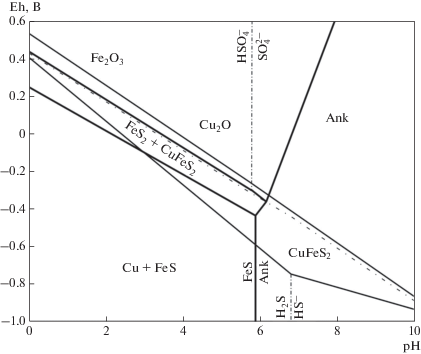
Рис. 6.
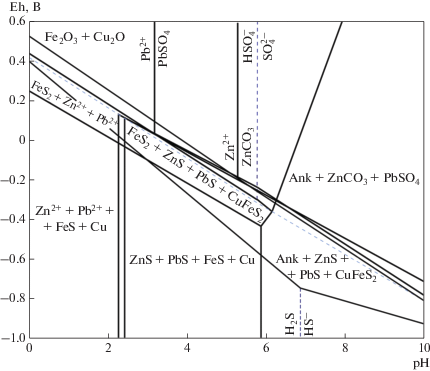
Сводная Eh–pH диаграмма с полями устойчивости минералов Pb, Zn, Fe и Cu золото-полиметаллической ассоциации при 300 °С и активности компонентов углекислоты и суммарной активности серы, равных 10–3. Штриховыми линиями обозначены линии равновесия между серосодержащими компонентами. Fig. 6. Summary Eh–pH plot with fields of stability of Pb, Zn, Fe, and Cu minerals in the gold-polymetallic assemblage (at 300 °C, the activity level of the carbonic acid components and sulfur is equal to 10–3). Stroke lines indicate the equilibrium between sulfur-bearing components.
На рН–Eh диаграмме (рис. 4) показаны равновесные соотношения между галенитом, ионом свинца, англезитом и церусситом. Эта диаграмма совмещена с аналогичной диаграммой, выполненной для сфалерита и ионов цинка. Широкая область существования сульфидов, значительно уменьшающаяся при рН ≥ 6, со стороны кислых сред ограничена полями устойчивости ионов свинца и цинка (рН ≤ 2.4 при активности ионов, равной 10–4). Со стороны больших значений Eh поле устойчивости сульфидов ограничено областью существования сульфата свинца и карбонатов свинца и цинка; при этом с увеличением щелочности среды значения Eh уменьшаются. Так, при рН = 3.4 точка на линии равновесия PbS–PbSO4 соответствует величине Eh 0.1 В, а при рН = 6 – величине Eh (–0.3) В. Линия равновесия метана и компонентов углекислоты проходит несколько ниже линии равновесия сульфиды–сульфаты–карбонаты. Точка тройного равновесия СН4 –СО2–${\text{HCO}}_{3}^{ - }$ соответствует Eh = 0.1 В, рН = 3.5.
Перейдем к диаграмме, построенной для минералов железа, и совмещенной с ней диаграмме для минералов меди (рис. 5). Как уже было сказано, в золото-полиметаллической ассоциации присутствует пирит, а в кварце отмечены включения анкерита, поэтому на диаграмме показаны линии равновесия анкерита с пиритом, пирротином и гематитом, которые ограничивают поля устойчивости последних со стороны повышенных значений. Поле устойчивости пирита представляет собой узкую область, лежащую в интервале рН от 0 (при Eh = 4.3 В) до 6.5 (при Eh = –0.3 В). Она практически полностью вписывается на совмещенной диаграмме в поле устойчивости халькопирита. Поэтому область совместного существования пирита и халькопирита со стороны повышенных значений Eh ограничена линией равновесия пирит–гематит, со стороны пониженных значений Eh ограничена линиями равновесий халькопирит–медь и пирит–пирротин, а при рН ≥ 6 она сменяется полем существования анкерита.
На диаграмме рис. 6 представлено соотношение полей устойчивости минералов золото-полиметаллической ассоциации. Расчет минеральных равновесий для этой ассоциации показал, что область совместного сосуществования минералов свинца, цинка, железа и меди находится в интервале величины pH от 3.4 до 5.8, величины Eh – от 0.1 до (–0.3) В.
Расчет равновесий минералов золото-теллур-висмутовой ассоциации выполнен для температуры 150 °С и давления 1 кбар, при этом учтено, что газовая фаза обогащена СО2 и содержит СН4. Уравнения реакций для минералов и компонентов серы и теллура и их окислительно-восстановительные потенциалы приведены в табл. 3. При анализе многочисленных вариантов расчетов равновесий было установлено, что для совместного сосуществования лиллианита, тетрадимита и теллуровисмутита в среде, содержащей СН4 и обогащенной СО2, оптимальные активности компонентов должны соответствовать: a∑S = 10–3, ${{P}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}}$ = 10 бар, ${{f}_{{{\text{C}}{{{\text{H}}}_{{\text{4}}}}}}}$ = 10–7, ${{a}_{{{\text{P}}{{{\text{b}}}^{{{\text{2 + }}}}}}}}$ =10–2, a∑Te = 10–7, ${{a}_{{{\text{A}}{{{\text{g}}}^{{\text{ + }}}}}}}$ = 10–3, ${{a}_{{{\text{B}}{{{\text{i}}}^{{{\text{3 + }}}}}}}}$ = 10–7, ${{a}_{{{\text{HCO}}_{{\text{3}}}^{ - }}}}$ =10–3. Соотношения полей устойчивости лиллианита, тетрадимита и теллуровисмутита даны на диаграмме (рис. 7).
Таблица 3.
Уравнения реакций и их окислительно-восстановительные потенциалы в зависимости от pH раствора для золото-теллур-висмутовой ассоциации при 150 °С Table 3. Chemical equations and their redox potential (Eh) depending on pH of water solution for the gold-tellurium-bismuth-quartz assemblage at 150 °С
| pH | |||
|---|---|---|---|
| Уравнения реакций | Eh, B | ||
| 0 | 5 | 9 | |
| H2S + 4H2O = ${\text{HSO}}_{4}^{ - }$ + 9H+ + 8e | 0.338 | 0.149 | –0.134 |
| H2S + 4H2O = ${\text{SO}}_{4}^{{2 - }}$+ 10H+ + 8e | 0.378 | 0.168 | –0.147 |
| HS– + 4H2O = ${\text{SO}}_{4}^{{2 - }}$+ 9H+ + 8e | 0.313 | 0.124 | –0.160 |
| HTe + 3H2O ↔ HTeO3 + 6H(+) + 6e | 0.297 | 0.151 | –0.123 |
| H2Te + 3H2O ↔ ${\text{HTeO}}_{3}^{{( - )}}$+ 7H(+) + 6e | 0.374 | 0.233 | –0.312 |
| H2Te + 3H2O = H2TeO3 + 6H + 6e | 0.288 | 0.120 | –0.131 |
| CH4 + 3H2O = ${\text{HCO}}_{3}^{ - }$+ 9H+ + 8e | 0.325 | 0.136 | –0.336 |
| CH4 + 2H2O = CO2 + 8H+ + 8e | 0.296 | 0.128 | –0.292 |
| 3Bi2Te2S + 12H2O = 2Bi2Te3 + 2Bi3+ + ${\text{3HSO}}_{4}^{ - }$+ 21Н+ + 24е | 0.380 | 0.233 | –0.135 |
| 3Bi2Te2S +12H2O = 2Bi2Te3 + 2Bi3 + ${\text{3SO}}_{4}^{{2 - }}$+ 24Н+ + 24е | 0.420 | 0.252 | –0.168 |
| Lil + 2H2TeO3 + 14H2O = = Bi2Te2S + 2.8Pb(2+) + 0.4Ag(+) + ${\text{5HSO}}_{4}^{{( - )}}$+ 27H(+) + 28e | 0.324 | –0.081 | –0.405 |
| Lil + 2H2TeO3 + 14H2O = = Bi2Te2S + 2.8Pb(2+) + 0.4Ag(+) + $5{\text{SO}}_{4}^{{(2 - )}}$+ 32H(+) + 28e | 0.381 | 0.189 | –0.291 |
| Lil +$2{\text{HTeO}}_{3}^{{( - )}}$+ 14H2O = = Bi2Te2S + 2.8Pb(2+) + 0.4Ag(+) + $5{\text{SO}}_{4}^{{(2 - )}}$+ 30H(+) + 28e | 0.350 | 0.149 | –0.354 |
| Уравнения реакций и их рН, не зависящие от Eh | |||
| H2S ↔ HS(–) + H(+) | 6.2 | ||
| ${\text{HSO}}_{4}^{{( - )}}$↔ ${\text{SO}}_{4}^{{(2)}}$+ H | 3.8 | ||
| H2Te = HTe(–) + H | 4.0 | ||
| ${\text{HTeO}}_{3}^{ - }$ + H+ = H2TeO3 | 4.7 | ||
| СO2 + H2O ↔ ${\text{HCO}}_{3}^{{( - )}}$+ H | 2.8 | ||
Примечание. Активности растворенных компонентов: a∑S = 10–3, ${{P}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}}$ = 10 бар, ${{f}_{{{\text{C}}{{{\text{H}}}_{{\text{4}}}}}}}$ = 10–7, ${{a}_{{{\text{P}}{{{\text{b}}}_{{{\text{2 + }}}}}}}}$ = 10–2, a∑Te = 10–7, ${{a}_{{{\text{A}}{{{\text{g}}}^{{\text{ + }}}}}}}$ = 10–3, ${{a}_{{{\text{A}}{{{\text{g}}}^{{\text{ + }}}}}}}$ = 10–3, ${{a}_{{{\text{B}}{{{\text{i}}}^{{{\text{3 + }}}}}}}}$ = 10–7, ${{a}_{{{\text{HCO}}_{{\text{3}}}^{ - }}}}$ = 10–3. Lil – лиллианит (Pb2.8Ag0.4Bi2S6).
Рис. 7.
Eh–pH диаграмма с полями устойчивости минералов золото-теллур-висмутовой ассоциации при 150 °С, активности компонентов углекислоты и серы равны 10–3, суммарная активность компонентов теллура принята равной 10–7. Штриховыми линиями обозначены линии равновесия между теллурсодержащими компонентами раствора. Тонкими линиями показаны равновесия между метаном, углекислым газом и компонентами углекислоты. Овальной линией выделена предполагаемая область формирования теллур-висмутовой ассоциации на месторождении Бодороно. Fig. 7. Eh–pH plot with fields of stability of minerals in the gold-tellurium-bismuth assemblage at 150 °C, the activity level of the carbonic acid components and sulfur is equal to 10–3, the activity level of tellurium components is considered to be 10–7. Stroke lines indicate the equilibrium between tellurium-bearing components. Thin lines show the equilibrium between methane, carbon dioxide and components of carbonic acid. The oval shows the hypothetical field of forming the tellurium-bismuth-quartz association in the Bodorono deposit.
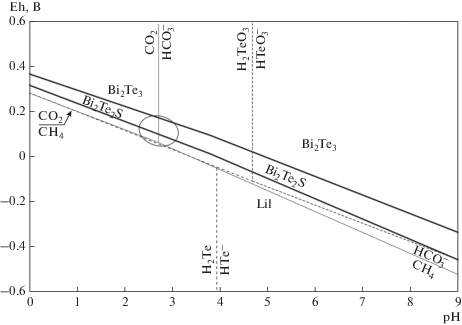
Поле устойчивости тетрадимита довольно узкое, незначительно увеличивается с увеличением щелочности растворов. Так, при рН = 0 оно лежит в интервале Eh между 0.32 и 0.38 В, а при рН = 9 – между (–0.35) и (–0.17) В. Со стороны больших значений Eh оно ограничено линией равновесия тетрадимит–теллуровисмутит. С уменьшением Eh поле устойчивости тетрадимита сменяется областью существования лиллианита.
На этой же диаграмме показаны линии равновесия между метаном, углекислым газом и ионом ${\text{HCO}}_{3}^{ - }$. Учитывая, что точка тройного равновесия этих компонентов при 150 °С соответствует рН 2.8, а Еh – 0.1 В, можно предполагать, что именно в таких условиях происходило формирование теллур-висмутовой ассоциации на изучаемом месторождении.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Результаты минералогических, термобарогеохимических исследований и анализа минеральных равновесий рудных минералов месторождения Бодороно позволяют реконструировать физико-химические условия процесса рудоотложения.
Минералогические исследования показывают, что на месторождении встречаются два типа оруденения. В соответствии с существующими классификациями месторождений золота, наиболее близкими к ним являются полиметаллический и теллуридный (Некрасов, 1991) или золото-кварцевый и золото-теллур-висмутовый (Сафонов, 1997) типы оруденения. Минеральные ассоциации руд (наличие галенит-сфалеритовой, теллуридно-висмутовой ассоциации с золотом, относительно низкопробное золото в ранней ассоциации и высокопробное в поздней) и прожилково-вкрапленный характер оруденения согласуются с основными признаками золото-кварцевых месторождений (Groves et al., 1997) с совмещенной теллуридно-висмутовой минерализацией (Thompson, Newberry, 2000).
Выполненные термобарогеохимические исследования показывают, что формирование золоторудной минерализации происходило из двух типов флюидов. Так, для образования первой (пирит-пирротин-кварцевой) ассоциации месторождения характерны температуры около 300 °С, и, с учетом данных расчета минеральных равновесий, слабощелочная среда и восстановительная обстановка (рН = 6.8–7.8, Еh = (–0.5)...(–0.7) В, аΣS =10–3–10–2).
Температуры образования золото-полиметаллической ассоциации лежат в интервале 270–300 °С, давление – в интервале 0.8–1 кбар, а в водно-солевой системе флюидов присутствуют хлориды Na и K с низкими концентрациями (от 2.57 до 4.96 мас. %-экв. NaCl). Также водно-солевая система содержит газовую фазу состава: СО2 68%, СН4 32%. Минералы золото-полиметаллической ассоциации формируются в кислой–слабокислой среде при величине рН, которая изменяется от 3.4 до 5.8 и в менее восстановительных условиях [Eh = 0.1...(–0.3) В] по сравнению с пирит-пирротин-кварцевой ассоциацией.
При дальнейшем понижении температуры и давления (до значений 145–200 °С, 0.4–0.6 кбар) формировалась золото-теллур-висмутовая ассоциация. При этом во флюидных включениях установлено заметно большее количество углекислого газа и значительно меньшее содержание метана (СО2 95%, CH4 3%, N2 2%).
Расчет параметров среды минералообразования минералов золото-теллур-висмутовой ассоциации (тетрадимита, теллуровисмутита, лиллианита) для температуры 150 °С, показал, что растворы становятся более кислыми (рН = ~3), а минералообразующая среда слабо восстановительной (Eh = ~0.1 В).
Авторы выражают признательность к. г.-м. н. Г.С. Анисимовой (ИГАБМ СО РАН), к. г.-м. н. Е.В. Баданиной (СПбГУ), главному геологу КГПП Е.П. Соколову (АО “Якутскгеология”) за консультации и плодотворное обсуждение результатов исследований, а также специалисту РЦ СПбГУ “Геомодель” В.Н. Бочарову за проведение аналитических работ. Статья подготовлена по плану НИР ИГАБМ СО РАН и при поддержке гранта РФФИ № 19-35-90051.
Список литературы
Анисимова Г.С., Соколов Е.П. Месторождение Бодороно – новый золоторудный объект Южной Якутии // Руды и металлы. 2014. № 5. С. 49–57.
Борисенко А.С. Изучение солевого состава газово-жидких включений в минералах методом криометрии // Геология и геофизика. 1977. № 8. С. 16–27.
Булах А.Г., Кривовичев В.Г. Расчет минеральных равновесий. Л.: Недра, 1985. 184 с.
Бортников Н.С., Прокофьев В.Ю., Раздолина Н.В. Генезис золото-кварцевого месторождения Чармитан (Узбекистан) // Геология и геофизика. 1996. Т. 38. № 3. С. 238‒257.
Гаррелс Р.М., Крайст Ч.Л. Растворы, минералы, равновесия. М.: Мир, 1968. 367 с.
Говоров И.Н. Термодинамика ионно-минеральных равновесий и минералогия гидротермальных месторождений. М.: Наука, 1977. 239 с.
Ермолаев М.М. Вычисление значений свободных энергий некоторых гипергенных минералов на основе предположения о стационарности химических потенциалов и концентраций главных элементов в водах Мирового океана / Миграция химических элементов при процессах выветривания (по экспериментальным данным). М.: Наука, 1966. С. 13–65.
Журавкова Т.В., Пальянова Г.А., Калинин Ю.А, Горячев Н.А., Зинина В.Ю., Житова Л.М. Физико-химические условия образования минеральных парагенезисов золота и серебра на месторождении Валунистое (Чукотка) // Геология и геофизика. 2019. Т. 60. № 11. С. 1565‒1576.
Кардашевская В.Н., Анисимова Г.С., Баданина Е.В., Бочаров В.Н., Пономарева Н.И. Условия образования золоторудного месторождения Бодороно (Саха, Якутия) // ЗРМО. 2020. Т. 149. № 3. С. 96–110.
Наумов Г.Б., Рыженко Б.Н., Ходаковский И.Л. Справочник термодинамических величин. М.: Атомиздат, 1971. 238 с.
Некрасов И.Я. Геохимия, минералогия и генезис золоторудных месторождений. М.: Наука, 1991. 302 с.
Николаев В.А., Доливо-Добровольский В.В. Основы теории процессов магматизма и метаморфизма. М.: Госгеолтехиздат, 1961. 389 с.
Плотинская О.Ю., Новоселов К.А., Зелтманн Р. Минералогия благородных металлов в рудах полиметаллического месторождения Биксизак (Южный Урал, Россия) // Геология рудн. месторождений. 2020. Т. 62. № 6. С. 483–502.
Пономарева Н.И., Гордиенко В.В. Физико-химические условия образования лепидолита // ЗВМО. 1991. Ч. 120. Вып. 5. С. 31–39.
Пономарева Н.И., Кривовичев В.Г. Минеральные равновесия в гранитных пегматитах на постмагматическом этапе. СПб.: СПбГУ, 2004. 142 с.
Прокофьев В.Ю., Наумов В.Б., Миронова О.Ф. Физико-химические параметры и геохимические особенности флюидов мезозойских золоторудных месторождений // Геохимия. 2020. Т. 65. № 2. С. 123–144.
Рёддер Э. Флюидные включения в минералах. М.: Мир, 1987. Т. 1. 558 с.
Тектоника, геодинамика и металлогения территории Республики Саха (Якутия) / Под ред. Л.М. Парфенова, М.И. Кузьмина М.: МАИК “Наука/Интерпериодика”, 2001. 571 с.
Дополнительные материалы отсутствуют.
Инструменты
Записки Российского минералогического общества


