Записки Российского минералогического общества, 2023, T. 152, № 4, стр. 1-15
Термодинамика арсенатов, селенитов и сульфатов в зоне окисления сульфидных руд. XVI. Растворимость синтетического аналога мандариноита при 25 °C
д. чл. М. В. Чарыкова 1, *, К. Л. Ушакова 1, **, А. Хольцхайд 2, почетный член В. Г. Кривовичев 1, ***, Н. М. Ефименко 1, д. чл. Н. В. Платонова 1
1 Санкт-Петербургский государственный университет, Институт наук о Земле
199155 Санкт-Петербург, ул. Декабристов, 16, Россия
2 Институт наук о Земле, Кильский университет имени Кристиана Альбрехта
D_24098 Киль, Германия
* E-mail: m.charykova@spbu.ru
** E-mail: k.ushakova@spbu.ru
*** E-mail: v.krivovichev@spbu.ru
Поступила в редакцию 09.06.2023
После доработки 13.06.2023
Принята к публикации 14.06.2023
- EDN: GQLZRR
- DOI: 10.31857/S0869605523040032
Аннотация
Цель данного исследования – синтез двух селенитов железа(III): Fe2(SeO3)3·5H2O (аналог минерала мандариноита) и Fe2(SeO3)3·3H2O, а также исследование их растворимости. Идентификация полученных образцов выполнялась с помощью порошковой дифрактометрии и энергодисперсионного рентгеноспектрального микроанализа. Растворимость определяли методом изотермического насыщения при 25 °C. Для подавления гидролиза ионов Fe3+ и предотвращения осаждения гидроксида железа эксперимент выполнялся в растворах азотной или серной кислоты. Полученные составы насыщенных растворов использовались для расчета произведения растворимости с помощью программного пакета Geochemist’s Workbench (GMB 9.0, программа SpecE8). В результате расчета получены lg ПР(Fe2(SeO3)3·5H2O) = –38.6 ± 0.5 и lg ПР(Fe2(SeO3)3·3H2O) = –39.0 ± 0.2.
ВВЕДЕНИЕ
Мандариноит был описан в качестве нового минерала – четырехводного селенита железа в статье (Dunn et al., 1978). Он найден в руднике Пакахаке (Pacajake), Колкечака, Боливия, в ассоциации с самородным селеном, сидеритом, пенрозеитом NiSe2 и продуктами окисления селенсодержащих сульфидов и селенидов – альфельдитом NiSeO3·2H2O, кобальтоменитом CoSeO3·2H2O, халькоменитом CuSeO3·2H2O и молибдоменитом PbSeO3. Название минералу дано в честь Джозефа Энтони Мандарино (1929–2007), американо-канадского минералога, куратора минералогии Королевского музея Онтарио (Торонто), за его выдающийся вклад в минералогию. Химический состав был определен методом микрозондового анализа как Fe2(SeO3)3·4H2O, а содержание воды было рассчитано по разности H2O = 100 – (Σ(Fe2O3 + SeO2)).
Мандариноит также найден в рудниках Скуриотисса (Кипр) и Эль-Пломо (Гондурас) (Hawthorne, 1984), на месторождении Эль Драгон (Боливия) (Grundman, Förster, 2017) и на серебряном руднике Де Ламара (Айдахо, США) (Lasmanis et al., 1981). Кристаллическая структура минерала из Айдахо была изучена Ф. Хоторном (Hawthorne, 1984), который на основании этих данных получил идеальную формулу Fe2(SeO3)3·6H2O, впоследствии одобренную Комиссией по новым минералам и названиям минералов Международной Минералогической Ассоциации.
В работе (Rai et al., 1988) был синтезирован селенит железа, который ее авторы сочли аналогом мандариноита с формулой Fe2(SeO3)3·6H2O. Г. Гистер с соавторами (Giester et al., 1996) повторно синтезировали и исследовали это вещество и пришли к заключению, что в работе (Rai et al., 1988) был получен Fe2(SeO3)3·3H2O, а не Fe2(SeO3)3·6H2O. Помимо уже перечисленных формул Fe2(SeO3)3·6H2O, Fe2(SeO3)3·4H2O и Fe2(SeO3)3·3H2O, в литературе можно найти сведения о существовании и других водных селенитов железа(III): Fe2(SeO3)3·7H2O, Fe2(SeO3)3·5H2O и Fe2(SeO3)3·H2O. Так, в работах (Бакеева и др., 1970) и (Nishimura et al., 2005) представлены данные о пятиводном селените Fe2(SeO3)3·5H2O; Г.Ф. Пинаевым и В.П. Волковой (1970) получено соединение, которое, по данным этих исследователей, имеет формулу Fe2(SeO3)3·7H2O; синтезу и определению структуры Fe2(SeO3)3·H2O посвящена работа (Giester, 1993).
Таким образом, до недавнего времени вопрос о формуле мандариноита не был решен окончательно, и все термодинамические данные для этого минерала, определенные на основании работы (Rai, 1995) и вошедшие в справочные издания (например, Olin et al., 2005), на самом деле характеризуют не мандариноит, а кристаллогидрат с тремя молекулами воды.
В нашей работе (Holzheid et al., 2018) было проведено систематическое исследование двух кристаллогидратов селенита трехвалентного железа. Один из них – синтезированный по методике (Rai et al., 1988; Rai, 1995) трехводный селенит железа. Второй – синтетический аналог мандариноита (что подтверждается данными порошковой дифрактометрии), содержащий, как было установлено, 5 молекул кристаллизационной воды на формулу. Основываясь на результатах рентгенофазового и химического анализа полученных образцов, изучении их термического поведения, а также структуры природного образца, определенной в работе (Hawthorne, 1984), мы предложили для мандариноита формулу Fe2(SeO3)3·(6 – x)H2O, где x принимает значения от 0 до 1 (Holzheid et al., 2018). Общее количество воды, по-видимому, влияет на степень кристалличности и, возможно, на стабильность кристаллов: чем меньше значение x, тем более высокой степени кристалличности можно ожидать. В условиях лабораторного синтеза удается получить лишь образцы, формула которых наиболее близка к Fe2(SeO3)3·5H2O (т.е. x = 1), и это вполне соответствует литературным данным о составе синтетического селенита железа (Бакеева и др. 1970; Nishimura et al., 2005).
Что касается термодинамических свойств мандариноита, то впервые произведение растворимости (ПР) селенита железа было определено в работе (Чухланцев, Томашевский, 1957). Несколько работ этих авторов середины 50-х гг. XX века (например, Чухланцев, 19561, 2; Чухланцев, Томашевский, 1957) были посвящены определению растворимости селенитов и арсенатов целого ряда металлов, однако в них не было надежной идентификации твердых фаз. Нужно отметить, что целью этих работ являлось не изучение фазовых равновесий в водно-солевых системах, а установление оптимальных условий для количественного осаждения из раствора селенит- и арсенат-ионов, поэтому подробно исследовалась растворимость осадка в различных средах и не имели столь существенного значения температура и идентификация твердой фазы (безводная соль или кристаллогидрат, аморфная или кристаллическая). Продолжительность эксперимента составляла 8 ч; в насыщенных растворах определялась только концентрация железа, а общая концентрация Se принималась равной 3/2 от концентрации Fe3+ (исходя из стехиометрии). Растворимость селенита железа была измерена при температуре 20 °C, твердую фазу авторы предположительно описали как Fe2(SeO3)3, и рассчитали логарифм произведения растворимости этого соединения lg ПР (20 °C) = –30.91 ± 0.25. Авторы справочника (Olin et al., 2005) на основе тех же данных (Чухланцев, Томашевский, 1957) пересчитали произведение растворимости и получили величину lg ПР (20 °C) = –33.77 ± 0.15. При этом они не рекомендовали это значение в качестве надежного термодинамического параметра, считая твердую фазу недостаточно полно охарактеризованной и, вероятно, аморфной.
Следующая работа, посвященная определению произведения растворимости селенита железа (имеющего, по мнению ее авторов, формулу Fe2(SeO3)3·6H2O и являющегося аналогом мандариноита) при 23 ± 2 °C, была выполнена Д. Рэем с соавторами (Rai et al., 1995). Они провели скрупулезные и трудоемкие эксперименты, время которых составляло до 1725 сут. Растворимость определялась в растворах соляной кислоты, а также в присутствии избытка ионов ${\text{SeO}}_{3}^{{2 - }}$ (в присутствии селенита натрия). Получено значение lgПР (23 °C) = –41.58 ± 0.11, что заметно отличается от результата работы (Чухланцев, Томашевский, 1957). Именно значение из работы (Rai et al., 1995) рекомендовано в справочнике (Olin et al., 2005), и оно использовано в нашей статье (Кривовичев и др., 2010), где впервые была построена Eh–pH диаграмма в системе Fe–Se–H2O, учитывающая образование мандариноита. Однако, как уже было сказано, вещество, синтезированное в работах (Rai et al., 1988, 1995), представляет собой не аналог мандариноита, а другой кристаллогидрат селенита железа – Fe2(SeO3)3·3H2O, и, следовательно, полученное значение ПР характеризует растворимость именно этого соединения.
Авторы работы (Nishimura et al., 2005) изучали растворимость в системе Fe2O3–SeO2–H2O при 25 °C в широком диапазоне содержаний SeO2. Продолжительность экспериментов достигала трех месяцев. Устанавливалось равновесие предварительно синтезированного селенита железа с растворами селенистой кислоты различных концентраций. В результате получены составы растворов, насыщенных относительно Fe2(SeO3)3·5H2O и Fe(HSeO3)3, однако произведение растворимости авторы не рассчитывали.
В этой же работе (Nishimura et al., 2005) есть ссылка еще на одни литературные данные, посвященные определению произведения растворимости селенита Fe(III) при комнатной температуре – это работа Г.Ф. Пинаева и В.П. Волковой (1970), в которой приводится значение lgПР = –35.4.
В 2018 г. в работе М.И. Лелета и др. (Lelet et al., 2018) были впервые проведены калориметрические измерения энтальпии растворения и низкотемпературной теплоемкости синтетического аналога мандариноита (с уточненной нами формулой Fe2(SeO3)3·5H2O). На основании полученных данных рассчитана стандартная свободная энергия Гиббса образования:
Таким образом, вопрос о термодинамических свойствах мандариноита до сих пор является дискуссионным. В связи с этим и учитывая противоречивость предшествующих данных по растворимости, относящихся к различным селенитам железа, целью настоящей работы явилось экспериментальное изучение растворимости надежно идентифицированного синтетического аналога мандариноита в сравнении с растворимостью другого селенита железа – Fe2(SeO3)3·3H2O. Поскольку мандариноит является очень редким минералом и встречается в чрезвычайно мелких выделениях, для исследования его термодинамических свойств природный материал использован быть не может.
1. МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Синтез. Синтез селенитов железа выполнялся в лаборатории Института наук о Земле Кильского университета (Германия). За основу была взята методика, описанная в работе (Larrañaga et al., 2008), но позже в нее были внесены изменения (Holzheid et al., 2018). Низкотемпературный гидротермальный синтез выполнялся медленным осаждением из водного раствора, содержащего SeO2 и FeCl3·6H2O и подкисленного до pH ~ 1, в тефлоновых реакторах, помещенных в автоклавы из нержавеющей стали. Температура варьировала в интервале 30–110 °C, давление – 1.5–2.7 бар. Продолжительности синтеза составляла от 5 до 259 дней. Как показал последующий рентгенофазовый анализ, при температуре 30 °C синтезированное вещество представляет собой аналог мандариноита, а при высоких температурах образуется трехводный селенит железа. Всего было выполнено более 40 синтезов, чтобы получить достаточное количество вещества для его идентификации и последующих экспериментальных исследований.
Методы исследования. Идентификация синтезированных образцов проводилась методом рентгенофазового анализа на автоматическом порошковом дифрактометре UltimaIV (Rigaku). Для изучения их микроморфологии и определения химического состава использовался электронный микроскоп Hitachi S-3400N с аналитической приставкой для энергодисперсионного рентгеноспектрального микроанализа.
Растворимость изучалась методом изотермического насыщения: небольшие количества твердой фазы переносили в колбы, заливали растворами с различным значением pH, помещали в термостатируемый шейкер и оставляли на 30(40) сут при постоянном перемешивании при температуре 25 °C. Отбор проб насыщенных растворов проводился через 15 и через 30–40 сут – для подтверждения установления равновесия. Концентрации Fe и Se в растворах определяли методом ICP MS на масс-спектрометре Agilent 7700х. После окончания эксперимента осадок отделяли центрифугированием и фильтрованием, высушивали и исследовали методом порошковой рентгенографии для подтверждения того, что в ходе взаимодействия с раствором состав твердой фазы не изменился и не образовались дополнительные фазы.
Расчет произведения растворимости проводился с помощью программного комплекса Geochemist’s Workbench (GMB 9.0, программа SpecE8).
2. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
2.1. Рентгенофазовый и микрорентгеноспектральный анализ
Рентгенофазовый анализ был выполнен для всех синтезированных образцов; полученные дифрактограммы оказались соответствующими мандариноиту (PDF-2 № 01-084-0885) и трехводному селениту железа (PDF-2 № 01-085-2331), без примеси дополнительных фаз. Результаты 7 синтезов представляли собой смесь двух различных кристаллогидратов селенита железа – они не использовались для дальнейших исследований. Два примера дифрактограмм представлены на рис. 1. В табл. 1 приведены параметры элементарной ячейки синтетического аналога мандариноита и Fe2(SeO3)3·3H2O. Как видно из таблицы, они хорошо согласуются с литературными данными.
Рис. 1.
Примеры дифрактограмм синтезированных фаз: а – синтетический аналог мандариноита, б – Fe2(SeO3)3∙3H2O. Fig. 1. Representative XRD patterns of synthesized iron(III) selenite hydrates: a – synthetic analogue of mandarinoite; б – Fe2(SeO3)3∙3H2O.
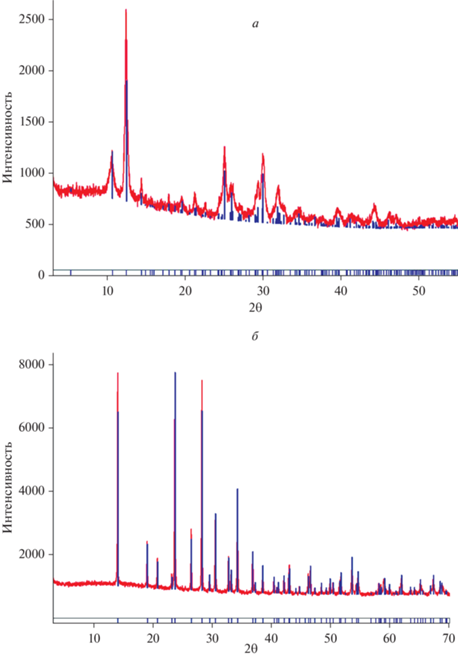
Таблица 1.
Параметры элементарной ячейки селенитов железа Table 1. Unit cell parameters of iron selenites
| Формула | Источник | Пространственная группа | а, Å | b, Å | c, Å | β, ° |
|---|---|---|---|---|---|---|
| Fe2(SeO3)3∙4H2O | Dunn et al., 1978 | P21/c | 16.78(3) | 7.86(1) | 9.96(6) | 98.3(6) |
| Fe2(SeO3)3∙6H2O | Hawthorne, 1984 | 16.810(4) | 7.880(2) | 10.019(2) | 98.26(2) | |
| Fe2(SeO3)3∙5H2O | Наши данные* | 16.824(6) | 7.849(3) | 10.010(4) | 98.20(2) | |
| Fe2(SeO3)3∙6H2O (?) | Rai et al., 1988 | 10.914 | 9.352 | 8.646 | 96.52 | |
| Fe2(SeO3)3∙3H2O | Giester, Pertlik, 1994 | R3c | 9.360(1) | 20.297(2) | ||
| Fe2(SeO3)3∙3H2O | Larrañaga et al., 2008 | 9.361(1) | 20.276(1) | |||
| Fe2(SeO3)3∙3H2O | Наши данные** | 9.3627(2) | 20.2642(7) |
На рис. 2 представлены СЭМ-изображения синтезированных образцов. Видно, что в случае Fe2(SeO3)3·3H2O они представляют собой кубоподобные агрегаты, состоящие из пластинчатых выделений, размером около 10 мкм. Образцы синтетического аналога мандариноита представлены шарообразными агрегатами, также состоящими из пластинчатых индивидов, размером около 5 мкм. Рентгеноспектральный микроанализ показал присутствие в синтезированном веществе только Fe, Se и O, за исключением нескольких образцов, в которых присутствуют следы Cl (до 0.2 мас. %) – по всей видимости, это связано с тем, что синтез производился из раствора хлорида железа. Отношение концентраций Se : Fe (в мол. %) в среднем составляет 1.52 для аналога мандариноита и 1.51 для Fe2(SeO3)3∙3H2O, т.е. близко к идеальному стехиометрическому соотношению Se : Fe = 3 : 2.
Рис. 2.
СЭМ-изображения синтезированных фаз: а – синтетический аналог мандариноита, б – Fe2(SeO3)3∙3H2O. Fig. 2. Secondary electron images of synthesized phases: a – synthetic analogue of mandarinoite; б – Fe2(SeO3)3∙3H2O.

Как уже сказано выше, в нашей предыдущей работе (Holzheid et al., 2018) было показано, что синтетический аналог мандариноита, полученный в лабораторных условиях, имеет формулу Fe2(SeO3)3·5H2O. Именно эту формулу мы будем использовать в дальнейшем для описания результатов экспериментального изучения растворимости.
2.2. Определение произведения растворимости
Для подавления гидролиза ионов Fe3+ определение растворимости выполнялось в кислых растворах. Была проведена серия предварительных экспериментов с Fe2(SeO3)3·5H2O в растворах серной кислоты с исходными значениями pH ≈ 1.0, 1.5, 2.0, 2.5, 3.0. Первые пробы растворов отбирали через 15 сут, вторые – через 30 сут. Время установления насыщения было выбрано с учетом результатов работы (Rai et al., 2005). Продолжительность эксперимента в этой работе составляла от 7 до 1725 дней, однако было показано, что уже через две недели концентрации Fe и Se в растворе достигают стационарных значений.
Результаты предварительных экспериментов показали, что, во-первых, при увеличении pH исходных растворов растворимость селенита железа ожидаемо понижается и, во-вторых, соотношение молярных концентраций Se : Fe в насыщенных растворах не всегда совпадает со стехиометрическим. Начиная с pH 2, оно превышает стехиометрическое в несколько раз, т.е. растворение перестает быть конгруэнтным – железо частично выводится из раствора. На дифрактограммах новая фаза не проявляется, т.к. ее количество слишком мало и она, по всей видимости, рентгеноаморфна.
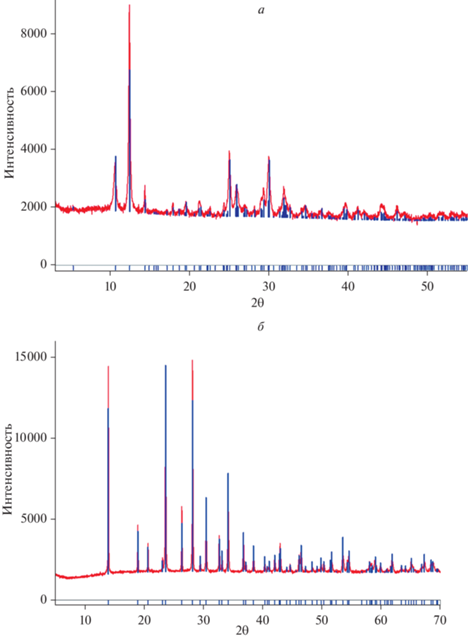
В силу перечисленных причин для дальнейших экспериментов было выбрано исходное значение pH, равное 1.0. Эксперимент выполнялся в растворах серной и азотной кислот. Пробы растворов отбирались через 15 и 30 (или 40) сут. В них были определены содержания Se и Fe методом ICP MS и измерено значение pH. Все осадки были идентифицированы после завершения эксперимента методом порошковой дифрактометрии, который подтвердил неизменность исходной твердой фазы в ходе эксперимента. Примеры дифрактограмм представлены на рис. 3. Этот факт, в числе прочего, свидетельствует о том, что в ходе взаимодействия с раствором не происходит превращения метастабильного при 25 °C кристаллогидрата Fe2(SeO3)3·3H2O в стабильную форму Fe2(SeO3)3·5H2O.
Рис. 3.
Примеры дифрактограмм равновесных с насыщенным раствором твердых фаз после эксперимента по определению растворимости: а – синтетический аналог мандариноита, б – Fe2(SeO3)3∙3H2O. Fig. 3. Representative XRD patterns of solid phases in equilibrium with a saturated solution after an experiment to determine solubility: a – synthetic analogue of mandarinoite; б – Fe2(SeO3)3∙3H2O.
Полученные результаты представлены в табл. 2. При рассмотрении этих данных, видно, что растворимость оказывается выше в растворах серной кислоты по сравнению с растворами азотной кислоты – очевидно, причиной этого является комплексообразование ионов Fe3+ и сульфат-ионов. Если сравнивать между собой концентрации железа и селена в растворах, насыщенных относительно Fe2(SeO3)3·3H2O и Fe2(SeO3)3·5H2O, то они оказываются очень близки между собой. Соотношение мольных концентраций Se : Fe в растворах близко к стехиометрическому – оно изменяется от 1.45 до 1.66. Таким образом, можно считать, что за это время система достигает равновесного (или по крайней мере стационарного) состояния, и, поскольку соотношение Se : Fe в сосуществующих фазах одинаково, селенит железа в данных условиях растворяется конгруэнтно. Следовательно, растворение может быть описано уравнениями
(1)
${\text{F}}{{{\text{e}}}_{{\text{2}}}}{{\left( {{\text{Se}}{{{\text{O}}}_{{\text{3}}}}} \right)}_{{\text{3}}}}{{\cdot5}}{{{\text{H}}}_{{\text{2}}}}{\text{O}} \to 2{\text{F}}{{{\text{e}}}^{{3 + }}} + 3{\text{SeO}}_{3}^{{2 - }} + 5{{{\text{H}}}_{{\text{2}}}}{\text{O}},$(2)
${\text{F}}{{{\text{e}}}_{{\text{2}}}}{{\left( {{\text{Se}}{{{\text{O}}}_{{\text{3}}}}} \right)}_{{\text{3}}}}{{\cdot3}}{{{\text{H}}}_{{\text{2}}}}{\text{O}} \to 2{\text{F}}{{{\text{e}}}^{{3 + }}} + 3{\text{SeO}}_{3}^{{2 - }} + 3{{{\text{H}}}_{{\text{2}}}}{\text{O}}.$(3)
${\text{lgПР}}\left( {{\text{F}}{{{\text{e}}}_{{\text{2}}}}{{{\left( {{\text{Se}}{{{\text{O}}}_{{\text{3}}}}} \right)}}_{3}}\cdot5{{{\text{H}}}_{{\text{2}}}}{\text{O}}} \right) = 2\lg a\left( {{\text{F}}{{{\text{e}}}^{{{\text{3 + }}}}}} \right) + 3\lg a\left( {{\text{SeO}}_{3}^{{2 - }}} \right) + 5\lg a\left( {{{{\text{H}}}_{{\text{2}}}}{\text{O}}} \right),$(4)
$\lg {\text{ПР}}\left( {{\text{F}}{{{\text{e}}}_{{\text{2}}}}{{{\left( {{\text{Se}}{{{\text{O}}}_{{\text{3}}}}} \right)}}_{{\text{3}}}}{{\cdot3}}{{{\text{H}}}_{{\text{2}}}}{\text{O}}} \right) = 2\lg a\left( {{\text{F}}{{{\text{e}}}^{{{\text{3 + }}}}}} \right) + 3\lg a\left( {{\text{SeO}}_{3}^{{2 - }}} \right) + 3\lg a\left( {{{{\text{H}}}_{{\text{2}}}}{\text{O}}} \right).$Таблица 2.
Результаты определения растворимости селенитов железа при 25 °C Table 2. Results of solubility measurements of iron selenites at 25 °C
| Кислота | Время эксперимента (сутки) | pH после насыщения | Концентрация в насыщенном растворе | Se : Fe | lgПР | |||
|---|---|---|---|---|---|---|---|---|
| мг/л | ммоль/л | |||||||
| Fe | Se | Fe | Se | |||||
| Fe2(SeO3)3·5H2O (синтетический аналог мандариноита) | ||||||||
| H2SO4 | 15 | 1.36 | 231 | 540 | 4.12 | 6.84 | 1.66 | –38.07 |
| H2SO4 | 40 | 1.40 | 198 | 458 | 3.54 | 5.79 | 1.64 | –38.22 |
| HNO3 | 15 | 1.28 | 62 | 131 | 1.11 | 1.65 | 1.50 | –39.18 |
| HNO3 | 40 | 1.42 | 63 | 129 | 1.13 | 1.64 | 1.45 | –38.79 |
| Fe2(SeO3)3·3H2O | ||||||||
| H2SO4 | 15 | 1.20 | 224 | 499 | 3.99 | 6.32 | 1.58 | –38.75 |
| H2SO4 | 30 | 1.11 | 207 | 448 | 3.70 | 5.67 | 1.53 | –39.29 |
| HNO3 | 15 | 1.25 | 75 | 154 | 1.33 | 1.95 | 1.47 | –39.01 |
| HNO3 | 30 | 1.20 | 79 | 168 | 1.41 | 2.13 | 1.51 | –39.05 |
Поскольку активность воды для растворов малорастворимых солей может быть принята равной единице, произведения растворимости для обоих кристаллогидратов могут быть вычислены без учета последнего слагаемого в формулах (3) и (4).
Расчет активностей растворенных частиц проводился с помощью программного комплекса Geochemist’s Workbench (GMB 9.0, программа SpecE8). В качестве брутто-концентраций в программе задаются полученные экспериментально значения pH, концентрации железа и селена в насыщенных растворах, а также рассчитанные предварительно, исходя из pH исходных растворов, концентрации сульфат- или нитрат-ионов. Коэффициенты активности вычисляются по расширенному уравнению Дебая–Хюккеля (уравнение B-dot), что для данных значений ионной силы вполне корректно. Результатами расчета являются концентрации равновесных форм в растворе, их коэффициенты активности и логарифмы активностей.
Расчет выполнен с учетом образования в растворе следующих частиц Fe(III) и Se(IV):
– различных форм диссоциации селенистой кислоты (H2SeO3, ${\text{HSeO}}_{3}^{ - },$ ${\text{SeO}}_{3}^{{2 - }}$);
– комплексов железа с анионами OH– (FeOH2+, ${\text{Fe(OH)}}_{2}^{ + },$ ${\text{Fe(OH)}}_{3}^{0},$ ${\text{Fe(OH)}}_{4}^{ - },$ ${\text{F}}{{{\text{e}}}_{{\text{2}}}}{\text{(OH)}}_{2}^{{4 + }}$ и ${\text{F}}{{{\text{e}}}_{{\text{3}}}}{\text{(OH)}}_{4}^{{5 + }});$
– комплексов железа с анионами ${\text{SO}}_{4}^{{2 - }}$ и ${\text{HSO}}_{4}^{ - }$ (${\text{FeSO}}_{4}^{ + },$ ${\text{FeHSO}}_{4}^{{2 + }}$).
Кроме того, в базу данных программы нами были дополнительно внесены константы равновесия реакций образования комплексов железа с анионами ${\text{SeO}}_{3}^{{2 - }}$ и ${\text{HSeO}}_{3}^{ - }:$
Полученные в результате расчета значения lg ПР(Fe2(SeO3)3·5H2O) и lg ПР(Fe2(SeO3)3·3H2O) представлены в табл. 2. Средние значения составляют
3. ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Полученные нами величины lg ПР Fe2(SeO3)3·5H2O и Fe2(SeO3)3·3H2O очень близки между собой. Если сравнить их с литературными данными, то ближе всего к ним значение –41.58, полученное в работе (Rai et al., 1995) для Fe2(SeO3)3·3H2O.
Сравнивать непосредственно экспериментальные данные различных авторов (концентрации Fe и Se в насыщенных растворах) не имеет смысла, т.к. они получены в разных кислотах и при различных значениях pH. Так, в работе (Rai et al., 1995) эксперимент проводился в растворах HCl; авторы (Nishimura et al., 2005) изучали растворимость селенита железа в растворах H2SeO3. В.Г. Чухланцев и Г.П. Томашевский (1957) использовали те же кислоты, что и в нашей работе, но проводили измерения при pH 2.05–2.74 и к тому же определяли в насыщенном растворе только концентрацию железа, а концентрацию селена принимали равной 3/2 от концентрации Fe.
Нужно иметь в виду, что на величину lgПР влияют особенности расчета активностей Fe3+ и ${\text{SeO}}_{3}^{{2 - }}$ из полученных экспериментально брутто-концентраций Fe и Se. Так, в работе (Rai et al., 1995) применялась следующая процедура расчета – учитывалось образование комплексов железа с анионами OH–, Cl–, ${\text{SeO}}_{3}^{{2 - }}$ и ${\text{HSeO}}_{3}^{ - },$ коэффициенты активности хлорид-ионов вычислялись с использованием уравнений Питцера. В.Г. Чухланцев и Г.П. Томашевский (1957) проводили расчет lg ПР вручную, без учета комплексообразования, только на основе констант диссоциации селенистой кислоты и принимая коэффициенты активности всех частиц в растворе равными единице. Заметим, что ими было получено значение lgПР = –30.91, а авторы справочника (Olin et al., 2005) на основе тех же самых исходных данных получили заметно меньшую величину –33.77, т.е. произведение растворимости только за счет другой процедуры расчета оказалось почти на 3 порядка меньше! Что касается работы (Пинаев, Волкова, 1970), то в этой работе вообще нет расчета произведения растворимости – есть составы маточных растворов при различных вариантах синтеза селенита железа(III), состав которого определен авторами как Fe2(SeO3)3·7H2O. Кем и каким образом рассчитано значение lg ПР = –35.4, о котором со ссылкой на статью Г.Ф. Пинаева и В.П. Волковой (1970) сообщается в работе (Nishimura et al., 2005), остается неясным.
Следует также отметить, что при расчетах произведения растворимости в системах с участием железа существенную роль играет окислительно-восстановительный потенциал среды. Можно варьировать его в ходе расчета и получать из одних и тех же исходных данных заметно различающиеся значения lgПР, т.к. в растворе будет меняться соотношение ионов Fe3+ и Fe2+. Мы в своих расчетах остановились на Eh = 0.78 В, т.к. при более низких значениях преобладающей формой является Fe(II), а не Fe(III), а при более высоких Eh селен в растворах оказывается преимущественно в виде соединений Se(VI). Разумеется, подобные допущения, влияющие на результат расчета, весьма условны, поэтому можно считать наши данные довольно близкими к результатам работы (Rai et al., 1995), несмотря на различие произведений растворимости на 2.5 порядка. При этом и наши, и литературные данные очень сильно отличаются от значения lgПР(Fe2(SeO3)3·5H2O), рассчитанного из калориметрических данных. Попытаемся проанализировать возможные причины такого расхождения.
Прежде всего напомним, что для определения произведений растворимости (ПР) чаще всего используются два метода. Первый – тот, который был реализован в настоящей работе. Это экспериментальное определение растворимости и последующий расчет ПР. Выше уже было сказано о возможных причинах расхождения результатов, полученных различными авторами для lgПР селенита железа. Подобные сложности возникают и для других соединений. Характерный пример приводят авторы обзора (Oelkers et al., 2009) – литературные данные по константам равновесия с насыщенным раствором такого распространенного и хорошо изученного минерала как апатит, различаются почти на 10 порядков. В обзоре (Nordstrom et al., 2014) перечислены следующие общие сложности, имеющие место при расчете ПР из экспериментальных данных по растворимости: неправильная характеристика твердой фазы до и/или после эксперимента, отсутствии доказательств конгруэнтного растворения, неправильный расчет коэффициентов активности, пренебрежение ассоциацией ионов в растворе.
Второй метод – вычисление lgПР из данных о стандартных свободных энергиях Гиббса образования $\left( {{{{{\Delta }}}_{{\text{f}}}}{{G}^{0}}} \right)$ веществ. В нашем случае это кристаллический селенит железа и частицы в насыщенном, равновесном с ним растворе (уравнения реакций (1) и (2)). Зная ${{{{\Delta }}}_{{\text{f}}}}{{G}^{0}}$ всех участников реакции, можно найти изменение потенциала Гиббса (${{{{\Delta }}}_{r}}{{G}^{0}})$, а затем и произведение растворимости:
Здесь R – универсальная газовая постоянная, T – температура (К). При этом, как пишут авторы монографии “Произведения растворимости” (Кумок и др., 1983), “расчет из системы ${{{{\Delta }}}_{{\text{f}}}}{{G}^{0}}$ может приводить к менее правильным результатам из-за наличия несогласованностей в этой системе”, поскольку не существует единой базы согласованных между собой исходных термодинамических данных. Как отмечают авторы одного из наиболее полных обзоров по теме термодинамических данных для описания системы “вода-порода” (Oelkers et al., 2009), “создание термодинамических баз данных может стать одним из величайших достижений в области геохимии за последнее столетие”. К сожалению, эта задача пока не решена, что приводит иногда не просто к неточным, но и к принципиально неверным результатам. Приведем два примера. В нашей работе (Чарыкова и др., 2009) мы уже разбирали случай минерала мелантерита (FeSO4∙7H2O). Расчет lgПР из величин ${{{{\Delta }}}_{{\text{f}}}}{{G}^{0}}$ для FeSO4∙7H2O, Fe2+, ${\text{SO}}_{4}^{{2 - }}$ и H2O, приведенных в справочнике (Wagman et al., 1982), дают результат lgПР = –10.7, что явно противоречит действительности, поскольку это хорошо растворимое вещество. Растворимость мелантерита изучена экспериментально (Reardon, Beckie, 1987; Christov, 2004) и составляет величину порядка 2 моль/1000 г H2O, что соответствует lgПР = –2.22 (рассчитано нами в работе (Чарыкова и др., 2010); В.Н. Кумок и соавторы (1983) дают близкое к нашему значение –2.46). Противоположный пример приведен в монографии (Кумок и др., 1983). Расчет произведения растворимости пирофосфата бария (Ba2P2O7) из величин ${{{{\Delta }}}_{{\text{f}}}}{{G}^{0}}$ дает значение lg ПР = –0.5, что противоречит известному экспериментальному факту о плохой растворимости этого вещества. Реальная величина lgПР должна быть не больше –10.5.В приведенных примерах причину расхождения, очевидно, нужно искать в исходных термодинамических данных. Действительно, как справедливо отмечено, например, в работах (Кумок и др., 1983; Nordstrom et al., 2014), расчет произведения растворимости по значениям свободной энергии, основанным на калориметрических данных, обычно включает в себя вычисление разностей больших чисел, имеющих, соответственно, довольно большие абсолютные погрешности. С этим может быть связана большая погрешность конечного результата, иногда делающая его неприемлемым. Не случайно авторы (Кумок и др., 1983) рекомендуют сопоставлять результаты расчета lg ПР из величин ${{{{\Delta }}}_{{\text{f}}}}{{G}^{0}}$ хотя бы с качественными сведениями о растворимости.
В нашем случае определение lg ПР селенита железа обоими методами – и из экспериментальных данных по растворимости, и путем расчета из величин ${{{{\Delta }}}_{{\text{f}}}}{{G}^{0}}$ – приводит к правдоподобным результатам для малорастворимого соединения, поэтому заранее трудно сказать, в чем именно нужно искать причину расхождения. Один из возможных источников ошибок при нахождении lg ПР из величин ${{{{\Delta }}}_{{\text{f}}}}{{G}^{0}}$ заключается именно в несогласованности или в недостаточной надежности используемых справочных данных для соединений Fe(III) (об этом подробно пишут, например, авторы работы (Majzlan et al., 2006)). В случае синтетического аналога мандариноита в работе (Lelet et al., 2018) энтальпия образования ${{{{\Delta }}}_{{\text{f}}}}{{H}^{0}}$(Fe2(SeO3)3·5H2O) рассчитывалась из теплот растворения с привлечением термодинамических данных из справочника (Wagman et al., 1982) для следующих веществ: ${{{{\Delta }}}_{{\text{f}}}}{{H}^{0}}({\text{Fe}}\left( {{\text{N}}{{{\text{O}}}_{3}}{{)}_{3}}{\kern 1pt} \cdot {\kern 1pt} 9{{{\text{H}}}_{2}}{\text{O}},{\text{\;cr}}} \right)$ = –3285.3 кДж/моль, ${{{{\Delta }}}_{{\text{f}}}}{{H}^{0}}\left( {{\text{NaSe}}{{{\text{O}}}_{3}},{\text{\;cr}}} \right)$ = –958.6 кДж/моль, ${{{{\Delta }}}_{{\text{f}}}}{{H}^{0}}\left( {{\text{NaN}}{{{\text{O}}}_{3}},{\text{\;cr}}} \right)$ = –467.85 кДж/моль, ${{{{\Delta }}}_{{\text{f}}}}{{H}^{0}}\left( {{{{\text{H}}}_{2}}{\text{O}},{\text{\;liq}}} \right)$ = –285.83 кДж/моль. Между тем база данных “Термические константы веществ”, в основе которой лежит наиболее полное отечественное справочное издание (Термические константы…, 1965–1982), дает для ${\text{Fe}}{{({\text{N}}{{{\text{O}}}_{3}})}_{3}}{\kern 1pt} \cdot {\kern 1pt} 9{{{\text{H}}}_{2}}{\text{O}}$ существенно отличающееся значение –3338.832 кДж/моль. При дальнейшем расчете lgПР(Fe2(SeO3)3·5H2O) из величин ${{{{\Delta }}}_{{\text{f}}}}{{G}^{0}}$ используются ${{{{\Delta }}}_{{\text{f}}}}{{G}^{0}}$(Fe3+aq) = –4.7 кДж/моль, ${{{{\Delta }}}_{{\text{f}}}}{{G}^{0}}$(${\text{SeO}}_{3}^{{2 - }}$aq) = –369.8 кДж/моль, ${{{{\Delta }}}_{{\text{f}}}}{{G}^{0}}$(H2O, liq) = –237.129 кДж/моль (Wagman et al., 1982), но и в этом случае возможны разночтения. Так, для ${{{{\Delta }}}_{{\text{f}}}}{{G}^{0}}$(Fe3+aq) в литературе можно найти существенно отличающиеся данные: –16.28 кДж/моль (Parker, Khodakovskii, 1995) и –16.7 кДж/моль (Robie, Hemingway, 1995). Эти отличия иногда могут показаться не очень значительными, но в совокупности и с учетом умножения ${{{{\Delta }}}_{{\text{f}}}}{{G}^{0}}$ на стехиометрические коэффициенты они могут заметно повлиять на результат расчета. Например, расчет из того же значения ${{{{\Delta }}}_{{\text{f}}}}{{G}^{0}}($Fe2(SeO3)3·5H2O), но с ${{{{\Delta }}}_{{\text{f}}}}{{G}^{0}}$(Fe3+aq) = = –16.7 кДж/моль вместо –4.7 кДж/моль изменяет lgПР(Fe2(SeO3)3·5H2O на 4 единицы (–47.70 вместо –51.90).
Отметим и еще одно обстоятельство, связанное с термодинамическими функциями образования частиц в растворе. Термодинамические данные всегда относятся к выбранному стандартному состоянию. Для твердых веществ это понятие не вызывает вопросов, но для растворенного вещества это гипотетический раствор, в котором и моляльная концентрация вещества, и его коэффициент активности равны единице. Результаты реальных измерений должны быть затем экстраполированы на стандартное состояние, что не всегда может быть выполнено точно (или вообще не может быть выполнено). Как отмечают авторы (Olin et al., 2005), такая ситуация неизменно имеет место в реакциях с участием ионов с высоким зарядом. Точная термодинамическая информация для этих систем может быть получена только в присутствии инертного электролита, гарантирующего, что коэффициенты активности будут достаточно постоянными на протяжении всех измерений. Возможно, именно это обстоятельство влияет на различие между данными разных авторов для ${{{{\Delta }}}_{{\text{f}}}}{{G}^{0}}$(Fe3+aq).
4. ЗАКЛЮЧЕНИЕ
В работе получены следующие основные результаты:
1. Синтезированы аналог мандариноита Fe2(SeO3)3∙5H2O и кристаллогидрат Fe2(SeO3)3∙3H2O; проведена их идентификация методами порошковой дифрактометрии и энергодисперсионного рентгеноспектрального микроанализа, рассчитаны параметры элементарной ячейки.
2. Определена растворимость обоих кристаллогидратов селенита железа(III) и рассчитаны их произведения растворимости: lg ПР(Fe2(SeO3)3·5H2O) = –38.6 ± 0.5 и lg ПР(Fe2(SeO3)3·3H2O) = –39.0 ± 0.2. Таким образом, произведения растворимости двух разных кристаллогидратов в данном случае почти не отличаются. Учитывая сложности экспериментального изучения взаимодействия селенита железа с водными растворами (гидролиз катионов и анионов, зависимость от окислительно-восстановительных условий системы, возможность инконгруэнтного растворения, зависимость результата от особенностей процедуры расчета ПР из экспериментальных данных), полученные нами значения lgПР можно считать довольно близкими к величине lg ПР(Fe2(SeO3)3·3H2O, полученной в работе (Rai et al., 1995) и рекомендованной в справочнике (Olin et al., 2005).
3. Проанализировав причины возможных расхождений между значениями lgПР мандариноита, полученными различными методами, можно сделать вывод, что значения, найденные из данных по растворимости, вероятно, более адекватно характеризуют поведение этого минерала при взаимодействии с водой, чем величина, полученная из ${{{{\Delta }}}_{{\text{f}}}}{{G}^{0}},$ чрезвычайно чувствительная к согласованности и надежности справочных данных о термодинамических функциях образования веществ и частиц в растворе.
Работа выполнена с использованием оборудования ресурсных центров СПбГУ “Геомодель” и “Рентгендифракционные методы исследования”.
Список литературы
Бакеева С.С., Мулдаргалиева Р.А., Букетов Е.А., Пашинкин А.С. О термической устойчивости среднего селенита железа // Труды химико-металлургического института АН Казахской ССР. 1970. Т. 15. С. 88–92.
Кривовичев В.Г., Чарыкова М.В., Яковенко О.С., Депмайер В. Термодинамика арсенатов, селенитов и сульфатов в зоне окисления сульфидных руд. IV. Диаграммы Eh–pH для систем Me–Se–H2O (Me = Co, Ni, Fe, Cu, Zn, Pb) при 25 °C // ЗРМО. 2010. Т. 137. № 4. С. 1–15.
Кумок В.Н., Кулешова О.М., Карабин Л.А. Произведения растворимости. Новосибирск: Наука, 1983. 267 с.
Пинаев Г.Ф., Волкова В.П. Получение и некоторые свойства селенита железа(III). Общая и прикладная химия: республиканский межведомственный сборник. 1970. № 3. С. 33–39.
Термические константы веществ: Вып. 1–10 / Отв. ред. Глушко В.П. М.: ВИНИТИ, 1965–1982.
Чарыкова М.В., Кривовичев В.Г., Депмайер В. Термодинамика арсенатов, селенитов и сульфатов в зоне окисления сульфидных руд. I. Термодинамические константы при стандартных условиях // ЗРМО. 2009. Т. 138. № 6. С. 105–117.
Чарыкова М.В., Кривовичев В.Г., Депмайер В. Термодинамика арсенатов, селенитов и сульфатов в зоне окисления сульфидных руд. II. Системы М1, M2 // ${\text{SO}}_{4}^{{2 - }}$–H2O (М1, M2 = Fe2+, Fe3+, Cu2+, Zn2+, Pb2+, Ni2+, Co2+, H+) при 298 K // ЗРМО. 2010. Т. 139. № 1. С. 3–18.
Чухланцев В.Г. Произведение растворимости селенитов некоторых металлов // Журн. неорг. химии. 1956а. Т. 1. С. 2300–2305.
Чухланцев В.Г. Произведение растворимости ряда арсенатов // Журн. аналит. химии. 1956б. Т. 11. С. 529–535.
Чухланцев В.Г., Томашевский Г.П. Растворимость селенитов некоторых металлов // Журн. аналит. химии. 1957. Т. 12. С. 296–301.
Дополнительные материалы отсутствуют.
Инструменты
Записки Российского минералогического общества


