Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 1, стр. 100-110
Взаимосвязь между андрогенным дефицитом и ослаблением чувствительности аденилатциклазы к гонадотропинам в семенниках крыс со стрептозотоциновым диабетом различной степени тяжести
А. А. Бахтюков 1, *, К. В. Деркач 1, А. О. Шпаков 1
1 Федеральное государственное бюджетное учреждение науки
Институт эволюционной физиологии и биохимии им. И.М. Сеченова
Российской академии наук
Санкт-Петербург, Россия
* E-mail: bahtyukov@gmail.com
Поступила в редакцию 26.10.2018
После доработки 26.10.2018
Принята к публикации 30.11.2018
Аннотация
Сахарный диабет 1-го типа (СД1) приводит к дисфункциям мужской репродуктивной системы, что обусловлено снижением синтеза тестостерона семенниками. Вопрос о том, как тяжесть СД1 влияет на продукцию тестостерона, и какую роль в развитии андрогенного дефицита играет снижение чувствительности аденилатциклазной системы клеток Лейдига к гонадотропинам, остается малоисследованным. Цель работы состояла в изучении базального и стимулированного хорионическим гонадотропином человека уровня тестостерона у самцов крыс с тяжелой, средней и мягкой формами СД1, а также в исследовании регуляции фермента аденилатциклазы (АЦ) негормональными агентами (форсколином, GppNHp) и хорионическим гонадотропином человека в тестикулярных мембранах диабетических крыс. Тяжелую и среднюю формы СД1 вызывали обработкой четырехмесячных крыс стрептозотоцином в дозах 60 и 35 мг/кг, мягкую форму СД1 – обработкой пятисуточных крысят стрептозотоцином (75 мг/кг), что приводило к развитию диабета в возрасте 4 месяцев. Значения AUC(11.00–18.00) (интегрированная площадь под кривой “концентрация тестостерона (нМ)–время (ч)") в группах с тяжелой средней и мягкой формами СД1 составили 50.4 ± 10.4, 75.7 ± 21.2 и 105.9 ± 9.3 усл. ед. и были снижены на 69, 53 и 34% в сравнении с контролем (161.1 ± 18.6 усл. ед., p < 0.05). Значения AUC(11.00–16.00) для стимулированного хорионическим гонадотропином человека (100 МЕ/крысу) уровня тестостерона в тех же группах составили 115.4 ± 30.4, 229.6 ± 64.3 и 306.4 ± 58.8 усл. ед. и были снижены на 74, 48 и 31% в сравнении с контролем (445.4 ± 132.7 усл. ед., p < 0.05). В тестикулярных мембранах крыс группы с тяжелой формой СД1 базальная и стимулированная форсколином, GppNHp и хорионическим гонадотропином человека активность АЦ были снижены на 34, 39, 54 и 68% соответственно. В группах со средней и мягкой формами СД1 снижались только АЦ эффекты GppNHp и хорионического гонадотропина человека. Таким образом, выраженность андрогенного дефицита у крыс с СД1 и стероидогенный ответ при обработке хорионическим гонадотропином человека зависят от тяжести СД1, а ключевой причиной андрогенного дефицита являются нарушения функциональной активности чувствительной к гонадотропинам аденилатциклазной системы в семенниках диабетических крыс.
Сахарный диабет 1-го типа (СД1) характеризуется в различной степени выраженными дисфункциями мужской половой системы, среди которых снижение либидо, нарушение сперматогенеза и, как следствие, снижение фертильности сперматозоидов [1, 2]. Одной из первопричин этих изменений является нарушение функционирования гипоталамо-гипофизарно-гонадной оси и ослабление стероидогенной функции семенников [3]. Андрогенный дефицит приводит не только к нарушениям репродуктивных функций, но и негативно сказывается на функционировании сердечно-сосудистой, нервной и эндокринной систем, опорно-двигательного аппарата. Логично предположить, что степень выраженности андрогенного дефицита у мужчин с СД1, а следовательно, и индуцируемых им функциональных нарушений должна определяться тяжестью и продолжительностью СД1, а также зависеть от качества гликемического контроля. Однако исследования в этом направлении практически не ведутся, тем более что многочисленные кокрейновские обзоры, в которых анализируются взаимосвязи между диабетической патологией и репродуктивными дисфункциями у мужчин, включают, как правило, гетерогенные группы диабетических пациентов без дифференцированной оценки тяжести СД1.
Остается невыясненным важный с теоретической и практической точек зрения вопрос о том, нарушения в каких звеньях гипоталамо-гипофизарно-гонадной оси играют определяющую роль в снижении продукции тестостерона. Так, согласно данным различных авторов, в условиях СД1 могут снижаться как уровни продуцируемого гипоталамическими нейронами гонадолиберина, рилизинг-фактора лютеинизирующего и фолликулостимулирующего гормонов, так и продуцируемого гонадотрофами гипофиза лютеинизирующего гормона, который, связываясь с рецепторами к нему в клетках Лейдига семенников, стимулирует в них продукцию тестостерона [1, 2]. Предполагается, что функциональные нарушения в клетках Лейдига, в том числе снижение их ответа на воздействие лютеинизирующего гормона и его функционального гомолога – хорионического гонадотропина человека, также могут вносить существенный вклад в снижение андрогенного статуса при СД1.
В настоящее время установлено, что стероидогенный эффект гонадотропинов с активностью, сходной с таковой лютеинизирующего гормона, в клетках Лейдига осуществляется в основном через активацию ими аденилатциклазной сигнальной системы, которая включает рецептор лютеинизирующего гормона, сопряженный с ним гетеротримерный Gs-белок и фермент аденилатциклазу (АЦ), катализирующий образование вторичного посредника цАМФ, активирующего протеинкиназу А и обменные факторы Epac-семейства. Результатом всех этих событий является стимуляция белка StAR, осуществляющего перенос холестерина в митохондрии, где реализуются первые стадии стероидогенеза, и активация большого числа генов, вовлеченных в процессы синтеза и секреции тестостерона [4]. Ослабление стимулирующего эффекта лютеинизирующего гормона и хорионического гонадотропина человека на АЦ в клетках Лейдига при различных по тяжести формах СД1 может являться одной из ключевых причин андрогенного дефицита, но исследований в этом направлении не проводилось.
Цель работы состояла в сравнительном изучении нарушений базальной и стимулированной хорионическим гонадотропином человека продукции тестостерона у самцов крыс с различным по степени тяжести СД1, а также в исследовании активации гонадотропином АЦ в семенниках диабетических крыс как триггера продукции тестостерона. Изучали формы СД1, различающиеся по выраженности гипергликемии и инсулинового дефицита, а также по тяжести функциональных и метаболических нарушений. Среди них (1) тяжелая форма СД1 с сильно выраженной гипергликемией и острым дефицитом инсулина, вызываемая инъекцией высокой дозы (60 мг/кг) стрептозотоцина взрослым самцам крыс [5], (2) средняя форма СД1, вызываемая инъекцией взрослым животным более низкой дозы стрептозотоцина (35 мг/кг), которая характеризуется постепенным смягчением изначально сильно выраженных гипергликемии и гипоинсулинемии вследствие запуска регенеративных процессов в поджелудочной железе [5], и (3) мягкая форма СД1, вызываемая инъекцией стрептозотоцина в дозе 75 мг/кг пятисуточным крысятам, что в возрасте 3 месяцев приводит к развитию умеренной гипергликемии на фоне снижения уровня инсулина [6]. Поскольку для этой модели характерны инсулиновая резистентность и дислипидемия, ее также рассматривают как модель, сочетающую черты СД1 и СД2.
Таблица 1.
Масса тела, уровни глюкозы и инсулина у диабетических крыс в сравнении с таковыми у контрольных животных, M ± SD, в каждой группе n = 12
| Масса тела, г | Глюкоза, мМ | Инсулин, нг/мл | |
|---|---|---|---|
| Контроль | 308 ± 15 | 4.4 ± 0.2 | 0.71 ± 0.20 |
| Тяжелая форма СД1 | 240 ± 17* | 21.4 ± 4.4* | 0.11 ± 0.06* |
| Средняя форма СД1 | 276 ± 13* | 13.9 ± 2.7* | 0.24 ± 0.10* |
| Мягкая форма СД1 | 311 ± 18 | 11.7 ± 1.7* | 0.54 ± 0.21 |
МЕТОДЫ ИССЛЕДОВАНИЯ
Для экспериментов использовали четырехмесячных самцов крыс линии Вистар, которых содержали в стандартных условиях и на стандартном рационе. Все процедуры выполняли в соответствии с требованиями Этического комитета ИЭФБ РАН, European Communities Council Directive 1986 (86/609/EEC) и “Guide for the Care and Use of Laboratory Animals”.
Для создания модели тяжелого СД1 самцам крыс в/б вводили стрептозотоцин (Sigma, США) в охлажденном 0.1 М Na-цитратном буфере (pH 4.5) в дозе 60 мг/кг. Через 10 суток отбирали животных с постпрандиальным уровнем глюкозы в крови выше 17 мМ. Для создания модели среднего СД1 самцам крыс в тех же условиях вводили более низкую дозу стрептозотоцина – 35 мг/кг, и через 10 дней отбирали животных с постпрандиальным уровнем глюкозы выше 12 мМ. Для индукции мягкого СД1 пятисуточным крысятам в/б вводили стрептозотоцин в дозе 75 мг/кг [6]. Животных тестировали в трехмесячном возрасте, когда у них выявлялись отчетливо выраженные признаки постпрандиальной гипергликемии и нарушенной толерантности к глюкозе. Для оценки толерантности к глюкозе использовали глюкозотолерантный тест, в ходе которого крысам в/б вводили 40%-ный раствор глюкозы из расчета 2 г/кг. Для дальнейших экспериментов отбирали животных с уровнем глюкозы выше 11 мМ через 120 мин после нагрузки. Таким образом были сформированы 4 группы крыс – контроль (К, n = 12), тяжелая (ДТ, n = 12), средняя (ДС, n = 12) и мягкая формы СД1 (ДМ, n = 12). Для экспериментов в каждой группе случайным образом формировали по две подгруппы (в каждой n = 6). Одна из них использовалась для оценки базального и стимулированного хорионическим гонадотропином человека уровня тестостерона, другая – для экспериментов in vitro, включающих выделение тестикулярных мембран и определение в них активности АЦ. Группы ДТ и ДС изучали через 30 дней после обработки стрептозотоцином, группу ДМ – в четырехмесячном возрасте, спустя месяц после развития признаков СД.
Уровень тестостерона в крови, взятой из хвостовой вены крыс, определяли с помощью набора “Тестостерон-ИФА” (Алкор-Био, Россия). Для оценки базального уровня тестостерона кровь забирали в течение 7 ч (в 11.00, 12.00, 14.00, 16.00 и 18.00), для оценки уровня тестостерона, стимулированного хорионическим гонадотропином человека (Московский эндокринологический завод, Россия), оценивали изменение концентрации тестостерона в крови до обработки (базовый уровень) и через 1, 3 и 5 ч после обработки животных гонадотропином. Хорионический гонадотропин человека вводили однократно, п/к, в дозе 100 МЕ/крысу.
Фракции плазматических мембран из семенников крыс выделяли, как описано ранее [7]. Для этого животных декапитировали под наркозом, забирали у них ткани семенников, измельчали их и гомогенизировали на холоде в 40 мМ Tris-HCl-буфере (pH 7.5), содержащем 5 мМ MgCl2, 10% сахарозы и ингибиторы протеаз. Гомогенат центрифугировали (1500 g, 10 мин), полученный супернатант снова центрифугировали (20 000 g, 30 мин), осадок ресуспендировали в буфере без сахарозы и снова центрифугировали (20 000 g, 30 мин). Осажденные мембраны суспендировали в 40 мМ Tris-HCl буфере (pH 7.5) и использовали для определения активности АЦ, которое проводили, как описано ранее [8]. Для этого использовали инкубационную смесь состава (мМ): 50 Tris-HCl (pH 7.5), 5 MgCl2, 0.1 цАМФ, 1 АТФ, креатинфосфата, 0.2 мг/мл креатинфосфокиназы (Sigma, США), 37 кБк [α-32P]АТФ (Изотоп, Россия). Реакцию начинали добавлением 50–100 мкг мембранного белка, проводили в течение 12 мин при 37°C и останавливали добавлением 100 мкл 0.5 M HCl. Образовавшийся [32P]цАМФ отделяли с помощью адсорбционной хроматографии на окиси алюминия. Радиоактивность измеряли на счетчике LKB 1209/1215 RackBeta (LKB, Швеция). Активность АЦ выражали в пмоль цАМФ/мин/мг мембранного белка.
Статистический анализ данных проводили с использованием метода ANOVA (Manugistics Inc., США). Различия между пробами оценивали с помощью t-критерия Стьюдента как достоверные при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В группах с тяжелой и средней формами СД1 отмечали снижение массы тела, в значительной степени выраженные гипергликемию и инсулиновый дефицит, в то время как для крыс группы с мягкой формой СД1 масса тела и уровень инсулина менялись слабо, а гипергликемия была выражена в небольшой степени (см. таблицу 1). С помощью глюкозотолерантного теста у крыс с мягким СД1 была показана нарушенная толерантность к глюкозе, на что указывает повышение в сравнении с контролем значения AUC0–120 – интегрированной площади под кривой “концентрация глюкозы(мМ)–время(120 мин)" (1869 ± 322 против 1011 ± 67 усл. ед., p < 0.05).
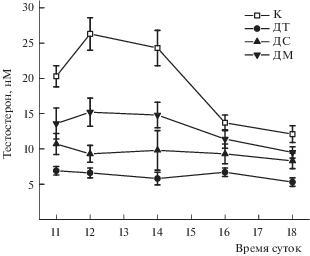
Исследование базального уровня тестостерона у самцов крыс с тяжелой и средней формами СД1 показало, что у них практически отсутствует динамика изменения уровня гормона в период времени с 11.00 до 18.00 (рис. 1). Рассчитанные значения AUC(11.00–18.00) – интегрированной площади под кривой “концентрация тестостерона(нМ)–время(ч)", в группах с тяжелой и средней формами СД1 составили 50.4 ± 10.4 и 75.7 ± 21.2 усл. ед. и были снижены в сравнении с контролем (161.1 ± 18.6 усл. ед.) на 69 и 53% соответственно (p < 0.05 в сравнении с контролем). У крыс с мягкой формой СД1 значение AUC(11.00–18.00) также было ниже, чем в контроле (105.9 ± 9.3 усл. ед.), но это снижение было выражено в меньшей степени, чем в группах с тяжелым и средним СД1 (рис. 1). Более того, у крыс с мягким СД1 сохранялась суточная динамика изменения уровня тестостерона, сходная с таковой в контрольной группе.
Рис. 1.
Динамика изменений базального уровня тестостерона в крови крыс с различными моделями сахарного диабета 1-го типа в сравнении с контрольными животными. Значения представлены как M ± SEM. Обозначения групп: К – контроль; ДТ – тяжелая форма СД1; ДС – средняя форма СД1; ДМ – мягкая форма СД1. В каждой группе n = 6.
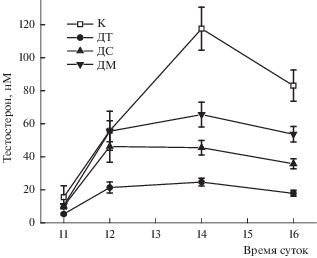
Далее изучали стимулирующий эффект хорионического гонадотропина человека на уровень тестостерона у контрольных и диабетических крыс при однократном его введении в дозе 100 МЕ/крысу. Для оценки стимулирующего эффекта гонадотропина рассчитывали значения AUC(11.00–16.00). Как и в случае базального уровня тестостерона, стимулирующий эффект хорионического гонадотропина человека на продукцию тестостерона был в наибольшей степени снижен у крыс с тяжелой формой СД1 (115.4 ± 30.4 усл. ед.), составляя 26% от такового в контроле (445.4 ± 132.7 усл. ед., p < 0.05) (рис. 2). Значения AUC(11.00–16.00) для стимулированного хорионическим гонадотропином человека уровня тестостерона в группах со средним и мягким СД1 (229.6 ± 64.3 и 306.4 ± 58.8 усл. ед.) были снижены в меньшей степени и составили 52 и 69% от AUC(11.00–16.00) в контроле.
Рис. 2.
Стимулирующий эффект хорионического гонадотропина человека на уровень тестостерона в крови диабетических и контрольных крыс. Обозначения групп как на рис. 1, в каждой группе n = 6. Значения представлены как M ± SEM.
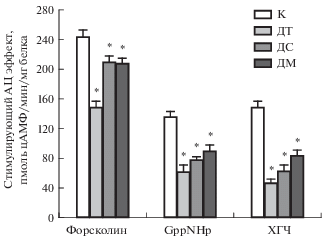
Базальная активность АЦ в тестикулярных мембранах, выделенных из семенников контрольных крыс, составила 24.5 ± 1.3 пмоль цАМФ/мин/мг белка. В группах с тяжелой и средней формами СД1 она была достоверно снижена (16.1 ± 1.5 и 20.5 ± 1.4 пмоль цАМФ/мин/мг белка, p < 0.05 в сравнении с группой К), а в группе с мягким СД1 имела тенденцию к снижению, но статистически значимо не отличалась от базальной активности АЦ в контроле (22.8 ± 2.3 пмоль цАМФ/мин/мг белка, p > 0.05 в сравнении с группой К). Стимулирующий АЦ эффект форсколина (10–5 М), действующего на каталитический сайт фермента, в группе с тяжелым СД1 был снижен в сравнении с контролем на 39%, в группах со средней и мягкой формами СД1 снижение было выражено слабо, хотя различия с контролем были статистически значимыми (p < 0.05) (рис. 3). Стимулирующий АЦ эффект GppNHp (10–5 М), негидролизуемого аналога ГТФ, активирующего Gs-белки, в значительной степени снижался во всех диабетических группах. Стимулирующий эффект хорионического гонадотропина человека (10–7 М) в тестикулярных мембранах крыс с тяжелой формой СД1 был снижен в три раза, в группах со средним и мягким СД1 – в среднем в два раза (рис. 3). Эти данные указывают на значительное ослабление чувствительности семенников диабетических животных к гонадотропинам, что хорошо согласуется с выявленным нами снижением стероидогенной функции, которая регулируется в клетках Лейдига через систему рецептор лютеинизирующего гормона–Gs-белок–АЦ.
Рис. 3.
Стимулирующий эффект форсколина, GppNHp и хорионического гонадотропина (ХГЧ) на активность АЦ в тестикулярных мембранах контрольных и диабетических крыс. Концентрации стимуляторов АЦ – форсколин (10–5 М), GppNHp (10–5 М) и ХГЧ (10–7 М). Стимулирующий АЦ эффект представляет собой прирост активности фермента над ее базальным уровнем, пмоль цАМФ/мин/мг белка. Обозначения групп как на рис. 1, в каждой группе n = 6. Значения представлены как M ± SD. * – различия с контролем статистически значимы при p < 0.05.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В условиях СД1 у человека и экспериментальных животных в значительной степени нарушаются все звенья гипоталамо-гипофизарно-гонадной оси, следствием чего является ослабление продукции половых стероидных гормонов, и это приводит к репродуктивным дисфункциям и бесплодию [1, 2, 9]. Среди механизмов, лежащих в основе дисфункций гипоталамо-гипофизарно-гонадной оси при СД1, рассматривают снижение продукции гонадолиберина гипоталамическими нейронами [10], ослабление ответа гонадотрофов гипофиза, секретирующих гонадотропины, на воздействие гонадолиберина [11, 12], а также нарушение функционирования гонад, являющееся следствием усиления окислительного стресса, процессов воспаления и апоптоза в условиях диабетической патологии [3, 13, 14].
Несмотря на то, что снижение регуляторного воздействия гонадотропинов на активность зависимой от лютеинизирующего гормона системы в клетках Лейдига может играть ведущую роль в развитии андрогенного дефицита при СД1, этот вопрос изучен недостаточно. Принято считать, что ослабление стероидогенной функции семенников при СД1 у человека и при экспериментальных моделях этого заболевания у грызунов опосредовано в основном дефицитом циркулирующего в крови лютеинизирующего гормона [2, 9, 15, 16]. При этом основными факторами такого снижения считают ослабление секреции гонадолиберина гипоталамическими нейронами в условиях инсулиновой и лептиновой недостаточности, характерных для СД1. Известно, что инсулин положительно влияет на продукцию лептина, на что указывают данные о нормализации уровня лептина у пациентов с СД1 при их лечении инсулином [17, 18]. Лептин, в свою очередь, преодолевая гематоэнцефалический барьер, стимулирует функциональную активность гипоталамических нейронов, в которых осуществляется синтез и секреция гонадолиберина [19]. Отчетливо продемонстрированная нами положительная корреляция между снижением уровня андрогенов у крыс с различными по тяжести и выраженности инсулиновой недостаточности моделями СД1 может являться косвенным доказательством роли инсулиновой и лептиновой систем в функционировании гипоталамических звеньев гипоталамо-гипофизарно-гонадной оси.
Следует, однако, отметить, что снижение уровня лютеинизирующего гормона в крови в условиях СД1 не является столь выраженным, чтобы стать причиной острого дефицита андрогенов. Показано, что умеренное снижение уровня лютеинизирующего гормона в диапазоне его физиологических концентраций почти не сказывается на интенсивности ответа клеток-мишеней на этот гонадотропин, что обусловлено избыточным числом молекул лютеинизирующего гормона по отношению к числу рецепторов [20, 21]. Более того, в ряде работ на фоне значительного снижения уровня тестостерона было обнаружено повышение уровня лютеинизирующего гормона [22] или увеличение доли его высокоактивных форм [12, 23]. Так, у крыс со стрептозотоциновым СД1, несмотря на повышение уровня лютеинизирующего гормона в крови, отмечали значительное ослабление стероидогенеза, что авторы связывают с усилением окислительного стресса и нарушением активности регулируемой лютеинизирующим гормоном сигнальной системы в семенниках [22].
Установлено, что в условиях СД1 из-за нарушения баланса регуляторных влияний гонадолиберина и андрогенов на синтез гонадотропинов гонадотрофами гипофиза меняется соотношение изоформ лютеинизирующего гормона, различающихся по паттерну N-гликозилирования [23]. Как известно, молекулы лютеинизирующего гормона, которые различаются по количеству, заряду и степени разветвленности N-гликанов, сильно варьируют по способности активировать рецептор лютеинизирующего гормона и зависимые от него стероидогенные белки в клетках Лейдига [24]. Показано, что при СД1 в значительной степени повышается доля высокоактивных форм лютеинизирующего гормона, что является механизмом, направленным на восстановление стероидогенного эффекта лютеинизирующего гормона в условиях снижения его суммарного пула в кровотоке [12, 23]. Следует, однако, отметить, что повышение доли высокоактивных форм лютеинизирующего гормона не приводит к нормализации стероидогенной функции клеток Лейдига и не компенсирует острый дефицит тестостерона [23]. Эти факты указывают на то, что причиной снижения продукции тестостерона при СД1 может являться снижение чувствительности семенников к лютеинизирующему гормону и хорионическому гонадотропину человека, что и было продемонстрировано нами при изучении влияния хорионического гонадотропина человека на стероидогенную активность семенников диабетических крыс в условиях in vitro и in vivo.
Нами впервые было показано, что повышение уровня тестостерона, вызванное обработкой крыс с различными по тяжести формами СД1 хорионическим гонадотропином человека, было намного менее выраженным в сравнении со здоровыми животными. В случае тяжелой и средней форм СД1, для которых характерны сильно выраженная гипергликемия и острый дефицит инсулина, стимулирующий эффект хорионического гонадотропина человека, который оценивали по значениям AUC(11.00–16.00), был в четыре и два раза ниже, чем в контроле. Следовательно, заместительная терапия гонадотропинами при СД1 может быть мало эффективной и не давать ожидаемого результата в отношении нормализации стероидогенной функции. Как известно, нарушения гипоталамо-гипофизарно-гонадной оси у мужчин в условиях СД1 описывают как гипогонадотропный гипогонадизм, в связи с чем представляют интерес результаты клинического исследования, в рамках которого лечение гонадолиберином мужчин с гипогонадотропным гипогонадизмом хотя и приводило к значительному повышению у них уровня лютеинизирующего гормона, но не вызывало нормализации сниженного уровня тестостерона [25].
Исследуя молекулярные механизмы ослабления ответа семенников диабетических крыс на хорионический гонадотропин человека, нами в тестикулярных мембранах крыс с СД1 было изучено влияние негормональных агентов и хорионического гонадотропина человека на активность аденилатциклазной сигнальной системы, опосредующей стимуляцию стероидогенных белков. Необходимо отметить, что чувствительная к лютеинизирующему гормону и хорионическому гонадотропину аденилатциклазная система, наряду с рецептором лютеинизирующего гормона, включает Gs-белок, АЦ и нижележащие цАМФ-зависимые эффекторные белки, непосредственно контролирующие систему стероидогенеза в клетках Лейдига. Для активации АЦ необходимо не только эффективное связывание рецептора с гонадотропином, но и полноценное сопряжение как между активированным рецептором и αβγ-гетеротримерным Gs-белком, так и между ГТФ-связанной формой α-субъединицы Gs-белка и регуляторным доменом АЦ [4]. Нами показано, что во всех группах диабетических крыс стимулирующие эффекты хорионического гонадотропина человека и GppNHp, негидролизуемого аналога ГТФ, активирующего Gs-белки, на активность АЦ в тестикулярных мембранах ослабляются примерно в одинаковой степени, в то время как стимулирующий АЦ эффект форсколина, действующего непосредственно на каталитический сайт фермента, существенно снижается только в группе с тяжелой формой СД1. Основываясь на этих данных можно заключить, что при тяжелой форме СД1 в семенниках ослабляются как каталитическая активность АЦ, так и ее функциональное сопряжение с Gs-белками, в то время как при средней и мягкой формах СД1 нарушения локализованы в основном на уровне Gs-белка. Эти изменения в аденилатциклазной системе опосредуют ослабление чувствительности клеток Лейдига к гонадотропинам, хотя нельзя исключить вклада в этот процесс и нарушений функциональной активности рецептора лютеинизирующего гормона и снижения числа рецепторов на поверхности клеток Лейдига.
Основными причинами снижения функциональной активности компонентов аденилатциклазной системы в семенниках при СД1 являются усиление апоптотических и воспалительных процессов, нарушение окислительно-восстановительного баланса, гипергомоцистеинемия, которые развиваются в условиях сильно выраженной гипергликемии. Имеются свидетельства того, что в семенниках грызунов с экспериментальными моделями СД1 повышается уровень активных форм кислорода и ослабляется система антиоксидантной защиты, что ведет к активации проапоптотических каскадов и нарушает процессинг белков в стероидогенных клетках [26, 27]. В условиях СД1 в крови повышается уровень гомоцистеина, что ведет к развитию эндотелиальных дисфункций и лежит в основе развития ряда тяжелых осложнений СД1 [28, 29]. При этом мишенями гомоцистеина являются, в том числе, и компоненты аденилатциклазной системы, в первую очередь Gs-белки [30, 31]. Имеется исследование, в котором показано ослабление активности цАМФ-зависимых путей, вовлеченных в нейростероидогенез, в условиях гипергомоцистеинемии [32]. Вследствие этого можно предположить, что гипергомоцистеинемия может рассматриваться в качестве одного из факторов ослабления функций Gs-белков и снижения чувствительности к гонадотропинам в семенниках диабетических крыс.
Таким образом, нами впервые показано, что выраженность андрогенного дефицита у крыс со стрептозотоциновым СД1 и стероидогенный ответ при обработке животных хорионическим гонадотропином человека зависят от тяжести СД1, выраженности гипергликемии и гипоинсулинемии. Важнейшим механизмом, ответственным за ослабление стероидогенной функции семенников при СД1, является снижение функциональной активности чувствительной к лютеинизирующему гормону и хорионическому гонадотропину человека аденилатциклазной сигнальной системы в семенниках. В случае тяжелой формы СД1 нарушения в ней локализованы во всех основных звеньях, при средней и мягкой формах СД1 они затрагивают преимущественно трансдукторный ее компонент – Gs-белок. Полученные нами данные свидетельствуют в пользу того, что ключевой причиной андрогенного дефицита и ослабления репродуктивных функций при СД1 являются нарушения трансдукции сигнала от активированного рецептора лютеинизирующего гормона в семенниках, ведущие к значительному ослаблению стимулирующего эффекта гонадотропинов на стероидогенез.
Список литературы
Шпаков А.О. Функциональное состояние гипоталамо-гипофизарно-гонадной системы при сахарном диабете. Пробл. эндокринол. 56(5): 23–29. 2010. [Shpakov A.O. The functional state of the hypothalamic-pituitary-gonad system in diabetes mellitus. Probl. Endocrinol. 56(5): 23–29. 2010. (In Russ.)].
Jangir R.N., Jain G.C. Diabetes mellitus induced impairment of male reproductive functions: a review. Curr. Diabetes Rev. 10(3): 147–157. 2014.
Carruthers M. Testosterone deficiency syndrome: cellular and molecular mechanism of action. Curr. Aging Sci. 6(1): 115–124. 2013.
Riccetti L., De Pascali F., Gilioli L., Potì F., Giva L. B., Marino M., Tagliavini S., Trenti T., Fanelli F., Mezzullo M., Pagotto U., Simoni M., Casarini L. Human LH and hCG stimulate differently the early signalling pathways but result in equal testosterone synthesis in mouse Leydig cells in vitro. Reprod. Biol. Endocrinol. 15(1): 2. 2017.
Derkach K.V., Bogush I.V., Berstein L.M., Shpakov A.O. The influence of intranasal insulin on hypothalamic-pituitary-thyroid axis in normal and diabetic rats. Horm. Metab. Res. 47(12): 916–924. 2015.
Shpakov A.O., Chistyakova O.V., Derkach K.V., Moiseyuk I.V., Bondareva V.M. Intranasal insulin affects adenylyl cyclase system in rat tissues in neonatal diabetes. Central Eur. J. Biol. 7(1): 33–47. 2012.
Shpakov A.O., Derkach K.V., Dar’in D.V., Lobanov P.S. Activation of adenylyl cyclase by thienopyrimidine derivatives in rat testes and ovaries. Cell Tissue Biol. 8(5): 400–406. 2014.
Derkach K.V., Bondareva V.M., Chistyakova O.V., Berstein L.M., Shpakov A.O. The effect of long-term intranasal serotonin treatment on metabolic parameters and hormonal signaling in rats with high-fat diet/low-dose streptozotocin-induced type 2 diabetes. Int. J. Endocrinol. 2015: 245459. 2015.
Schoeller E.L., Schon S., Moley K.H. The effects of type 1 diabetes on the hypothalamic, pituitary and testes axis. Cell Tissue Res. 349(3): 839–847. 2012.
Bestetti G.E., Boujon C.E., Reymond M.J., Rossi G.L. Functional and morphological changes in mediobasal hypothalamus of streptozocin-induced diabetic rats. In vitro study of LHRH release. Diabetes. 38(4): 471–476. 1989.
Zeidler A., Gelfand R., Tamagna E., Marrs R., Chopp R., Kletzky O. Pituitary gonadal function in diabetic male patients with and without impotence. Andrologia. 14: 62–68. 1982.
Lopez-Alvarenga J.C., Zarinan T., Olivares A., Gonzalez-Barranco J., Veldhuis J. D., Ulloa-Aguirre A. Poorly controlled type I diabetes mellitus in young men selectively suppresses luteinizing hormone secretory burst mass. J. Clin. Endocrinol. Metab. 87(12): 5507–5515. 2002.
Kianifard D., Sadrkhanlou R.A., Hasanzadeh S. The ultrastructural changes of the Sertoli and Leydig cells following streptozotocin induced diabetes. Iran J. Basic Med. Sci. 15(1): 623–635. 2012.
Liu H., Lin S., Lv Q., Yang Q., Wu G., Hu J., Yang J. Taurine recovers testicular steroidogenesis and spermatogenesis in streptozotocin-induced diabetic rats. Adv. Exp. Med. Biol. 975(Pt 2): 801–811. 2017.
Sudha S., Valli G., Julie P.M., Arunakaran J., Govindarajulu P., Balasubramanian K. Influence of streptozotocin-induced diabetes and insulin treatment on the pituitary-testicular axis during sexual maturation in rats. Exp. Clin. Endocrinol. Diabetes. 108(1): 14–20. 2000.
Baccetti B., La Marca A., Piomboni P., Capitani S., Bruni E., Petraglia F., De Leo V. Insulin-dependent diabetes in men is associated with hypothalamo-pituitary derangement and with impairment in semen quality. Hum. Reprod. 17(10): 2673–2677. 2002.
Hanaki K., Becker D.J., Arslanian S.A. Leptin before and after insulin therapy in children with new-onset type 1 diabetes. J. Clin. Endocrinol. Metab. 84(5): 1524–1526. 1999.
Azar S.T., Zalloua P.A., Zantout M.S., Shahine C.H., Salti I. Leptin levels in patients with type 1 diabetes receiving intensive insulin therapy compared with those in patients receiving conventional insulin therapy. J. Endocrinol. Invest. 25(8): 724–726. 2002.
Бахтюков А.А., Шпаков А.О. Молекулярные механизмы действия лептина на гипоталамо-гипофизарно-гонадную ось. Цитология. 60(10): 755–767. 2018. [Bakhtyukov A.A., Shpakov A.O. Molecular mechanisms of action of leptin on the hypothalamic-pituitary-gonad axis. Tsitologiia. 60(10): 755–767. 2018. (In Russ.)].
Puett D., Angelova K., da Costa M.R., Warrenfeltz S.W., Fanelli F. The luteinizing hormone receptor: insights into structure-function relationships and hormone-receptor-mediated changes in gene expression in ovarian cancer cells. Mol. Cell. Endocrinol. 329(1–2): 47–55. 2010.
Riccetti L., Yvinec R., Klett D., Gallay N., Combarnous Y., Reiter E., Simoni M., Casarini L., Ayoub M.A. Human luteinizing hormone and chorionic gonadotropin display biased agonism at the LH and LH/CG receptors. Sci. Rep. 7(1): 940. 2017.
Himabindu B., Madhu P., Reddy P.S. Diabetes and alcohol: Double jeopardy with regard to oxidative toxicity and sexual dysfunction in adult male Wistar rats. Reprod. Toxicol. 51: 57–63. 2015.
Olivares A., Méndez J.P., Cárdenas M., Oviedo N., Palomino M.A., Santos I., Perera-Marín G., Gutiérrez-Sagal R., Ulloa-Aguirre A. Pituitary-testicular axis function, biological to immunological ratio and charge isoform distribution of pituitary LH in male rats with experimental diabetes. Gen. Comp. Endocrinol. 161(3): 304–312. 2009.
Шпаков А.О. Гликозилирование гонадотропинов, как важнейший механизм регуляции их активности. Рос. физиол. журн. им. И.М. Сеченова. 103(9): 1004–1021. 2017. [Shpakov A.O. Glycosylation of gonadotropins, as the most important mechanism of regulation of their activity. Russ. J. Physiol. 103(9): 1004–1021. 2017. (In Russ.)].
Sykiotis G.P., Hoang X.H., Avbelj M., Hayes F.J., Thambundit A., Dwyer A., Au M., Plummer L., Crowley W.F., Pitteloud N. Congenital idiopathic hypogonadotropic hypogonadism: evidence of defects in the hypothalamus, pituitary, and testes. J. Clin. Endocrinol. Metab. 95(6): 3019–3027. 2010.
Li M., Liu Z., Zhuan L., Wang T., Guo S., Wang S., Liu J., Ye Z. Effects of apocynin on oxidative stress and expression of apoptosis-related genes in testes of diabetic rats. Mol. Med. Rep. 7(1): 47–52. 2013.
Kanter M., Aktas C., Erboga M. Curcumin attenuates testicular damage, apoptotic germ cell death, and oxidative stress in streptozotocin-induced diabetic rats. Mol. Nutr. Food Res. 57(9): 1578–1585. 2013.
Abdel Aziz M.T., Fouad H.H., Mohsen G.A., Mansour M., Abdel Ghaffar S. TNF-α and homocysteine levels in type 1 diabetes mellitus. East Mediterr. Health J. 7(4–5): 679–688. 2001.
Xu C., Wu Y., Liu G., Liu X., Wang F., Yu J. Relationship between homocysteine level and diabetic retinopathy: a systematic review and meta-analysis. Diagn. Pathol. 9: 167. 2014.
Vacek T.P., Sen U., Tyagi N., Vacek J.C., Kumar M., Hughes W.M., Passmore J.C., Tyagi S.C. Differential expression of Gs in a murine model of homocysteinemic heart failure. Vasc. Health Risk Manag. 5(1): 79–84. 2009.
Winchester L., Veeranki S., Givvimani S., Tyagi S.C. Exercise mitigates the adverse effects of hyperhomocysteinemia on macrophages, MMP-9, skeletal muscle, and white adipocytes. Can. J. Physiol. Pharmacol. 92(7): 575–582. 2014.
El Hajj Chehadeh S., Dreumont N., Willekens J., Canabady-Rochelle L., Jeannesson E., Alberto J.M., Daval J.L., Guéant J.L., Leininger-Muller B. Early methyl donor deficiency alters cAMP signaling pathway and neurosteroidogenesis in the cerebellum of female rat pups. Am. J. Physiol. Endocrinol. Metab. 307(11): 1009–1019. 2014.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


