Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 1, стр. 89-99
Процедуры гипоксического кондиционирования не приводят к чрезмерной активации оксидативного стресса у практически здоровых обследуемых
С. Ю. Крыжановская 1, *, Е. Н. Дудник 1, М. А. Запара 1, В. Г. Самарцева 1, О. С. Глазачев 1
1 Первый Московский государственный медицинский университет имени И.М. Сеченова
(Сеченовский университет)
Москва, Россия
* E-mail: svetlanakry@mail.ru
Поступила в редакцию 03.10.2018
После доработки 11.11.2018
Принята к публикации 22.11.2018
Аннотация
Гипоксическое кондиционирование (ГК) в режиме интервальных пассивных гипоксических тренировок оказывает терапевтические и профилактические эффекты, в реализации которых большое значение имеют активные формы кислорода (АФК). Дискуссионным является вопрос о степени выраженности оксидативного стресса при различных режимах ГК. С применением фотометрической установки FRAS-5 у 24 здоровых мужчин оценили концентрацию АФК (показатель d-ROM), антиоксидантную активность в плазме крови (РАТ) и рассчитали оксидативный стресс-индекс (OSI) до и после однократно проведенных процедур: интервальных гипоксически-нормоксической (ИГНТ) и гипоксически-гипероксической (ИГГТ) тренировок. Схема тренировки: эпизод дыхания гипоксической смесью (10% О2) 4–6 мин, затем атмосферный воздух или гипероксическая смесь (35% О2) 1.5–2 мин; всего – 40–45 мин. Не зарегистрировано достоверных среднегрупповых изменений исследуемых показателей после обеих процедур ГК при существенной индивидуальной вариабельности “ответов”. У большинства обследуемых значения показателей оставались в диапазонах нормальных или пограничных величин. Установлены значимая прямая связь между степенью десатурации крови кислородом (Delta SaO2) и повышением РАТ, отрицательная связь между значениями Delta SaO2 и степенью прироста OSI после проведения ИГГТ, но не ИГНТ. Сделан вывод, что однократные ИГНТ и ИГГТ не вызывают развития выраженного оксидативного стресса у большинства здоровых добровольцев, но изменяют продукцию АФК и степень антиоксидантной защиты. У субъектов, более устойчивых к гипоксии, ИГГТ приводит к более значительному повышению антиоксидантного потенциала и снижению интегративного показателя оксидативного стресса. Полученные результаты подтверждают безопасность применения ИГНТ и ИГГТ. Контроль про-/антиоксидантного статуса на основе показателей, получаемых с применением FRAS-5, может быть информативным для индивидуального подбора процедур адаптации к интервальной гипоксии.
Гипоксическое кондиционирование (ГК), или адаптация к интервальной гипоксии в последние десятилетия становится все более применимым и обоснованным подходом немедикаментозной профилактики и реабилитации пациентов с различными заболеваниями, технологией повышения работоспособности профессиональных спортсменов [1–6]. Экспериментально и клинически доказано, что повторяющиеся эпизоды гипоксии активируют каскад прямых и перекрестных адаптационных эффектов, повышая устойчивость организма как к гипоксическим состояниям, так и другим стрессорам. Это происходит посредством запуска гематологических (увеличение содержания эритропоэтина, гемоглобина, кислородной емкости крови) и негематологических (ангиогенез, активация гликолитической активности, утилизации липидов, систем антиоксидантной защиты, ингибирование апоптоза, повышение буферной емкости мышц, их толерантности к повышению концентрации лактата, биоэнергетической эффективности митохондриальной дыхательной цепи, транспорта глюкозы в мышцах, хеморецепторной чувствительности, снижение симпатико-адреналовой реактивности и др.) механизмов [2, 4, 6–11].
Развитие адаптации к гипоксии и повышение общей неспецифической резистентности организма существенно ускоряются в том случае, когда гипоксическое воздействие разделяется на несколько отдельных повторных эпизодов, сменяемых периодами реоксигенации, а его интенсивность ограничивается той физиологической нормой, при которой еще возможны эффективная компенсация происходящих функциональных сдвигов и быстрое восстановление в нормоксическую паузу [4, 6, 12, 13].
В период нормоксической реоксигенации увеличивается образование активных форм кислорода (АФК), которые включены в протективные механизмы ГК: способствуют экспрессии гипоксией индуцированного фактора HIF1α (hypoxia-inducible factor) и препятствуют его деградации [14], препятствуют апоптозу и аутофагии за счет активации транскрипционных факторов, например NFkB и CREB, Atg3 и Atg7 [15, 16]. В умеренных концентрациях АФК стимулируют NO-зависимую вазодилатацию при гипоксии [8]. Таким образом, продукция АФК в каждую фазу реоксигенации дополняет эффект собственно гипоксической стимуляции.
ГК в интервальном режиме, получившее название интервальных гипоксических нормобарических тренировок, успешно применяется в различных областях клинической и профилактической медицины [2, 4, 6]. Разработаны и проходят сопоставительный анализ эффективности и безопасности разные протоколы ГК, различающиеся как интенсивностью и длительностью гипоксических эпизодов, так и количеством их повторов в одной процедуре, кратностью тренировок в курсе и пр. [4, 6, 17, 18].
Для повышения эффективности ГК нами предложена новая технология адаптации к гипоксии – метод интервальных гипоксически-гипероксических тренировок (ИГГТ), где нормоксические паузы между дыханием гипоксической газовой смесью (11–14% О2) заменяются дыханием гипероксической смесью (30–40% О2). В периоды создаваемой гипероксии происходит быстрое восстановление сатурации крови кислородом и более выраженная, чем при нормоксической реоксигенации, индукция АФК, необходимых для запуска каскада редокс-сигнального пути [13]. Метод ИГГТ апробирован в исследованиях у пациентов с метаболическим синдромом, ИБС, реабилитационных программах для пожилых людей, а также для квалифицированных спортсменов с синдромом перетренированности [1, 3, 5, 12].
Несмотря на накопленный позитивный опыт применения ГК, у некоторых клиницистов остается определенный скепсис в отношении оправданности гипоксической адаптации из-за возможности чрезмерной стимуляции продукции АФК и провоцирования ряда осложнений у пациентов с кардиоваскулярной патологией, у пожилых и пр. Действительно, в литературе есть данные, подтверждающие увеличение образования АФК после гипоксического воздействия [18–20]. Однако непонятно, является ли такое повышение проявлением оксидативного стресса, влекущего за собой негативные последствия. В то же время отмечено отсутствие увеличения и даже снижение концентрации АФК как после серии процедур ГК, так и после нескольких сессий гипероксии [13, 21–23]. Таким образом, вопрос о степени развития оксидативного стресса, активации антиоксидантных механизмов и их выраженности после процедур ГК в режиме интервальной гипоксически-нормоксической тренировки (ИГНТ) или ИГГТ (где экспериментально показана более высокая степень редокс-сигнальной активации) пока остается открытым.
Цель настоящей работы — проследить изменения баланса “про-оксидантный/антиоксидантный статус” после однократно выполненной процедуры ИГНТ или ИГГТ у здоровых добровольцев.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследование выполнено с участием 24 здоровых добровольцев, студентов медицинского университета, средний возраст которых 20.2 ± 2.4 лет, индекс массы тела 24.02 ± 4.38 кг/м2. Протокол исследований был сформирован в соответствии с положениями “Биоэтических правил проведения исследований на человеке” и одобрен биоэтической комиссией Университета. От всех пациентов до начала работы было получено письменное информированное согласие.
В исследовании использовали нормобарическую установку для получения гипоксических и гипероксических газовых смесей на основе биообратной связи Re-Oxy Cardio (S.A. Aimediq, Люксембург).
На первом этапе исследования у всех испытуемых определяли индивидуальную чувствительность к гипоксии путем проведения 10-минутного гипоксического теста – дыхание через ротоносовую маску газовой смесью с 11%-ным содержанием О2, с ежеминутным мониторированием значений ЧСС и насыщения артериальной крови кислородом (SaO2). До и после гипоксического теста измеряли значения ЧСС, систолического и диастолического артериального давления (САД и ДАД).
Далее все участники исследования проходили по одной процедуре ИГНТ и ИГГТ в случайном порядке с интервалом 2–4 дня. Обследуемые не были информированы о различиях в структуре проводимых процедур, им было рекомендовано не менять сложившийся режим жизни, накануне прохождения процедур не выполнять тяжелых физических упражнений. Все исследования и процедуры проводились в утренние часы (10-00–12-00 ч), через 1.5–2 ч после приема пищи. Одна процедура длилась 40–45 мин. Время каждого гипоксического периода составляло в среднем 4–6 мин, концентрация кислорода во вдыхаемой газовой смеси – 10%; нормоксического (дыхание атмосферным воздухом) или гипероксического (концентрация кислорода во вдыхаемой смеси – 35%) периода – около 1.5–2 мин, в зависимости от скорости восстановления SaO2 до исходного уровня [12]. После каждой процедуры фиксировали субъективные самоотчеты обследуемых о переносимости процедуры, жалобах, изменениях состояния во время тренировки.
До и сразу после проведения процедуры ИГНТ или ИГГТ проводили забор капиллярной крови. Для оценки оксидативного/антиоксидантного статуса использовали фотометрическую аналитическую систему Free Radical Analytical System (FRAS-5) (“Diacron International”, H&D, Парма, Италия), которая включает в себя термостатированную центрифугу и фотометр. Концентрацию АФК определяли по показателю d-ROM (Reactive Oxygen Metabolites). Принцип метода заключается в том, что присутствующие в небольшом количестве в плазме крови гидроперекиси взаимодействуют с переходными металлами, в частности с железом, высвобождающимися в кислой среде из белков. Образующиеся при этом свободные радикалы окисляют хромоген (N,N диэтил-пара-фенил-диамин), который изменяет окраску. Для проведения теста капиллярную кровь смешивали с буфером рН 4.8 и хромогеном, центрифугировали в течение 90 с. Фотометрическую оценку осуществляли при длине волны 505 нм. Температура центрифугирования и считывания 37°С. Показатель d-ROM измеряется в условных единицах U Carr (Carratelli Units). 1 U Carr соответствует концентрации 0.8 мг H2O2 в 1 литре. В исследованиях с участием более 5000 относительно здоровых добровольцев установлено, что нормативными значениями d-ROM могут считаться 250–300 U Carr, а значения 300–320 U Carr являются пограничными [24, 25].
Для оценки общего антиоксидантного потенциала крови использовали тест РАТ (Plasma Antioxidant Test). Метод основан на способности компонентов плазмы, обладающих антиоксидантной активностью, восстанавливать ионы Fe3+ в присутствии хромогенного субстрата (раствор тиоцианата) до Fe2+. Капиллярную кровь, смешанную с буфером, раствором хлорида железа и хромогеном, центрифугировали, инкубировали в течение 1 мин. Оценку проводили на фотометре при длине волны 505 нм. Прибор был откалиброван с использованием антиоксидантного препарата – аскорбиновой кислоты. Единица измерения уровня антиоксидантного потенциала 1 U Cor соответствует 1.4 мкМ аскорбиновой кислоты. Нормативными значениями PAT считаются величины в диапазоне 2200–2800 U Cor, а снижение до 2000 – пограничными с нормой [24].
Рассчитывали OSI (Oxidative Stress Index) – оксидативный стресс-индекс, который интегрирует предыдущие показатели, отражая баланс между антиоксидантными и прооксидантными системами, что облегчает интерпретацию данных [25]. OSI определяли отношением стандартизированных переменных d-ROM и РАТ, используя программу производителя FRAS-5. В норме величина индекса не должна превышать 40, пограничными считают значения 41-65, OSI выше 65 свидетельствует о выраженном оксидативном стрессе.
Анализ данных проводили с помощью программы Statistica 11.0. Данные в работе представлены как среднее и стандартное отклонение M ± SD. Проверка нормальности распределения проведена с применением критерия Колмогорова–Смирнова, корреляции между показателями и их значимость оценены непараметрическим ранговым коэффициентом корреляции Спирмена, достоверность различий – тестом Уилкоксона для связанных выборок.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
При оценке индивидуальной чувствительности к гипоксии путем проведения гипоксического теста обнаружены статистически значимые изменения: снижение SaO2 и САД, повышение ЧСС (табл. 1). Такие изменения соответствуют ранее полученным нами данным при кратковременных гипоксических воздействиях у здоровых субъектов в аналогичных режимах [26], а также результатам других авторов [17, 27]. При анализе персональных данных обследуемых (несмотря на относительную однородность тестируемой выборки) выявлена существенная вариабельность гипоксической устойчивости по степени снижения SaO2 до 87–81% и прироста ЧСС – до 78–118 уд./мин.
Таблица 1.
Показатели системной гемодинамики и насыщения артериальной крови кислородом у испытуемых в гипоксическом тесте, M ± SD
| Показатели | До гипоксического теста | После гипоксического теста | p |
|---|---|---|---|
| ЧСС, уд. мин. | 75.5 ± 10.7 | 95.5 ± 11.6 | 0.001 |
| САД, мм рт. ст. | 124.7 ± 11.1 | 118.6 ± 11.0 | 0.04 |
| ДАД, мм рт. ст. | 77.9 ± 12.4 | 77.0 ± 7.6 | 0.9 |
| SаO2, % | 98.2 ± 1.4 | 84.0 ± 1.5 | 0.008 |
Исходные средние групповые значения показателей оксидативного статуса (d-ROM) и уровня антиоксидантной защиты (PAT) плазмы крови, а также интегрального показателя OSI находились в диапазоне нормальных или пограничных величин (табл. 2). Сразу после проведения процедур ГК в режимах ИГНТ и ИГГТ не зарегистрировано каких-либо достоверных сдвигов среднегрупповых значений показателей d-ROM и PAT (табл. 2), при высокой средней (по модулю) вариабельности величин сдвигов (коэффициент вариации 15–50%).
Таблица 2.
Показатели оксидативно-антиоксидантного статуса при проведении процедур ГК, M ± SD
| Показатель | Процедура ИГНТ | Процедура ИГГТ | ||||
|---|---|---|---|---|---|---|
| до | после | р | до | после | р | |
| d-RОМ, U Carr | 281.8 ± 81.3 | 272.4 ± 90.1 | 0.17 | 285.6 ± 88.0 | 275.4 ± 83.3 | 0.20 |
| PAT, U Cor | 2335 ± 466 | 2475 ± 397 | 0.50 | 2608 ± 536 | 2464 ± 528 | 0.24 |
| OSI | 48.6 ± 28.9 | 54.2 ± 27.7 | 0.60 | 59.8 ± 25.5 | 53.9 ± 32.6 | 0.87 |
При анализе индивидуальных показателей в сопоставлении с нормативными данными выявлена существенная вариабельность как исходных значений, так и их “ответов” на процедуры ГК. Так, перед процедурой ИГНТ у 7, а перед процедурой ИГГТ у 8 обследуемых были зарегистрированы значения d-ROM в диапазонах умеренного и выраженного повышения, при этом значения PAT у них находились в диапазоне нормальных величин. На процедуру ГК эти обследуемые реагировали неоднозначно – как повышением, так и снижением показателей про-антиоксидантного статуса в пределах 10–25% от исходных значений, причем если после процедуры ИГНТ отмечалось повышение (либо понижение) значений d-ROM или PAT, то в ответ на воздействие ИГГТ изменения были противоположными (а иногда – аналогичными).
При анализе индивидуальных “траекторий” индекса OSI можно отметить, что у большинства участников исследования (17 из 24) значения OSI находились в диапазоне 35–55 без существенных сдвигов под влиянием процедур ИГНТ или ИГГТ. Лишь у 7 обследованных значения OSI исходно были выше 65, но на процедуры ИГНТ и ИГГТ они либо понижались, либо несколько увеличивались без выявления какой-либо закономерности связей с различиями в структуре процедуры ГК – ИГНТ или ИГГТ.
При оценке размаха изменений величины d-ROM у каждого отдельного испытуемого оказалось, что он был примерно одинаков после разных режимов гипоксических тренировок. Средние значения модуля амплитуды изменений d-ROM составили после ИГНТ 84.9 ± 38.7 U Carr, а после ИГГТ – 74.7 ± 37.9 U Carr, т.е. 30 и 29.4% относительно исходных значений соответственно. Следовательно, процедуры ГК были стимулами, достаточными для активации системы прооксиданты/антиоксиданты. Среднее значение модуля амплитуды изменений РАТ после ИГНТ составило 446.3 ± 345.3 U Cor, т.е. 24% от величины показателя, зарегистрированного до процедуры, а после ИГГТ – 490.4 ± 326.2 U Cor, т.е. 20%. Это означает, что происходили изменения активности антиоксидантных систем, направленные на поддержание оксидативного баланса. Сохранение баланса подтверждает OSI (табл. 2). Как до, так и после процедур ИНГТ или ИГГТ средние значения этого интегративного показателя находились в зоне пограничных (незначительно повышенных) величин.
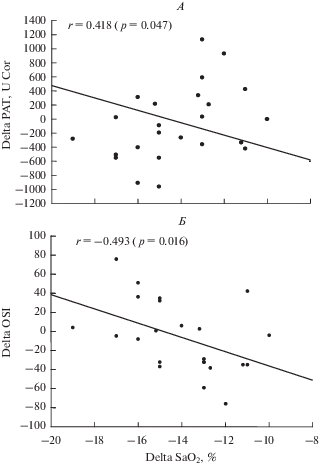
При проведении корреляционного анализа показателей гипоксической устойчивости в ГТ и значений проксидантного/антиоксидантного статуса на процедуры ГК (амплитуды их сдвигов), установлена статистически значимая прямая связь между степенью десатурации крови кислородом в ГТ (Delta SaO2) и повышением РАТ при проведении процедуры ИГГТ, а также отрицательная связь между значениями Delta SaO2 и степенью прироста OSI после процедуры ИГГТ (см. рисунок 1). Достоверных связей каких-либо параметров при ИГНТ не обнаружено. Следовательно, чем выше была устойчивость обследованных добровольцев к гипоксии, тем сравнительно в большей степени происходили активация антиоксидантного потенциала и снижение значения интегративного показателя оксидативного стресса при ИГГТ.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Полученные данные свидетельствуют, что однократные ИГНТ и ИГГТ не вызывают развития выраженного оксидативного стресса у большинства здоровых добровольцев, но сопровождаются изменением продукции АФК и степени антиоксидантной защиты, что может косвенно свидетельствовать об активации редокс-сигнальных механизмов. Такие выводы согласуются с результатами проведенных ранее экспериментов [2, 22, 23]. В то же время ряд авторов [7, 11, 18–20] показали нарушение оксидативного баланса после воздействия гипобарической и нормобарической гипоксии, выраженность которого коррелировала с десатурацией крови. Однако при продолжении процедур ГК исследователи отмечают увеличение активности антиоксидантных ферментов [11, 18, 21], повышение резистентности клеточных мембран при отсутствии стимуляции свободнорадикальных процессов [7, 13, 19]. Большинство авторов считают, что развитие умеренного оксидативного стресса является проявлением оптимизации АФК-опосредованной сигнальной трансдукции. Противоречия в полученных результатах, скорее всего, связаны с разными способами и условиями применения ГК и оценки оксидативного статуса. Механизмы разнонаправленных изменений могут быть обусловлены динамикой экспрессии и влияния специфических факторов защиты, НIF-1 и HIF-2. НIF-1 играет ведущую роль в процессах срочной адаптации к гипоксии [7, 11, 28]. Он активирует экспрессию эритропоэтина, VEGF (фактор роста эндотелия сосудов), индуцибельной нитрооксидсинтазы, трансферрина, гемоксигеназы-1, белков-переносчиков глюкозы, гликолитиченских ферментов [28], препятствует апоптозу, стимулирует ангиогенез [9, 10, 29]. Целью этих изменений является предотвращение избыточного образования АФК [28]. Показано, что фазы экспрессии HIF-1α совпадали с развитием устойчивости к гипоксии [7]. Однако этот фактор может увеличивать активность NАDРН-оксидазы [28]. Фактор HIF-2 повышает экспрессию фермента супероксиддисмутазы, но тяжелая гипоксия понижала уровень HIF-2 [30]. Противоположные эффекты НIF и двойственная роль АФК-сигнализации объясняет осторожное отношение к ГК и важность поиска безопасного, но эффективного режима воздействия. Направленность процессов, инициированных гипоксией с последующей нормоксической или гипероксической реоксигенацией, их адаптивное значение зависят в первую очередь от выбранной стратегии ГК [4, 6, 17].
Степень снижения насыщения крови кислородом у испытуемых во время гипоксического теста отражает степень устойчивости к гипоксии, и, вероятно, связана со степенью активации защитных механизмов при гипоксии/реоксигенации [26, 27]. Так, в тканях животных, устойчивых к гипоксии, экспрессия HIF-1 и VEGF значительно выше [29], но ниже уровень свободнорадикального окисления белков, являющийся маркером повреждения тканей [19]. Обратная зависимость между снижением сатурации и приростом антиоксидантной активности плазмы при ИГГТ, обнаруженная нами, также может быть связана с различиями в активации транскрипционных факторов. Важным является сохранение баланса про- и антиоксидантных систем после ИГГТ у высокоустойчивых субъектов, судя по показателю OSI. Можно предположить, что такая особенность могла быть проявлением перекрестной адаптации к другим факторам, например, физической нагрузке. Полученные в последнее время доказательства эпигенетических механизмов долговременной адаптации подтверждают наше предположение. Так, в экспериментах на животных показано метилирование генов, кодирующих ферменты антиоксидантной защиты, после 30-дневного воздействия интермиттирующей гипоксии, что сопровождалось изменением продукции АФК и HIF1α, чувствительности каротидных хеморецепторов [31].
Связи между изменениями показателей сатурации и РАТ обнаружены нами только после ИГГТ. Гипероксические экспозиции являются самостоятельным кондиционирующим фактором, дополняющим влияния ГК [3, 26]. Повторные тренировки к гипоксии-гипероксии нормализуют функцию ферментов антиоксидантной защиты, что способствует коррекции митохондриальной дисфункции [21], компенсируют стресс-индуцируемые сдвиги в оксидативном статусе [13]. Полученные результаты подтверждают эффективность и безопасность такого режима.
Необходимо отметить, что приведенные данные получены на здоровых молодых субъектах после однократных воздействий. Для сбора расширенной доказательной базы и надежного обоснования безопасности применения в практике восстановительной медицины необходима оценка влияния предложенных режимов ГК на оксидативный статус пожилых людей и пациентов с сердечно-сосудистой, бронхо-легочной патологией, а также изучение динамики показателей при повторяющихся ИГНТ/ИГГТ. Дальнейшие исследования будут способствовать расширению перспектив использования ГК в области персонифицированной профилактической медицины.
ЗАКЛЮЧЕНИЕ
Применение двух предложенных режимов гипоксического кондиционирования – ИГНТ и ИГГТ сопровождается перестройками в активности прооксидантных/антиоксидантных механизмов, но не приводит к развитию выраженного оксидативного стресса у здоровых добровольцев, что обосновывает безопасность их применения. При этом у добровольцев, более устойчивых к гипоксии, гипероксическая реоксигенация при ИГГТ приводит к более выраженной активации антиоксидантного потенциала.
Оценка баланса про- и антиоксидантных систем с помощью обобщающих показателей D-ROM и PAT, реализованных в фотометрической аналитической системе Free Radical Analytical System (FRAS-5) может быть одним из информативных подходов контроля степени индукции АФК-сигнализации при ГК и методом индивидуального подбора процедур адаптации к интервальной гипоксии.
Список литературы
Сыркин А.Л., Глазачев О.С., Копылов Ф.Ю., Дудник Е.Н., Загайная Е.Э., Тутер Д.С. Адаптация к интервальной гипоксии-гипероксии в реабилитации пациентов с ишемической болезнью сердца: переносимость физических нагрузок и качество жизни. Кардиология. 57(5): 10–16. 2017. [Syrkin A.L., Glazachev O.S., KopylovF.Yu., Dudnik E.N., Zagaryanova E.E., Tuter D.S. Adaptation to Intermittent Hypoxia-Hyperoxia in the Rehabilitation of Patients With Ischemic Heart Disease: Exercise Tolerance and Quality of Life. Kardiologiia. 57(5): 10–16. 2017. (In Russ.)].
Barrington J.H., Chrismas B.C., Gibson O.R. Hypoxic air inhalation and ischemia interventions both elicit preconditioning which attenuate subsequent cellular stress in vivo following blood flow occlusion and reperfusion. Front. Physiol. 8: 560–14. 2017.
Bayer U., Glazachev O.S., Likar R., Burtscher M., Kofler W., Pinter G., Stettner H., Demschar S., Trummer B., Neuwersch S. Adaptation to intermittent hypoxia-hyperoxia improves cognitive performance and exercise tolerance in elderly. Advances in Gerontology. 7(3): 214–220. 2017.
Serebrovskaya T.V., Xi L. Intermittent hypoxia training as non-pharmacologic therapy for cardiovascular diseases: Practical analysis on methods and equipment. Exp. Biol. Med. (Maywood). 241(15): 1708–1723. 2016.
Susta D., Dudnik E.A., Glazachev O.S. A programme based on repeated hypoxia-hyperoxia exposure and light exercise enhances performance in athletes with overtraining syndrome: A pilot study. Clin. Physiol. Funct. Imaging. 3(37): 276–281. 2017.
Verges S., Chacaroun S., Godin-Ribuot D., Baillieul S. Hypoxic conditioning as a new therapeutic modality. Front. Pediatr. 3: 58–14. 2015.
Lukyanova L.D., Sukoyan G.V., Kirova Y.I. Role of proinflammatory factors, nitric oxide, and some parameters of lipid metabolism in the development of immediate adaptation to hypoxia and HIF-1α accumulation. Bull. Exp. Biol. Med. 154(5): 597–601. 2013.
Totzeck M. Hendgen-Cotta U.B., Kelm M., Rassaf T. Crosstalk between nitrite, myoglobin and reactive oxygen species to regulate vasodilation under hypoxia. PLoS One (Public Library of Science). 9(8): e105951-10. 2014.
Yoshida T., Zhang H., Iwase T., Shen J., Semenza G.L., Campochiaro P.A. Digoxin inhibits retinal ischemia-induced HIF-1α expression and ocular neovascularization. FASEB J. 24: 1759–1767. 2010.
Zhang J., Feng Z., Wei J., Yu1 Y., Luo J., Zhou J., Li Y., Zheng X., Tang W., Liu L., Long J., Li X., Jing W. Repair of critical-sized mandible defects in aged rat using hypoxia preconditioned BMSCs with up-regulation of Hif-1α. Int. J. Biol. Sci. 14(4): 449–460. 2018.
Балыкин М.В., Сагидова С.А., Жарков А.С., Айзятулова Е.Д., Павлов Д.А., Антипов И.В. Влияние прерывистой гипобарической гипоксии на экспрессию HIF-1α и морфофункциональные изменения в миокарде. Ульяновск. мед.-биол. журн. 2: 126–135. 2017. [Balykin M.V., Sagidova S.A., Zharkov A.S., Ayzyatulova E.D., Pavlov D.A., Antipov I.V. Effect of intermittent hypobaric hypoxia on HIF-1α expression and morphofunctional changes in the myocardium. Ulyanovsk. med.-biol. J. 2: 126–135. 2017. (In Russ.)].
Глазачев О.С., Звенигородская Л.А., Дудник Е.Н., Ярцева Л.А., Мищенкова Т.В., Платоненко А.В., Спирина Г.К. Интервальные гипо-гипероксические тренировки в коррекции индивидуальных компонентов метаболического синдрома. Экспериментальная и клиническая гастроэнтерология. 7: 51–56. 2010. [Glazachev O.S., Zvenigorodskaja L.A., Dudnik E.N., Jarceva L.A., Mishenkova T.V., Platonenko A.V., Spirina G.K. Interval Hypo-hyperoxic training in the treatment of the metabolic syndrome. Exp. Clin. Gastroenterol. 7: 51–56. 2010. (In Russ.)].
Сазонтова Т.Г., Глазачев О.С., Болотова А.В., Дудник Е.Н., Стряпко Н.В., Бедарева И.В., Анчишкина Н.А., Архипенко Ю.В. Адаптация к гипоксии-гипероксии повышает физическую выносливость: роль активных форм кислорода и редокс-сигнализации. Рос.физиол. журн. им. И. М. Сеченова. 98(6): 793–807. 2012. [Sazontova T.G., Glazachev O.S., Bolotova A.V., Dudnik E.N., Stryapko N.V., Bedareva I.V., Anchishkina N.A., Arkhipenko Yu.V. Adaptation to hypoxia and hyperoxia increases physical endurance: the role of reactive oxygen species and redox signaling. Russ. J. Physiol. 98(6): 793–807. 2012. (In Russ.)].
Mansfield K.D., Guzy R.D., Pan Y., Young R.M., Cash T.P., Schumacker P.T., Simon M.C. Mitochondrial dysfunction resulting from loss of cytochrome c impairs cellular oxygen sensing and hypoxic HIF-α activation. Cell Metab. 1(6): 393–399. 2005.
Маслов Л.Н., Нарыжная Н.В., Подоксенов Ю.К., Семенцов А.С., Горбунов А.С., Жанг И., Пей Ж.М. Сигнальный механизм кардиопротекторного эффекта активных форм кислорода. Рос. физиол. журн. им. И.М. Сеченова. 101(4): 377–385. 2015. [Maslov L.N., Naryzhnaya N.V., Podoksenov Yu.K., Sementsov A.S., Gorbunov A. S., Zhang Y., Pei. J. M. Signaling mechanism of cardioprotective effect of reactive oxygen species Russ. J. Physiol. 101(4): 377–385. 2015. (In Russ.)].
Frudd K., Burgoyne T., Burgoyne J.R. Oxidation of Atg3 and Atg7 mediates inhibition of autophagy. Nat Commun. 9: 950–15. 2018.
Chacaroun S., Borowik A., Morrison S. A., Baillieul S., Flore P., Doutreleau S., Verges S. Physiological Responses to Two Hypoxic Conditioning Strategies in Healthy Subjects. Front. Physiol. 7: 675–200. 2017.
Debevec T., Pialoux V., Saugy J., Schmitt L., Cejuela R., Mury P., Ehrström S.,, Faiss R., Millet G.P. Prooxidant/antioxidant balance in hypoxia: a cross-over study on normobaric vs. hypobaric “Live High-Train Low”. PLoS One 10(9): e0137957-14.2015.
Байбурина Г.А., Нургалеева Е.А., Аглетдинов Э.Ф., Степанова Е.М. Соотношение между показателями свободнорадикального окисления липидов и белков в плазме крови после системной аноксии у животных с разной устойчивостью к гипоксии. Межд. научно-исслед. журн. 12(54): 6–9. 2016. [Bayburina G.A., Nurgaleeva E.A., Agletdinov E.F., Stepanova E.M. The ratio between free radical oxidation of lipids and proteins in the blood plasma after systemic anoxia in animals with different resistance to hypoxia. Int. Res. J. 12(54): 6–9. 2016. (In Russ.)].
Pialoux V., Mounier R., Rock E., Mazur A., Schmitt L., Richalet J.P., Robach P., Coudert J., Fellmann N. Effects of acute hypoxic exposure onprooxidant/antioxidant balance in elite endurance athletes. Int J Sports Med.30(2): 87–93. 2009.
Gonchar O.A., Mankovska I.N. Moderate intermittent hypoxia/hyperoxia: implication for correction of mitochondrial dysfunction. Cent. Eur. J. Biol. 7(5): 801–809. 2012.
Ishihara A., Nagatomo F., Fujino H., Kondo H. Exposure to mild hyperbaric oxygen increases blood flow and resting energy expenditure but not oxidative stress. J. Sci. Res. & Reports. 3(14): 1886–1896. 2014.
Kim S.,Yukishita T., Lee K., Yokota S., Nakata K., Suzuki D., Kobayashi H. The effect of mild-pressure hyperbaric therapy (Oasis O2) on fatigue and oxidative stress. Health. 3: 432–436. 2011.
Vadalà M., Palmieri B., Malagoli A., Laurino C. Oxidative stress, plasma/salivary antioxidant status detection and health risk factors. Asian J. Med. Sci. 8(1): 32–41. 2017.
Vassalle C., Pratali L., Boni C., Mercuri A., Ndreu R. An oxidative stress score as a combined measure of the pro-oxidant and anti-oxidant counterparts in patients with coronary artery disease. Clin.Biochem. 41(14–15): 1162–1167. 2008.
Глазачев О.С., Дудник Е.Н. Особенности реактивности сосудов микроциркуляторного русла практически здоровых людей при моделировании острой умеренной гипоксии и гипероксии. Физиология человека. 39(4): 74–81. 2013. [Glazachev O.S., Dudnik E.N. Microcirculatory reactivity features in almost healthy people during acute moderate hypoxia and hyperoxia modeling. Human Physiol. 39(4): 74–81. 2013. (In Russ.)].
Максимов А.Л., Аверьянова И.В. Информативность пробы с респирацией для оценки устойчивости организма юношей к сочетанному действию гипоксии и гиперкапнии Рос. физиол. журн. им. И.М. Сеченова. 103(9): 1057–1068. 2017. [Maksimov A.L., Averyanova I.V. Informative value of a rebreathing test in assessing young males` resistance to the combined impact of hypoxia and hypercapnia. Russ. J. Physiol. 103(9): 1057–1068. 2017. (In Russ.)].
Semenza G.L. Hypoxia-inducible factors in physiology and medicine. Cell. 148(3): 399–408. 2012.
Xiao B. Wang S., Yang G., Sun X., Zhao S., Lin L., Cheng J., Yang W., Cong W., Sun W., Kan G., Cui1 S. HIF-1α contributes to hypoxia adaptation of the naked mole rat. Oncotarget. 8(66):109 941–109 951. 2017.
Nanduri J., Wang N., Yuan G., Khan S.A., Souvannakitti D., Peng Y.J., Kumar G.K., Garcia J.A., Prabhakar N.R. Intermittent hypoxia degrades HIF-2α via calpains resulting in oxidative stress: implications for recurrent apnea-induced morbidities. Proc.Natl.Acad.Sci. USA. 106: 1199–1204. 2009.
Nanduri J., Peng Y.J., Wang N., Khan S.A., Semenza G., Kumar G.K., Prabhakar N.R. Epigenetic regulation of redox state mediates persistent cardiorespiratory abnormalities after long-term intermittent hypoxia. J. Physiol 595(1): 63–77. 2017.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова