Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 1, стр. 62-75
Каналоблокаторы NMDA-рецепторов мемантин и ИЭМ‑1921 сокращают продолжительность эпилептического статуса у крыс Вистар и Крушинского–Молодкиной в литий-пилокарпиновой модели
С. И. Ватаев 1, А. В. Зайцев 1, *, Н. Я. Лукомская 1, Л. Г. Магазаник 1, 2
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова
Российской академии наук
Санкт-Петербург, Россия
2 Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
* E-mail: aleksey_zaitsev@mail.ru
Поступила в редакцию 05.12.2018
После доработки 05.12.2018
Принята к публикации 07.12.2018
Аннотация
В хронических опытах на крысах Вистар и крысах Крушинского–Молодкиной с наследственной предрасположенностью к аудиогенным судорогам изучали влияние предварительного введения мемантина и ИЭМ-1921 – каналоблокаторов NMDA-рецепторов глутамата – на электрическую активность мозга при развитии эпилептического статуса (ЭС), вызванного пилокарпином. Регистрировали электрограммы гиппокампа, хвостатого ядра, соматосенсорной, зрительной и слуховой коры. Выявили, что характер и последовательность смены фаз ЭС, определяемых по паттернам электрограмм, не изменяются под действием блокаторов. Вместе с тем у крыс Вистар латентный период до появления эпилептиформной активности на ЭЭГ после введения пилокарпина сокращался почти в 2 раза (до 10–15 мин) на фоне действия мемантина (5 мг/кг) или ИЭМ-1921 (5 мг/кг). У крыс Крушинского–Молодкиной латентный период развития эпилептиформной активности был изначально короче (13 ± 2 мин) и применение блокаторов его не изменяло. Средняя продолжительность ЭС на фоне введения мемантина у крыс Вистар и Крушинского-Молодкиной была, соответственно, в 2 и 3 раза меньше, а при действии ИЭМ-1921 – в 7 раз меньше, чем без применения блокатора. Блокаторы NMDA-рецепторов также существенно ослабляли поведенческие моторные судорожные проявления, снижая интенсивность судорог с 8 до 4 баллов по шкале Pinel, Rovner [1978]. Полученные данные свидетельствуют о том, что блокада NMDA-рецепторов не позволяет прервать типичное развитие ЭС, вызванного пилокарпином, однако существенно сокращает его продолжительность.
Глутамат является основным возбуждающим медиатором в ЦНС, и при развитии ряда патологических процессов в мозге, в частности, судорожных синдромов, он может выступать в роли нейротоксического агента [1, 2]. Было показано, что блокаторы открытых каналов ионотропных глутаматных рецепторов способны предупреждать или купировать у животных эпилептиформные проявления разной этиологии [3–6], что послужило основанием для поиска среди веществ этого класса лекарственных средств, обладающих противосудорожным действием [7, 8]. В результате экспериментальных исследований было установлено, что у грызунов неконкурентные селективные блокаторы NMDA-рецепторов глутамата эффективно подавляют аудиогенные [3, 9–12] и пентилентетразоловые судороги [3, 6, 13], а также значимо снижают частоту спонтанных эпилептиформных разрядов у крыс линии WAG/Rij с генетической предрасположенностью к эпилепсии с абсансами [3, 14]. Вместе с тем, при изучении действия неконкурентного блокатора NMDA-рецепторов дизоцилпина (МК-801) на литий-пилокарпиновой модели эпилепсии у грызунов были получены противоречивые результаты: наблюдали как анти-, так и проэпилептические эффекты, которые к тому же сопровождались рядом неблагоприятных изменений поведения животных, таких как гипер- или гипоактивность, а также атаксия и стереотипии [15–22]. Следует заметить, что в настоящее время для терапевтических целей и экспериментальных исследований в качестве неконкурентных блокаторов NMDA-рецепторов используют препараты нового поколения, которые обладают существенно меньшим спектром побочных действий. К такого рода препаратам относятся широко применяемый в клинической практике мемантин [3]. Определенный терапевтический потенциал есть и у разработанного в нашем Институте препарата ИЭМ-1921 [5]. Представляется актуальным исследовать на литий-пилокарпиновой модели эпилепсии у крыс влияние указанных антагонистов глутамата на развитие острого патологического пароксизмального состояния в форме эпилептического статуса (ЭС). Ранее нами была детально изучена динамика последовательных проявлений поведенческой моторной судорожной активности и трансформации паттернов электрограмм различных структур мозга по мере развития ЭС [23]. Опыты проводились на крысах, различающихся по уровням судорожной готовности (крысы Крушинского–Молодкиной, наследственно предрасположенные к аудиогенным судорогам, и крысы Вистар, устойчивые к конвульсиогенному действию звука). Целью настоящей работы являлось исследовать на литий-пилокарпиновой модели эпилепсии у этих крыс влияние неконкурентных избирательных блокаторов глутаматных NMDA-рецепторов мемантина и ИЭМ-1921 на электрическую активность мозга, поведение и проявления судорожной симптоматики при развитии вызванного пилокарпином ЭС от его начала до завершения.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследования выполняли на крысах (самцы, масса тела 200–300 г) Вистар, полученных из питомника “Рапполово”, и Крушинского–Молодкиной из аутбредной популяции, содержащейся в виварии ИЭФБ РАН. Предварительно животных проверяли на способность реагировать судорожными реакциями на звуковой стимул (синусоидальный тон частотой 8 кГц, интенсивность 90 дБ). Из популяции крыс Крушинского–Молодкиной отбирали наиболее возбудимых животных, реагировавших на звук полными генерализованными клонико-тоническими судорожными припадками, а из крыс Вистар – нечувствительных к действию данного стимула животных.
Отобранным крысам под золетиловым (Zoletil 100; Vibrac, Франция) наркозом (70 мг/кг, внутримышечно) вживляли по стереотаксическим координатам [24] электроды для хронической регистрации электрической активности гиппокампа, хвостатого ядра, соматосенсорной, слуховой и зрительной областей коры мозга. Координаты и методика имплантации электродов подробно описаны в нашей предыдущей работе [23]. Все оперативные вмешательства и последующие эксперименты выполняли в соответствии с Протоколом обращения с лабораторными животными ИЭФБ РАН, согласующегося с директивой Европарламента 2010/63/ЕС от 22.09.2010 г.
После операции каждую из крыс размещали в индивидуальной камере, снабженной электродинамическим датчиком для регистрации актограммы. Камеру помещали в объемный бокс, который обеспечивал электро-, свето- и звукоизоляцию от внешних источников. Животных содержали в условиях 12-часового цикла свет/темнота (свет с 09.00 до 21.00) при свободном доступе к пище и воде и адаптировали в течение 5–7 суток к условиям эксперимента, подключая ежедневно посредством легкого отводящего кабеля к компьютерному электроэнцефалографу.
По окончании адаптации выполняли 6-часовые контрольные опыты, которые проводили с 09.00 до 15.00. За 30 мин до начала опытов животных подключали к электроэнцефалографу и помещали в камеру, давая крысам успокоиться. С помощью веб-камеры вели наблюдение и видеозапись поведения животных и одновременно осуществляли монополярную регистрацию в полосе 1–30 Гц электрограмм указанных структур мозга и актограммы с вводом данных при частоте дискретизации процессов 185 Гц. Полиграфическая запись в течение всего опыта позволяла на основе анализа поведения, паттернов электрограмм и актограммы выделять у крыс периоды активного и спокойного бодрствования, медленно- и быстроволнового (парадоксального) сна и определить характеристики электрической активности мозга на фоне этих состояний в норме.
Через 2–3 дня крысам вводили внутримышечно (в/м) хлорид лития (127 мг/кг, Sigma-Aldrich). Спустя сутки, животных подключали к электроэнцефалографу и вели непрерывную регистрацию паттернов электрограмм структур мозга и актограммы, а также видеозапись поведения. В 8 ч утра крысам вводили в/м блокаторы NMDA-рецепторов мемантин (5 мг/кг, Sigma) или ИЭМ-1921 (5 мг/кг, произведен в ИЭМ РАМН), а также метилскополамин (1 мг/кг, Sigma), ингибирующий периферические мускариновые рецепторы. Через 1 ч, когда, согласно нашим данным, полученным при изучении аудиогенных эпилептиформных припадков [11, 12], противосудорожное действие указанных антагонистов достигало максимума, животным вводили в/м раствор пилокарпина (Sigma): крысам Крушинского–Молодкиной в дозе 20 мг/кг, а крысам Вистар – 30 мг/кг. Непрерывная полиграфическая запись поведения, ЭЭГ и актограммы в ходе возникновения и развития ЭС позволяла проследить в течение 6–12 ч последовательную динамику проявлений поведенческой моторной судорожной активности и трансформации паттернов электрограмм структур мозга, а также выявить электрографические феномены, сопутствующие тем или иным видам судорог. Тип и интенсивность судорожных проявлений определяли как и ранее [23] в баллах, используя классификацию J.P. Pinel и L.I. Rovner [25]: 0 баллов – нормальное поведение; 1 – затаивание, клонические подергивания вибрисс и ушей, жевательные движения; 2 – раскачивание головы в вертикальной плоскости, жевательные движения; 3 – активные роющие и круговые движения, интенсивный груминг, ригидность хвоста, клонические подергивания конечностей, вздрагивания всего тела, прыжки с отрывом от пола; 4 – тонические спазмы мышц туловища и хвоста с переходом животных в вертикальные стойки, сопровождающиеся клоническими подергиваниями передних конечностей (поза “кенгуру”); 5 – одиночные клонико-тонические судороги, завершающиеся потерей позы (падениями); 6 – частые судороги с падениями; 7 – круговые пробежки животных, сходные с “диким бегом” при аудиогенных судорожных припадках; 8 – продолжительные генерализованные клонико-тонические судороги.
Всего в экспериментах было использовано 25 животных. Исследования по влиянию мемантина на вызванные пилокарпином эпилептиформные реакции были выполнены на 7 крысах Вистар и 5 Крушинского–Молодкиной, а по влиянию ИЭМ-1921 – на 8 крысах Вистар и 5 Крушинского–Молодкиной.
Для оценки достоверности различий при статистической обработке экспериментальных данных использовали t-критерий Стьюдента. Данные представлены в виде средних значений ± стандартная ошибка среднего.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Предварительное введение мемантина или ИЭМ-1921 не изменяло общую картину последовательных трансформаций паттернов электрограмм структур мозга крыс при развитии вызванного пилокарпином ЭС от его начала до завершения, описанную нами ранее [23]. Последовательно сменялись паттерны ЭЭГ, на основе которых можно выделить шесть фаз ЭС: нормальная спонтанная ЭЭГ активность (фаза 0), спорадические пароксизмальные проявления (фаза 1), ритмические пароксизмальные (иктальные) разряды переменной амплитуды и частоты следования (фаза 2), непрерывная ритмическая высокочастотная и высокоамплитудная пароксизмальная активность (фаза 3), высокочастотная пароксизмальная активность с периодическими высоковольтными эпилептиформными разрядами (фаза 4), периодические высоковольтные эпилептиформные разряды на фоне низкоамплитудной базовой электрической активности мозга (фаза 5). Вместе с тем введение антагонистов NMDA-рецепторов изменяло время возникновения и продолжительность отдельных фаз, а также сокращало общую длительность статуса (табл. 1 и 2).
Таблица 1.
Латентные периоды (ЛП) фаз эпилептического статуса (ЭС) у крыс в литий-пилокарпиновой модели эпилепсии в контроле и на фоне действия антагонистов глутамата
| Эксперимент | Линия крыс | Средние значения ЛП фаз ЭС (мин) | ||||
|---|---|---|---|---|---|---|
| фаза 1 | фаза 2 | фаза 3 | фаза 4 | фаза 5 | ||
| Пилокарпин | В (n = 7) | 22.5 ± 0.7 | 32 ± 3 | 46 ± 3 | 84 ± 9 | 198 ± 17 |
| КМ (n = 7) | 12.8 ± 1.1 | 21 ± 2 | 35 ± 3 | 64 ± 9 | 184 ± 16 | |
| Мемантин + пилокарпин | В (n = 7) | 14.3 ± 1.1* | 24 ± 3 | 41 ± 4 | 74 ± 10 | 221 ± 17 |
| КМ (n = 5) | 12.4 ± 1.6 | 21 ± 3 | 33 ± 4 | 61 ± 9 | 170 ± 13 | |
| ИЭМ-1921 + пилокарпин | В (n = 8) | 10.8 ± 1.1* | 25 ± 4 | 40 ± 6 | 83 ± 10 | 158 ± 16 |
| КМ (n = 5) | 13.4 ± 1.4 | 24 ± 3 | 40 ± 4 | 77 ± 10 | 172 ± 18 | |
Таблица 2.
Длительности отдельных фаз и общая продолжительность ЭС у крыс в литий-пилокарпиновой модели эпилепсии в контроле и на фоне действия антагонистов глутамата
| Эксперимент | Линия крыс | Средняя длительность фаз ЭС (мин) | Средняя длительность ЭС (ч) | |||||
|---|---|---|---|---|---|---|---|---|
| фаза 0 | фаза 1 | фаза 2 | фаза 3 | фаза 4 | фаза 5 | |||
| Пилокарпин | В (n = 7) | 23 ± 1 | 10 ± 3 | 14 ± 2 | 38 ± 9 | 114 ± 11 | 986 ± 80 | 19.4 ± 1.3 |
| КМ (n = 7) | 13 ± 2 | 9 ± 2 | 14 ± 2 | 28 ± 8 | 120 ± 15 | 989 ± 98 | 19.5 ± 1.6 | |
| Мемантин + + пилокарпин | В (n = 7) | 14 ± 2 | 10 ± 4 | 17 ± 4 | 33 ± 10 | 147 ± 23 | 424 ± 72* | 10.5 ± 1.2* |
| КМ (n = 5) | 12 ± 2 | 8 ± 3 | 12 ± 4 | 28 ± 9 | 109 ± 15 | 342 ± 40* | 8.0 ± 0.7* | |
| ИЭМ-1921 + + пилокарпин | В (n = 8) | 11 ± 2 | 14 ± 4 | 15 ± 4 | 44 ± 10 | 75 ± 16* | 128 ± 26* | 4.6 ± 0.4* |
| КМ (n = 5) | 13 ± 2 | 11 ± 2 | 15 ± 3 | 37 ± 10 | 96 ± 18 | 144 ± 26* | 5.0 ± 0.4* | |
Непосредственно после инъекций пилокарпина крысы пребывали в состоянии активного бодрствования. Паттерны электрограмм исследованных структур мозга в этот период соответствовали паттернам ЭЭГ активного бодрствования животных в контрольных опытах (фаза 0, рис. 1А). Через 3–5 мин у крыс возникали минимальные судорожные проявления интенсивностью 1–2 балла по шкале J.P. Pinel и L.I. Rovner [25] в форме клонических подергиваний вибрисс и ушей, раскачивания головы в вертикальной плоскости, жевательных движений. Эти двигательные акты не отражались в виде изменений ЭЭГ.
Рис. 1.
Паттерны электрограмм соматосенсорной (1), зрительной (2) и слуховой (3) коры, гиппокампа (4), хвостатого ядра (5) и актограммы (6) у крысы линии Крушинского–Молодкиной в фазах 0 (А), 1 (Б) и 2 (В) вызванного пилокарпином на фоне действия мемантина эпилептического статуса. Калибровка : 1 с; на А и Б – 50, на В – 100 мкВ.
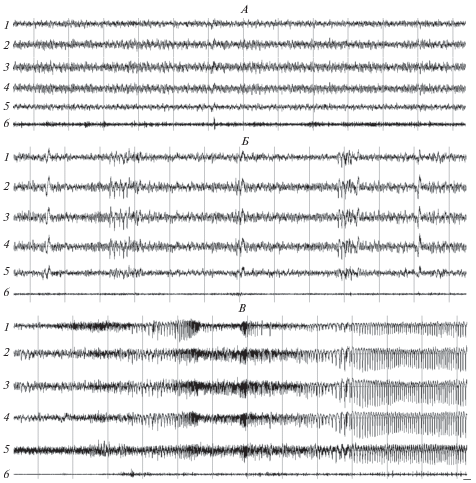
Спорадические пароксизмальные проявления на ЭЭГ в виде низкоамплитудных (до 100 мкВ) одиночных или сгруппированных острых волн (рис. 1Б), свидетельствующие о начале фазы 1, возникали у крыс Вистар в среднем через 14.3 ± 1.1 мин на фоне влияния мемантина и через 10.8 ± 1.1 мин на фоне действия ИЭМ-1921 (табл. 1). Без применения блокаторов латентный период возникновения фазы 1 был больше (p < 0.01), составляя в среднем 22.5 ± 0.7 мин [23]. У крыс Крушинского–Молодкиной переход в фазу 1 происходил через 12–14 мин и не зависел от действия блокаторов (табл. 1). Применение антагонистов не влияло на продолжительность фазы 1 у крыс обеих линий (табл. 2), а также на поведенческие судорожные проявления в виде слабых клонических сокращений мышц морды, раскачиваний головы в вертикальной плоскости и постоянных жевательных автоматизмах. Интенсивность судорожных проявлений не превышала двух баллов.
Переход в фазу 2 характеризовался появлением на ЭЭГ эпилептиформной активности типа множественных пиков (рис. 1В), которая в течение нескольких минут трансформировалась сначала в отдельные пик-волновые разряды амплитудой от 100 до 250 мкВ, возникавшие с частотой следования около 1–2 Гц, а затем в ритмические пароксизмальные комплексы. Эти комплексы имели разную длительность, произвольно сменяли друг друга и состояли из чрезвычайно вариабельных по форме, амплитуде (от 100 до 500 мкВ) и частоте следования (от 1.5 до 15 Гц) острых пиков, острых волн и пик-волновых разрядов. Иногда эпилептиформная активность прерывалась краткими эпизодами межприступного торможения. На поведенческом уровне у крыс в начале фазы 2 отмечалось усиление и учащение миоклонических подергиваний вибрисс и ушей, раскачиваний головы в вертикальной плоскости (интенсивность судорожных проявлений – 2 балла). Далее, на фоне появления на ЭЭГ пик-волновых разрядов, у животных возникала моторная активация в форме роющих движений, кратких эпизодов груминга, быстрых круговых пробежек по клетке. При этом отмечались клонические судороги в виде вздрагиваний всего тела, подергивания конечностей или прыжков с отрывом от пола (интенсивность судорожных проявлений – 3 балла). Применение антагонистов не влияло на латентный период (табл. 1) и продолжительность фазы 2 (табл. 2).
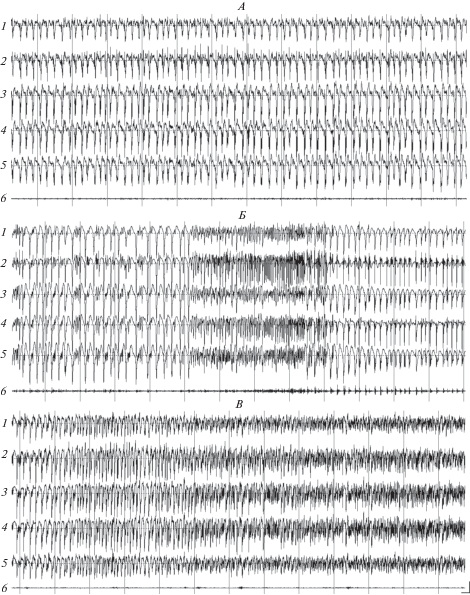
При переходе в фазу 3 пароксизмальные комплексы на ЭЭГ сменялись непрерывной ритмической эпилептиформной активностью в виде высокоамплитудных (до 700 мкВ) спайкообразных пик-волновых разрядов, чередующихся с разрядами типа острых волн. Сначала, в течение 7–15 мин, на ЭЭГ превалировали пик-волновые разряды (рис. 2А), а затем доминировали быстрые острые волны с несколько меньшей амплитудой по сравнению с пик-волновыми разрядами, но с более высокой (до 12–15 Гц) частотой следования (рис. 2В). Латентные периоды и продолжительность этой фазы у крыс не менялись при действии антагонистов (табл. 1 и 2). Однако антагонисты NMDA-рецепторов снижали уровень двигательной активности крыс. Без них у животных в течение этой фазы наблюдались практически непрерывные интенсивные перемещения по камере, сопровождаемые всем спектром поведенческих судорожных проявлений, начиная с одиночных клонических судорог и стоек в позе “кенгуру”, вплоть до продолжительных генерализованных клонико-тонических конвульсий интенсивностью 8 баллов [23]. На фоне влияния антагонистов судорожных проявлений интенсивностью выше 4 баллов у крыс обеих линий не отмечено. В начале фазы 3 у некоторых животных на фоне появления высокоамплитудной эпилептиформной активности наблюдались кратковременные быстрые пробежки по камере. Эти пробежки чередовались с продолжительными периодами покоя, когда крысы застывали в одной позе, сидя с высоко поднятой мордой. Однако большинство крыс затаивались, припадали ко дну камеры с вытянутой вперед мордой. Иногда у них возникали тонические спазмы мышц туловища и хвоста с последующим переходом животных в вертикальные стойки, сопровождавшиеся быстрыми клоническими подергиваниями передних конечностей (поза “кенгуру”; интенсивность судорог – 4 балла). Развитию такого рода судорожных приступов предшествовало резкое учащение пик-волновых разрядов на ЭЭГ (рис. 2Б). При обратном переходе к более низкочастотным пик-волновым разрядам на ЭЭГ стойки завершались, но еще некоторое время у сидящих животных отмечались клонические судорожные вздрагивания всего тела, четко проявлявшиеся на актограмме. Стойки в позе “кенгуру” наблюдались у всех крыс, но количество этих стоек у разных животных варьировало от одной до 15. Также варьировала от 20 с до 8 мин их продолжительность.
Рис. 2.
Паттерны электрограмм соматосенсорной (1), зрительной (2) и слуховой (3) коры, гиппокампа (4), хвостатого ядра (5) и актограммы (6) у крысы Вистар в начале развития фазы 3 вызванного пилокарпином на фоне действия мемантина эпилептического статуса (А), в течение фазы 3 при возникновении у животного клонико-тонических судорог с переходом в вертикальную стойку в позе “кенгуру” (Б), а также в ходе фазы 3 на этапе перехода от высокоамплитудной пик-волновой активности к активности типа высокочастотных быстрых острых волн (В). Калибровка: 100 мкВ; 1 с.
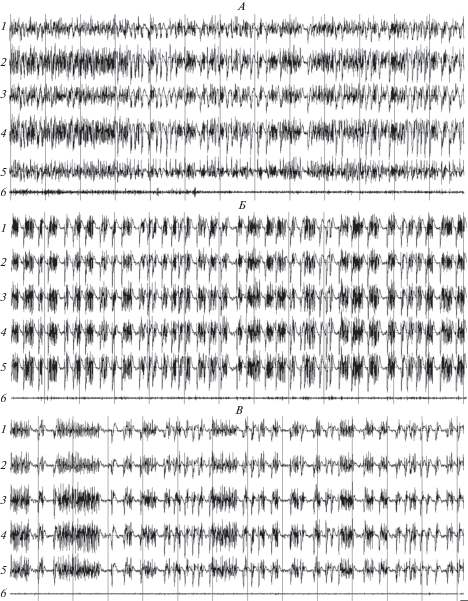
Переход в фазу 4 характеризовался появлением на фоне пароксизмальной активности типа высокочастотных острых волн высокоамплитудных (до 800 мкВ) эпилептиформных разрядов (рис. 3А). В течение этой фазы уровень двигательной активности животных был очень низким. Как правило, крысы сидели или лежали на боку. При этом высокоамплитудные эпилептиформные разряды на ЭЭГ сопровождались интенсивными рывками тела и головы животного (интенсивность судорожных проявлений до 3-х баллов). Время от времени животные начинали совершать нецеленаправленные круговые перемещения по камере. В эти периоды у крыс наблюдались отдельные миоклонические вздрагивания.
Рис. 3.
Паттерны электрограмм соматосенсорной (1), зрительной (2) и слуховой (3) коры, гиппокампа (4), хвостатого ядра (5) и актограммы (6) у крысы Вистар в начале (А), середине (Б) и в конце (В) фазы 4 вызванного пилокарпином на фоне действия ИЭМ-1921 эпилептического статуса. Калибровка: 100 мкВ; 1 с.
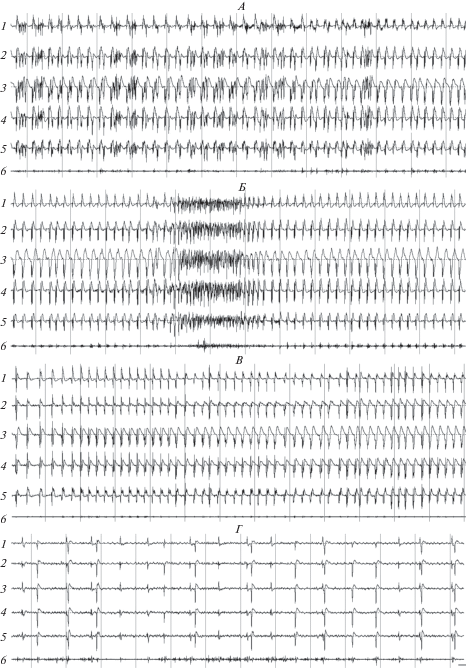
В ходе развития фазы 4 отмечалось постепенное исчезновение на ЭЭГ активности типа высокочастотных острых волн (рис. 3Б, В). При этом на фоне снижения амплитуды основной базовой электрической активности мозга происходило формирование типичного для фазы 5 статуса паттерна ритмических высокоамплитудных пик-волновых эпилептиформных разрядов на ЭЭГ (рис. 4А). В начале фазы 5 частота эпилептиформных разрядов составляла 1–1.5 Гц. У некоторых крыс периодически возникали интенсивные конвульсии в виде отдельных судорожных приступов. Как правило, эти приступы начинались с учащения пик-волновых разрядов на ЭЭГ (рис. 4Б). Слабые по силе судороги проявлялись в виде тонического напряжения конечностей животного при явно выраженной экстензии хвоста. Более интенсивные судороги выражались в форме сильного тонического напряжения всего тела животных с переходом их в вертикальную стойку в позу “кенгуру”. Эти судороги завершались серией миоклонических вздрагиваний, четко проявлявшихся на актограмме (рис. 4Б). В ходе фазы 5 частота эпилептиформных разрядов постепенно снижалась (рис. 4В, Г), а поведение крыс возвращалось к нормальному: они начинали прием пищи и воды, заниматься грумингом. Также наблюдалось восстановление амплитуды основной базовой электрической активности мозга. Паттерны электрограмм структур мозга крыс постепенно приходили в соответствие с паттернами нормального активного или спокойного бодрствования, что свидетельствовало о завершении ЭС.
Рис. 4.
Паттерны электрограмм соматосенсорной (1), зрительной (2) и слуховой (3) коры, гиппокампа (4), хвостатого ядра (5) и актограммы (6) у крысы Крушинского–Молодкиной в начале фазы 5 вызванного пилокарпином на фоне действия мемантина эпилептического статуса (А), в течение фазы 5 при возникновении у животного клонико-тонических судорог с переходом в стойку в позе “кенгуру” (Б), в средине (В) и в конце (Г) фазы 5. Калибровка: 100 мкВ; 1 с.
Введение мемантина сокращало продолжительность фазы 5 у крыс Вистар в 2 раза (до 424.0 ± 71.9 мин), а у крыс Крушинского–Молодкиной – почти в 3 раза (до 342.2 ± 39.5 мин) (табл. 2). Длительность всего ЭС уменьшалась с примерно 19 ч до 10.5 ± 1.2 и 8.0 ± 0.7 ч у крыс Вистар и Крушинского–Молодкиной соответственно. Еще более существенное воздействие оказывало введение ИЭМ-1921. Средняя продолжительность фазы 5 сокращалась почти в 7 раз (до 127.8 ± 25.8 и 143.4 ± 25.7 мин соответственно), а общая продолжительность ЭС – почти в 4 раза (до 4.6 ± 0.4 и 5.0 ± 0.4 ч соответственно).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Полученные результаты свидетельствуют о том, что неконкурентные блокаторы NMDA‑рецепторов не изменяют характер и последовательность смены фаз ЭС, определяемых по паттернам электрограмм. Вместе с тем, блокада NMDA‑рецепторов ведет к ряду различий в динамике возникновения, продолжительности отдельных фаз и общей длительности статуса.
На фоне действия мемантина и ИЭМ-1921, латентные периоды первых пароксизмальных проявлений на ЭЭГ у крыс Вистар после инъекций пилокарпина были почти в 2 раза короче, чем у крыс, которым вводили только пилокарпин. У крыс Крушинского–Молодкиной введение блокаторов не влияло на латентный период ЭС. Одним из возможных объяснений этих результатов может быть следующее. В случае литий-пилокарпиновой модели эпилепсии первичным звеном возникновения эпилептиформных проявлений является холинергическая система мозга, активизация деятельности которой происходит под влиянием агониста М‑холинорецепторов пилокарпина [4, 21, 26, 27]. В качестве вторичного звена формирования ЭС выступает усиление активности возбуждающих глутаматергических нейронов мозга. При этом в течение латентного периода до начала статуса первично проявляется не возбуждающий, а, наоборот, тормозный эффект. Дело в том, что усиление функциональной активности глутаматергических возбуждающих входов в гиппокамп и стриатум вызывает активацию ГАМКергических тормозных нейронов в этих структурах и как следствие – проявление эффекта торможения [21, 26, 28–30]. Не исключено, что такого рода тормозный механизм выполняет у животных в условиях нормальной работы мозга функцию предотвращения возникновения в гиппокампе и стриатуме патологической пароксизмальной активности при чрезмерном усилении активности возбуждающих NMDA‑рецепторных глутаматергических входов. У крыс Вистар функционирование данного тормозного механизма, по-видимому, проявлялось в течение латентного периода до начала развития ЭС, если он формировался в результате действия только пилокарпина. В этом случае латентный период возникновения первых эпилептиформных проявлений на ЭЭГ составлял в среднем 22.5 ± 0.7 мин [23]. На фоне влияний мемантина или ИЭМ-1921, блокирующих работу возбуждающих NMDA‑рецепторных глутаматергических входов в гиппокамп и стриатум, активация ГАМКергических тормозных нейронов в этих структурах не происходила, и временные интервалы до начала ЭС сокращались почти в 2 раза.
У крыс Крушинского–Молодкиной, как и у крыс других линий с наследственной предрасположенностью к судорожным проявлениям, имеет место генетически обусловленный дефицит ГАМКергического торможения [31–36], и у них функционирование такого рода тормозного механизма, вероятнее всего, нарушено. Поэтому у этих животных латентный период первых эпилептиформных проявлений на ЭЭГ был почти в 2 раза короче [23], а блокаторы NMDA‑рецепторов его не изменяли.
Возникающее в начале статуса временное усиление ГАМКергического торможения, вызванное пилокарпином, затем сменяется резким его ослаблением. Высокий уровень глутаматергических возбуждающих влияний при этом сохраняется, что создает условия для формирования в мозге патологической эпилептиформной активности [29, 30]. У крыс обеих линий после возникновения на ЭЭГ первых пароксизмальных проявлений в дальнейшем происходило формирование во всех исследованных структурах мозга (кора, гиппокамп, хвостатое ядро) высокоамплитудных синхронных эпилептиформных разрядов. В отсутствие блокаторов NMDA‑рецепторов такого рода генерализация электрической активности мозга приводила к повышению двигательной активности животных и возникновению частых судорожных проявлений разной степени интенсивности – от одиночных клонических судорог до продолжительных генерализованных клонико-тонических конвульсивных припадков силой 8 баллов. При действии мемантина или ИЭМ-1921 для крыс более характерными были снижение моторной активности и затаивание с редкими судоржными проявлениями в виде тонического напряжения мышц туловища с переходом животных в вертикальные стойки, сопровождавшиеся клоническими подергиваниями передних конечностей (поза “кенгуру”; интенсивность судорог – 4 балла). Аналогичные результаты были получены и другими авторами [15, 16] при изучении действия МК-801. Эти данные указывают на то, что блокаторы NMDA-рецепторов глутамата снижают интенсивность поведенческих судорожных проявлений.
Предварительное введение мемантина крысам Вистар и Крушинского–Молодкиной сокращало средние длительности завершающей статус фазы 5 и ЭС в целом примерно в 2 раза. Еще более эффективным в этом отношении был ИЭМ-1921. При его введении средние продолжительности фазы 5 сокращались почти в 7 раз, а сам ЭС завершался в 4 раза быстрее. Аналогичные данные были получены и при изучении действия МК-801 [15, 16, 20]. Таким образом, неконкурентные блокаторы NMDA-рецепторов, хотя и не обладают явно выраженным антиэпилептическим эффектом, поскольку мало влияют на характер эпилептиформной ЭЭГ-активности, но в силу наблюдаемого снижения интенсивности поведенческих судорожных реакций и продолжительности пароксизмальных проявлений эти антагонисты могут быть использованы в качестве дополнительных нейропротекторных средств при лечении генерализованных форм судорожных состояний.
Список литературы
Mehta A., Prabhakar M., Kumar P., Deshmukh R., Sharma P. L. Excitotoxicity: bridge to various triggers in neurodegenerative disorders. Eur. J. Pharmacol. 698(1–3): 6–18. 2013.
Stojanovic I.R., Kostic M., Ljubisavljevic S. The role of glutamate and its receptors in multiple sclerosis. J. Neural. Transm. (Vienna). 121(8): 945–955. 2014.
Parsons C.G., Danysz W., Quack G. Memantine is a clinically well tolerated N‑methyl‑D‑aspartate (NMDA) receptor antagonist – a review of preclinical data. Neuropharmacology. 38(6): 735–767. 1999.
Leite J.P., Garcia-Cairasco N., Cavalheiro E. A. New insights from the use of pilocarpine and kainate models. Epilepsy Res. 50(1–2): 93–103. 2002.
Лукомская Н.Я., Рукояткина Н.И., Горбунова Л.В., Гмиро Е.В., Большаков К.В., Магазаник Л.Г. Сопоставление противосудорожной активности органических моно- и дикатионов с их способностью ингибировать NMDA и AMPA глутаматные рецепторы. Рос. физиол. журн. им. И. М. Сеченова. 88(9): 1161–1171. 2002. [Lukomskaya N.Y., Rukojatkina N.I., Gorbunova L.V., Gmiro V.E., Bolshakov K.V., Magazanik L.G. Comparison of anticonvulsant activity of organic mono- and di- cations, and their potency to inhibit NMDA and AMPA glutamate receptors. Russ. J. Physiol. 88(9): 1161–1171. 2002. (In Russ.)].
Лукомская Н.Я., Рукояткина Н.И., Горбунова Л.В., Гмиро Е.В., Магазаник Л.Г. Исследование роли NMDA и AMPA глутаматных рецепторов в механизме коразоловых судорог у мышей. Рос. физиол. журн. им. И. М. Сеченова. 89(3): 292–301. 2003. [Lukomskaya N.Y., Rukojatkina N.I., Gorbunova L.V., Gmiro V.E., Magazanik L.G. Study of NMDA and AMPA glutamate receptor involvement in the genesis of clonic and tonic convulsions induced by pentylenetetrazole in mice. Russ. J. Physiol. 89(3): 292–301. 2003. (In Russ.)].
Ghasemi M., Schachter S.C. The NMDA receptor complex as a therapeutic target in epilepsy: a review. Epilepsy Behav. 22(4): 617–640. 2011.
Rogawski M.A. AMPA receptors as a molecular target in epilepsy therapy. Acta Neurol. Scand. Suppl. 197: 9–18. 2013.
Faingold C.L., Randall M.E., Naritoku D.K., Boersma Anderson C.A. Noncompetitive and competitive NMDA antagonists exert anticonvulsant effects by actions on different sites within the neuronal network for audiogenic seizures. Exp. Neurol. 119(2): 198–204. 1993.
Faingold C.L. Emergent properties of CNS neuronal networks as targets for pharmacology: application to anticonvulsant drug action. Prog. Neurobiol. 72(1): 55–85. 2004.
Ватаев С.И., Жабко Е.П., Лукомская Н.Я., Оганесян Г.А., Магазаник Л.Г. Влияние мемантина на судорожные реакции и организацию сна у крыс линии Крушинского–Молодкиной с наследственной предрасположенностью к аудиогенным судорогам. Рос. физиол. журн. им. И. М. Сеченова. 95(8): 802–812. 2009. [Vataev S.I., Zhabko E.P., Lukomskaya N.Y., Oganesyan G.A., Magazanik L.G. The effects of memantine on convulsive reactions and sleep-waking cicle in Krushinskii–Molodkina strain rats with an inherited predisposition to audiogenic convulsions. Russ. J. Physiol. 95(8): 802–812. 2009. (In Russ.)].
Лукомская Н.Я., Ватаев С.И., Жабко Е.П., Магазаник Л.Г. Влияние блокаторов каналов ионотропных глутаматных рецепторов на аудиогенные судорожные реакции крыс линии Крушинского–Молодкиной. Рос. физиол. журн. им. И.М. Сеченова. 98(4): 449–460. 2012. [Lukomskaya N.Y., Vataev S.I., Zhabko E.P., Magazanik L.G. Effects of ionotropic glutamate receptor channel blockers on the development of audiogenic seizures in Krushinskii–Molodkina rats. Russ. J. Physiol. 98(4): 449–460. 2012. (In Russ.)].
Ким К.Х., Зайцев А.В., Лаврентьева В.В., Жабко Е.П., Ватаев С.И., Лукомская Н.Я., Магазаник Л.Г. Влияние блокаторов ионотропных глутаматных рецепторов на вызванные пентилентетразолом судороги у крыс линии Крушинского–Молодкиной. Рос. физиол. журн. им. И. М. Сеченова. 98(12): 1520–1529. 2012. [Kim K.K., Zaitsev A.V., Lavrentieva V.V., Zhabko E.P., Vataev S.I., Lukomskaya N.Y., Magazanik L.G. The effect of ionotropic glutamate receptor antagonist on pentylenetetrazole-indused seizures in Krushinskii–Molodkina rats. Russ. J. Physiol. 98(12): 1520–1529. 2012. (In Russ.)].
Filakovszky J., Kantor S., Halasz P., Bagdy G. 8-OH-DPAT and MK-801 affect epileptic activity independently of vigilance. Neurochem. Int. 38(7): 551–556. 2001.
Ormandy G.C., Jope R.S., Snead O.C. Anticonvulsant actions of MK-801 on the lithium-pilocarpine model of status epilepticus in rats. Exp. Neurol. 106(2): 172–180. 1989.
Walton N.Y., Treiman D.M. Motor and electroencephalographic response of refractory experimental status epilepticus in rats to treatment with MK-801, diazepam, or MK-801 plus diazepam. Brain Res. 553(1): 97–104. 1991.
Hughes P., Young D., Dragunow M. MK-801 sensitizes rats to pilocarpine induced limbic seizures and status epilepticus. Neuroreport. 4(3): 314–316. 1993.
Starr M.S., Starr B.S. Glutamate-dopamine interactions in the production of pilocarpine motor seizures in the mouse. J. Neural Transm. Park. Dis. Dement. Sect. 6(2): 109–117. 1993.
Starr M.S., Starr B.S. The new competitive NMDA receptor antagonist CGP 40116 inhibits pilocarpine-induced limbic motor seizures and unconditioned motor behaviour in the mouse. Pharmacol. Biochem. Behav. 47(1): 127–131. 1994.
Lee M.G., Chou J.Y., Lee K.H., Choi B.J., Kim S.K., Kim C.Y. MK-801 augments pilocarpine-induced electrographic seizure but protects against brain damage in rats. Prog. Neuropsychopharmacol. Biol. Psychiatry. 21(2): 331–344. 1997.
Smolders I., Khan G.M., Manil J., Ebinger G., Michotte Y. NMDA receptor-mediated pilocarpine-induced seizures:characterization in freely moving rats by microdialysis. Br. J. Pharmacol. 121(6): 1171–1179. 1997.
Rice A.C., DeLorenzo R.J. N-methyl-D-aspartate receptor activation regulates refractoriness of status epilepticus to diazepam. Neuroscience. 93(1): 117–123. 1999.
Ватаев С.И., Зайцев А.В., Ким К.Х., Лукомская Н.Я., Магазаник Л.Г. Изменения электрической активности мозга при формировании эпилептического статуса на литий-пилокарпиновой модели у крыс, различающихся по уровню судорожной готовности. Рос. физиол. журн. им. И. М. Сеченова. 102(6): 633–646. 2016. [Vataev S.I., Zaitsev A.V., Kim K.K., Lukomskaya N.Y., Magazanik L.G. Changes in brain electrical activity patterns in rats with different susceptibility to seizures in lithium-pilocarpine model of status epilepticus. Russ. J. Physiol. 102(6): 633–646. 2016. (In Russ.)].
Paxinos G., Watson C. The rat brain in stereotaxic coordinates. Compact 3 rd. ed. CD‑ROM. San Diego. Acad. Press. 1997.
Pinel J.P., Rovner L.I. Experimental epileptogenesis: kindling-induced epilepsy in rats. Exp. Neurol. 58(2): 190–202. 1978.
Khan G.M., Smolders I., Lindekens H., Manil J., Ebinger G., Michotte Y. Effects of diazepam on extracellular brain neurotransmitters in pilocarpine-induced seizures in rats. Eur. J. Pharmacol. 373(2–3): 153–161. 1999.
Чепурнов С.А., Чепурнова Н.Е., Редкозубова О.М., Саакян С.А. Status epilepticus – новые механизмы и пути торможения (литий-пилокарпиновая модель) Успехи физиол. наук. 36(1): 68–84. 2005. [Chepurnov S.A., Chepurnova N.E., Redkozubova О.M., Saakyan S.A. Status epilepticus - the new mechanisms and lines of inhibition (the lithium-pilocarpine model). Usp. Fiziol. Nauk. 36(1): 68–84. 2005. (In Russ.)].
Turski L., Meldrum B.S., Cavalheiro E.A., Calderazzo-Filho L.S., Bortolotto Z.A., Ikonomidou-Turski C., Turski W.A. Paradoxical anticonvulsant activity of the excitatory amino acid N-methyl-D-aspartate in the rat caudate-putamen. Proc. Natl. Acad. Sci. USA. 84(6): 1689–1693. 1987.
Millan M.H., Chapman A.G., Meldrum B.S. Extracellular amino acid levels in hippocampus during pilocarpine-induced seizures. Epilepsy Res. 14(2): 139–148. 1993.
Costa M.S., Rocha J.B.T., Perosa S.R., Cavalheiro E.A., Naffah-Mazzacoratti M.G. Pilocarpine induced status epilepticus increases glutamate release in rat hippocampal synaptosomes. Neurosci. Lett. 356(1): 41–44. 2004.
Жулин В.В., Плескачева М.Г. Связывание ГАМК и диазепама в головном мозге крыс линии Крушинского–Молодкиной. Нейрохимия. 10(1–2): 10–17. 1991. [Joulin V.V., Pleskacheva M.G. GABA and diazepam binding in rats of Krushinsky–Molodkina strain. Neurochimia. 10(1–2): 10–7. 1991. (In Russ.)].
Faingold C.L., Boersma Anderson C.A., Caspary D.M. Involvement of GABA in acoustically-evoked inhibition in inferior colliculus neurons. Hear Res. 52(1): 201–216. 1991.
Molnar L.R., Fleming W.W., Taylor D.A. Alterations in neuronal gamma-aminobutyric acid(A) receptor responsiveness in genetic models of seizure susceptibility with different expression patterns. J. Pharmacol. Exp. Ther. 295(3):1258–1266. 2000.
Faingold C.L. Role of GABA abnormalities in the inferior colliculus pathophysiology-audiogenic seizures. Hear Res. 168(1–2): 223–237. 2002.
Solius G.M., Revishchin A.V., Pavlova G.V., Poletaeva I.I. Audiogenic epilepsy and GABAergic system of the colliculus inferior in Krushinsky-Molodkina rats. Dokl. Biochem. Biophys. 466: 32–34. 2016.
Ribak C.E. An abnormal GABAergic system in the inferior colliculus provides a basis for audiogenic seizures in genetically epilepsy-prone rats. Epilepsy Behav. 71(Pt B): 160–164. 2017.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


