Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 1, стр. 76-88
Дексаметазон предотвращает сепсис-индуцированное угнетение сократительной функции лимфатических сосудов и узлов посредством ингибирования индуцибельной no-синтазы и циклооксигеназы-2
1 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: gilobov@yandex.ru
Поступила в редакцию 26.03.2018
После доработки 01.11.2018
Принята к публикации 02.11.2018
Аннотация
In vitro изучена сократительная активность брыжеечных лимфатических сосудов и лимфатических узлов крысы при абдоминальном экспериментальном сепсисе, вызванном лигированием-пункцией слепой кишки. Установлено, что сепсис приводит к выраженному снижению тонуса и уменьшению частоты и амплитуды фазных сокращений лимфатических сосудов и лимфатических узлов. Показано, что при сепсисе основными причинами, приводящими к угнетению сократительной функции лимфатических сосудов и узлов, является повышенная экспрессия iNOS и СОХ-2. В лимфатических сосудах преобладает механизм гиперпродукции NO, что приводит к открыванию АТФ-чувствительных K+-каналов мембраны гладкомышечных клеток лимфатических сосудов, гиперполяризации мембраны и расслаблению гладкомышечных клеток. В лимфатических узлах экспрессируется преимущественно СОХ-2, что сопровождается повышением продукции простациклина, вызывающего расслабление гладкомышечных клеток капсулы лимфатических узлов. Эндогенные и экзогенные глюкокортикоиды при сепсисе оказывают протективное действи на транспортную функцию лимфатических сосудов и лимфатических узлов посредством ингибирования экспрессии iNOS и СОХ-2.
Традиционно сепсис определяется как комплекс симптомов, возникающих, когда бактериальная, вирусная или грибковая инфекция приводит к развитию синдрома системного воспалительного ответа, включающего лихорадку, лейкоцитоз/лейкопению, снижение сосудистого сопротивления и полиорганную недостаточность [1, 2]. У части пациентов сепсис приводит к развитию септического шока, сопровождающегося высокой смертностью. Клиницисты и исследователи предлагали различные объяснения высокой смертности при сепсисе, такие, как тяжелые нарушения клеточного метаболизма и оксигенации тканей, дисфункция миокарда, необратимые повреждения легких и др. [3], однако с течением времени и первые и вторые пришли к заключению, что основной причиной развития тяжелого сепсиса является стойкое и сложное нарушение регуляции иммунного ответа [2, 3, 4]. Инфекционный процесс вызывает как провоспалительные, так и противовоспалительные реакции, величина которых зависит от множества факторов, в том числе от вирулентности возбудителя, места заражения, генетики хозяина и сопутствующих заболеваний. При сепсисе начальный острый ответ на инфекционные патогены обычно приводит к образованию значительного количества цитокинов, обладающих провоспалительными свойствами, а в последующем повышенная иммунная активация в начальной фазе сепсиса вызывает истощение иммунной системы, что приводит к выраженной иммуносупрессии [3, 5].
Чаще всего причинами сепсиса являются инфекции легких и органов брюшной полости [6]. Среди последних можно перечислить широкий спектр интраабдоминальных инфекций: от простых (внутри- и забрюшинные абсцессы) до сложных (перитонит). Считается, что в развитии сепсиса значимую роль играет кишечник. С одной стороны, первичная транслокация бактерий в слизистую оболочку кишечника может служить причиной развития сепсиса. С другой стороны, кишечник вовлечен в развитие отдаленной органной недостаточности при сепсисе некишечного происхождения. Нарушения кишечного барьера играет критическую роль в развитии системного воспалительного ответа и полиорганной недостаточности [7]. Однако повреждение кишечного барьера – это не просто увеличение проницаемости стенки кишечника, что дополнительно приводит к транслокации бактерий, но также включает активацию иммунокомпетентных клеток внутри стенки кишечника и в соседних лимфатических узлах [8]. Транслокация бактерий, связанная с повышенной проницаемостью кишечной стенки, как полагают, стимулирует лимфоидную ткань и способствует развитию воспаления, что сопровождается высвобождением цитокинов, хемокинов и других медиаторов, которые поддерживают воспалительное состояние кишечника [9]. Цитокины и другие медиаторы воспаления проникают в кишечную лимфу. Существуют экспериментальные и клинические данные, показывающие, что при сепсисе лимфатическая система кишечника и брыжейки является основным путем доставки бактерий и токсических факторов в системный кровоток [10]. Дренирование центрального лимфатического коллектора – грудного протока, на ранних стадиях сепсиса значительно улучшает состояние экспериментальных животных и пациентов [11]. В свою очередь, известно, что скорость транспорта лимфы от места образования до лимфатических узлов и в дальнейшем от лимфатических узлов в системный кровоток, определяется активной транспортной функцией лимфатических сосудов [12]. Липополисахариды, цитокины и другие медиаторы в процессе продвижения из очага воспаления по лимфатическим сосудам оказывают воздействие на эндотелиальные и гладкомышечные клетки лимфатических сосудов, а при поступлении лимфы в лимфатические узлы, влияют на различные структуры лимфатических узлов, в т.ч. и на эндотелиоциты и гладкомышечные клетки капсулы лимфатических узлов [13].
Воспаление и иммунный ответ являются сложными процессами, регулируемыми разнообразными механизмами, включая нервную и эндокринную системы [14]. Нейро-эндокринная система контролирует широкий спектр физиологических функций, которые имеют решающее значение для регулирования иммунных реакций. В частности, в ответ на воспаление и повышение содержания провоспалительных цитокинов возрастает продукция кортикотропин-рилизинг фактора, который стимулирует образование в гипофизе больших количеств адренокортикотропного гормона, в ответ на который в надпочечниках возрастает синтез кортизола, приводящего к активации синтеза противовоспалительных цитокинов и инактивации ядерного фактора транскрипции κB (NF-κB) [15]. Существует мнение, что недостаточность надпочечников при сепсисе является основной причиной снижения чувствительности сосудов к вазопрессорам и оказывает выраженное влияние на развитие септического шока [15]. В норме активация гипоталамо-гипофизарно-надпочечниковой оси приводит к контролируемому ингибированию иммунных и воспалительных реакций и предупреждает гиперактивацию воспаления, перепроизводство цитокинов и иммунное повреждение тканей [16]. Эта физиологическая петля обратной связи служит главным регуляторным механизмом контроля и сдерживания врожденного/приобретенного иммунитета и воспалительных реакций. Кортизол модулирует концентрацию нескольких провоспалительных цитокинов, включая IL-2, IL-3, IL-6, TNF-α и интерферон-γ [17]. Известно, что при воспалении концентрация глюкокортикоидов в плазме крови и тканях возрастает в несколько раз [18]. Глюкокортикоидные рецепторы имеются практически во всех тканях, включая структуры лимфатической системы. Поскольку в литературе практически нет данных о действии глюкокортикоидов на сократительную активность лимфатических сосудов и узлов, лежащую в основе их транспортной функции, нам представлялось важным изучить влияние и механизмы действия глюкокортикоидов на транспортную функцию лимфатических сосудов и узлов при экспериментальном сепсисе, что и стало целью настоящего исследования.
МЕТОДЫ ИССЛЕДОВАНИЯ
При моделировании сепсиса у лабораторных животных используются различные модели: инъекция липополисахарида, бактериальная инъекция внутрибрюшинно или внутривенно, внутриперитонеальная инъекция содержимого слепой кишки от грызуна-донора, лигирование и пункция слепой кишки [19]. В этом исследовании использовали модель сепсиса, вызванного лигированием и перфорацией слепой кишки, что имитирует сепсис абдоминального происхождения [20].
Данное исследование было одобрено этическим комитетом Института физиологии им. И.П. Павлова РАН. В эксперименте использовали самцов крыс линии Sprague-Dawley из биоколлекции лабораторных млекопитающих Института физиологии им. И.П. Павлова РАН (36 животных) в возрасте 6 месяцев и массой 450–480 г. До эксперимента животных содержали в условиях вивария на стандартном пищевом рационе при свободном доступе к воде. Было выделено несколько групп крыс: контрольная группа – 8 животных и три группы экспериментальных животных: 1) адреналэктомированные (8 крыс), которым осуществляли лигирование-пункцию слепой кишки, 2) адреналэктомированные (8 крыс), которым за 1 ч до лигирования-пункции слепой кишки вводили дексаметазон (2 мг/кг массы), 3) интактные (с функционирующими надпочечниками), которым осуществляли лигирование-пункцию слепой кишки (12 крыс). Животных анестезировали внутрибрюшинной инъекцией золетила (30 мг/кг) [21]. У 16 животных под наркозом за 7 дней до исследования была проведена двусторонняя адреналэктомия. Этим животным на протяжении всего исследования проводили заместительную терапию (ежедневно осуществляли подкожные инъекции дезоксикортикостерона ацетата (масляный раствор, 0.17 мг/кг)) [21]. За 1 ч до лигирования-пункции слепой кишки 8 адреналэктомированным крысам интраперитонеально вводили дексаметазон (2 мг/кг массы). У всех животных была проведена срединная лапаротомия. С помощью тупых анатомических пинцетов выводили на поверхность слепую кишку. У животных контрольной группы через 5 мин кишку возвращали в брюшную полость и брюшную стенку послойно ушивали. У остальных крыс лигировали слепую кишку в 5 см от илеоцекального клапана шелковой нитью (3-0, SOFSILK). После этого слепую кишку прокалывали насквозь инъекционной иглой 21G и слегка массировали до появления на поверхности маленьких капель кишечного содержимого. Затем кишку возвращали в брюшную полость и послойно ушивали брюшную стенку. Каждому животному вводили 10 мл физиологического раствора для восстановления баланса жидкости.
Через 24 ч под наркозом у животных вскрывали брюшную полость и забирали для исследования несколько брыжеечных лимфатических узлов и кишечный ствол. До исследования препараты хранили в физиологическом солевом растворе при температуре +2…+4°С. Перед исследованием лимфатические сосуды и узлы тщательно очищали от жира и окружающей соединительной ткани и размещали в камере экспериментальной установки с датчиком силы FORT-10 (WPI, США) при непрерывном протоке физиологического солевого раствора следующего состава (ммоль/л): NaCl – 120.4; KCl – 5.9; CaCl2 – 2.5; MgCl2 – 1.2; NaH2PO4 – 1.2; NaHCO3 – 15.5; глюкоза – 11.5. Физиологический раствор насыщали газовой смесью, состоящей из 95% О2 и 5% СО2. Температуру раствора в камере поддерживали на уровне +37.0 ± 0.1°С. Подробно методика исследования описана ранее [13]. Препараты подвергали исходному натяжению, соответствующему трансмуральному давлению 3 см водн. ст., и после 30-минутной стабилизации регистрировали параметры их сократительной активности.
В настоящем исследовании использовали следующие вещества: дексаметазон (Dexamethasone, MP Biomedicals); 1400W (1400W dihydrochloride, Sigma-Aldrich), 20 мкмоль/л; глибенкламид (Glibenclamide, MP Biomedicals), 10 мкмоль/л; династат (Dynastat, Pfizer Inc.), 3 мг/л; RO1 138 452 (4,5-dihydro-1H-imidazol-2-yl)-[4-(4-isopropoxy-benzyl)-phenyl]-amine, R&D Systems), 1 мкмоль/л; GW627368X (N-{2-[4-(4,9-diethoxy-1-oxo-1,3-dihydro-2H-benzo[f]isoindol-2-yl)phenyl]acetyl} benzene sulphonamide, Cayman Chemical), 20 мкмоль/л.
Дексаметазон предварительно растворяли в метаноле (20 мг/мл), глибенкламид – в этаноле (2 мг/мл), GW627368X – в DMSO (10 мг/мл). Полученные растворы добавляли в физиологический раствор до достижения необходимой концентрации. Растворители в разведении 1/1000 не вызывали значимых изменений параметров сократительной активности лимфатических сосудов и узлов.
Статистическую обработку полученных результатов проводили с помощью программы “StatSoft STATISTICA 6.1.478". Поскольку полученные данные имели нормальное распределение, они представлены в виде средних значений с их стандартной ошибкой (M ± SE). Для установления достоверности различий использовали t-критерий Стьюдента. Различия считали статистически значимыми при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Клинические признаки развития сепсиса у крыс начинали проявляться через 6 ч после операции. Через 24 ч у всех животных с лигированием-перфорацией слепой кишки были выявлены признаки сепсиса (гиподинамия, взъерошенность шерсти, сгорбленное положение, диарея, низкое среднее АД (у интактных крыс с сепсисом – 86 ± 6.6 мм рт. ст., у адреналэктомированных с сепсисом – 75.4 ± 4.8 мм рт. ст., у адреналэктомированных с сепсисом (+дексаметазон) – 92.4 ± 4.8 мм рт. ст., в контрольной группе – 109 ± 5.3 мм рт. ст.). Смертность составила: 3 адреналэктомированные крысы и 2 интактные с сепсисом. Все контрольные животные выжили. После вскрытия у всех животных с лигированием-перфорацией слепой кишки были выявлены признаки перитонита: воспаленный отечный кишечник темного цвета, гнойный перитонеальный экссудат, диффузное осаждение фибрина и множественные спайки.
У животных с сепсисом выявлено выраженное снижение тонуса лимфатических сосудов и узлов по сравнению с контролем, фазные сокращения были более редкими и низкоамплитудными (см. табл. 1). Максимальное угнетение сократительной активности наблюдалось в лимфатических сосудах и узлах у адреналэтомированных крыс с сепсисом. У интактных животных с сепсисом и адреналэктомированных, которым вводился дексаметазон, тонус, амплитуда и частота фазных сокращений были значительно выше.
Таблица 1.
Параметры сократительной активности лимфатических сосудов и узлов крыс
| Параметры сократительной активности | Объект исследования | Крысы с сепсисом | Крысы с сепсисом (адр-) | Крысы с сепсисом (адр- + Dex) | Контроль |
|---|---|---|---|---|---|
| Тонус, мН | Кишечный ствол | 1.18 ± 0.11** | 0.74 ± 0.09## | 1.31 ± 0.08& | 1.66 ± 0.13 |
| Лимфатический узел | 0.86 ± 0.09** | 0.44 ± 0.06## | 1.25 ± 0.08& | 1.64 ± 0.11 | |
| Частота фазных сокращений, мин–1 | Кишечный ствол | 3.6 ± 0.28** | 2.2 ± 0.19## | 3.2 ± 0.16& | 5.7 ± 0.38 |
| Лимфатический узел | 0.7 ± 0.06** | 0.3 ± 0.04## | 1.1 ± 0.08& | 1.9 ± 0.16 | |
| Амплитуда фазных сокращений, мН | Кишечный ствол | 0.87 ± 0.08** | 0.63 ± 0.06## | 0.97 ± 0.06& | 1.08 ± 0.10 |
| Лимфатический узел | 0.51 ± 0.05** | 0.36 ± 0.03## | 0.63 ± 0.04& | 0.76 ± 0.06 |
Примечание. (адр-) – Адреналэктомированные крысы; (адр- + Dex) – адреналэктомированные крысы + дексаметазон; * – различия достоверны по отношению к данным в контроле, p < 0.05; ** – то же, p <0.01; # – различия достоверны по отношению к данным, зарегистрированным при исследовании препаратов от животных с сепсисом, p < 0.05; ## – то же, p < 0.01; & – различия достоверны по отношению к данным, зарегистрированным при исследовании препаратов от адреналэктомированных животных с сепсисом, p < 0.01.
Известно, что при сепсисе в гладкомышечных и эндотелиальных клетках кровеносных сосудов возрастает экспрессия индуцибельной синтазы NO (iNOS) и циклооксигеназы-2 (COX-2) [22–24]. Основываясь на этих данных с целью выяснения механизмов, посредством которых глюкокортикоиды оказывают протективное действие на транспортную функцию лимфатических сосудов и узлов, были проведены две серии экспериментов. В первой из них определяли роль iNOS в ингибировании сократительной функции лимфатических сосудов и узлов. С этой целью в раствор, омывающий лимфатические сосуды и узлы, вводили селективный ингибитор iNOS-1400W [22]. У животных с сепсисом 1400W приводил к повышению тонуса и увеличению частоты фазных сокращений лимфатических узлов и сосудов (рис. 1 и 2). Максимальное увеличение параметров сократительной активности при применении 1400W наблюдалось у адреналэктомированных животных, а минимальное – у адреналэктомированных крыс, которым до лигирования-пункции слепой кишки вводили дексаметазон.
Рис. 1.
Тонус и частота фазных сокращений брыжеечных лимфатических сосудов крысы при сепсисе. Сепсис – лимфатические сосуды от интактных крыс с сепсисом, Адр– лимфатические сосуды от адреналэктомированных крыс с сепсисом, Адр- (+ DEX) – лимфатические сосуды от адреналэктомированных крыс с сепсисом, которым перед лигированием-пункцией вводили дексаметазон. Исх – исходная величина параметра, 1400W – величина параметра при действии ингибитора iNOS-1400W (20 мкмоль/л), Глибенкламид – величина параметра при действии блокатора АТФ-чувствительных К+-каналов – глибенкламида (10 мкмоль/л). Данные представлены в % от величины соответствующих параметров в контроле.
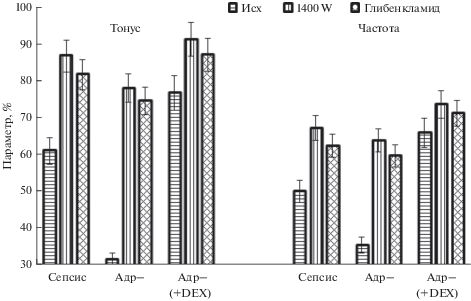
Рис. 2.
Тонус и частота фазных сокращений брыжеечных лимфатических узлов крысы при сепсисе. Сепсис – лимфатические узлы от интактных крыс с сепсисом, Адр– – лимфатические узлы от адреналэктомированных крыс с сепсисом, Адр– (+ DEX) – лимфатические узлы от адреналэктомированных крыс с сепсисом, которым перед лигированием-пункцией вводили дексаметазон. Остальные обозначения такие же, как и на рис. 1. Данные представлены в % от величины соответствующих параметров в контроле.
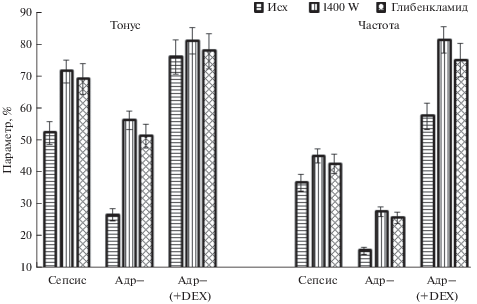
В ряде работ при исследовании реактивности кровеносных сосудов при сепсисе было установлено, что липополисахариды и цитокины в различных клетках стимулируют экспрессию iNOS, что сопровождается гиперпродукцией NO и активацией АТФ-чувствительных К+-каналов. Последнее приводит к гиперполяризации мембраны сосудистых гладкомышечных клеток и их расслаблению [22, 24]. Поскольку подобных исследований на лимфатических сосудах и узлах не проводилось, мы провели эксперименты, в которых оценили вклад АТФ-чувствительных К+-каналов в ингибирование сократительной активности лимфатических сосудов и узлов при сепсисе. С этой целью в омывающий раствор вводили блокатор АТФ-чувствительных К+-каналов – глибенкламид. Результаты этих экспериментов представлены на рис. 1 и 2. Глибенкламид приводил к выраженному увеличению тонуса и частоты фазных сокращений лимфатических сосудов и узлов, сопоставимому с эффектом 1400W. При этом максимальные изменения параметров сократительной деятельности также наблюдались в лимфатических сосудах и узлах от адреналэктомированных крыс.
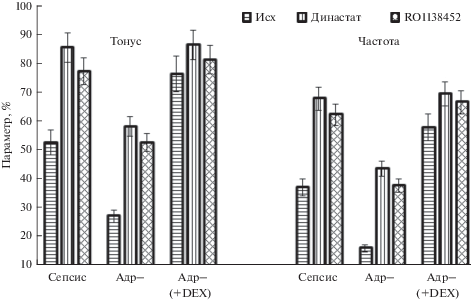
В ряде работ показана важная роль циклооксигеназы-2 в развитии гипореактивности кровеносных сосудов при сепсисе [23]. Что касается лимфатических сосудов, то имеется всего одна работа, в которой показана роль СОХ-2 в ингибировании сократительной функции мелких лимфатических сосудов при воспалении кишечника, вызванного введением 2,4,6-тринитробензолсульфокислоты [25]. В связи с этим нами были проведены исследования сократительной функции лимфатических сосудов и лимфатических узлов с применением династата (селективный ингибитор СОХ-2). Ингибирование СОХ-2 приводило к существенным изменениям тонуса и частоты фазных сокращений лимфатических узлов, в лимфатических сосудах эффект династата был выражен значительно слабее (рис. 3 и 4). С целью определения типов простагландинов, принимающих участие в ингибировании сократительной функции лимфатических сосудов и узлов при сепсисе, использовали RO1 138 452 (селективный антагонист IP-рецепторов) и GW627368X (ангагонист EP4-рецепторов) [26]. Ингибирование IP-рецепторов сопровождалось выраженным увеличением тонуса и частоты фазных сокращений лимфатических узлов от крыс с сепсисом и от адреналэктомированных крыс с сепсисом. В то же время, параметры сократительной активности лимфатических сосудов от адреналэктомированных крыс с сепсисом, которым предварительно вводили дексаметазон, изменялись незначительно (рис. 4). Применение GW627368X (антагониста EP4-рецепторов) сопровождалось незначительными изменениями тонуса и частоты фазных сокращений лимфатических узлов (в пределах 5–8% от величины тонуса и частоты фазных сокращений лимфатических сосудов и узлов при сепсисе (не показано).
Рис. 3.
Тонус и частота фазных сокращений брыжеечных лимфатических сосудов крысы при сепсисе. Сепсис – лимфатические сосуды от интактных крыс с сепсисом, Адр– – лимфатические сосуды от адреналэктомированных крыс с сепсисом, Адр– (+ DEX) – лимфатические сосуды от адреналэктомированных крыс с сепсисом, которым перед лигированием-пункцией вводили дексаметазон. Исх – исходная величина параметра, Династат – величина параметра при действии ингибитора СОХ-2 – династата (3 мг/л), RO1138452 – величина параметра при действии антагониста IP-рецепторов (1 мкмоль/л). Данные представлены в % от величины соответствующих параметров в контроле.
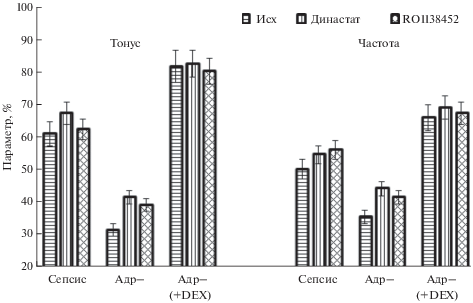
Рис. 4.
Тонус (слева) и частота фазных сокращений (справа) брыжеечных лимфатических узлов крысы при сепсисе. Сепсис – лимфатические узлы от интактных крыс с сепсисом, Адр– – лимфатические узлы от адреналэктомированных крыс с сепсисом, Адр– (+ DEX) – лимфатические узлы от адреналэктомированных крыс с сепсисом, которым перед лигированием-пункцией вводили дексаметазон. Остальные обозначения такие же, как и на рис. 3. Данные представлены в % от величины соответствующих параметров в контроле.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Хорошо известно, что важнейшей функцией лимфатической системы является поддержание гомеостаза межклеточной жидкости посредством изменений скорости тока лимфы [12, 27]. В то же время в последние годы все большее внимание исследователей и клиницистов привлекает иммунная функция лимфатической системы. Известно, что лимфатические сосуды участвуют в иммунном ответе, обеспечивая структурную и функциональную поддержку доставки антигенов и антигенпрезентирующих клеток к дренирующим лимфатическим узлам. Новые данные свидетельствуют, что лимфатическая система может регулировать конечный иммунный ответ посредством модуляции нескольких процессов: поступление антигенов/дендритных клеток в лимфатические капилляры; активный трафик антигенов/дендритных клеток по афферентным лимфатическим сосудам; представление антигена в лимфатических узлах лимфатическим эндотелиальным клеткам и клеткам стромы лимфатических узлов; активный выход лимфоцитов из лимфатических узлов и, наконец, транспорт лимфоцитов из лимфатических узлов по эфферентным лимфатическим сосудам в кровеносную систему для последующей доставки их в воспаленную ткань [28–30].
Транспорт лимфы по афферентным и эфферентным лимфатическим сосудам и перемещение ее внутри лимфатических узлов обеспечиваются сокращениями гладких мышц, входящих в состав стенки лимфатических сосудов и капсулы лимфатических узлов [12, 31]. Параметры сокращений лимфатических сосудов и узлов, а соответственно и их транспортная функция, в физиологических условиях регулируются посредством нескольких хорошо изученных механизмов [12, 32, 33]. Но при воспалении в тканях появляются различные соединения (липополисахариды, цитокины, хемокины), которые при поступлении в лимфатические сосуды оказывают выраженное влияние на эндотелиальные и гладкомышечные клетки, что приводит к изменению тонуса, частоты и амплитуды фазных сокращений лимфатических сосудов и узлов, а в конечном итоге, определяет скорость развития и интенсивность иммунных реакций [13].
Воспаление и иммунитет являются сложными процессами и модулируются посредством различных механизмов с участием большого количества про- и противовоспалительных субстанций, как предсуществующих, так и образующихся при воспалении. В частности, воспаление приводит к активации гипоталамо-гипофизарно-надпочечниковой оси, которая осуществляет строгое регулирование иммунных и воспалительных реакций и предупреждает гиперактивацию воспаления, перепроизводство цитокинов и иммунное повреждение тканей [16, 18]. Глюкокортикоидные рецепторы обнаружены практически во всех тканях, включая органы лимфатической системы [34]. Однако данных о действии глюкокортикоидов на транспортную функцию лимфатических сосудов и узлов при воспалении практически нет.
Из данных литературы известно, что снижение тонуса артерий при сепсисе преимущественно обусловлено NO и PGI2, образующимися в значительных количествах эндотелиальными, гладкомышечными клетками и фибробластами под влиянием липополисахаридов и цитокинов [35, 36]. Поскольку данных об изменениях сократительной функции лимфатических сосудов и узлов при сепсисе нет, нами были проведены эксперименты по изучению эффектов сепсиса на сократительную активность лимфатических сосудов и узлов. Было установлено, что сепсис сопровождается угнетением транспортной функции лимфатических сосудов и узлов. При исследовании in vitro лимфатических сосудов и узлов от животных с сепсисом наблюдалось выраженное снижение тонуса лимфатических сосудов и узлов и уменьшение амплитуды и частоты их фазных сокращений.
Применение специфического ингибитора iNOS-1400W позволило установить, что одним из механизмов, приводящих к снижению тонуса и частоты фазных сокращений лимфатических сосудов и узлов при сепсисе, является повышение экспрессии iNOS в клетках лимфатических сосудов и узлов, при этом в лимфатических сосудах экспрессия iNOS была выражена сильнее. Ингибирование iNOS 1400W приводило к повышению тонуса лимфатических сосудов у крыс с сепсисом на 42.2 ± 4.2%, а у адренаэктомированных крыс с сепсисом – на 147.4 ± 20.1%. Примерно такие же изменения были обнаружены и в отношении частоты фазных сокращений ЛС. Результаты экспериментов с применением блокатора АТФ-чувствительных К+-каналов – глибенкламида позволили раскрыть механизм ингибирующего влияния сепсиса на лимфатические сосуды и узлы. Повышенная экспрессия iNOS приводит к гиперпродукции NO и таким образом активирует сигнальный путь: NO–цГМФ–АТФ-чувствительные К+-каналы мембраны гладкомышечных клеток [24]. Открывание этих каналов сопровождается гиперполяризаций мембраны гладкомышечных клеток, закрытием потенциал-чувствительных Са2+-каналов мембраны гладкомышечных клеток и их расслаблением, что проявляется в виде снижения тонуса и урежения частоты фазных сокращений лимфатических сосудов и узлов. Ранее повышенная экспрессия iNOS и участие NO и АТФ-чувствительных К+-каналов мембраны гладкомышечных клеток в вазодилатации были убедительно продемонстрированы при изучении тонуса аорты и мелких брыжеечных артерий при септическом шоке у крыс и брыжеечных лимфатических сосудов морской свинки с экспериментальным илеитом [22, 37].
Известно также, что при сепсисе в клетках различных органов и тканей значительно возрастает экспрессия СОХ-2 с образованием простаноидов, обладающих вазодилататорными свойствами [23, 26, 38]. В наших опытах на лимфатических сосудах и узлах также были получены данные, свидетельствующие о том, что при сепсисе в этих структурах наблюдается повышение экспресии СОХ-2, при этом в лимфатических узлах повышение экспресии СОХ-2 было выражено сильнее по сравнению с лимфатическими сосудами. Ингибирование СОХ-2 специфическим антагонистом – династатом в наших экспериментах приводило к повышению тонуса лимфатических узлов у крыс с сепсисом на 62.7 ± 5.3% и частоты фазных сокращений на 83.6 ± 6.3%, а у адреналэктомированных крыс с сепсисом повышение тонуса составило 116.4 ± 12.8%, частоты фазных сокращений – 176.4 ± 11.4%. В лимфатических сосудах династат приводил к значительно меньшим изменениям тонуса: у крыс с сепсисом тонус повышался на 12.3 ± 1.6%, а у адреналэктомированных крыс с сепсисом – на 31.6 ± 2.6%. Эксперименты с использованием антагонистов IP-рецепторов (RO1 138 452) и EP4-рецепторов (GW627 368X) показали, что основным простаноидом, образующимся в лимфатических узлах при сепсисе и приводящим к подавлению их сократительной функции, является PGI2. Применение антагониста IP-рецепторов приводило практически к таким же изменениям параметров сократительной активности ЛУ, как и действие ингибитора СОХ-2 – династата. В то же время антагонист EP4-рецепторов – GW627 368X при сепсисе оказывал незначительное влияние на параметры сократительной функции лимфатических узлов (мы использовали антагонист EP4-рецепторов поскольку ранее было показано, что EP4 является основным рецептором для PGE2 в лимфатических сосудах [26, 39].
При анализе результатов исследования параметров сократительной активности лимфатических сосудов и узлов от животных разных групп необходимо отметить следующую закономерность: максимальное угнетение параметров сократительной активности лимфатических сосудов и узлов было выявлено у адреналэктомированных крыс с сепсисом, у интактных крыс с сепсисом изменения тонуса и параметров фазной сократительной активности были выражены слабее, минимальное ингибирование сократительной функции было зарегистрировано у адреналэктомированных крыс, которым за 1 ч до лигирования-пункции слепой кишки вводили дексаметазон (2 мг/кг массы). Необходимо отметить, что это высокая доза, она вводилась намеренно с целью оценить эффект экзогенных глюкокортикоидов на состояние лимфатических сосудов и узлов. [33]. Представленные данные дают нам основание сделать заключение о том, что при сепсисе эндогенные и экзогенные глюкокортикоиды оказывают протективный эффект на транспортную функцию лимфатических сосудов и узлов.
В экспериментах с ингибиторами iNOS и СОХ-2, антагонистом IP-рецепторов и блокатором АТФ-чувствительных К+-каналов было установлено, что максимальное увеличение параметров сократительной активности лимфатических сосудов и узлов наблюдалось при исследовании препаратов от адреналэктомированных крыс с сепсисом, у интактных крыс с сепсисом изменения были меньшими, а у адреналэктомированных крыс с сепсисом, которым вводили дексаметазон – минимальными. Например, тонус лимфатических сосудов при действии 1400W повышался на 147% по отношению к его исходной величине. У интактных крыс с сепсисом повышение тонуса было меньшим – 42%, а у адреналэктомированных крыс с сепсисом, которым вводили дексаметазон – 19%. Представленные данные приводят нас к заключению, что в лимфатических сосудах и узлах эндогенные и экзогенные глюкокортикоиды при сепсисе так же, как в брыжеечных артериях крыс [33, 40] существенно ослабляют экспрессию iNOS и СОХ-2 и таким образом способствуют улучшению оттока лимфы от воспаленных органов.
Список литературы
Russell J.A., Rush B., Boyd J. Pathophysiology of septic shock. Crit. Care Clin. 34(1): 43–61. 2018.
Ward P.A., Bosmann M. A historical perspective on sepsis. Am. J. Pathol. 181(1): 2–7. 2012.
Deutschman C.S., Tracey K.J. Sepsis: current dogma and new perspectives. Immunity. 40(4): 463–475. 2014.
Delano M.J., Ward P.A. The immune system’s role in sepsis progression, resolution, and long-term outcome. Immunol. Rev. 274(1): 330–353. 2016.
Weber G.F., Swirski F.K. Immunopathogenesis of abdominal sepsis. Langenbecks Arch. Surg. 399(1): 1–9. 2014.
Minasyan H. Sepsis and septic shock: Pathogenesis and treatment perspectives. J. Crit. Care. 40: 229–242. 2017.
Aranow J.S., Fink M.P. Determinants of intestinal barrier failure in critical illness. Br. J. Anaesth. 77(1): 71–81. 1996.
Andersson R., Andersson B., Andersson E., Eckerwall G., Nordén M., Tingstedt B. Gut barrier failure in critical illness: Lessons learned from acute pancreatitis. J. Organ Dysfunc. 8(2): 93–100. 2006.
Schleicher C., Baas J.C., Elser H., Senninger N. Reticuloendothelial system blockade promotes progression from mild to severe acute pancreatitis in the opossum. Ann. Surg. 233(4): 528–536. 2001.
Landahl P., Ansari D., Andersson R. Severe acute pancreatitis: gut barrier failure, systemic inflammatory response, acute lung injury, and the role of the mesenteric lymph. Surg. Infect. (Larchmt). 16(6): 651–656. 2015.
Выренков Ю.Е., Шевхужев З.А., Ахундов И. Лимфогенные методы терапии при воспалительных заболеваниях органов брюшной полости. Анналы хирургии. (4): 74–78. 1999. [Vyrenkov Yu.E., Shevkhuzhev ZA, Akhundov I. Lymphogenic methods of therapy for inflammatory diseases of the abdominal organs. Ann. Surgery. (4): 74–78. 1999. (In Russ.)].
Лобов Г.И., Панькова М.Н. Транспорт лимфы по лимфатическим узлам: механизмы регуляции. Рос. физиол. журн. им. И.М. Сеченова. 98(11): 1350–1361. 2012. [Lobov G.I., Pankova M.N. Lymph flow through the lymph nodes: regulatory mechanisms. Russ. J. Physiol. 98(11): 1350–1361. 2012. (In Russ.)].
Лобов Г.И., Унт Д.В. Глюкокортикоиды стимулируют сократительную активность лимфатических сосудов и узлов. Регионарное кровообращение и микроциркуляция. 16(4): 73–79. 2017. [Lobov G. I., Unt D. Glucocorticoids stimulate the contractile activity of lymphatic vessels and nodes. Region. Blood Circul. Microcircul. 16(4): 73–79. 2017. (In Russ.)].
Sharshar T., Hopkinson N.S., Orlikowski D., Annane D. Science review: The brain in sepsis–culprit and victim. Crit. Care. 9(1): 37–44. 2005.
Weismüller K., Bauer M., Hofer S., Weigand M.A. The neuroendocrine axis and the pathophysiology of sepsis. Anasthesiol. Intensivmed. Notfallmed. Schmerzther. 45(9): 574–578. 2010.
Borghetti P., Saleri R., Mocchegiani E., Corradi A., Martelli P. Infection, immunity and the neuroendocrine response. Vet. Immunol. Immunopathol. 130 (3–4): 141–162. 2009.
Cutolo M., Seriolo B., Craviotto C., Pizzorni C., Sulli A. Circadian rhythms in RA. Ann. Rheum. Dis. 62(7): 593–596. 2003.
Okuyama K., Dobashi K., Miyasaka T., Yamazaki N., Kikuchi T., Sora I., Takayanagi M., Kita H., Ohno I. The involvement of glucocorticoids in psychological stress-induced exacerbations of experimental allergic asthma. Int. Arch. Allergy Immunol. 163(4): 297–306. 2014.
Lewis A.J., Seymour C.W., Rosengart M.R. Current murine models of sepsis. Surg. Infect. (Larchmt). 17(4): 385–393. 2016.
Hua T., Wu X., Wang W., Li H., Bradley J., Peberdy M.A., Ornato J.P., Tang W. Micro- and macro circulatory changes during sepsis and septic shock in a rat model. Shock. 2017. doi 10.1097/SHK.0000000000000954
Saha D.C., Saha A.C., Malik G., Astiz M.E., Rackow E.C. Comparison of cardiovascular effects of tiletamine-zolazepam, pentobarbital, and ketamine-xylazine in male rats. J. Am. Assoc. Lab. Anim. Sci. 46(2): 74–80. 2007.
Collin S., Sennoun N., Dron A.G., de la Bourdonnaye M., Montemont C., Asfar P., Lacolley P., Meziani F., Levy B. Vascular ATP-sensitive potassium channels are over-expressed and partially regulated by nitric oxide in experimental septic shock. Intensive Care Med. 37(5): 861–869. 2011.
Kimmoun A., Ducrocq N., Levy B. Mechanisms of vascular hyporesponsiveness in septic shock. Curr. Vasc. Pharmacol. 11(2): 139–149. 2013.
Pacher P., Beckman J.S., Liaudet L. Nitric oxide and peroxynitrite in health and disease. Physiol. Rev. 87(1): 315–424. 2007.
Wu T.F., Carati C.J., Macnaughton W.K., von der Weid P.Y. Contractile activity of lymphatic vessels is altered in the TNBS model of guinea pig ileitis. Am. J. Physiol. Gastrointest. Liver Physiol. 291(4): G566–G574. 2006.
Rehal S., von der Weid P.Y. Experimental ileitis alters prostaglandin biosynthesis in mesenteric lymphatic and blood vessels. Prostaglandins Other Lipid Mediat. 116–117: 37–48. 2015.
Scallan J.P., Zawieja S.D., Castorena-Gonzalez J.A., Davis M.J. Lymphatic pumping: mechanics, mechanisms and malfunction. J. Physiol. 594(20): 5749–5768. 2016.
Kim K.W., Song J.H. Emerging roles of lymphatic vasculature in immunity. Immune Netw. 17(1): 68–76. 2017.
Liao S., von der Weid P.Y. Lymphatic system: an active pathway for immune protection. Semin. Cell Dev. Biol. 38: 83–89. 2015.
Randolph G.J., Ivanov S., Zinselmeyer B.H., Scallan J.P. The lymphatic system: integral roles in immunity. Annu. Rev. Immunol. 35: 31–52. 2017.
Muthuchamy M., Zawieja D. Molecular regulation of lymphatic contractility. Ann. N.Y. Acad. Sci. 1131: 89–99. 2008.
Лобов Г.И., Панькова М.Н. NO-зависимая модуляция сократительной функции гладких мышц капсулы лимфатических узлов. Рос. физиол. журнал им. И.М. Сеченова. 96 (5): 489–497. 2010. [Lobov G.I., Pankova M.N. NO-dependent modulation of the smooth muscle contractile function of the lymph node capsule. Russ. J. Physiol. 96(5): 489–497. 2010. (In Russ.)]
Shi W.L., Zhang T., Zhou J.R., Huang Y.H., Jiang C.L. Rapid permissive action of dexamethasone on the regulation of blood pressure in a rat model of septic shock. Biomed. Pharmacother. 84: 1119–1125. 2016.
Yao L.C., Baluk P., Srinivasan R.S., Oliver G., McDonald D.M. Plasticity of button-like junctions in the endothelium of airway lymphatics in development and inflammation. Am. J. Pathol. 180(6): 2561–2575. 2012.
Ginnan R., Guikema B.J., Halligan K.E., Singer H.A., Jourd’heuil D. Regulation of smooth muscle by inducible nitric oxide synthase and NADPH oxidase in vascular proliferative diseases. Free Radic. Biol. Med. 44(7): 1232–1245. 2008.
Jiang Z.L., Zhu X., Diamond M.P., Abu-Soud H.M., Saed G.M. Nitric oxide synthase isoforms expression in fibroblasts isolated from human normal peritoneum and adhesion tissues. Fertil. Steril. 90(3): 769–774. 2008.
Mathias R., von der Weid P.Y. Involvement of the NO-cGMP-K(ATP) channel pathway in the mesenteric lymphatic pump dysfunction observed in the guinea pig model of TNBS-induced ileitis. Am. J. Physiol. Gastrointest. Liver Physiol. 304(6): G623–G634. 2013.
Jones R.L., Wise H., Clark R., Whiting R.L., Bley K.R. Investigation of the prostacyclin (IP) receptor antagonist RO1138452 on isolated blood vessel and platelet preparations. Br. J. Pharmacol. 149(1): 110–120. 2006.
Von Der Weid P.Y., Rehal S. Lymphatic pump function in the inflamed gut. Ann. N.Y. Acad. Sci. 1207(Suppl 1): E69–E74. 2010.
Miike T., Kanda M., Kunishiro K., Shirahase H. Lipopolysaccharide-induced impairment of nitric oxide-mediated vasorelaxation and protective effects of nitric oxide synthesis inhibitors in isolated rat mesenteric arteries. Arzneimittelforschung. 60(6): 315–319. 2010.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


