Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 10, стр. 1316-1328
Влияние рН среды на нейрогенную реактивность внутренней сонной артерии крысы на фоне действия норадреналина
В. Н. Ярцев *
Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: yartsevv@infran.ru
Поступила в редакцию 17.06.2019
После доработки 07.08.2019
Принята к публикации 02.09.2019
Аннотация
В опытах на сегментах внутренней сонной артерии крысы изучалось влияние рН среды на нейрогенную констрикторную реакцию этих сегментов, вызванную их стимуляцией электрическим полем с частотой 1, 3, 10 и 40 Гц до и на фоне действия норадреналина в концентрации от 0.01 до 10 мкМ. Показано, что в условиях ацидоза (рН 6.6) и отсутствия норадреналина происходит снижение этой реакции, наиболее значительное при высоких частотах электростимуляции, в то время как на фоне действия норадреналина ацидоз скорее повышал, а алкалоз (рН 7.6) снижал данную реакцию, и это снижение было статистически значимым и наиболее выраженным при низких частотах электростимуляции. Реакция артерии на норадреналин во всех концентрациях кроме 10 мкМ под действием ацидоза имела тенденцию к возрастанию. Норадреналин потенцировал нейрогенную вазоконстрикцию, причем наибольшее потенцирование наблюдалось при концентрации норадреналина 0.5–10.0 мкМ, увеличивалось на фоне ацидоза и уменьшалось на фоне алкалоза. Обнаруженное увеличение сократительной способности внутренней сонной артерии при сдвиге рН в кислую сторону может иметь значение для предотвращения повышения артериального давления в головном мозге при мышечной работе, сопровождающейся значительным ростом кровяного давления, ацидозом и повышением концентрации норадреналина.
Нейрогенный тонус кровеносных сосудов, с помощью которого центральная нервная система осуществляет перераспределение кровотока в целях обеспечения нормальной жизнедеятельности всего организма, может испытывать значительное влияние со стороны гормональных и локальных механизмов регуляции кровообращения [1]. Изучение этого влияния имеет большое значение для понимания принципов работы сердечно-сосудистой системы. При различных изменениях функционального состояния организма может изменяться содержание разных гормонов в крови. В частности, во время стрессорных состояний может значительно возрастать уровень содержания норадреналина в крови. Например, в плазме крови крыс концентрация норадреналина при стрессе может увеличиваться, согласно различным данным, в 6–11 раз [2–4], достигая значения 0.27 мкМ [2]. При анализе литературы мы обнаружили, что работы по изучению действия норадреналина на нейрогенный тонус сосудов довольно немногочисленны. В частности, было показано, что норадреналин угнетает нейрогенную констрикторную реакцию сосудов [5], либо вызывает вазодилатацию [6] или двухфазную реакцию [7] на раздражение периваскулярных нервов. Нам удалось найти только одно исследование, в котором было обнаружено потенцирующее действие норадреналина на нейрогенную вазоконстрикцию [8]. Изучая действие норадреналина на нейрогенное сокращение хвостовой артерии крысы, мы впервые показали восстанавливающее действие норадреналина на нейрогенную сократительную реакцию этой артерии после спонтанного или вызванного ацидозом уменьшения величины этой реакции [9].
Внеклеточный рН считается одним из главных локальных регуляторов тонуса кровеносных сосудов [10], причем ацидоз в подавляющем большинстве исследований оказывал вазодилататорное действие [11], в то время как алкалоз – вазоконстрикторное [10, 12]. В частности, на изолированных сосудах было показано, что ацидоз вызывает расслабление передней спинномозговой и средней мозговой артерии свиньи [13], артериол паренхимы головного мозга мыши [14], а также уменьшает сокращение брыжеечной и базилярной артерии мыши, вызванное норадреналином и аналогом тромбоксана соответственно [12], и общей сонной артерии мыши, вызванное фенилэфрином [10]. Кроме того, в немногочисленных исследованиях по изучению действия ацидоза на нейрогенный тонус сосудов было продемонстрировано снижение этого тонуса [15–17]. При исследовании влияния ацидоза на нейрогенный тонус хвостовой артерии крыс, пресокращенной норадреналином, нами было обнаружено значительное уменьшение нейрогенной констрикции этой артерии под действием ацидоза в условиях отсутствия норадреналина и при его наличии в небольших концентрациях. Что же касается впервые показанного нами потенцирующего действия норадреналина на нейрогенный ответ данной артерии [9], то при низких концентрациях этого гормона на фоне ацидоза оно не уменьшалось, а при высоких значительно возрастало.
Как известно, внутренняя сонная артерия играет в организме важную роль, являясь основным сосудом, обеспечивающим кровоснабжение головного мозга человека и крысы [18, 19], однако нам не удалось обнаружить работ по изучению действия ацидоза и алкалоза на нейрогенный тонус этой артерии. Целью нашей работы являлось исследование влияния рН среды на нейрогенный тонус внутренней сонной артерии крысы на фоне пресокращения этой артерии норадреналином в разной концентрации. В качестве контроля для сравнения с данными, полученными при ацидозе и алкалозе, была поставлена серия экспериментов при нормальном рН, аналогичных описанным в статье, опубликованной ранее [20]. Предварительные данные, полученные в условиях ацидоза в тезисной форме опубликованы в виде краткого сообщения [21].
МЕТОДЫ ИССЛЕДОВАНИЯ
Опыты проводили (в соответствии с принципами Базельской декларации и рекомендациями Комиссии по биоэтике Института физиологии им. И.П. Павлова РАН) на самцах крыс (n = 36, где n – количество крыс = количество сосудистых сегментов) линии Вистар массой 150–200 г. Под эфирным наркозом отпрепаровывали левую внутреннюю сонную артерию, от которой в месте отхождения от нее крыловидно-небной артерии отрезали кольцевой участок длиной 1.2 мм. Артериальный сегмент помещали на две вольфрамовые иголочки (диаметром 70 мкм каждая), одна из которых была соединена со штоком погружателя микроэлектродов, а вторая – с механотроном 6МХ1С, сигнал от которого, отражающий изменение натяжения в стенке сегмента, усиливался и поступал на АЦП S-Recorder-L, а далее на компьютер для обработки в программе S-Recorder. Иголочки с кольцевым участком помещали в проточную термостатируемую (36°C) ванночку объемом 10 мл, заполненную бикарбонатным раствором Кребса следующего состава (в мМ): NaCl – 115, KCl – 4.7, CaCl2 – 2.6, MgSO4 – 1.2, NaHCO3 – 25, KH2PO4 –1.2, глюкоза – 10. рН раствора доводили до значения 7.4 и контролировали в течение всего эксперимента. После адаптации препарата в течение 30 мин при степени растяжения, соответствующей натяжению примерно 0.8 мН, иголочки миографа сводили и затем ступенчато разводили до значения натяжения, при котором наблюдался максимальный ответ сосудистого сегмента на стимуляцию электрическим полем (30 В, 3 мс, в течение 3 с) с частотой 10 Гц, после чего с интервалом 3 мин проводили его стимуляцию с частотой 10, 1, 3 и 40 Гц, что соответствует частотам в симпатических нервах in vivo [22]. Электростимуляция осуществлялась с помощью двух платиновых электродов, расположенных на расстоянии 2 мм от сосудистого сегмента. В опытах с применением тетродотоксина (0.1 мкМ) ранее нами было показано, что в наших методических условиях при используемых параметрах электростимуляции сокращение сосуда происходит, преимущественно, за счет раздражения его нервных волокон [23]. В течение последующих 90 мин сосуд стимулировали через каждые 3 мин с частотой 10 Гц, а по прошествии 90 мин проводили электростимуляцию с интервалом 3 мин и частотой 1, 3 и 40 Гц, после чего прекращали электростимуляцию и вводили норадреналин битартрат (Sigma, Steinheim, Германия), концентрацию которого кумулятивно увеличивали от 0.01 до 10 мкМ (в ванночке). После достижения максимального (для каждой данной концентрации норадреналина) значения тонического напряжения стенки сосуда проводили серию электростимуляций с частотой 10, 1, 3 и 40 Гц. Частота 10 Гц стояла первой, так как, начиная с опытов на хвостовой артерии крысы, она являлась сначала единственной, а затем основной частотой, используемой нами для изучения нейрогенного тонуса артерий. Сила сокращения внутренней сонной артерии при данной частоте электростимуляции составляла около 90% от максимальной, наблюдавшейся при частоте 40 Гц. Вторая серия экспериментов (n = 13) отличалась от вышеописанной первой серии (n = 11) только тем, что через 60 мин после растяжения сегмента рН раствора снижали с помощью СО2 с 7.4 до 6.6 и поддерживали на этом уровне до конца эксперимента. Для снижения рН использовали CO2 в силу физиологической адекватности и широкого применения такого способа. Поддержание постоянного рН раствора обеспечивалось путем попеременного пропускания через раствор соответствующего количества СО2 и комнатного воздуха, содержащего 21% О2. Известно, что для нормального функционирования изолированных артерий достаточно кислорода, содержащегося в смеси в количестве 16–21% [12, 24]. В третьей серии экспериментов (n = 12) через 60 мин после растяжения сегмента рН раствора повышали с 7.4 до 7.6 и поддерживали на этом уровне до конца эксперимента, указанным выше способом. Во всех сериях величину первоначального ответа на электростимуляцию с частотой 10 Гц через 5–10 мин после растяжения сегмента принимали за 100%. Для оценки потенцирующего действия норадреналина мы вычисляли значение прироста величины реакции артерии на электростимуляцию в присутствии норадреналина по сравнению с величиной, измеренной при данной частоте электростимуляции непосредственно перед его введением.
При статистической обработке результатов использовали программу Statistica v.12. Полученные данные представляли в виде среднего значения ± стандартная ошибка среднего. Достоверность отличий определяли, применяя дисперсионный анализ с учетом повторных измерений и используя t-критерий Стьюдента с поправкой Бонферрони. Различия считали статистически значимыми при р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
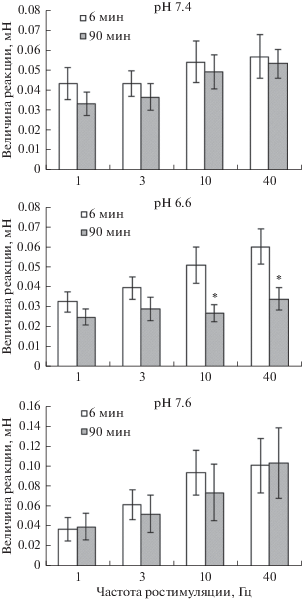
В первой серии экспериментов на внутренней сонной артерии крысы, проводившихся при рН 7.4, как и в предыдущих наших экспериментах, выполненных на хвостовой артерии крысы [25, 26], в ходе опыта происходило некоторое снижение величины сократительной реакции, вызванной электростимуляцией. В частности, величина сократительного ответа сонной артерии крысы на электростимуляцию с частотой 10 Гц, составлявшая в начале опыта 0.054 ± 0.010 мН, через 90 мин составляла 0.049 ± 0.009 мН (рис. 1, рН 7.4). Из приведенного рисунка видно, что снижение сократительного ответа на электростимуляцию с частотой 1, 3 и 40 Гц через 90 мин также было незначительным, в то время как на фоне действия ацидоза происходило существенное уменьшение этого ответа, который при частоте 10 и 40 Гц снижался с 0.051 ± 0.009 и 0.060 ± 0.009 мН до 0.027 ± 0.004 и 0.034 ± 0.006 мН соответственно, то есть практически в два раза (рис. 1, рН 6.6). На фоне действия алкалоза не наблюдалось даже однонаправленности изменения ответа, величина которого до и на фоне действия раствора с рН 7.6 составляла, например, при частоте 10 Гц 0.094 ± 0.023 и 0.074 ± 0.028 мН, а при частоте 40 Гц 0.101 ± 0.027 и 0.104 ± 0.035 мН соответственно (рис. 1, рН 7.6).
Рис. 1.
Сократительная реакция сегмента внутренней сонной артерии крысы на электростимуляцию с частотой 1–40 Гц через 6 и 90 мин после растяжения этого сегмента в контроле (рН 7.4), а также в сериях с изменением рН через 60 мин с 7.4 до 6.6 и 7.8. По оси ординат – величина реакции, мН. Достоверность отличия: *р < 0.05, при сравнении реакции через 6 и 90 мин.
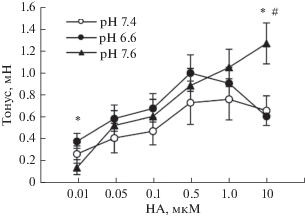
Какого-либо изменения тонуса при действии ацидоза обнаружено не было, в то время как при алкалозе наблюдалось его небольшое возрастание, составлявшее 0.084 ± 0.026 мН. Сила сокращения сегмента внутренней сонной артерии, вызванного норадреналином в минимальной концентрации 0.01 мкМ, при рН 7.4 составляла 0.26 ± 0.08 мН. При рН 6.6 она была несколько больше, составляя 0.38 ± 0.07 мН, а при рН 7.6 несколько меньше, составляя 0.14 ± 0.07 мН, причем относительно ответа при рН 6.6 отличие было статистически значимым (рис. 2). Максимальная сила сокращения, наблюдавшаяся в растворе с нормальным рН при концентрации норадреналина 1.0 мкМ, составляла 0.76 ± 0.19 мН (рис. 2). Ни ацидоз, ни алкалоз не вызывал статистически значимого изменения реакции на норадреналин в концентрации от 0.05 до 1.0 мкМ, а при концентрации норадреналина 10.0 мкМ величина этой реакции на фоне действия алкалоза была значительно больше, чем на фоне действия нормального и закисленного раствора, составляя 1.26 ± 0.19, 0.66 ± 0.14 и 0.61 ± 0.08 мН соответственно.
Рис. 2.
Вызванный норадреналином (НА) тонус сегмента внутренней сонной артерии крысы при рН 7.4, 6.6 и 7.6. По оси ординат – величина тонуса, мН. Здесь и далее данные представлены в виде среднего значения ± ± стандартная ошибка среднего. Достоверность отличия: *р < 0.05 при сравнении рН 6.6 и 7.6, # р < 0.05 при сравнении рН 7.6 и 7.4.
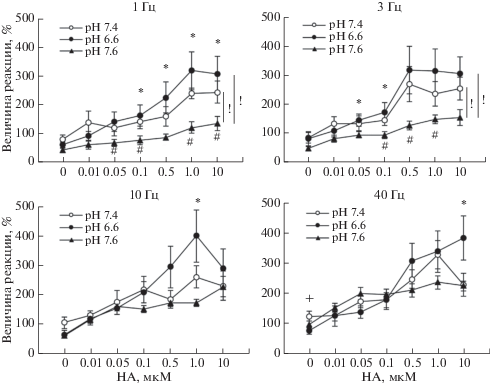
Норадреналин вызывал значительное увеличение сократительного ответа на электростимуляцию, который на фоне действия этого гормона в концентрации 0.5–10 мкМ достигал в растворе с рН 7.4 максимального значения, равного 229.0 ± 37.3, 253.2 ± 57.4, 255.8 ± 35.7 и 318.3 ± 43.3% при частоте электростимуляции 1, 3, 10 и 40 Гц соответственно (рис. 3). В условиях ацидоза величина сократительного ответа на электростимуляцию при наличии норадреналина в большинстве случаев была не меньше, а скорее больше, чем в растворе с нормальным рН. Так, на фоне действия норадреналина в концентрации 0.5–10 мкМ нейрогенный ответ достигал в растворе с рН 6.6 максимального значения, равного 318.5 ± 66.8, 315.9 ± 81.3, 404.0 ± 88.5 и 385.7 ± 72.6% при частоте электростимуляции 1, 3, 10 и 40 Гц соответственно. В условиях алкалоза величина сократительного ответа на электростимуляцию при наличии норадреналина в подавляющем большинстве случаев была меньше, чем в растворе с нормальным и низким рН. При частотах стимуляции 1 и 3 Гц для большинства концентраций, а при частотах стимуляции 10 и 40 Гц для двух последних концентраций это различие было статистически значимым. На фоне действия норадреналина в концентрации 0.5–10 мкМ нейрогенный ответ достигал в растворе с рН 7.6 максимального значения, равного 133.6 ± 24.1, 153.8 ± 27.7, 230.7 ± 34.6 и 238.8 ± 23.0%, при частоте электростимуляции 1, 3, 10 и 40 Гц соответственно. Наиболее сильное влияние рН проявлялось при низких частотах электростимуляции, при которых, в частности, было показано достоверное отличие рН 7.6 как от 7.4, так и от 6.6 при учете всех концентраций норадреналина.
Рис. 3.
Сократительная реакция сегмента внутренней сонной артерии крысы на электростимуляцию с частотой 1-40 Гц через 90 мин после растяжения этого сегмента до (0.0), а также на фоне действия норадреналина (НА) в концентрации 0.01–10.0 мкМ при рН 7.4, 6.6 и 7.6. По оси ординат – величина реакции. Первоначальная величина сократительной реакции при частоте электростимуляции 10 Гц принята за 100%. Достоверность отличия: *р < 0.05, при сравнении рН 6.6 и 7.6, # р < 0.05 при сравнении рН 7.6 и 7.4, + р < 0.05 при сравнении рН 7.4 и 6.6, ! р < 0.05 для эффекта рН при учете внутригрупповых эффектов всех концентраций НА.
Для корректной оценки потенцирующего действия норадреналина на нейрогенный ответ, то есть, насколько увеличивался этот ответ под действием норадреналина, мы вычисляли изменение величины реакции артерии на электростимуляцию в присутствии норадреналина по сравнению с величиной, измеренной при данной частоте электростимуляции непосредственно перед его введением. В условиях нормального рН максимальное увеличение нейрогенного ответа под действием норадреналина при частоте электростимуляции 1, 3, 10 и 40 Гц составляло 151.2 ± 38.7, 170.1 ± 47.4, 150.7 ± 38.5 и 169.6 ± 45.6% соответственно (рис. 4). В условиях ацидоза возрастание нейрогенного ответа под действием норадреналина при всех частотах электростимуляции и практически всех концентрациях норадреналина было больше, чем в условиях нормального рН. При частоте электростимуляции 1, 3, 10 и 40 Гц максимальное возрастание этого ответа в растворе с рН 6.6 составляло 241.0 ± 59.6, 239.6 ± 62.8, 336.9 ± 76.0 и 306.5 ± 65.6% соответственно.
Рис. 4.
Изменение сократительной реакции сегмента внутренней сонной артерии крысы на электростимуляцию с частотой 1–40 Гц до (0.0), а также на фоне действия норадреналина (НА) в концентрации 0.01–10.0 мкМ при рН 7.4, 6.6 и 7.6. По оси ординат – изменение реакции (0.0 НА – через 90 мин после растяжения сегмента по сравнению с первоначальной величиной при данной частоте электростимуляции, а на фоне НА – по сравнению с величиной реакции при данной частоте электростимуляции непосредственно перед введением НА). Первоначальная величина сократительной реакции при частоте электростимуляции 10 Гц принята за 100%. Достоверность отличия: *р < 0.05 при сравнении рН 6.6 и 7.6, # р < 0.05 при сравнении рН 7.6 и 7.4, + р < 0.05 при сравнении рН 7.4 и 6.6, ! р < 0.05 для эффекта рН при учете внутригрупповых эффектов всех концентраций НА, § р < 0.05 для эффекта рН при учете внутригрупповых эффектов последних трех концентраций НА.
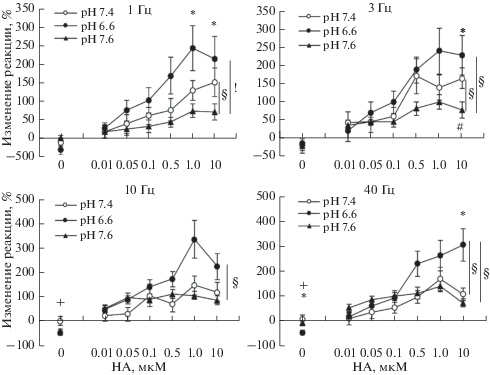
Так как максимальное потенцирующее действие норадреналина на нейрогенный ответ и его значительно большее возрастание наблюдалось при концентрации данного гормона в диапазоне 0.5–10 мкМ, то представляло интерес оценить влияние рН на потенцирующее действие норадреналина при учете внутригрупповых эффектов последних трех его концентраций. Оказалось, что в этом случае потенцирующее действие норадреналина в условиях алкалоза было достоверно меньше, чем в условиях нормального рН при частоте электростимуляции 1 и 3 Гц, и достоверно меньше, чем в условиях ацидоза при всех частотах электростимуляции. Кроме того, только такой способ обсчета позволил выявить достоверное отличие результатов, полученных в условиях ацидоза, от результатов, полученных в условиях нормального рН при частоте электростимуляции 40 Гц (рис. 4). Следует заметить, что учет внутригрупповых эффектов последних трех концентраций норадреналина не выявил достоверности действия рН на величину нейрогенной констрикции при частотах электростимуляции 10 и 40 Гц, при которых наблюдалось достоверное увеличение этой констрикции в условиях ацидоза относительно алкалоза только для одной концентрации норадреналина (рис. 3).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В наших опытах на сегментах внутренней сонной артерии крысы при действии ацидоза не происходило какого-либо однонаправленного изменения тонуса артерии, в то время как при действии алкалоза наблюдалось его небольшое возрастание. Отсутствие изменения тонуса непресокращенных сосудов при ацидозе было отмечено ранее нами на брыжеечной [27] и хвостовой [26] артерии крысы, а также другими авторами, в частности, на артериолах m. cremaster· [28], мелких артериях брыжейки [29] и общей сонной артерии мыши [10], в то время как при алкалозе наблюдалось сокращение, в частности, артериол головного мозга крысы в результате действия на обменники Na+/Ca2+, Na+/Н+ и Na+/К+ [30]. В опытах на перфузируемой большеберцовой кости собаки ацидоз, как и в наших опытах, не изменял, а алкалоз увеличивал тонус сосудов [16]. При изменении рН в кислую сторону нами было обнаружено статистически значимое возрастание сократительной реакции на норадреналин в концентрации 0.01 мкМ и прослеживалась тенденция к возрастанию реакции на норадреналин в концентрации от 0.05 до 1.0 мкМ. В подавляющем большинстве исследований ацидоз оказывал вазодилататорное действие на сосуды, пресокращенные различными веществами [11]. В частности, он расслаблял артерии, питающие скелетные мышцы (подмышечной и паховой области) человека, пресокращенные КС1 или фенилэфрином [31], уменьшал вазоконстрикторное действие аналога тромбоксана - U46619 на базилярную артерию мыши [12] и расслаблял грудную аорту крысы, пресокращенную фенилэфрином или KCl [11]. Уменьшение реакции на норадреналин на фоне ацидоза было показано, в частности, на брыжеечных артериях крысы [32], мыши [12] и козы [33]. Ранее в опытах на брыжеечной [27] и хвостовой артерии крысы [25, 26] в аналогичных условиях мы показали значительное ослабление ацидозом сократительной реакции на норадреналин. В противоположность ацидозу алкалоз, как правило, увеличивал сократительный ответ сосудов, в частности, на норадреналин, как это было продемонстрировано в опытах на перфузируемой большеберцовой кости собаки [16] и брыжеечной артерии мыши [12]. Наблюдавшееся при ацидозе некоторыми авторами сокращение кровеносных сосудов было быстропроходящим [13, 34] и сменялось расслаблением, главной причиной которого являлось ингибирование потенциал-зависимых кальциевых каналов, при участии также KATP-, ВКСа- и ASIC- каналов [34]. Однако в некоторых опытах было показано длительное сокращение, обусловленное ацидозом. Так, например, в опытах на пресокращенной фенилэфрином аорте крыс линии WKY наблюдался двухфазный ответ, при котором расслабление сменялось сокращением [35]. Следует однако заметить, что в этих опытах аорта была деэндотелизирована. Сокращение аорты крыс линии WKY наблюдали также под действием сильного ацидоза (рН 6.4, 5.4 и 4.4), который действовал путем активации потенциалзависимых кальциевых каналов и вызывал, кроме того, сокращение аорты крыс линии Вистар [36]. Перфузия сосудов сердца крыс линии Вистар и WKY закисленным раствором сопровождалась подъемом перфузионного давления (сокращение сосудов), который был больше у крыс линии SHR и обуславливался входом кальция через потенциалзависимые кальциевые каналы [37]. В опытах на изолированных коронарных (но не почечных и брыжеечных) артериях крысы также наблюдали вызванное ацидозом сокращение, частично обусловленное активацией потенциалзависимых кальциевых каналов L-типа и H+,K+-ATФ-азы, а также блокадой потенциалзависимых калиевых каналов [38]. Можно предположить, что наблюдавшееся нами при закислении среды увеличение реакции на норадреналин в низких концентрациях объясняется такими же механизмами действия. В любом случае, угнетающего действия на эту реакцию внутренней сонной артерии крысы он не оказывал. Нам не удалось найти работ по изучению влияния рН на данную артерию, однако имеется одно исследование, выполненное на общей сонной артерии мыши, в котором было показано, что ацидоз (рН 7.0) уменьшает, а алкалоз (рН 7.8) увеличивает сокращение этой артерии, вызванное агонистом α1-адренорецепторов – фенилэфрином в концентрации от 0.01 до 10 мкМ [10]. Следует заметить, что в этом исследовании в отличие от нашего кроме всего прочего, опыты проводились в присутствии L-NAME – блокатора синтеза NO. В опытах на человеке в условиях in vivo было показано, что при гиперкапнии, которая ведет к снижению рН крови, может наблюдаться как увеличение [39, 40], так и отсутствие изменения диаметра внутренней сонной артерии [19, 41], однако в этих опытах нельзя разграничить центральное и периферическое действие гиперкапнии.
В проведенных нами экспериментах ацидоз в условиях отсутствия норадреналина значительно уменьшал величину нейрогенного сократительного ответа внутренней сонной артерии крысы. Аналогичным образом в наших предыдущих работах он действовал на этот ответ изолированных сегментов брыжеечной и хвостовой артерии крысы [17, 27]. В немногочисленных работах по изучению действия рН на нейрогенный тонус сосудов было показано, что ацидоз уменьшает этот тонус изолированной v. saphena собаки [42], а также перфузируемой сосудистой системы петли тонкой кишки собаки [15], большеберцовой кости собаки [16] и брыжейки крысы [17]. Причинами такого снижения нейрогенного тонуса, как было показано в данных работах, в частности, являлись нарушения адренергической передачи [42], ингибирование действия нейронально высвобождаемого норадреналина на постсинаптические α2-адренорецепторы [15] и действие на ваниллоидные рецепторы TRPV1 CGRP-эргических нервов [17]. Кроме того, при ацидозе, эффект которого, в частности, реализуется через ASIC каналы [34, 43], могло уменьшаться действие выделяющегося вазоконстрикторного медиатора на гладкомышечные клетки сосудов через постсинаптические α1-адренорецепторы [31] и увеличиваться выделение NO как эндотелиальными, так и гладкомышечными клетками [44]. Можно предположить, что те же причины приводили к снижению нейрогенного сокращения в наших экспериментах.
На фоне действия норадреналина в концентрации от 0.05 до 10 мкМ нами было обнаружено значительное увеличение нейрогенного ответа при ацидозе по сравнению с алкалозом и при алкалозе по сравнению с нормальным рН. В опытах, проводившихся нами ранее на хвостовой артерии крысы в аналогичных условиях ацидоз вызывал значительное уменьшение нейрогенного ответа по сравнению с нормальным рН при всех концентрациях норадреналина за исключением 1 и 10 мкМ, при которых изменения не наблюдалось [26]. Отсутствие угнетающего действия ацидоза на нейрогенную констрикцию внутренней сонной артерии в условиях наличия норадреналина в среде и проявление такого действия у алкалоза сопровождалось усилением потенцирующего действия норадреналина на нейрогенную констрикцию на фоне ацидоза и снижением этого действия на фоне алкалоза, особенно выраженным при низких частотах электрростимуляции. Потенцирующее действие норадреналина на нейрогенную вазоконстрикцию ранее было отмечено в работе С. Su [8], который обнаружил его на брыжеечной артерии кролика. Причем оказалось, что это действие не было связано с обратным захватом норадреналина, а также со стимуляцией пресинаптических β-адренорецепторов и сопровождалось уменьшением его выброса из нервных окончаний. Было высказано предположение, что потенцирующее действие норадреналина объяснялось частичной деполяризацией мембраны сосудистых гладкомышечных клеток, облегчающей их сокращение при нейрогенной стимуляции этих клеток. Возможно, что в наших опытах потенцирование нейрогенной вазоконстрикции норадреналином было связано с таким же механизмом, а усиление этой констрикции при закислении среды объяснялось, как и в опытах на не менее жизненно-важных коронарных сосудах активацией потенциалзависимых кальциевых каналов L-типа [37, 38], H+,K+-ATФазы, а также блокадой потенциалзависимых калиевых каналов [38]. Более выраженное действие рН при низких частотах электростимуляции, возможно, было связано с тем, что при высоких частотах процесс нейрогенного сокращения в основном обеспечивается α1-адренорецепторами, а при низких - постсинаптическими α2-адренорецепторами [45], через которые и реализуется действие рН [15, 28]. Ранее [46] было показано, что нейрогенный ответ внутренней сонной артерии крысы обеспечивается α1- и α2-адренорецепторами, так как он полностью блокируется фентоламином – блокатором α1- и α2-адренорецепторов, и не изменяется в присутствии агониста Y2-рецепторов при всех использованных частотах электростимуляции (1–40 Гц).
В наших опытах повышение рН на 0.2 ед. по сравнению со снижением рН на 0.8 ед. относительно контроля на фоне действия норадреналина при низких частотах электростимуляции вызывало намного более значительное изменение нейрогенной констрикции относительно контроля. Это может быть связано с тем, что гладкомышечные клетки сосудов лучше защищены от ацидоза, чем от алкалоза, как было показано в опытах на базилярной артерии мыши, в которых повышение рН среды на 0.3 ед. по сравнению со снижением рН среды на 0.3 ед., вызывало в 3 раза большее изменение внутриклеточного рН [12].
Итак, нами впервые было показано, что в условиях ацидоза и отсутствия норадреналина происходит снижение нейрогенной констрикторной реакции внутренней сонной артерии крысы, в то время как на фоне действия норадреналина ацидоз скорее повышал, а алкалоз снижал данную реакцию, и это снижение было статистически значимым и наиболее выраженным при низких частотах электростимуляции. Норадреналин потенцировал нейрогенную вазоконстрикцию, причем это потенцирование увеличивалось на фоне ацидоза и уменьшалось на фоне алкалоза. Обнаруженное увеличение сократительной способности внутренней сонной артерии при сдвиге рН в кислую сторону может иметь значение для предотвращения повышения артериального давления в головном мозге при мышечной работе, сопровождающейся значительным ростом кровяного давления, ацидозом и повышением концентрации норадреналина.
ИСТОЧНИК ФИНАНСИРОВАНИЯ
Работа проведена на животных из ЦКП Биоколлекция ИФ РАН, поддержанной Программой ФАНО России по сохранению и развитию биоресурсных коллекций. Работа выполнена при финансовой поддержке Программы фундаментальных научных исследований государственных академий на 2013–2020 годы (ГП-14, раздел 64).
Список литературы
Rhoades R.A., Bell D.R Medical physiology: principles for clinical medicine (4th ed.). Philadelphia. PA. Wolters Kluwer, Lippincott Williams & Wilkins. 2012.
Borovsky V., Herman M., Dunphy G., Caplea A., Ely D. CO2 asphyxia increases plasma norepinephrine in rats via sympathetic nerves. Am. J. Physiol. 274(1 Pt 2): R19–R22. 1998.
Omerovic E., Bollano E., Mobini R., Kujacic V., Madhu B., Soussi B., Fu M., Hjalmarson Å., Waagstein F., Isgaard J. Growth hormone improves bioenergetics and decreases catecholamines in postinfarct rat hearts. Endocrinology. 141(12): 4592–4599. 2000.
Pacak K., Palkovits M., Yadid G., Kvetnansky R., Kopin I.J., Goldstein D.S. Heterogeneous neurochemical responses to different stressors: a test of Selye’s doctrine of nonspecificity. Am. J. Physiol. 275(4 Pt 2): R1247–R1255. 1998.
Atkinson J., Boillat N., Fouda A. K., Guillain H., Sautel M., Sonnay M. Noradrenaline inhibits vasoconstriction induced by electrical stimulation. Gen. Pharmacol. 18(3): 219–223. 1987.
Medina P., Segarra G., Peiro M., Flor B., Martinez-Leon J.B., Vila J.M., Lluch S. Influence of nitric oxide on neurogenic contraction and relaxation of the human gastroepiploic artery. Am. J. Hypertens. 16(1): 28–32. 2003.
Nelson S.H., Steinsland O.S., Johnson R.L., Suresh M.S., Gifford A., Ehardt J.S. Pregnancy-induced alterations of neurogenic constriction and dilation of human uterine artery. Am. J. Physiol. 268(4 Pt 2): H1694–H1701. 1995.
Su C. Potentiative effects of alpha agonistic sympathomimetic amines on vasoconstriction by adrenergic nerve stimulation. J. Pharmacol. Exp. Ther. 215(2): 377–381. 1980.
Ярцев В.Н., Караченцева О.В., Дворецкий Д.П. Эффекты экзогенного норадреналина и мелатонина на нейрогенную вазореактивность. Рос. физиол. журн. им. И. М. Сеченова. 90(11): 1363–1369. 2004. [Yartsev V.N., Karachentseva O.V., Dvoretsky D.P. Effects of noradrenaline and melatonin on the neurogenic vasoreactivity. Russ. J. Physiol. 90(11): 1363–1369. 2004. (In Russ.)].
Baretella O., Xu A., Vanhoutte P.M. Acidosis prevents and alkalosis augments endothelium-dependent contractions in mouse arteries. Pflugers Arch. 466(2): 295–305. 2014.
Celotto A.C., Restini C.B., Bendhack L.M., Evora P.R. Acidosis induces relaxation mediated by nitric oxide and potassium channels in rat thoracic aorta. Eur. J. Pharmacol. 656(1–3): 88–93. 2011.
Boedtkjer E., Hansen K.B., Boedtkjer D.M., Aalkjaer C., Boron W.F. Extracellular HCO3- is sensed by mouse cerebral arteries: Regulation of tone by receptor protein tyrosine phosphatase γ. J. Cereb. Blood Flow Metab. 36(5): 965–980. 2016.
Kokubun S., Fukuda S., Shimoji K., Sakamoto H., Gamou S., Ogura M., Yunokawa S., Morita S. Differential responses of porcine. Crit. Care. Med. 37(3): 987–992. 2009.
Dabertrand F., Nelson M.T., Brayden J.E. Acidosis dilates brain parenchymal arterioles by conversion of calcium waves to sparks to activate BK channels. Circ. Res. 110(2): 285–294. 2012.
Chen L.Q., Shepherd A.P. Role of H+ and alpha 2-receptors in escape from sympathetic vasoconstriction. Am. J. Physiol. 261(3 Pt 2): H868–H873. 1991.
Davis T.R., Wood M.B. The effects of acidosis and alkalosis on long bone vascular resistance. J. Orthop. Res. 11(6): 834–839. 1993.
Kawasaki H., Eguchi S., Miyashita S., Chan S., Hirai K., Hobara N., Yokomizo A., Fujiwara H., Zamami Y., Koyama T., Jin X., Kitamura Y. Proton acts as a neurotransmitter for nicotine-induced adrenergic and calcitonin gene-related peptide-containing nerve-mediated vasodilation in the rat mesenteric artery. J. Pharmacol. Exp. Ther. 330(3): 745–755. 2009.
Roloff E.V., Tomiak-Baquero A.M., Kasparov S., Paton J.F. Parasympathetic innervation of vertebrobasilar arteries: is this a potential clinical target? J. Physiol. 594(22): 6463–6485. 2016.
Sato K., Sadamoto T., Hirasawa A., Oue A., Subudhi A.W., Miyazawa T., Ogoh S. Differential blood flow responses to CO2 in human internal and external carotid and vertebral arteries. J. Physiol. 590(14): 3277–3290. 2012.
Ярцев В.Н. Потенцирующее действие норадреналина на вызванное электромагнитной стимуляцией нейрогенное сокращение внутренней сонной артерии крысы. Биомед. радиоэлектроника. (11): 40–47. 2018. [Yartsev V.N. Noradrenaline-induced potentiation of the electrical field-evoked neurogenic contraction of the rat internal carotid artery. Biomed. Radioelectronics. (11): 40–47. 2018. (In Russ.)].
Ярцев В.Н. Сравнение действия ацидоза на реактивность внутренней сонной и хвостовой артерий крысы с применением электромагнитного стимулятора. Биомед. радиоэлектроника. (1): 63–65. 2019. [Yartsev V.N. Comparison of the effect of acidosis on the reactivity of the rat internal carotid and the tail artery with application of an electromagnetic neurostimulator. Biomed. Radioelectronics (1): 63–65. 2019. (In Russ.)].
Ootsuka Y., McAllen R.M. Interactive drives from two brain stem premotor nuclei are essential to support rat tail sympathetic activity. Am. J. Physiol. 289(4): R1107–R1115. 2005.
Dvoretsky D.P., Yartsev V.N., Karachentseva O.V., Granstrem M.P. Changes in reactivity of rat arteries subjected to dynamic stretch. Acta Physiol. Scand. 169(1): 13–20. 2000.
Mohammed R., Provitera L., Cavallaro G., Lattuada D., Ercoli G., Mosca F., Villamor E. Vasomotor effects of hydrogen sulfide in human umbilical vessels. J. Physiol. Pharmacol. 68(5): 737–747. 2017.
Karachentseva O.V., Yartsev V.N., Dvoretskii D.P. Noradrenaline can restore decreased neurogenic vasoreactivity. Neurosci. Behav. Physiol. 39 (2): 161–166. 2009.
Yartsev V.N., Karachentseva O.V. Noradrenaline-induced restoration of acidosis-inhibited neurogenic vasoreactivity at using different electrical stimulation frequencies. Neurosci. Behav. Physiol. 47(2): 179–185. 2017.
Yartsev V.N., Karachentseva O.V., Dvoretsky D.P. Effect of pH changes on reactivity of rat mesenteric artery segments at different magnitude of stretch. Acta Physiol. Scand. 174(1): 1–7. 2002.
Tateishi J., Faber J.E. Inhibition of arteriole α2- but not α1-adrenoceptor constriction by acidosis and hypoxia in vitro. Am. J. Physiol. 268 (5, Pt 2): H2068–H2076. 1995.
Jensen P.E., Hughes A., Boonen H.C.M., Aalkjaer C. Force, membrane potential, and [Ca2+]i during activation of rat mesenteric small arteries with norepinephrine, potassium, aluminum fluoride, and phorbol ester. Effects of changes in pHi. Circ. Res. 73 (2): 314–324. 1993.
Li Y., Horiuchi T., Murata T., Hongo K. Mechanism of alkalosis-induced constriction of rat cerebral penetrating arterioles. Neurosci. Res. 70(1): 98–103. 2011.
Ives S.J., Andtbacka R.H., Noyes R.D., Morgan R.G., Gifford J.R., Park S.Y., Symons J.D., Richardson R.S. α1-Adrenergic responsiveness in human skeletal muscle feed arteries: the impact of reducing extracellular pH. Exp. Physiol. 98(1): 256–267. 2013.
Handy J.M., Soni N. Physiological effects of hyperchloraemia and acidosis. Br. J. Anaesth. 101(2): 141–150. 2008.
Mohanty I., Suklabaidya S., Parija S.C. Acidosis reduces the function and expression of α1D-adrenoceptor in superior mesenteric artery of Capra hircus. Indian J. Pharmacol. 48(4): 399–406. 2016.
Boedtkjer E. Acid-base regulation and sensing: Accelerators and brakes in metabolic regulation of cerebrovascular tone. J. Cereb. Blood Flow Metab. 38(4): 588–602. 2018.
Rohra D.K., Saito S.Y., Ohizumi Y. Strain-specific effects of acidic pH on contractile state of aortas from Wistar and Wistar Kyoto rats. Eur. J. Pharmacol. 476(1–2): 123–130. 2003.
Ma Z., Qi J., Fu Z., Ling M., Li L., Zhang Y. Protective role of acidic pH-activated chloride channel in severe acidosis-induced contraction from the aorta of spontaneously hypertensive rats. PLoS One. 8(4): e61018. 2013.
Horai Y., Furukawa K., Iwata S., Ohizumi Y. Changes in pH increase perfusion pressure of coronary arteries in the rat. J. Pharmacol. Sci. 97(3): 400–407. 2005.
Niu L., Liu Y., Hou X., Cui L., Li J., Zhang X., Zhang M. Extracellular acidosis contracts coronary but neither renal nor mesenteric artery via modulation of H+, K+-ATPase, voltage-gated K+ channels and L-type Ca2+ channels. Exp. Physiol. 99(7): 995–1006. 2014.
Willie C.K., Macleod D.B., Shaw A.D., Smith K.J., Tzeng Y.C., Eves N.D., Ikeda K., Graham J., Lewis N.C., Day T.A., Ainslie P.N. Regional brain blood flow in man during acute changes in arterial blood gases. J. Physiol. 590(Pt 14): 3261–3275. 2012.
Hoiland R.L., Tymko M.M., Bain A.R., Wildfong K.W., Monteleone B., Ainslie P.N. Carbon dioxide-mediated vasomotion of extra-cranial cerebral arteries in humans: a role for prostaglandins? J. Physiol. 594(12): 3463–3481. 2016.
Coverdale N.S., Lalande S., Perrotta A., Shoemaker J.K. Heterogeneous patterns of vasoreactivity in the middle cerebral and internal carotid arteries. Am. J. Physiol. Heart. Circ. Physiol. 308(9): H1030–H1038. 2015.
Verbeuren T.J., Janssens W.J., Vanhoutte P.M. Effects of moderate acidosis on adrenergic neurotransmission in canine saphenous veins. J. Pharmacol. Exp. Ther. 206(1): 105–114. 1978.
Akanji O., Weinzierl N., Schubert R., Schilling L. Acid sensing ion channels in rat cerebral arteries: Probing the expression pattern and vasomotor activity. Life Sci. 227: 193–200. 2019.
Capellini V.K., Restini C.B., Bendhack L.M., Evora P.R., Celotto A.C. The effect of extracellular pH changes on intracellular pH and nitric oxide concentration in endothelial and smooth muscle cells from rat aorta. PLoS One. 8(5): e62887. 2013.
Bao J.X., Gonon F., Stjarne L. Kinetics of ATP- and noradrenaline-mediated sympathetic neuromuscular transmission in rat tail artery. Acta Physiol. Scand. 149(4): 503–519. 1993.
Potter E.K., Tripovic D. Modulation of sympathetic neurotransmission by neuropeptide Y Y2 receptors in rats and guinea pigs. Exp. Brain Res. 173(2): 346–352. 2006.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


