Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 10, стр. 1305-1315
Участие Y1-рецепторов в регуляции электрической активности кардиомиоцитов крыс в раннем постнатальном онтогенезе
А. А. Зверев 1, *, Н. Г. Искаков 1, Т. А. Аникина 1, Е. Н. Зверева 1, Т. Л. Зефиров 1
1 Казанский (Приволжский) федеральный университет
Казань, Россия
* E-mail: Alekcei5@rambler.ru
Поступила в редакцию 28.06.2019
После доработки 03.08.2019
Принята к публикации 08.08.2019
Аннотация
В кардиомиоцитах крыс обнаружены метаботропные Y-рецепторы, экспрессия которых меняется в раннем постнатальном онтогенезе. В представленной работе исследовали влияние селективного агониста ([Leu31, Pro34]) NPY и блокатора (BIBP 3226) Y1-рецепторов на параметры электрической активности кардиомиоцитов правого предсердия крыс 7- и 100-суточного возраста. Установлено, что агонист Y1-рецепторов вызывает укорочение фазы реполяризации на уровне 90%. Эффект агониста зависит от его концентрации и возраста животных. Наибольший эффект вызывает концентрация 10–6 М, и в большей степени он выражен у 7-суточных крысят. Добавление селективного блокатора Y1-рецепторов уменьшает длительность потенциала действия за счет укорочения фазы реполяризации на уровне 20 и 50%. Введение селективного агониста на фоне блокады Y1-рецепторов не вызывает достоверных изменений в исследуемых параметрах мембранного потенциала и потенциала действия в обеих возрастных группах животных. Показано, что селективный агонист измененяет длительность потенциала действия у крыс 7- и 100-суточного возраста через активацию Y1-рецепторов.
Нейропептидная передача сигналов является древним механизмом, обнаруженным почти у всех животных [1]. Нейропептиды могут действовать как нейротрансмиттеры, нейромодуляторы, гормоны или факторы роста.
Особое внимание привлекает нейропептид Y (NPY), который относится к числу пептидов, распространенных как в центральной, так и в различных отделах автономной нервной системы, включая симпатический, парасимпатический и метасимпатический [2]. NPY полностью удовлетворяет нейротрансмиттерным критериям, поскольку хранится в синаптических везикулах, высвобождается при высокачастотной электрической стимуляции и действует на свои собственные специфические рецепторы [3]. NPY экспрессируется в больших количествах в головном мозге, постганглионарных симпатических волокнах, мегакариоцитах и тромбоцитах [4]. NPY выявляется в интрамуральных узлах предсердий, звездчатых узлах уже с момента рождения. В раннем постнатальном онтогенезе процент нейронов в узлах автономной нервной системы, содержащих нейропептид Y, возрастает [6].
Нейропептид Y влияет на многочисленные физиологические процессы. К центральным процессам относятся: угнетение дыхания, гипотензия и т.д. [5], к периферическим: регуляция сосудистого тонуса, частоты и силы сердечных сокращений [7, 8], частоты дыхания, секреции желудочно-кишечного тракта. Также NPY влияет на трофические процессы и стимуляцию пролиферации клеток-мишеней, расположенных в сосудах, миокарде и жировой ткани [9].
Нейропептид Y также способствует гипертрофии кардиомиоцитов сердца in vitro [10]. Показано, что NPY принимает участие в созревании адренергических сигнальных каскадов и ионных каналов сердца [3]. Известно, что NPY может ингибировать высвобождение норадреналина из нервных окончаний сердца и изменять норадренергический ответ за счет активации Y2-рецепторов [11, 12]. Активация Y1-рецепторов в сердечно-сосудистой системе усиливает симпатическую стимуляцию и эффект норадреналина [13].
Инотропные и хронотропные эффекты на сердце экзогенного NPY или его производных зависят от вида животного и типа препарата. Эффекты могут быть как отрицательными [14], так и положительными [15]. Существуют также долговременные или трофические постсинаптические эффекты NPY в сердце и других тканях [16].
В нескольких исследованиях NPY идентифицировали как функциональный регулятор работы сердца, способный осуществлять свои эффекты как через собственные рецепторы, так и модулируя функциональную активность различных рецепторов сердца [17]. NPY способен проявлять разнонаправленный (противоположный) эффект в сердце и сосудах, включая действие в качестве кардиодепрессанта [18]. Эти противоречивые эффекты NPY в значительной степени зависят от уровня адренергической активности, характера экспрессии Y-рецепторов, его концентрации и активности фермента дипептидилпептидаза-4 (DPP-4) [18]. Описанные эффекты NPY на сердце могут играть важную роль как в физиологических, так и патологических процессах.
Рецепторы, чувствительные к NPY, принадлежат к суперсемейству метаботропных рецепторов, сопряженных с G-белками, имеющих 7 трансмембранных доменов. NPY-рецепторы взаимодействуют с разными G-белками: Gi/о-белками, которые угнетает аденилатциклазу, Gs-белком, который стимулирует каскад аденилатциклаза-цАМФ-протеинкиназа А и Gq-белком, который стимулирует фосфолипазу С [19]. Калиевые каналы также являются мишенью для связанных с рецептором NPY G-белков: активация рецептора NPY может привести к активации или ингибированию калиевых каналов [20].
Расположенные в сердце рецепторы NPY: Y1-, Y2- и Y5-рецепторы, как правило, участвуют в патогенезе сердечно-сосудистых заболеваний, включая гипертонию, атеросклероз, ишемию/инфаркт миокарда, диабетическую, стрессовую, гипертрофическую кардиомиопатию и сердечную недостаточность [17, 21].
В ранее проведенных исследованиях нами было показано, что неселективный агонист Y рецепторов нейропептид Y вызывает уменьшение длительности фазы реполяризации на уровне 20, 50 и 90% в рабочих кардиомиоцитах предсердий крыс 7-, 21- и 100-суточного возраста [22]. Данное исследование направлено на изучения влияния селективного агониста ([Leu31, Pro34] NPY) и блокатора (BIBP 3226) Y1-рецепторов на амплитудно-временные показатели потенциала действия (ПД). Целью данного исследования является изучение влияния селективного агониста и блокатора Y1-рецепторов на параметры электрической активности кардиомиоцитов правого предсердия крыс на разных этапах постнатального онтогенеза.
МЕТОДЫ ИССЛЕДОВАНИЯ
Данное исследование проводилось в соответствии с принципами Базельской декларации и рекомендациями локального этического комитета КФУ. Крысы содержались в одинаковых условиях, по 5–7 животных в клетке. Все крысы имели свободный доступ к воде и еде. Для всех крыс использовали один рацион. Эксперименты проводились на двух возрастных группах животных. Согласно данным литературы 7-суточные крысята относятся к неонатальному периоду развития и характеризуются отсутствием симпатической иннервации в сердце и низким уровнем симпатических регуляторных влияний на сердце. 100-суточные животные выступают как биологическая модель полного формирования симпатической иннервации и регуляции сердца [23].
Исследование проведено на 7- (n = 39) и 100-суточных (n = 33) крысах разного пола стока Вистар из питомника лабораторных животных “Пущино”. В качестве наркоза использовали 25%-ный раствор уретана из расчета 1.2 г/кг массы животного, который вводился внутрибрюшинно. Наркотизированным животным вскрывали грудную клетку, сердце быстро извлекали и помещали в чашку Петри с оксигенизированным (95% О2 и 5% СО2) раствором Тироде, в мМ: 129 NaCl, 4 КСl, 1.2 СаС12, 0.5 MgSO4, 20.9 NaH2PO4, 20 NaHCO3, 5 глюкозы, при температуре 37 ± 1°С. Сердца препарировали и выделяли препарат с ушком правого предсердия, поперечным гребешком и фрагментами верхней и нижней полой вен. Препарат помещали в камеру, куда подавался термостатируемый раствор. Буфер Trizma использовали после оксигенации раствора для поддержания рН в пределах 7.3–7.4 (Sigma-Aldrich, США).
Электрическая активность. Внешнее раздражение осуществляли через платиновые электроды (частота 5 Гц). Приготовленный препарат помещался в экспериментальную камеру, объемом 3 мл, куда подавался раствор Тироде (37°С) со скоростью 10 мл/мин. После стабилизации амплитудно-временных параметров потенциала действия (ПД) подавался раствор агониста Y1-рецепторов [Leu31, Pro34] NPY в течение 20 мин. Сначала подавался раствор в наименьшей концентрации, затем производили отмывку препарата раствором Тироде, ожидали восстановление параметров ПД и подавали большую концентрацию. Регистрацию электрической активности кардиомиоцитов при действии [Leu31, Pro34] NPY проводили в диапазоне концентраций 10–10–10–6М. На одном препарате изучали эффект агониста Y1-рецепторов в трех последовательно возрастающих концентрациях. Все растворы готовились в день эксперимента. [Leu31, Pro34] NPY является селективным агонистом Y1-рецепторов. Данный агонист характеризуется связыванием только с короткими С-концевым фрагментом NPY, что доказывает его селективность к данному виду рецептора [24].
Отдельно изучали влияние селективного блокатора Y1-рецептора BIBP 3226 на параметры электрической активности рабочих кардиомиоцитов предсердия. Концентрация блокатора составляла 10–5 М [25], блокатор подавлся в ванночку, и регистриция показателей проводилась в течение 20 мин.
Для определения типа рецепторов нами была выбрана следующая последовательность добавления препаратов: сначала вводился блокатор, а на 7-й минуте в ванночку подавался раствор, в котором находились блокатор и агонист в концентрации 10–6 М.
В экспериментах использовали химические реактивы и вещества [Leu31, Pro34] NPY и BIBP 3226 фирмы Sigma-Aldrich.
Мембранный потенциал (МП) и ПД регистрировали с использованием стеклянных микроэлектродов (диаметр кончика <1 мкм, сопротивление 30–80 МΩ), которые изготавливались в день эксперимента на горизонтальном пуллере Р-1000 (Sutter Instruments, США). Сигналы усиливали с помощью усилителя (A-M Systems, США), затем анализировали параметры ПД при помощи аналогово-цифрового преобразователя Е14-140 (Л КАРД, Россия). Полученные записи электрической активности миокарда анализировали в оригинальной программе Elph 3.0. Обработка включала определение величины МП, амплитуды ПД, длительности фазы деполяризации ПД, длительности фазы реполяризации ПД на уровне 20, 50 и 90% спада ПД (ДПД 20, ДПД 50, ДПД 90%). Более детально ознакомиться с методикой вычисления вышеуказанных параметров можно в нашей статье [22]. Параметры ПД регистрировали на 7-й и 15-й минуте после аппликации [Leu31, Pro34] NPY.
Статистика. Все результаты в тексте и на рисунках представлены как среднее ± ± ошибка среднего для n экспериментов. Проверку выборки на нормальное распределение проводили во всех сериях экспериментов. Статистическую значимость эффекта исследуемых препаратов по сравнению с контролем выявляли с помощью парного критерия Стьюдента и ANOVA. Результаты считали статистически значимыми при р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Влияние агониста Y1-рецепторов [Leu31, Pro34] NPY на параметры электрической активности кардиомиоцитов
[Leu31, Pro34] NPY в концентрации 10–10, 10–9 М (р > 0.05, n = 4) не вызывал достоверных изменений в МП и параметров ПД по сравнению с контрольными значениями во всех исследуемых возрастных группах животных.
У 7-суточных животных [Leu31, Pro34] NPY в концентрации 10–8 М не изменял МП (79.3 ± 1.3 и 79.1 ± 1.5 мВ), амплитуду и длительность фазы деполяризации ПД (р > 0.05, n = 10) укорачивая фазу реполяризации ПД. К 15-й минуте действия [Leu31, Pro34] NPY наблюдается укорочение ДПД 90 на 9% с 42.1 ± 1.4 до 38.2 ± 2.6 мс (р < 0.05; n = 10; табл. 1).
Таблица 1.
Показатели МП и амплитудно-временных показателей ПД кардиомиоцитов предсердия 7- и 100-суточного возраста при аппликации [Leu31, Pro34] NPY разных концентраций, (М ± m), (*р < 0.05). Эффект агониста представлен на 15-й минуте
| Возраст | Показатели ПД | ||||||
|---|---|---|---|---|---|---|---|
| МП, мВ | Амплитуда ПД, мВ | Длительность фазы деполяризации ПД, мс | ДПД 20, мс | ДПД 50, мс | ДПД 90, мс | ||
| 7-суточные | Контроль | 79.3 ± 1.3 | 96.3 ± 3.4 | 0.2 ± 0.1 | 8.9 ± 0.9 | 16.2 ± 0.9 | 42.1 ± 1.4 |
| [Leu31, Pro34] NPY 10–8 М | 79.1 ± 1.5 | 96.1 ± 3.9 | 0.2 ± 0.1 | 8.7 ± 1.2 | 16.1 ± 1.2 | 38.2 ± 2.6* | |
| Контроль | 79.2 ± 2.3 | 96.2 ± 3.6 | 0.2 ± 0.1 | 8.8 ± 0.8 | 16.1 ± 1.3 | 43.2 ± 1.6 | |
| [Leu31, Pro34] NPY 10–7 М | 79.0 ± 2.5 | 95.9 ± 3.8 | 0.2 ± 0.1 | 8.7 ± 1.1 | 15.9 ± 1.8 | 38.1 ± 2.9* | |
| Контроль | 79.1 ± 2.4 | 95.4 ± 4.2 | 0.2 ± 0.1 | 8.5 ± 1.2 | 16.3 ± 1.7 | 42.4 ± 1.7 | |
| [Leu31, Pro34] NPY 10–6 М | 78.9 ± 2.6 | 95.3 ± 4.7 | 0.2 ± 0.1 | 8.3 ± 1.4 | 16.1 ± 1.8 | 32.1 ± 2.9* | |
| 100-суточные | Контроль | 80.3 ± 1.8 | 98.2 ± 8.3 | 0.2 ± 0.1 | 6.7 ± 0.6 | 14.8 ± 0.7 | 52.4 ± 1.4 |
| [Leu31, Pro34] NPY 10–8 М | 80.1 ± 2.1 | 97.8 ± 8.7 | 0.2 ± 0.1 | 6.5 ± 0.7 | 14.7 ± 0.8 | 49.6 ± 3.2* | |
| Контроль | 80.2 ± 1.9 | 98.1 ± 8.4 | 0.2 ± 0.1 | 6.8 ± 0.7 | 14.5 ± 0.9 | 51.9 ± 1.9 | |
| [Leu31, Pro34] NPY 10–7 М | 79.9 ± 2.4 | 98.3 ± 9.2 | 0.2 ± 0.1 | 6.5 ± 0.9 | 14.3 ± 1.1 | 48.7 ± 2.1* | |
| Контроль | 81.6 ± 3.2 | 97.6 ± 9.6 | 0.2 ± 0.1 | 6.7 ± 0.8 | 14.9 ± 0.8 | 52.6 ± 1.9 | |
| [Leu31, Pro34] NPY 10–6 М | 79.6 ± 3.4 | 97.9 ± 9.8 | 0.2 ± 0.1 | 6.6 ± 0.7 | 14.7 ± 0.9 | 44.3 ± 3.8* | |
[Leu31, Pro34] NPY в концентрации 10–7 М не изменял МП (79.2 ± 2.3 и 79.0 ± 2.5 мВ), амплитуду ПД (рис. 1А) и длительность фазы деполяризации (р > 0.05; n = 10). К 15-й минуте наблюдается уменьшение ДПД 90 на 11% с 43.2 ± 1.6 до 38.1 ± 2.9 мс (р < 0.05; n = 10; табл. 1).
Рис. 1.
Эффекты селективного агониста Y1-рецепторов [Leu31, Pro34] NPY на параметры электрической активности рабочих кардиомиоцитов правого предсердия. А. Пример записи, показывающий влияние [Leu31, Pro34] NPY при разных концентрациях на уровень МП и амплитуды ПД у крыс 7- и 100-суточного возраста (эффект агониста на 15-й минуте). Б. Эффект [Leu31, Pro34] NPY в концентрации 10–6 М на длительность ПД в рабочем миокарде правого предсердия 7- и 100-суточных животных (эффект на 15-й минуте). В. Дозозависимое влияние [Leu31, Pro34] NPY на длительность фазы реполяризации у крыс 7- и 100-суточного возраста (*р < 0.05 относительно контроля).

[Leu31, Pro34] NPY в концентрации 10–6 М не изменял МП (79.1 ± 2.4 и 78.9 ± ± 2.6 мВ), амплитуду ПД (рис. 1А) и длительность фазы деполяризации (р > 0.05; n = 10). К 7-й минуте наблюдается уменьшение ДПД 90 на 7.7% с 42.4 ± 1.7 до 39.1 ± 2.4 мс (р < 0.05). К 15-й минуте ДПД 90 уменьшилась на 24% до 32.1 ± 2.9 мс (р < 0.01; n = 10; рис. 1Б, В; табл. 1).
У 100-суточных животных [Leu31, Pro34] NPY в концентрации 10–8 М не изменял МП (80.3 ± 1.8 и 80.1 ± 2.1 мВ), амплитуду и длительность фазы деполяризации ПД (р > 0.05; n = 10), укорачивая фазу реполяризации ПД. К 15-й минуте действия [Leu31, Pro34] NPY наблюдается укорочение ДПД 90 на 5% с 52.4 ± 1.4 до 49.6 ± 3.2 мс (р < 0.05; n = 10; рис. 1В; табл. 1).
Увеличение концентрации агониста [Leu31, Pro34] NPY до 10–7 М не изменяло МП (80.2 ± 1.9 и 79.9 ± 2.4 мВ), амплитуду ПД и длительность фазы деполяризации (р > 0.05; n = 10). К 15-й минуте наблюдается уменьшение ДПД 90 на 6% с 51.9 ± 1.9 до 48.7 ± 2.1 мс (р < 0.05; n = 10; рис. 1В; табл 1).
[Leu31, Pro34] NPY в концентрации 10–6 М не приводил к изменянию МП (81.6 ± 3.2 и 79.6 ± 3.4 мВ), амплитуды ПД и длительности фазы деполяризации (р > 0.05; n = 10). К 7-й минуте наблюдается уменьшение ДПД 90 на 10% с 52.6 ± 1.9 до 47.6 ± 2.9 мс (р < 0.05; n = 10). К 15-й минуте ДПД 90 уменьшилась на 16% до 44.3 ± 3.8 мс (р < 0.05; рис. 1В; табл. 1). После удаления [Leu31, Pro34] NPY (10–8–10–6 М) из раствора в течение 10 мин наблюдается тенденция к восстановлению длительности фазы реполяризации относительно исходных значений во всех возрастных группах.
В наших экспериментах [Leu31, Pro34] NPY оказывает влияние только на временные показатели ПД рабочих кардиомиоцитов предсердий, то есть на ДПД 90%. Эффект агониста Y1-рецепторов является дозозависимым.
Влияние блокады Y1-рецепторов BIBP 3226 на параметры электрической активности кардиомиоцитов.
Пептидный антагонист (BIBP 3226) описан как мощный и селективный антагонист Y-рецепторов [14]. Это соединение представляет собой очень интересный инструмент в фармакологической характеристике Y-рецепторов. BIBP 3226 доказал свою селективность в отношении Y1-рецепторов в экспериментах связывания с тканями человека и грызунов и в своей способности блокировать опосредованные Y1-рецепторами функциональные ответы [25].
У 7-суточных животных BIBP 3226 в концентрации 10–5 М не изменял МП (78.3 ± 5.3 и 77.4 ± 4.4 мВ), амплитуду ПД и длительность фазы деполяризации (р > 0.05; n = 9) (табл. 2). К 15-й минуте эксперимента наблюдается уменьшение ДПД 20 и 50 c 7.8 ± 0.6 до 6.7 ± 0.5 мс (рис. 2А), ДПД 50 с 15.4 ± 0.6 до 13.9 ± 0.9 мс (р < 0.05; n = 9), т.е. на 14 и 9.7% соответственно (рис. 2Б). ДПД 90 достоверно не изменяется относительно исходных значений в течение всего эксперимента (р > 0.05; n = 9) (рис. 2В; табл. 2).
Таблица 2.
Показатели МП и амплитудно-временных показателей ПД рабочих кардиомиоцитов 7- и 100-суточного возраста при совместном влиянии блокатора и агониста Y1-рецепторов BIBP 3226 и [Leu31, Pro34] NPY (М ± m, * р < 0.05 относительно контроля)
| Показатели ПД | 7-суточные | 100-суточные | ||||
|---|---|---|---|---|---|---|
| контроль | BIBP 3226 (n = 10) | BIBP 3226 +[Leu31, Pro34] NPY (n = 9) | контроль | BIBP 3226 (n = 10) | BIBP 3226 +[Leu31, Pro34] NPY (n = 10) | |
| Мембранный потенциал, мВ | 78.3 ± 5.3 | 77.43 ± 4.4 | 77.9 ± 4.9 | 80.1 ± 2.3 | 79.3 ± 3.4 | 79.1 ± 3.5 |
| Амплитуда ПД, мВ | 89.4 ± 12.6 | 87.4 ± 13.2 | 87.2 ± 12.9 | 92.6 ± 11.8 | 91.8 ± 12.3 | 91.4 ± 12.5 |
| Длительность фазы деполяризации ПД, мс | 0.2 ± 0.1 | 0.2 ± 0.1 | 0.2 ± 0.1 | 0.2 ± 0.1 | 0.2 ± 0.2 | 0.2 ± 0.1 |
| ДПД 20, мс | 7.8 ± 0.6 | 6.7 ± 0.5* | 7.7 ± 0.8 | 6.4 ± 0.2 | 5.9 ± 0.1* | 6.3 ± 0.3 |
| ДПД 50, мс | 15.4 ± 0.6 | 13.9 ± 0.9* | 15.3 ± 1.9 | 13.3 ± 0.6 | 11.9 ± 0.4* | 13.2 ± 0.9 |
| ДПД 90, мс | 43.4 ± 1.4 | 43.1 ± 1.8 | 43.4 ± 2.1 | 53.6 ± 1.9 | 52.2 ± 2.4 | 53.7 ± 2.6 |
Рис. 2.
Влияние BIBP 3226 на длительность фазы реполяризации ПД кардиомиоцитов предсердия крысы. А, Б и В. Изменения длительности фазы реполяризации при действии BIBP 3226 (10–5 М) у крыс 7-суточного возраста. Стрелками отмечено начало и конец подачи блокатора (*р < 0.05 относительно контроля).

У 100-суточных животных BIBP 3226 в концентрации 10–5 М не изменял МП (80.1 ± 2.3 и 79.3 ± 3.4 мВ), амплитуду ПД и длительность фазы деполяризации. К 15-й минуте наблюдается уменьшение ДПД 20 c 6.4 ± 0.2 до 5.9 ± 0.1 мс, ДПД 50 с 13.3 ± 0.6 до 11.9 ± 0.4 мс, (р < 0.05; n = 10), т.е. на 8 и 10% соответственно (рис. 2). ДПД 90 достоверно не изменяется относительно исходных значений в течение всего эксперимента (р > 0.05; n = 10) (табл. 2).
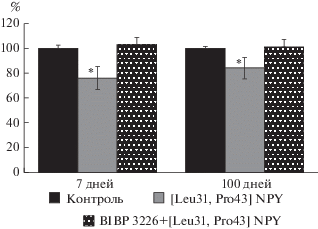
В следующей серии экспериментов исследовали влияние селективного агониста [Leu31, Pro34] NPY на фоне блокады Y1-рецепторов BIBP 3226 у 7- (n = 9) и 100-суточных (n = 9) животных. Контролем являлся эффект блокатора, который принимали за 100%. Во всех возрастных группах животных добавление [Leu31, Pro34] NPY на фоне блокады Y1-рецепторов достоверных изменений в исследуемых параметрах МП и ПД не выявлено (рис. 3, табл. 2).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
По нашим данным селективный агонист Y1-рецептора вызывает уменьшение длительности фазы реполяризации без изменений других характеристик МП и ПД в обеих возрастных группах.
При оценке действия селективного агониста Y1-рецепторов на биоэлектрическую активность кардиомиоцитов предсердия при навязанном ритме наблюдали дозозависимое влияние [Leu31, Pro-34] NPY на параметры ПД. Максимальный эффект агониста наблюдается с увеличением его концентрации. В наших экспериментах наиболее эффективной оказалась концентрация 10–6 М. Влияние агониста также зависит от возраста животных и в большей степени проявляется у 7-суточных крысят (рис. 1В). Известно, что экспрессия Y1-, Y2-, Y5-рецепторов в сердце меняется в раннем постнатальном онтогенезе. Y1-рецепторы выявлены в миокарде предсердий у новорожденных крысят, и экспрессия этих рецепторов увеличивается с 20 дня постнатального онтогенеза [2]. Таким образом, взаимодействие лиганда с Y1-рецепторами способно влиять на процесс реполяризации ПД предсердных кардиомиоцитов.
Известно, что длительность фазы реполяризации ПД в кардиомиоцитах определяется выходящими калиевыми токами: IKur (сверхбыстрый выходящий ток задержанного выпрямления), Ito1,2 (транзиторный выходящий ток), IKr и IKs (быстрая и медленная компоненты токов задержанного выпрямления), IK1 (ток аномального выпрямления) и некоторыми другими. Токи задержанного выпрямления протекают через потенциал-чувствительные калиевые каналы. У человека и крысы длительность фазы реполяризации ПД в основном определяется током IKr [26].
Уменьшение длительности ПД при активации Y1-рецепторов может осуществляться посредством снижения уровня цАМФ и усиления реполяризующих токов, через GIRK-каналы [15]. Y-рецепторы сопряжены с Gq-белками, которые активируют фосфолипазы γ-PLC и β-PLC. PLC-зависимое фосфорилирование каналов усиливает токи задержанного выпрямления (IK). Расщепление фосфатидилинозитола в мембране клетки под действием фосфолипазы С снимает ингибирующее действие на IK. В результате активация IK приводит к укорочению длительности фазы реполяризации ПД.
Добавление селективного блокатора Y1-рецепторов BIBP 3226 само по себе приводило к уменьшению длительности ПД, за счет укорочения фазы реполяризации на уровне 20 и 50% (рис. 2А, Б). Доказано, что в формировании длительности фазы реполяризации ПД кардиомиоцитов предсердия принимают участие разные токи. Длительность фазы реполяризации на уровне 20% определяется в основном IСa, роль IK незначительна. В формировании длительности фазы реполяризации на уровне 50 и 90% важную роль играют IK. По нашим данным BIBP 3226 приводит к изменению суммарных Сa2+- и K+-токов.
Действие селективного агониста Y1-рецептора [Leu31, Pro-34] NPY, приводящего к уменьшению длительности ПД на уровне ДПД 90%, полностью ингибируется блокатором BIBP3226 в обеих возрастных группах (рис. 3, табл. 1).
Таким образом, селективный агонист Y1-рецепторов оказывает влияние на длительность ПД, вызывая изменения паттерна электрической активности миокарда предсердий у крыс 7- и 100-суточного возраста. Полученные нами данные об уменьшении длительности ПД, по всей видимости, связаны с изменениями плотности и кинетики К+-каналов, что ведет к увеличению суммарного К+-тока. Физиологическая роль NPY в сердце заключается в уменьшении длительности ПД за счет укорочения фазы реполяризации, что приводит к увеличению продолжительности паузы и кардиотропному эффекту.
Список литературы
Blomqvist A., Söderberg C., Lundell I., Milner R.J., Larhammar D. Strong evolutionary conservation of neuropeptide Y: Sequences of chicken, goldfish, and Torpedo marmorata DNA clones. Proc. Natl. Acad. Sci. U. S. A. 89: 2350–2354. 1992.
Masliukov P., Moiseev K., Emanuilov A., Anikina T., Zverev A., Nozdrachev A. Delopment of neuropeptide Y-mediated heart innervation in rats. Neuropeptides. 55: 47–54. 2016.
Protas L., Barbuti A., Qu J., Rybin V.O., Palmiter R.D., Steinberg S.F., Robinson R.B. Neuropeptide Y Is an Essential In Vivo Developmental Regulator of Cardiac ICa,L. Circulation Res. 93(10): 972–979. 2003.
Zukowska Z., Pons J., Lee E.W., Li L. Neuropeptide Y: A new mediator linking sympathetic nerves, blood vessels and immune system? Can. J. Physiol. Pharmacol. 81: 89–94. 2003.
Batterham R.L., Le Roux C.W., Cohen M.A., Park A.J., Ellis S.M., Patterson M., Frost G.S., Ghatei M.A., Bloom S.R. Pancreatic polypeptide reduces appetite and food intake in humans. J. Clin. Endocrinol. Metab. 88(8): 3989–3992. 2003.
Maslukov P.M., Moiseev K. Ju., Emanyilov A.I. Age changes of heart neuropeptide Y-ergic inervation.Neuroscience and Behavioral Physiology. 149 (3): 133–134. 2016.
Zverev A.A., Anikina T.A., Maslyukov P.M., Zefirov T.L. Role of neuropeptide Y in myocardial contractility of rats during early postnatal ontogeny. Bull. Exp. Biol. Medicine. 157(4): 415–417. 2014.
Oki Y., Teraoka H., Kitazawa T. Neuropeptide Y (NPY) inhibits spontaneous contraction of the mouse atrium by possible activation of the NPY1 receptors. Auton Autacoid Pharmacol. 37: 23–28. 2017.
Ammar D.A., Eadie D.M., Wong D.J., Ma Y.-Y., Kolakowski Jr. L.F., Yang-Feng T.L., Thompson D.A. Characterization of the human type 2 neuropeptide Y receptor gene (NPY2R) and localization to the chromosome 4q region containing the type 1 neuropeptide Y receptor gene. Genomics. 38: 392–398. 1996.
Pellieux C., Sauthier T., Domenighetti A., Marsh D.J., Palmiter R.D., Brunner H.R., Pedrazzini T. Neuropeptide Y (NPY) potentiates phenylephrine-induced mitogen-activated protein kinase activation in primary cardiomyocytes via NPY Y5 receptors Proc. Natl. Acad. Sci. U. S. A. 97(4): 1595–1600. 2000.
Lundberg J., Hua X., Franco-Cereceda A. Effects of neuropeptide Y (NPY) on mechanical activity and neurotransmission in the heart, vas deferens and urinary bladder of the guinea-pig Acta Physiol. Scand. 121(4): 325–332. 1984.
Rump L.C., Riess M., Schwertfeger E., Michel M.C., Bohmann C., Schollmeyer P. Prejunctional neuropeptide Y receptors in human kidney and atrium. J. Cardiovasc. Pharmacol. 29 (5): 656–661. 1997.
Saraf R., Mahmood F., Amir R., Matyal R. Neuropeptide Y is an angiogenic factor in cardiovascular regeneration. Eur. J. Pharmacol. 776: 64–70. 2016.
Doods H.N., Wieland H.A., Engel W., Eberlein W., Willim K.D., Entzeroth M., Wienen W., Rudolf K. BIBP 3226, the first selective neuropeptide Y1 receptor antagonist: A review of its pharmacological properties. Regul. Pept. 65(1): 71–77. 1996.
Heredia Mdel P., Delgado C., Pereira L., Perrier R., Richard S., Vassort G., Bénitah JP, Gómez A.M. Neuropeptide Y rapidly enhances [Ca2+] I transients and Ca2+ sparks in adult rat ventricular myocytes through Y1 receptor and Plc activation. J. Mol. Cell. Cardiol. 38: 205–212. 2005.
Hansel D.E., Eipper B.A., Ronnett G.V. Neuropeptide Y functions as a neuroproliferative factor. Nature. 410 (6831): 940–944. 2001.
Zukowska-Grojec Z., Karwatowska-Prokopczuk E., Fisher T.A., Ji H. Mechanisms of vascular growth-promoting effects of neuropeptide y: Role of its inducible receptors. Regul. Pept. 75: 231–238. 1998.
Pons J., Kitlinska J., Ji H., Lee E.W., Zukowska Z. Mitogenic actions of neuropeptide y in vascular smooth muscle cells: Synergetic interactions with the beta-adrenergic system. Can. J. Physiol. Pharmacol. 81: 177–185. 2003.
Colmers W.F., Pittman Q.J. Presynaptic inhibition by neuropeptide Y and baclofen in hippocampus: insensitivity to pertussis toxin treatment. Brain Res. 498(1): 99–104. 1989.
Millar B.C., Weis T., Piper H.M., Weber M., Borchard U., McDermott B.J., Balasubramaniam A. Positive and negative contractile effects of neuropeptide Y on ventricular cardiomyocytes. Amer. J. Physiol. Heart and Circulat. Physiol. 261(6): 1727–1733. 1991.
Luo G., Xu X., Guo W., Luo C., Wang H., Meng X. Zhu S., Wei Y. Neuropeptide Y damages the integrity of mitochondrial structure and disrupts energy metabolism in cultured neonatal rat cardiomyocytes. Peptides. 71: 162–169. 2015.
Zverev A.A., Anikina T.A., Iskakov N.G., Zefirov A.L., Zefirov T.L. Effect of neuropeptide Y on action potential generation in working cardiomyocytes of the right atrium in rat heart. Bull. Exp. Biol. Med. 165(5): 610–612. 2018.
Sitdikov F.G., Anikina T.A., Zverev A.A., Bilalova G.A., Khamzina E.I. Purinergic regulation of rat heart function in ontogeny. Ontogenez. 39(5): 333–339. 2008.
Fuhlendorff J., Gether U., Aakerlund L., Langeland-Johansen N., Thøgersen H., Melberg S.G., Olsen U.B., Thastrup O., Schwartz T.W. [Leu31,Pro34] Neuropeptide Y: Aspecific Y1 receptor agonist. Proc. Natl. Acad. Sci. U. S. A. 87(1): 182–186. 1990.
Mollereau C., Gouardères C., Dumont Y., Kotani M., Detheux M., Doods H., Parmentier M., Quirion R., Zajac J.-M. Agonist and antagonist activities on human NPFF2 receptors of the NPY ligands GR231118 and BIBP3226. Brit. J. Pharmacol. 133(1): 1–4. 2001.
Virág L., Iost N., Opincariu M., Szolnoky J., Szécsi J., Bogáts G., Szenohradszky P., Varró A., Papp J.G. The slow component of the delayed rectifier potassium current in undiseased human ventricular myocytes. Cardiovasc. Res. 49(4): 790–797. 2001.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова