Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 11, стр. 1436-1451
Исследование паттернов кальциевой динамики в сетях астроцитов головного мозга
А. Р. Браже 1, 2, М. С. Доронин 2, А. В. Попов 2, П. А. Денисов 3, А. В. Семьянов 1, 2, *
1 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
2 Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова
Москва, Россия
3 Нижегородский государственный университет им. Н.И. Лобачевского
Нижний Новгород, Россия
* E-mail: semyanov@ibch.ru
Поступила в редакцию 03.07.2019
После доработки 01.09.2019
Принята к публикации 02.09.2019
Аннотация
Астроциты кодируют информацию о состоянии окружающей нервной ткани в виде пространственно-временных паттернов Ca2+ активности. В свою очередь, Ca2+ события в астроцитах через ряд механизмов влияют на синаптическую пластичность, высвобождение глиопередатчиков и локальный кровоток. Использование генетически кодируемых Ca2+ индикаторов позволило визуализировать астроцитарную Ca2+ активность на уровнях от тонких периферических отростков до целых клеточных доменов и сетей клеток. Интерпретация экспериментальных результатов требует использования адекватных методов обработки данных, включая стабилизацию изображений, подавление шума, разделение сигнала на быстрые и медленные компоненты, сегментацию отдельных событий сигнализации и установление возможных закономерностей в появлении этих событий. В данной работе демонстрируется, что спонтанная Ca2+ активность в отдельных астроцитах имеет вид локализованных событий. Эти события возникают преимущественно на периферии пространственных доменов астроцита и характеризуются распределениями с тяжелым хвостом по размерам и длительностям. Локальные кинетические параметры нарастания и затухания флуоресценции привязаны к морфологии клетки; в зависимости от степени вовлеченности крупных отростков в наблюдаемые события, присутствуют градации средней амплитуды и пиковой скорости изменения флуоресценции. На уровне астроцитарной сети наблюдаются флуктуации суммарной Ca2+ активности, наибольший вклад в пики активности вносят одиночные события, охватывающие целиком пространственный домен астроцита. Разработанные методические подходы и полученные данные могут пролить свет на принципы формирования пространственно-временных паттернов астроцитарной Ca2+ активности и их вовлеченность в когнитивные процессы.
Астроциты – клетки нейроэпителиального происхождения, тесно интегрированные в процессы метаболического обеспечения, гомеостатического контроля и пластичности центральной нервной системы [1]. В коре и гиппокампе зрелые астроциты образуют практически неперекрывающиеся пространственные домены, при этом каждый астроцит контактирует с дендритами 200–400 различных нейронов и с примерно 10 000 синапсов [2]. Каждый астроцит образует несколько первичных отростков, ветвящихся на дочерние отростки все более высокого порядка, в итоге заполняя свой пространственный домен сложной трехмерной сетью тонких отростков, оканчивающихся “листочками” – плоскими выростами, не содержащими органелл, но мембраны которых содержат большое количество транспортеров синаптических нейропередатчиков [3]. Астроцитарные листочки формируют контакты с синапсами (трехчастный синапс) и обеспечивают захват нейропередатчиков, вытекающих из синаптической щели. Астроциты, занимающие соседние пространственные домены, формируют единый синцитий благодаря щелевым контактам между дистальными отростками и способны обмениваться низкомолекулярными соединениями и ионами [4]. Астроциты обладают морфологической пластичностью, и изменения физиологического состояния ЦНС приводят к изменениям в пространственной организации астроцитов, влияя на эффективность захвата нейромедиаторов [5].
Развитие методов флуоресцентного Ca2+ имиджинга показало, что основной формой возбудимости астроцитов является изменение концентрации свободного Ca2+ ([Ca2+]) в цитоплазме клетки. Ca2+ является вторичным мессенджером и регулирует экспрессию генов, пролиферацию и апоптоз, синтез и секрецию сигнальных молекул и т.д. В случае астроцитов Ca2+ сигнализацию также связывают с секрецией глиопередатчиков, синхронизацией работы нейронов, синаптической пластичностью и нейро-сосудистым сопряжением [6].
Астроцитарные Ca2+ события (ограниченные во времени и пространстве области повышения уровня Ca2+) могут как охватывать небольшие субклеточные области, так и распространяться на всю клетку и далее на уровне синцития [7]. За внутриклеточное распространение Ca2+ события отвечает механизм Ca2+-активируемого выхода Ca2+ из эндоплазматического ретикулума через инозитолтрифосфатные (ИТФ) рецепторы, тогда как за межклеточное распространение сигнала может отвечать как диффузия ИТФ и Ca2+ через щелевые контакты, так и паракринная сигнализация, опосредуемая пуринергическими рецепторами [8]. Относительный вклад этих двух механизмов может варьировать между областями мозга.
В ранних работах по Ca2+ имиджингу на астроцитах использовались низкомолекулярные флуоресцентные зонды на основе Ca2+ хелаторов (FURA-2, Oregon Green BAPTA). Загрузка зондов осуществлялась либо через патч-пипетку, либо с использованием мембранно-проникающей ацетоксиметильной (AM) формы зонда [9]. Использование низкомолекулярных зондов, однако, имело ряд недостатков. АМ форма зонда приводила к неизбирательному окрашиванию всех типов клеток, включая нейроны и астроциты, что затрудняло интерпретацию сигналов флуоресценции. Загрузка через патч-пипетку крайне затруднительна при проведении экспериментов in vivo.
Избавиться от этих недостатков стало возможным благодаря использованию генетически кодируемых Ca2+ индикаторов, созданных генно-инженерными методами на основе зеленого флуоресцирующего белка (GFP), кальмодулина и M13-пептидной последовательности из киназы легкой цепи миозина, получивших название GСaMP [10]. Использование векторных конструкций на основе вирусов позволяет доставлять генетический материал, кодирующий GCaMP, в любые ткани, также осуществлять его экспрессию под промоторами, специфичными для нужного типа клеток, что идеально подходит для исследования Ca2+ динамики в астроцитах.
Первые измерения Ca2+ активности в астроцитах при помощи генетически кодируемых индикаторов проводились с использованием цитозольных и мембраносвязанных конструктов на основе GCaMP 3-го поколения [11]. В настоящее время часто используются более новые сенсоры GCaMP 6-го поколения, различающиеся по кинетике нарастания и спада флуоресценции: медленный GCaMP6s, средний GCaMP6m и быстрый GCaMP6f [12]. Применение генетически кодируемых индикаторов выявило, что наиболее активными областями оказываются тонкие отростки благодаря высокому отношению их площади к объему [13].
Представление о том, что Ca2+ события в астроцитах могут участвовать в процессах кодирования и обработки информации в мозге, требует адекватных методов детектирования, анализа и интерпретации наблюдаемой активности, оптимизированных именно для астроцитов. При анализе нейрональной активности основная задача состоит в выявлении стационарных источников (отдельные нейроны) и присущих им временных сигналов. В этом случае хорошо работает традиционный подход с выделением областей интереса (region of interest, ROI), и техническая сложность наблюдается лишь в одновременной обработке десятков и сотен таких областей в одной экспериментальной записи. В случае астроцитов необходимо исходить из стохастического характера наблюдаемых Ca2+ событий, которые могут возникать в произвольном месте и либо оставаться локализованными в пространстве, либо распространяться на значительные расстояния. При этом интерес вызывают как локальные свойства Ca2+ сигнала, определяемые морфологией клеток, так и свойства пространственно-временных паттернов, формируемых этими событиями.
В настоящей работе рассмотрены основные аспекты исследования Ca2+ сигнализации в астроцитах in situ с использованием генетически кодируемых Ca2+ сенсоров, оригинальных методов обработки изображений для выявления полезного сигнала из зашумленных записей и анализа наблюдаемых Ca2+ событий.
МЕТОДЫ ИССЛЕДОВАНИЯ
Все эксперименты проводились на лабораторных мышах линии C57BL/6 возрастом 3–4 мес. в соответствии с принципами Базельской декларации и рекомендациями биоэтического комитета Нижегородского государственного университета. Операции делались на мышах в условиях общей анестезии смесью кислорода и изофлурана (1.5–5% в зависимости от типа и массы животных со скоростью потока газовой смеси 1.5–2 л/мин).
Вирусная трансфекция
Кожа головы рассекалась продольно по медиальной линии и фиксировалась ранорасширителем для удобства проведения дальнейших манипуляций. В работе была использована экспрессия Ca2+ индикатора GCaMP6f (быстрый с высокой аффинностью, KD = = 147 нM) под астроцит-специфичным промотором GFAP. Для этого использовался аденоассоциированный вирусный вектор 5 серотипа AAV5.pZAC2.1.gfaABC1D-cyto-GCaMP6f (титр ≥ 7 × 1012 вг/мл). Для инъекции проводилась краниотомия согласно координатам, определенным по атласу мозга животного [14]. Вирусный вектор вводился через стеклянный микроэлектрод при помощи подсоединенного через силиконовую трубку инсулинового шприца (рис. 1А). Скорость введения составляла ~500 нл/мин. После инъекции кожа головы зашивалась хирургической нитью. Для предотвращения открытия раны силами животного использовался адгезив для тканей, наносимый поверх наложенных швов.
Рис. 1.
Операция по инъекции вирусного вектора и контроль жизнеспособности образца. А. Схематическое изображение животного во время проведения операции по инъекции вирусного вектора. Б. Схематическое изображение животного в клетке для постоперационного восстановления животных с регулируемой температурой на время выхода из состояния анестезии. В. Схематическое изображение гиппокампа. Расположение стимулирующего (стим. эл.) и регистрирующего электрода (рег. эл.). Регистрирующий электрод был расположен в stratum radiatum поля СА1. С помощью него регистрировался полевой ВПСП (пВПСП) и потенциал пресинаптических волокон (пВ) в ответ на электрическую стимуляцию. Пунктирная линия – границы области Ca2+ имиджинга. Г. Типичная форма ответов на электрическую стимуляцию. Амплитуда пВПСП измерялась как расстояние от базовой линии до пика (Ампл). Д. Типичное изображение астроцитов, экспрессирующих GCaMP6.
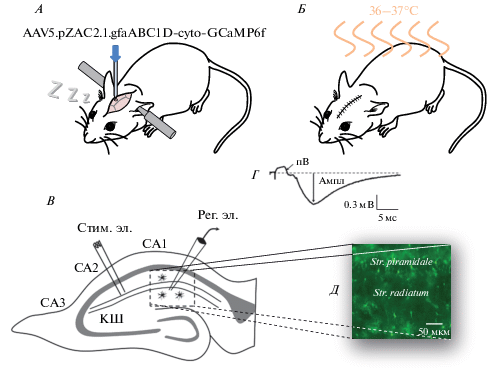
После операции животное помещалось в клетку для постоперационного восстановления с регулируемой температурой на время выхода из состояния анестезии (рис. 1Б). Животному вводились анальгетик и антибиотик, и его состояние наблюдалось через несколько часов после операции, а также на следующий день. Мыши использовались в экспериментах через 14 дней после трансфекции.
Приготовление срезов
Для приготовления поперечных срезов гиппокампа толщиной 350 мкм животные были анестезированы изофлураном и декапитировались. Гиппокамп извлекался и помещался в чашу вибратома Microm HM650V, заполненную раствором, содержащим (в мM): сахароза – 50; NaCl – 87; KCl – 2.5; MgSO4 – 8.48; NaH2PO4 – 1.24; NaHCO3 – 26.2; CaCl2 – 0.5; D-глюкоза – 11, при температуре 4°С и насыщенным карбогеном (95% О2 + 5% СО2, рН 7.4, осмолярность 290–300 мОсм/л). После приготовления срезы восстанавливались в течение часа в камере погруженного типа при комнатной температуре. Затем они переносились в камеру рабочей установки, где перфузировались при температуре 34°С. Для восстановления и перфузии использовался модифицированный раствор Рингера, содержащий (в мМ): NaCl – 119; KCl – 2.5; MgSO4 – 1.3; NaH2PO4 – 1; NaHCO3 – 26.2; CaCl2 – 2.5; D-глюкоза – 11 (рН 7.4, осмолярность 290–300 мОсм/л).
Контроль жизнеспособности срезов
Для контроля жизнеспособности среза в ходе эксперимента использовался метод внеклеточной регистрации полевого возбуждающего постсинаптического потенциала (пВПСП). Стимулирующий биполярный электрод из нержавеющей стали размещался в поле СА2 гиппокампа (рис. 1В). Стимуляция коллатералей Шаффера выполнялась с помощью изолированного токового стимулятора прямоугольными импульсами длительностью 0.1 мс и межимпульсным интервалом 20 с. Использовалась интенсивность стимуляции, при которой амплитуда пВПСП составляла половину от максимальной. Особое внимание уделялось тому, чтобы амплитуда потенциала волокон (пВ) составляла менее 50% от амплитуды пВПСП (рис. 1Г). Регистрирующий микроэлектрод сопротивлением 4–8 МОм изготавливался из стеклянных капилляров (Harvard Part No. 30-0053) при помощи пуллера P-97 (Sutter Instruments, США). Электрод заполнялся раствором Рингера и размещался в stratum radiatum поля CA1. Для регистрации использовался усилитель Axoclamp 700B (Axon Instruments, США). Сигнал фильтровался фильтром низких частот на 1 кГц, оцифровывался на частоте 2 кГц и сохранялся на жестком диске персонального компьютера с помощью программного обеспечения WinWCP.
Регистрация Ca2+ динамики
Для Ca2+ имиджинга использовался конфокальный флуоресцентный микроскоп Carl Zeiss LSM 510 DuoScan с 20-кратным объективом с числовой апертурой 1.0. Для возбуждения флуоресценции GCaMP6 использовался аргоновый лазер с длиной волны 488 нм. Флуоресцентный сигнал выделялся с помощью полосового фильтра в диапазоне 500–530 нм, и детектировался с помощью фотоумножителя. Запись спонтанной Ca2+ активности проводилась с частотой 1 кадр в секунду с поля СА1 гиппокампа 420 × 420 мкм (512 × 512 пикселей при размере пикселя 0.82 мкм2; рис. 1Д)
Коррекция артефактов движения
Для коррекции артефактов движения использовался сигнал автофлуоресценции, регистрируемый в красном канале. Флуктуации сигнала флуоресценции возникали вследствие как пространственно-нескоррелированного шума, так и движений образца, приводящих к скоррелированным изменениям флуоресценции в соседних областях. Наличие корреляций в полезном сигнале позволило проводить подавление шума методом проекции изображений на первые несколько главных компонент (ГК). Для нахождения пространственных ГК был использован приближенный алгоритм, основанный на случайных проекциях исходных данных, что существенно снизило время обработки. Дополнительное подавление шума достигалось за счет сглаживания пространственных ГК перед обратным преобразованием. На рис. 2А показан пример одиночного кадра, зарегистрированного в канале автофлуоресценции, до и после фильтрации. Сами ГК выглядят как пространственные производные среднего кадра, отражая наличие сдвигов образца во времени (рис. 2Б).
Рис. 2.
Коррекция артефактов движения. А. Произвольно выбранный единичный кадр из серии до обработки (слева) и после фильтрации в пространстве главных компонент (справа); фрагмент в красном квадрате увеличен внизу. Б. Усредненный во времени кадр для того же набора данных (слева вверху) и первые 5 главных компонент после фильтрации. В. Иллюстрация коррекции сдвигов для пары произвольно взятых кадров из одного видео (№№ 10 и 900); слева – наложение двух кадров до коррекции движения, один из которых показан в пурпурном цветовом канале, а второй – в зеленом цветовом канале, заметны сдвиги одного изображения относительно другого; справа – аналогичное наложение для той же пары кадров после коррекции движения. Г. Первоначальное совмещение изображений делается в пределах кластера. Показано отнесение каждого кадра к одному из 10 кластеров.
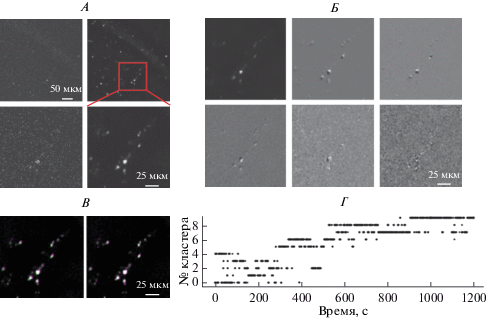
Затем создавался набор изображений, с которыми совмещались кадры зарегистрированного видео. Для создания изображений-шаблонов использовался метод кластеризации: после подавления шума производился поиск кластеров схожих кадров, и каждый кадр классифицировался по принадлежности к определенному кластеру. Кластеризация производилась не в пространстве самих изображений, а в более низкоразмерном пространстве проекций на ГК. После кластеризации производилось совмещение каждого кадра в видео с соответствующим центроидом кластера, т.е. изображением, реконструированным из усредненных коэффициентов при ГК для всех элементов данного кластера, а центроиды каждого кластера, в свою очередь, совмещались с одним из центроидов для наиболее представленного в видео класса изображений. Результирующие векторные поля смещений координат пикселей были суммой локальных полей – в пределах одного кластера – и глобальных полей смещений между центроидами.
На тестовых данных с синтетическими полями смещений данный метод позволял компенсировать смещения от субпиксельных до десятков пикселей. Смещения по оси Z и дефокусировку изображения невозможно полноценно скомпенсировать методами совмещения изображений, поэтому для анализа использовались данные без видимого смещения по оси Z.
В завершение процедуры компенсации артефактов движения, поля деформации положений пикселей, рассчитанные для данных в канале регистрации автофлуоресценции, применялись к данным в канале регистрации GCaMP6. Дальнейший анализ динамики флуоресценции делался уже для стабилизированных изображений.
Детектирование Ca2+ событий
Для детектирования Ca2+ событий мы разработали новый метод, основанный на локальных проекциях на ГК, одновременного подавления шума и разделения наблюдаемой флуоресценции на медленно меняющийся фоновый уровень и значимые быстрые отклонения флуоресценции, соответствующие Ca2+ событиям. Исходный сигнал F(t, x, y) разделяется на медленную, быструю и шумовую компоненты: F(t, x, y) = F0(t, x, y) + ΔF(t, x, y) + ξ(t, x, y). Для стабилизации дисперсии перед использованием алгоритма производилось преобразование к квадратному корню: G(t, x, y) = √F(t, x, y), и дальнейшая обработка осуществлялась на данных G(t, x, y), после чего делалось обратное преобразование для получения искомых F0 и ΔF. Метод основан на разложении сигнала G(t) в скользящих перекрывающихся локальных окошках на пространственные и временные ГК, выделения медленных и быстрых составляющих во временных ГК, фильтрацией пространственных ГК и раздельном обратном преобразовании для фонового уровня и быстрых изменений флуоресценции.
Рассмотрим метод более подробно: пусть P(t, x, y) – небольшая часть данных (патч) размером Nf × 10 × 10 (Nf – число кадров), вырезанная окошком из полного видео G(t, x, y) (рис. 3А, Б). Она разворачивалась в прямоугольную матрицу, где каждая строка – одно изображение из этого патча (рис. 3В–Д). Используя сингулярное разложение (singular value decomposition, SVD), прямоугольная матрица P ' размера Nf × 100 представлялась в виде произведения P ' = UΣV*, где столбцы U – левые сингулярные векторы (соответствуют временным ГК), строки V* – правые сингулярные векторы (соответствуют пространственным ГК), а Σ – диагональная матрица, взвешивающая соответствующие ГК (рис. 3Г). При этом для хорошей аппроксимации P ' достаточно использовать первые несколько компонент, отбросив остальные. Количество сохраняемых компонент выбиралось автоматически, исходя из распределения значений в матрице Σ и размерности данных [15]. Каждый оставшийся столбец в U затем разделялся на медленную составляющую и быстрые отклонения U = U0+ UΔ+ Unoise. Из-за особенностей SVD-разложения, в котором используются ортогональные векторы и которое инвариантно относительно знаков у парных векторов из U и V*, значимые отклонения UΔ были как положительными, так и отрицательными. Частичные реконструкции для фоновой флуоресценции и отклонений от фонового уровня были получены как $P_{0}^{'}$ = U0ΣV* и $P_{\Delta }^{'}$ = UΔΣV* соответственно. Перед реконструкцией исходного сигнала производилась дополнительная фильтрация взвешенных пространственных компонент W = ΣV*, где выбирались области наиболее согласующиеся с временной динамикой в P '. Следует отметить, что каждая из компонент U – комбинация сигналов из разных пикселей, что позволяет сконцентрировать полезную динамику в небольшом наборе сигналов, повышая соотношение сигнал–шум. Результат подавления шума для одного патча показан на рис. 3E.
Рис. 3.
Оконный подход к обработке данных Ca2+ имиджинга с использованием SVD-разложения. А. Обработка производится в скользящем окне (патчах). Временные сигналы из одного патча (Б) реорганизуются (В) в двумерную матрицу так, чтобы каждый столбец соответствовал одному моменту времени (Д). Г. Схема SVD-разложения исходного патча с данными. Полезная информация содержится в первых компонентах. Е. Обратное преобразование после фильтрации в пространстве ГК позволяет избавиться от шума. Ж. Реконструкция относительных изменений флуоресценции ΔF/F0 после обработки всех патчей.
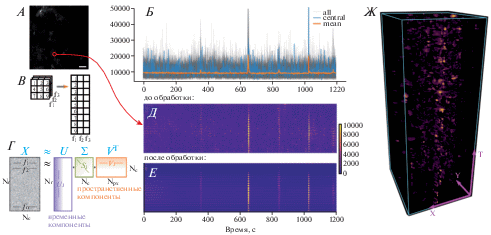
Как правило, удобно использовать окошки размером 10 × 10 пикселей с шагом смещения в 2 пикселя. В этом случае каждый пиксель изображения попадает в 10 окошек, что дает 10 разных оценок временной динамики в данной точке. Оценки динамики для каждого пикселя, полученные из различных окошек, усреднялись. Использование более мелких окошек не дает достаточного объема данных для подавления шума. Использование более крупных окошек повышает чувствительность метода к небольшим по амплитуде но скоррелированным на большой площади изменениям флуоресценции, однако существенно увеличивает время обработки данных.
Резюмируя, нами был использован алгоритм детектирования Ca2+ событий, включающий в себя преобразование, стабилизирующее дисперсию, локальное SVD-разложение, автоматический выбор оптимального количества компонент и одновременное выделение фоновой флуоресценции и активности.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Распределение размеров и длительностей Ca2+ событий
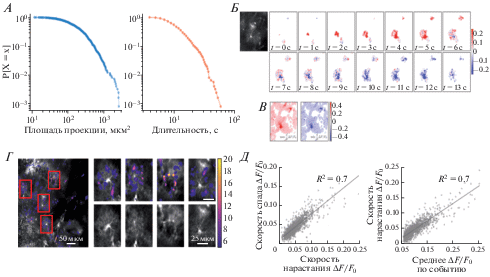
После разделения исходного сигнала на фоновую флуоресценцию (F0) и значимые отклонения (ΔF), Ca2+ сигналы были определены как ΔF/F0 и представлены внутри трёхмерных массивов (x-y-время, рис. 3Ж). Для интерпретации наблюдаемой активности каждый массив ΔF/F0 сегментировался на отдельные связные множества пикселей, в которых значения превышают заданный порог (рис. 4А). Такие пространственно-временные области мы назвали Ca2+ событиями. Каждая экспериментальная запись была охарактеризована набором Ca2+ событий, для которых рассчитывались распределения размеров (максимальных проекций), длительностей, точек инициации. В соответствии с нашими данными, полученными на отдельных астроцитах, Ca2+ события в астроцитарном синцитии также характеризуются распределениями с тяжелым хвостом (рис. 4А) [7]. Размеры одиночных событий варьировались в пределах нескольких порядков (среднее – 113 мкм2, стандартное отклонение – 155 мкм2, коэффициент эксцесса 37.4), тогда как длительности событий различались в десятки раз (среднее – 8.4 с, стандартное отклонение 5.3 с, коэффициент эксцесса 7.7). Однако следует учитывать, что на длительность событий накладываются ограничения, зависящие от длительности записи и от того, на каком масштабе времени производилось деление между Ca2+ сигналом и медленным изменением фонового уровня F0.
Рис. 4.
Пространственно-временные характеристики отдельных событий. А. Комплементарные интегральные функции распределения для площадей проекции (слева) и длительностей (справа) событий. Б. Нарастание и спад ΔF/F0 в ходе формирования одного события. Для сопоставления с морфологией слева показан усредненный кадр. Цветом показаны значения производной сигнала ΔF/F0 по времени. В. Максимальная и минимальная проекции производной сигнала ΔF/F0 по времени. Г. Точки инициации Ca2+ событий. Области, отмеченные прямоугольниками, показаны в увеличенном виде справа. Цветовая шкала отражает число раз, которое данная область находилась в первых двух кадрах одного события. Д. Корреляция между максимальной скоростью нарастания, усредненной в пределах события, и аналогичной величины для убывания ΔF/F0 (слева) и между скоростью нарастания и средней амплитудой ΔF/F0 в пределах события (справа).
Точки инициации Ca2+ событий
Отдельные Ca2+ события могут оставаться пространственно локализованными или распространяться на весь клеточный домен, при этом большинство наблюдаемых событий инициировалось на периферии пространственного домена астроцита, откуда они могли распространяться как в сторону сомы, так и от нее (рис. 4Г). Мы определяли область инициации события как множество пикселей, попадающих в первые два кадра индивидуального события. При использовавшемся увеличении невозможно разрешить тонкие отростки астроцитов, однако видно, что в некоторых местах астроцитарного домена события возникают чаще, чем в соседних, образуя “горячие точки” инициации событий. Это согласуется с представлением о том, что вероятность инициации Ca2+ событий в астроцитах выше в тонких отростках, имеющих большее отношение поверхности к объему [13].
В некоторых образцах отмечались также случаи возникновения видимых событий в теле клетки или в проксимальных участках одного из основных отростков с распространением по более периферическим участкам. При этом нельзя исключить того, что видимое событие могло инициироваться в периферических отростках, расположенных вне фокальной плоскости, активируя затем и тело клетки.
Кинетика нарастания и затухания Ca2+ событий
Более детальную информацию о пространственно-временном развитии Ca2+ событий можно получить, картируя области с нарастающими и затухающими значениями флуоресценции (рис. 4Б). Значения первой производной ΔF/F по времени, т.е. скорости нарастания и спада флуоресцентного сигнала рассчитывались при помощи конволюции массива ΔF/F(t, x, y) с трехмерным Гауссовским фильтром, который вдоль оси времени представлял собой производную от функции Гаусса, а вдоль пространственных осей – обычный фильтр Гаусса. Таким образом, одновременно осуществлялось локальное усреднение в пространстве для понижения шума и расчет производной по времени. По развертке развития одного из событий можно видеть, как инициируется и растет область с нарастающими значениями ΔF/F(t) (красный цвет), достигая сомы. После этого наблюдается разнонаправленная динамика сигнала: в области сомы значения ΔF/F(t) уже затухают (синий цвет), тогда как на периферии клетки продолжается увеличение ΔF/F(t) за счет распространения сигнала. Постепенно все затронутые области переходят в состояние с затухающим уровнем ΔF/F(t).
Пиковые скорости изменения флуоресценции коррелировали с морфологией астроцита, достигая максимальных абсолютных значений в теле клетки и первичных отростках (рис. 4В). Это можно связать с более выраженным вкладом ИТФ-зависимого обмена Ca2+ с ЭПР в соме и толстых отростках, обладающего свойствами положительной обратной связи, тогда как в области более тонких отростков относительная доля объема ЭПР в цитоплазме меньше, что приводит к более медленной кинетике Ca2+ сигналов в этой области [16]. Далее мы сравнивали кинетические параметры отклонений флуоресценции на уровне отдельных событий. Для этого в каждой точке события находились максимальные значения нарастания и затухания флуоресценции, эти значения затем усреднялись в пределах одного события (скорости нарастания: среднее – 4.8%/с, стандартное отклонение – 2.7%/c, коэффициент эксцесса – 15.1; скорости затухания: среднее – 4.5%/c, стандартное отклонение – 2.1%/c, коэффициент эксцесса – 11.4). Оказалось, что средние пиковые значения нарастания флуоресценции коррелируют со средними пиковыми значениями спада флуоресценции: события, в которых в среднем достигались высокие пиковые скорости нарастания флуоресценции, характеризовались также и быстрым спадом, отражая эффективность механизмов восстановления концентрации Ca2+ уровня покоя (рис. 4Д). Скорость нарастания флуоресценции также коррелировала и со средней амплитудой ΔF/F0 в пределах события (коэффициент детерминации R2 = 0.7), связывая динамические свойства сигнала и морфологию клетки, поскольку наиболее амплитудные изменения флуоресценции происходили в соме и первичных отростках клетки, так же, как и наиболее быстрые изменения (коэффициент детерминации R2 = 0.7; рис. 4Д). Таким образом, локализованные события, затрагивающие только периферические отростки, характеризовались относительно медленной кинетикой флуоресценции и менее амплитудными ее изменениями, чем события, затрагивающие более крупные отростки и сому. Вместе с тем не наблюдалось явного разделения событий на два класса по амплитуде или кинетике, это свидетельствует о том, что вовлеченность крупных отростков, а, следовательно, и ИТФ-зависимой подсистемы, носит градуированный, а не бинарный характер.
Ca2+ активность в астроцитарной сети
До настоящего момента рассматривалась Ca2+ сигнализация на уровне отдельных событий, но интерес представляет также и то, как ведет себя во времени общий уровень активности на масштабе сети (синцития) астроцитов. Мы проанализировали процент площади, охваченный Ca2+ активностью, количество фрагментов отдельных событий и размеры этих фрагментов, видимых в каждом кадре (рис. 5А). Уровень спонтанной Ca2+ активности флуктуировал во времени: менялось как количество отдельных событий, так и суммарная активная площадь. При этом пики увеличения суммарной активной площади не коррелировали с увеличением количества мелких событий; но хорошо коррелировали со средним размером одиночных событий в каждом кадре (рис. 5А–В).
Рис. 5.
Зависимость сетевого уровня активности от времени. А. Максимальное и медианное значение площади, занимаемой одиночным событием, видимым в данном кадре. Б. Суммарное число активных пикселей в поле зрения. В. Число отдельных событий, наблюдаемых в каждом кадре. Г. Диаграммы рассеяния для покадровых значений максимальной и медианной площади одиночного события в зависимости от суммарного числа активных пикселей. Д. Диаграмма разброса для покадровых значений количества видимых отдельных событий в зависимости от суммарного числа активных пикселей. В панелях Г и Д прямые линии – линейная регрессия, указан коэффициент детерминации R2.
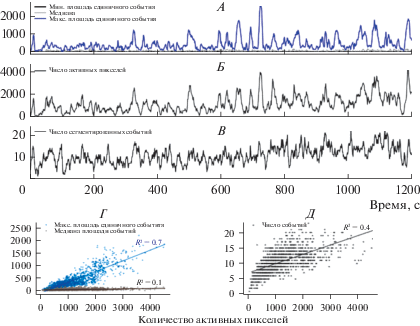
Таким образом, именно отдельные крупные события, охватывающие целые клеточные домены, ответственны за увеличение суммарной активной области, тогда как в целом не происходит сдвига распределения в сторону увеличения доли крупных событий, на что указывает отсутствие увеличения медианного уровня размеров видимых событий. Действительно, наблюдается явная корреляция между суммарным числом активных пикселей в каждом кадре и максимальной площадью отдельного видимого события (R2 = 0.7), но не для медианного уровня площадей (R2 = 0.1), в то же время корреляция между суммарным числом активных пикселей и числом отдельных событий в кадре много слабее (R2 = 0.4) (рис. 5Г, Д).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В данной работе представлен уникальный набор методов детектирования и анализа Ca2+ активности астроцитов, разработанный нашим коллективом. Рассмотрены этапы от инъецирования вирусного конструкта, кодирующего Ca2+ сенсор, до интерпретации наблюдаемой активности.
Для пространственно-разрешенного описания Ca2+ сигнализации критически важно, чтобы образец оставался неподвижен относительно поля зрения микроскопа. Поэтому подробно описан оригинальный способ коррекции артефактов движения образца в поле зрения, в котором используются современные методы понижения размерности данных, кластерный анализ и эффективные методы совмещения изображений. Предлагаемый подход является модульным, на разных этапах можно использовать алгоритмы, оптимальные для конкретного набора данных. Так, на этапе кластеризации можно использовать различные объединяющие или разделяющие алгоритмы; на этапе совмещения изображений также можно использовать любые доступные алгоритмы, хотя для данных на срезах гиппокампа, как правило, достаточно использовать наиболее простой метод коррекции сдвига кадра как единого целого.
Используемый нами метод детектирования значимых отклонений флуоресценции (ΔF) основан на оконном подходе и операциях в пространстве ГК или, что эквивалентно, в пространстве сингулярного разложения. Следует отметить, что сингулярное разложение – один из наиболее простых вариантов факторизации матриц, однако он и один из самых удобных вариантов: для этого разложения есть эффективные алгоритмы, оно гарантированно существует и однозначно для любой прямоугольной матрицы. При разработке описанного подхода мы делали попытки использовать и другие варианты факторизации матриц, например, неотрицательное разложение, на котором базируется недавно опубликованный популярный алгоритм для обработки нейрональной Ca2+ активности [17], однако именно сингулярное разложение оказалось оптимальным выбором, учитывая скорость и качество обработки сигнала. Обработка каждого окошка производится независимо, что позволяет использовать параллельные вычисления.
Одним из полезных для нас свойств сингулярного разложения является его способность концентрировать полезный сигнал в первых нескольких компонентах. Здесь мы исходим из предположения, что флуктуации флуоресценции, отражающие реальные Ca2+ сигналы, в отличие от шума должны быть скоррелированы хотя бы на небольших расстояниях. Несмотря на то, что сингулярное разложение позволяет найти лишь линейное приближение для наблюдаемой динамики, использование небольших перекрывающихся окошек позволяет выявлять более сложные взаимоотношения сигналов на более крупных пространственных масштабах. Предлагаемый нами метод позволяет выделить на фоне шума даже довольно слабые сигналы, если они локально скоррелированы.
Для анализа Ca2+ активности в нейронах недавно предложен набор методов CaIMAn [17, 18], однако прямое сравнение эффективности этого метода и предлагаемого в настоящей работе невозможно, поскольку данный метод ориентирован на поиск стационарных независимых источников сигнала и чрезмерно сегментирует исследуемое поле зрения. Предлагаемый же подход ориентирован на выделение отдельных пространственно-временных событий Ca2+ сигнализации.
Анализ событий Ca2+ сигнализации подтвердил ранее полученные результаты о том, что размеры и длительности отдельных событий имеют распределения c тяжелым хвостом без явно выраженных характерных значений, и что точки инициации Ca2+ событий лежат на периферии пространственного домена астроцита [7, 13]. Отслеживание областей с нарастанием и затуханием уровня флуоресценции позволило нам наблюдать развитие Ca2+ событий во времени. Локальные кинетики нарастания и затухания флуоресценции коррелировали с морфологией астроцита: наиболее быстрые изменения в обоих направлениях происходили в соме и крупных отростках, там же наблюдались и наибольшие по амплитуде сигналы ΔF/F0. По-видимому, именно морфология и определяемые ею механизмы лежат в основе наблюдаемых корреляций. Ранее мы моделировали взаимосвязь морфологии астроцита и паттернов активности, которые он способен производить [13, 19]. В дальнейших теоретических работах будет важно проверить, воспроизводятся ли эти результаты в разрабатываемых нами распределенных моделях, а также проверить гипотезу о том, что более быстрая кинетика и высокая амплитуда Ca2+ сигнализации в соме и крупных отростках объясняется более высоким вкладом ИТФ-зависимого выхода Ca2+ из ЭПР в этих областях.
Нами показано, что уровень Ca2+ активности на масштабе ансамблей клеток является нестационарным и флуктуирует в широких пределах. При этом всплески активности, которые выражаются в резком увеличении суммарной площади, охваченной на данный момент Ca2+ сигнализацией, объясняются, прежде всего, крупными одиночными событиями, распространяющимися на всю клетку. Несмотря на наличие таких крупных событий, непосредственного и явного “перетекания” активности из домена одного астроцита в домен другого астроцита не наблюдалось, хотя нельзя исключить, что такие процессы просто не попали в фокальную плоскость исследованного набора данных. Таким образом, требуется дальнейшая работа по выявлению паттернов активации связанных между собой “суперсобытий” в соседних астроцитах, равно как и по поиску воздействий, которые бы привели к формированию мультиклеточных Ca2+ волн в астроцитах гиппокампа.
Впервые коллективные Ca2+ сигналы в астроцитах в виде распространяющихся волн наблюдали в культурах клеток около 30 лет назад [20]. Исходя из анализа распределений площадей проекций и длительностей отдельных Ca2+ событий в культурах астроцитов, которые носили степенной характер, было сделано предположение, что Ca2+ активность астроцитов может находиться в состоянии самоорганизованной критичности [21]. Спонтанные Ca2+ волны в астроглии in vivo впервые наблюдались в мозжечке [22], где они имели уже стереотипные пространственные характеристики и не были связаны с активностью нейронов, тогда как более глобальные Ca2+ “вспышки” коррелировали с двигательной активностью животного [23]. Позже была установлена связь между частотой возникновения спонтанных радиально распространяющихся Ca2+ волн в бергмановской глии мозжечка и возрастом животного, а также уровнем парциального давления кислорода в ткани [24], были описаны характерные пространственно-временные паттерны таких волн, свидетельствующие о более сложном, чем простая диффузия сигнальных молекул после точечного выброса, механизме их возникновения и распространения [25]. Повышенный уровень спонтанной Ca2+ сигнализации в астроцитах наблюдался также у пожилых мышей в периинфарктной области после инсульта [26].
Более подробный анализ распределений размеров и длительностей астроцитарных Ca2+ событий был проведен на культурах и переживающих срезах гиппокампа [7, 8]. Было показано, что в пределах нескольких порядков сохраняется степенная зависимость частоты встречаемости события от его размера, что может указывать на поведение системы в критическом режиме, что согласуется с более ранними работами на астроцитах в культуре и представлении о Ca2+ активности как о поддерживаемых шумом волновых паттернах в подпороговых системах [21].
Фокус современных исследований астроцитарной Ca2+ активности направлен прежде всего на механизмы формирования сигналов в различных субклеточных структурах, ее интеграцию на клеточном и сетевом уровнях, а также Ca2+-зависимые эффекты на уровне синаптической пластичности, синхронизации нейрональных сетей и регуляции локального кровотока. Если повышение уровня Ca2+ в отдельном отростке астроцита через модуляцию состояния самой клетки или секрецию сигнальных молекул приведет к изменению свойств синапсов, расположенных в “зоне влияния” данного отростка и его дочерних ветвей, это отразится в изменении нейронной сети, определяемом пространственным расположением в большей степени, чем коннектомом. На основании данных наблюдений была высказана гипотеза “управляющего шаблона” [27]. Суть этой гипотезы заключается в том, что нейронная сеть в головном мозге находится в активной среде, создаваемой внесинаптическими взаимодействиями, которые вовлекают астроцитарную сеть [8]. Эти взаимодействия могут менять состояние нейронной сети, формируя своего рода виртуальные сети на базе физической сети нейронов. Таким образом, информационная емкость головного мозга существенно повышается.
Список литературы
Verkhratsky A., Nedergaard M. Physiology of Astroglia. Physiol. Rev. 98(1): 239–389. 2018.
Bushong E.A., Martone M.E., Jones Y.Z., Ellisman M.H. Protoplasmic astrocytes in CA1 stratum radiatum occupy separate anatomical domains. J. Neurosci. 22(1): 183–192. 2002.
Gavrilov N., Golyagina I., Brazhe A., Scimemi A., Turlapov V., Semyanov A. Astrocytic Coverage of Dendritic Spines, Dendritic Shafts, and Axonal Boutons in Hippocampal Neuropil. Front. Cell. Neurosci. 12(248). 2018.
Giaume C., Koulakoff A., Roux L., Holcman D., Rouach N. Astroglial networks: A step further in neuroglial and gliovascular interactions. Nat. Rev. Neurosci. 11: 87. 2010.
Plata A., Lebedeva A., Denisov P., Nosova O., Postnikova T.Y., Pimashkin A., Brazhe A., Zaitsev A.V., Rusakov D.A., Semyanov A. Astrocytic Atrophy Following Status Epilepticus Parallels Reduced Ca2+ Activity and Impaired Synaptic Plasticity in the Rat Hippocampus. Front. Mol. Neurosci. 11(215). 2018.
Zorec R., Araque A., Carmignoto G., Haydon P.G., Verkhratsky A., Parpura V. Astroglial excitability and gliotransmission: An appraisal of Ca2+ as a signalling route. ASN Neuro. 4(2). 2012.
Wu Y.-W., Tang X., Arizono M., Bannai H., Shih P.-Y., Dembitskaya Y., Kazantsev V., Tanaka M., Itohara S., Mikoshiba K., Semyanov A. Spatiotemporal calcium dynamics in single astrocytes and its modulation by neuronal activity. Cell Calcium. 55(2): 119–129. 2014.
Semyanov A. Spatiotemporal pattern of calcium activity in astrocytic network. Cell Calcium. 78: 15–25. 2019.
Ye L., Haroon M. A., Salinas A., Paukert M. Comparison of GCaMP3 and GCaMP6f for studying astrocyte Ca2+ dynamics in the awake mouse brain. PloS One. 12(7): e0181113–e0181113. 2017.
Nakai J., Ohkura M., Imoto K. A high signal-to-noise Ca2+ probe composed of a single green fluorescent protein. Nat. Biotechnol. 19(2): 137–141. 2001.
Tong X., Shigetomi E., Looger L.L., Khakh B.S. Genetically encoded calcium indicators and astrocyte calcium microdomains. Neuroscientist. 19(3): 274–291. 2013.
Chen T.-W., Wardill T.J., Sun Y., Pulver S.R., Renninger S.L., Baohan A., Schreiter E.R., Kerr R.A., Orger M.B., Jayaraman V., Looger L.L., Svoboda K., Kim D.S. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499: 295. 2013.
Wu Y.-W., Gordleeva S., Tang X., Shih P.-Y., Dembitskaya Y., Semyanov A. Morphological profile determines the frequency of spontaneous calcium events in astrocytic processes. Glia. 67(2): 246–262. 2019.
Paxinos G., Watson C. The rat brain in stereotaxic coordinates. 6th ed. Amsterdam; Boston. Acad. Press/Elsevier. 2007.
Gavish M., Donoho D. L. The Optimal Hard Threshold for Singular Values is 4/sqrt (3). IEEE Transact. Informat. Theory. 60(8): 5040–5053. 2014.
Patrushev I., Gavrilov N., Turlapov V., Semyanov A. Subcellular location of astrocytic calcium stores favors extrasynaptic neuron-astrocyte communication. Cell Calcium. 54(5): 343–349. 2013.
Pnevmatikakis Eftychios A., Soudry D., Gao Y., Machado T.A., Merel J., Pfau D., Reardon T., Mu Y., Lacefield C., Yang W., Ahrens M., Bruno R., Jessell T.M., Peterka Darcy S., Yuste R., Paninski L. Simultaneous Denoising, Deconvolution, and Demixing of Calcium Imaging Data. Neuron. 89(2): 285–299. 2016.
Giovannucci A., Friedrich J., Gunn P., Kalfon J., Brown B.L., Koay S.A., Taxidis J., Najafi F., Gauthier J.L., Zhou P., Khakh B.S., Tank D.W., Chklovskii D.B., Pnevmatikakis E.A. CaImAn an open source tool for scalable calcium imaging data analysis. eLife. 8: e38173. 2019.
Brazhe A.R., Postnov D.E., Sosnovtseva O. Astrocyte calcium signaling: Interplay between structural and dynamical patterns. Chaos: An Interdisciplinary Journal of Nonlinear Science. 28(10): 106320. 2018.
Cornell-Bell A., Finkbeiner S., Cooper M., Smith S. Glutamate induces calcium waves in cultured astrocytes: Long-range glial signaling. Science. 247(4941): 470–473. 1990.
Jung P., Cornell-Bell A., Madden K.S., Moss F. Noise-induced spiral waves in astrocyte syncytia show evidence of self-organized criticality. J Neurophysiol. 79(2): 1098–101. 1998.
Hoogland T.M., Kuhn B., Göbel W., Huang W., Nakai J., Helmchen F., Flint J., Wang S.S.-H. Radially expanding transglial calcium waves in the intact cerebellum. Proc. Nat. Acad. Sci. U. S. A. 106(9): 3496–3501. 2009.
Nimmerjahn A., Mukamel E.A., Schnitzer M.J. Motor Behavior Activates Bergmann Glial Networks. Neuron. 62(3): 400–412. 2009.
Mathiesen C., Brazhe A., Thomsen K., Lauritzen M. Spontaneous Calcium Waves in Bergman Glia Increase with Age and Hypoxia and may Reduce Tissue Oxygen. J. Cereb. Blood Flow Metabolism. 33(2): 161–169. 2013.
Brazhe A., Mathiesen C., Lauritzen M. Multiscale vision model highlights spontaneous glial calcium waves recorded by 2-photon imaging in brain tissue. NeuroImage. 68: 192–202. 2013.
Fordsmann J.C., Murmu R.P., Cai C., Brazhe A., Thomsen K.J., Zambach S.A., Lønstrup M., Lind B.L., Lauritzen M. Spontaneous astrocytic Ca2+ activity abounds in electrically suppressed ischemic penumbra of aged mice. Glia. 67(1): 37–52. 2019.
Semyanov A. Can diffuse extrasynaptic signaling form a guiding template? Neurochem. Internat. 52(1–2): 31–33. 2008.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


