Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 11, стр. 1452-1462
Фармакологическая характеристика пептидных лигандов калиевых каналов MeKTx13-2 и MeKTx13-3 из яда скорпиона Mesobuthus eupeus
А. И. Кузьменков 1, С. Пеньёр 2, Я. Титгат 2, А. А. Василевский 1, *
1 Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН
Москва, Россия
2 Лёвенский университет
Лёвен, Бельгия
* E-mail: avas@ibch.ru
Поступила в редакцию 13.08.2019
После доработки 04.09.2019
Принята к публикации 04.09.2019
Аннотация
Токсины скорпионов, блокирующие калиевые каналы, в настоящее время служат незаменимыми молекулярными инструментами исследований в нейробиологии. При этом наблюдается острая нехватка соединений, селективно воздействующих на определенные изоформы каналов. Ранее из яда Среднеазиатского скорпиона Mesobuthus eupeus мы выделили целый ряд токсинов, воздействующих на потенциал-чувствительные калиевые каналы. Далее мы изучили активность двух сходных токсинов M. eupeus, получивших названия MeKTx13-2 и MeKTx13-3, на панели калиевых каналов и обнаружили, что они характеризуются селективным действием в отношении изоформы Kv1.1, экспрессия которой характерна для центральной нервной системы млекопитающих. Мы полагаем, что эти результаты позволят получить производные токсинов с повышенной селективностью к Kv1.1, которые будут востребованы в исследованиях нервной системы.
Природные токсины, выделяемые из ядовитых животных, давно зарекомендовали себя как эффективные молекулярные исследовательские инструменты, используемые в различных областях физиологии, биохимии и нейробиологии. Токсины обладают значительным потенциалом в качестве лекарственных препаратов нового поколения и диагностических инструментов [1, 2]. Модифицированные изотопными и флуоресцентными метками производные токсинов были успешно применены в десятках исследований по идентификации и выделению новых рецепторов, клеточной и тканевой локализации ионных каналов, а также для поиска новых лигандов [3]. Особая ценность природных токсинов состоит в их непревзойденной селективности и способности с высокой аффинностью взаимодействовать с определенной молекулярной мишенью [4].
Одним из наиболее традиционных источников токсинов как молекулярных инструментов выступает яд скорпионов, который может содержать десятки и даже сотни индивидуальных соединений. По способности воздействовать на определенную молекулярную мишень токсины скорпионов делятся на несколько групп, главными из которых являются лиганды натриевых (NaTx) и калиевых каналов (KTx) [5]. В большинстве случаев эти токсины представляют собой полипептиды длиной от 20 до 75 аминокислотных остатков с 2–4 внутримолекулярными дисульфидными связями [6, 7]. В ходе длительной эволюции сформировалось характерное разнообразие структуры компонентов яда скорпионов, а также проявляемых ими физиологических эффектов. Наибольшее число известных пептидных молекул из яда скорпионов имеют укладку типа CSα/β (цистеин-стабилизированные α-спираль и β-слой), а их действие сводится к активации потенциал-чувствительных натриевых (Nav) и ингибированию потенциал-чувствительных калиевых каналов (Kv) [7–9].
Согласно базе данных Kalium (https://kaliumdb.org/), в яде различных скорпионов было идентифицировано порядка 200 полипептидных лигандов калиевых каналов [10, 11]. Около половины этих молекул либо не получили никакой физиологической характеристики, либо были протестированы лишь на одной изоформе каналов. Два токсина (MeKTx13-2 и MeKTx13-3) были выделены нами ранее из яда пестрого скорпиона Mesobuthus eupeus, а их физиологическая активность была продемонстрирована лишь на одной изоформе каналов [12]. В данной работе мы провели фармакологическое профилирование MeKTx13-2 и MeKTx13-3 на шести изоформах калиевых каналов млекопитающих (Kv1.1–1.6), а также установили значения концентрации полуингибирования (IC50) для обоих токсинов и каналов, на которых наблюдался выраженный эффект. В результате мы показали, что MeKTx13-2 и MeKTx13-3 являются селективными в отношении Kv1.1 – одной из наиболее распространенных и важных изоформ в нервной системе [13].
МЕТОДЫ ИССЛЕДОВАНИЯ
Эксклюзионная хроматография
Разделение яда проводили согласно методикам, опубликованным ранее [14]. Высушенный лиофильно образец яда скорпиона M. eupeus растворяли в 500 мкл элюирующего раствора, содержащего 0.1% (v/v) трифторуксусной кислоты (ТФУ) и 10% (v/v) ацетонитрила, и наносили на колонку TSK 2000SW (7.5 × 600 мм, 125 Å, 10 мкм; Tosoh Bioscience). Элюирующий раствор подавали на колонку со скоростью 0.5 мл/мин, предварительно дегазируя. Детекцию осуществляли по оптической плотности элюата при 210 нм с помощью детектора Waters 2489 и с регистрацией на компьютере с установленным программным комплексом МультиХром.
Обращенно-фазовая высокоэффективная жидкостная хроматография (ОФ-ВЭЖХ)
После эксклюзионной хроматографии дальнейшее фракционирование осуществлялось на аналитической колонке Vydac 218TP54 C18 (4.6 × 250 мм, 300 Å, 5 мкм; Separations Group) с использованием градиентного хроматографа Waters 1525. Хроматографию проводили в линейном градиенте концентрации ацетонитрила (от 0 до 60%, v/v) в присутствии 0.1% ТФУ в течение 60 мин со скоростью элюции 1 мл/мин. Второй раунд ОФ-ВЭЖХ проводили на той же колонке в линейном градиенте раствора, содержащего 20% (v/v) изопропанола, 30% ацетонитрила и 0.1% ТФУ, в течение 90 мин со скоростью элюции 1 мл/мин. Детекцию осуществляли по оптической плотности элюата при 210 и 280 нм с регистрацией на компьютере с установленной программой Breeze 2.0.
Масс-спектрометрия
Измерение молекулярных масс токсинов проводили с помощью метода матрично-активированной лазерной десорбции/ионизации (МАЛДИ) масс-спектрометрии на приборе Ultraflex TOF-TOF (Bruker Daltonik) с идентификацией положительных ионов в рефлекторном режиме, как описано в [15]. В качестве матрицы использовали 2,5-дигидроксибензойную кислоту или α-циано-4-гидроксикоричную кислоту. Для обработки результатов использовалось программное обеспечение Data Analysis 4.3 и Data Analysis Viewer 4.3 (Bruker).
Определение концентрации пептидов. УФ-спектрофотометрия
Для получения спектров поглощения веществ в УФ-области их высушивали лиофильно, после чего растворяли в 0.5 мл воды, полученной на установке Milli-Q (Millipore). В работе использовали спектрофотометр UV-1800 (Hitachi); длина оптического пути кюветы – 1 см, раствором сравнения служила вода. Концентрацию MeKTx13-2 и MeKTx13-3 определяли по спектру поглощения по формулам (1) и (2) соответственно:
где СA – концентрация (моль/л) пептидов, содержащих ароматические аминокислоты; A274.5, A257 и A320 – оптическая плотность раствора при 274.5, 257 и 320 нм; εY – молярный коэффициент поглощения тирозина при 274.5 нм (1340 M–1 cm–1), εF – молярный коэффициент поглощения фенилаланина при 257 нм (200 M–1 cm–1).Экспрессия генов, кодирующих Kv, в ооцитах Xenopus laevis
Все процедуры были выполнены в строгом соответствии с рекомендациями руководства ARRIVE по разработке, анализу и представлению научных исследований, выполненных на животных, и Европейской конвенцией по защите позвоночных животных, используемых для экспериментальных и других научных целей (Страсбург, 18.03.1986).
Экспрессию генов каналов и электрофизиологические исследования проводили согласно опубликованным протоколам [16]. Для экспрессии различных изоформ α-субъединицы Kv каналов (rKv1.1, rKv1.2, hKv1.3, rKv1.4, rKv1.5 и rKv1.6, где префикс r обозначает канал крысы, h – канал человека) в ооцитах шпорцевой лягушки Xenopus laevis соответствующие гены были клонированы в составе вектора pSP64T. Далее вектор линеаризовали по сайтам рестрикции EcoRI (rKv1.1), SphI (rKv1.2), NotI (hKv1.3 и rKvv1.4), SalI (rKv1.5), NdeI (rKv1.6). Кэпированные молекулы мРНК синтезировались с помощью системы для транскрипции mMESSAGE mMACHINE T7 (Thermo Fisher Scientific). Ооциты на V–VI стадии развития изымались из яичников предварительно анестезированной самки лягушки. 50 нл раствора РНК, кодирующей α-субъединицы Kv каналов, с концентрацией 1 нг/нл вводили в ооциты с помощью микроинжектора Nanoject II (Drummond), после чего клетки инкубировали 2–4 дня в растворе для инкубации ND96 (мМ): 96 NaCl, 2 KCl, 1.8 CaCl2, 2 MgCl2, 5 HEPES, pH 7.4 с добавлением гентамицина (50 мг/л).
Электрофизиологические исследования
Эксперименты проводили методом двухэлектродной фиксации потенциала на электрофизиологической установке Geneclamp 500 (Molecular Devices). Все измерения проводились при комнатной температуре (18–22°C). Регистрация токов через мембрану ооцитов, экспрессирющих ту или иную изоформу Kv, проводилась спустя 1–4 дня после инъекции мРНК. В качестве раствора, в который помещались ооциты во время записи токов, использовали ND96. Электроды были заполнены 3 М раствором KCl, их сопротивление составляло 0.7–1.5 МОм. Вычитание тока утечки было выполнено с использованием протокола –P/4. Потенциал покоя был установлен на –90 мВ. Ионные токи через Kv (IK) вызывались деполяризацией в течение 500 мс до 0 мВ с последующим импульсом длительностью 500 мс до –50 мВ. Чтобы исследовать вольтамперную характеристику, токи вызывали последовательной деполяризацией мембраны от потенциала покоя (–90 мВ) с шагом 10 мВ. Зависимость значений IK от напряжения анализировалась с помощью уравнения Больцмана:
Чтобы оценить концентрационную зависимость ингибирующего эффекта, вызванного токсином, была построена кривая с помощью уравнения Хилла:
Сравнение двух выборочных средних было выполнено с использованием парного критерия Стьюдента. Все данные получены в как минимум трех независимых измерениях (n ≥ 3) и представлены как среднее ± стандартная ошибка среднего. Обработка полученных результатов проводилась с использованием программы Ori-gin (OriginLab Corporation).
Молекулярное моделирование
Молекулярная модель MeKTx13-2 была построена с помощью программы Modeller 9.14 (оболочка UCSF Chimera 1.10.1) [17, 18], в качестве шаблона использовалась пространственная структура токсина OSK1 (PDB ID: 1SCO) из скорпиона Ortho-chirus scrobiculosus [19]. Визуализация пространственных структур осуществлялась посредством программы PyMOL 1.7.4 (Schrödinger).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Идентификация и выделение MeKTx13-2 и MeKTx13-3
Выделение пептидных лигандов калиевых каналов из яда скорпиона M. eupeus проводилось согласно стандартному протоколу с использованием многостадийной хроматографии. Подробное описание стратегии разделения яда и идентификации токсинов приведено в предыдущих работах [12, 20]. На первом этапе цельный яд был разделен на три грубые фракции с помощью эксклюзионной хроматографии (I–III, рис. 1А). Искомые компоненты содержались во фракции II, поэтому она была отобрана для дальнейшего разделения. Для выделения активных пептидов фракция II была подвержена разделению с помощью ОФ-ВЭЖХ на субфракции (рис. 1Б). Искомые MeKTx13-2 и MeKTx13-3 содержались в субфракциях II-3 и II-5 соответственно.
Рис. 1.
Выделение токсинов MeKTx13-2 и MeKTx13-3 из яда скорпиона M. eupeus. A – профиль эксклюзионной хроматографии 1 мг сухого яда на колонке TSK 2000SW. Отобранные фракции отмечены римскими цифрами I–III. Фракция II, содержащая искомые вещества, была отобрана для дальнейшего анализа. Б – профиль разделения фракции II с помощью ОФ-ВЭЖХ на колонке Vydac C18 в линейном градиенте концентрации ацетонитрила (0–60%). На профиле показаны субфракции, содержащие M-eKTx13-2 (II-3) и MeKTx13-3 (II-5). В, Г – профили финального раунда очистки MeKTx13-2 и Me-KTx13-3 соответственно на колонке Vydac C18, в качестве подвижной фазы использовался раствор 20%-ного изопропанола и 30%-ного ацетонитрила.
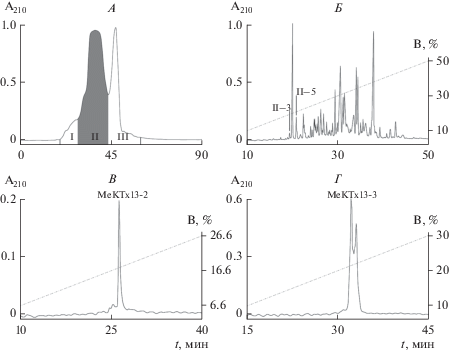
Второй раунд ОФ-ВЭЖХ позволил выделить активные компоненты в индивидуальном виде. Cубфракция II-3 содержала единственный активный компонент – пептид MeKTx13-2 (рис. 1В). В субфракции II-5 находились два пептидных токсина, один из которых искомый MeKTx13-3 (рис. 1Г). Гомогенность полученных соединений была подтверждена масс-спектрометрически. Концентрация пептидов была рассчитана с помощью УФ-спектроскопии, из 1 мг цельного яда мы получили 0.25 нмоль MeKTx13-2 и 0.85 нмоль MeKTx13-3.
Аминокислотные последовательности токсинов, а также посттрансляционные модификации были установлены на предыдущем этапе работы. Оба пептида содержат по 37 аминокислотных остатков, C-концевой остаток амидирован (рис. 2). Характерное расположение шести остатков цистеина позволяет предполагать каноничное замыкание внутримолекулярных дисульфидных связей, способствующих пространственной укладке типа CSα/β. MeKTx13-2 и MeKTx13-3 были классифицированы как α-KTx3.18 и α-KTx3.19 соответственно согласно номенклатуре Титгата–Поссани и базе данных полипептидных лигандов калиевых каналов Kalium (https://kaliumdb.org/) [10, 11, 21]. В базе данных UniProt (https://www.uniprot.org/) [22] токсины получили идентификационные номера C0HJQ4 и C0HJQ6 соответственно. Токсин MeKTx13-3 оказался идентичен по аминокислотной последовательности токсину BmKTX (α-KTx3.6, UniProt ID: Q9NII7) из родственного скорпиона Mesobuthus martensii [23].
Рис. 2.
Первичная структура пептидов OSK1, MeKTx13-2 и MeKTx13-3. Указаны классификаторы в базе данных Kalium, идентификационные номера в базе данных UniProt, приведены полные аминокислотные последовательности, показано предполагаемое расположение цистинов, а также отмечены измеренные молекулярные массы (Мм) токсинов. Серым цветом отмечены аминокислотные остатки -MeKTx13-2 и MeKTx13-3, отличающиеся от OSK1, пространственная структура которого использовалась для молекулярного моделирования.

Электрофизиологическая характеристика MeKTx13-2 и MeKTx13-3
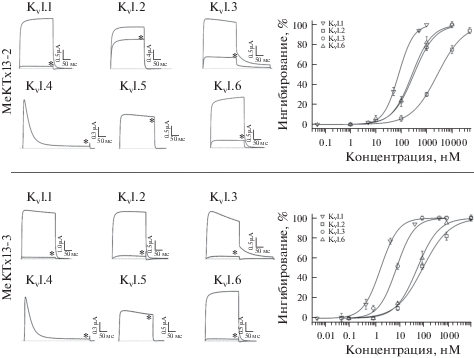
Характеристика активности MeKTx13-2 и MeKTx13-3 проводилась посредством электрофизиологического исследования на ряде изоформ Kv методом двухэлектродной фиксации потенциала. На рис. 3 приведены записи токов через гомотетрамерные калиевые каналы различных изоформ до и после добавления токсинов в концентрации 1 мкМ. Оба пептида частично или полностью ингибировали все каналы, кроме Kv1.4 и Kv1.5. Для всех изоформ Kv, на которых наблюдался эффект, были построены кривые концентрационной зависимости ингибирования (рис. 3, справа) и рассчитаны средние значения концентрации полуингибирования (IC50, табл. 1).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Место MeKTx13-2 и MeKTx13-3 среди блокаторов калиевых каналов из яда скорпионов
Как уже было отмечено выше, в настоящее время известно порядка 200 токсинов скорпионов, относящихся к лигандам калиевых каналов (KTx). Практически все эти полипептиды реализуют свой блокирующий эффект путем физического “закупоривания” поры ионного канала, подобно бутылочной пробке. Согласно базе данных Kalium, базирующейся на улучшенной классификации Титгата–Поссани, выделяют семь семейств KTx: α-, β-, γ-, δ-, ε-, κ- и λ-KTx. В основе классификации, как правило, лежат структурные особенности токсинов, однако также могут учитываться их функциональные характеристики [7, 10, 11, 21].
MeKTx13-2 (α-KTx3.18) и MeKTx13-3 (α-KTx3.19) относятся к наиболее представленному семейству α-KTx и к подсемейству α-KTx3, в которое входят такие хорошо изученные токсины, как калиотоксин-1 (KTX-1, α-KTx3.1, UniProt ID: P24662) из мавританского толстохвостого скорпиона Androctonus mauritanicus, агитоксин-2 (AgTx-2, α-KTx3.2, P46111) из палестинского желтого скорпиона Leiurus quinquestriatus hebraeus и OSK1 (α-KTx3.7, P55896) из Среднеазиатского черного скорпиона Orthochirus scrobiculosus [24–26]. Представители данного подсемейства содержат 37 или 38 аминокислотных остатков, шесть из которых – остатки цистеина, образующие три внутримолекулярные дисульфидные связи с расположением: C1–C4, C2–C5 и С3–С6 (рис. 2). Некоторые из них, включая MeKTx13-2 и MeKTx13-3, имеют распространенную для токсинов скорпионов посттрансляционную модификацию – С-концевое амидирование [7].
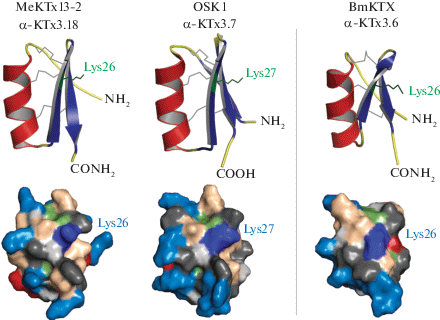
С точки зрения пространственной структуры MeKTx13-2 и MeKTx13-3 – классические представители пептидов, формирующих укладку типа CSα/β (цистеин-стабилизированные α-спираль и β-слой). MeKTx13-3, как отмечалось выше, идентичен токсину BmKTX, для которого трехмерная структура была изучена ранее (PDB ID: 1BKT) [27]. Пространственная структура MeKTx13-2 может быть предсказана с достаточно высокой точностью с помощью гомологичного моделирования (рис. 4), поскольку его аминокислотная последовательность сходна на ~70% с OSK1, структура которого известна (PDB ID: 1SCO) [19]. В случае консервативности пространственной укладки и наличия разрешенной структуры близкого гомолога использование метода молекулярного моделирования кажется весьма эффективным и рациональным.
Рис. 4.
Модель пространственной структуры MeKTx13-2 и структура OSK1, использованного в качестве шаблона, а также структура MeKTx13-3 (BmKTX). Сверху представлены ленточные модели, где элементы вторичной структуры окрашены: α-спирали – красным, β-тяжи – синим, петлевые участки – желтым. Серым обозначены дисульфидные связи. Зеленым выделен остаток лизина, который является ключевым во взаимодействии KTx c порой калиевых каналов. Снизу показаны молекулярные поверхности, где темно-серым цветом обозначены гидрофобные аминокислотные остатки, светло-серым – остатки глицина, зеленым – цистеина, бежевым – гидрофильные нейтральные аминокислотные остатки, красным – отрицательно заряженные, голубым – положительно заряженные остатки. Ключевой остаток лизина обозначен синим цветом.
MeKTx13-2 и MeKTx13-3 – селективные лиганды Kv1.1
Для обоих токсинов была обнаружена активность на Kv1.1, 1.2, 1.3 и 1.6, в то время как на Kv1.4 и 1.5 эффект отсутствовал (табл. 1, рис. 3). В настоящее время не было найдено ни одного пептидного блокатора калиевых каналов из яда скорпионов, который бы проявлял активность по отношению к Kv1.4 или 1.5 [10, 11]. Анализ профиля селективности MeKTx13-2 и MeKTx13-3 показывает, что эти пептиды проявляют специфичность по отношению к изоформе Kv1.1. Стоит отметить, что BmKTX, идентичный MeKTx13-3, ранее исследовался на панели Kv [28], однако только в концентрации 2 мкМ, что не позволило изучить его селективность.
Согласно данным литературы ранее был описан всего один токсин из яда скорпиона, который также проявлял селективность к Kv1.1, а именно хонготоксин-1 (HgTX1, α-KTx2.5, P59847) из Центральноамериканского скорпиона Centruroides limbatus [29]. В яде других животных Kv1.1-селективные токсины, по-видимому, также встречаются крайне редко. Так, помимо скорпионов, лишь в яде двух морских анемон: Bunodosoma granuliferum и Anthopleura elegantissima – были идентифицированы полипептиды BgK (κ-actitoxin-Bgr1a, P29186) и APEKTx1 (κPI-actitoxin-Ael3a, P86862) соответственно, проявляющие селективность в отношении Kv1.1 [16, 30]. Последний токсин можно назвать несомненным лидером, поскольку для него активность была показана лишь на изоформу Kv1.1 (IC50 = 0.9 нМ) и не обнаружена для других изоформ Kv вплоть до концентрации 1 мкМ.
Для оценки специфичности токсинов по отношению к той или иной изоформе канала (в нашем случае Kv1.1) удобно использовать коэффициенты селективности: отношения значений IC50 (или Kd) для двух каналов (табл. 2) [31]. Данный параметр наглядно оценивает специфичность каждого токсина к Kv1.1. Наибольшие значения коэффициентов селективности ожидаемо имеет APEKTx1, однако MeKTx13-2 и MeKTx13-3 также показывают достаточно высокий результат. С точки зрения разработки новых лигандов Kv токсины скорпионов имеют приоритет, поскольку именно их структурно-функциональные особенности исследованы лучше всего, кроме того, известна пространственная структура комплекса токсина скорпиона и Kv [32]. Мы заключаем, что изученные нами токсины представляют собой удобный шаблон для дальнейшего рационального дизайна и получения селективных лигандов Kv1.1.
Таблица 2.
Пептидные токсины с наибольшей селективностью к Kv1.1. Для перечисленных токсинов показаны соотношения IC50 (или Kd) в отношении указанных пар каналов
| Токсин | Kv1.2/Kv1.1 | Kv1.3/Kv1.1 | Kv1.6/Kv1.1 |
|---|---|---|---|
| Скорпионы | |||
| MeKTx13-2 | 30 | 3 | 3 |
| MeKTx13-3 | 56 | 5 | 33 |
| HgTX1 | 5 | 3 | 194 |
| Морские анемоны | |||
| APEKTx1 | >1111 | >1111 | >1111 |
| BgK | 3 | 2 | – |
Список литературы
Norton R.S. Enhancing the therapeutic potential of peptide toxins. Expert Opin. Drug Discov. 12: 611–623. 2017.
Cohen-Inbar O., Zaaroor M. Glioblastoma multiforme targeted therapy: The Chlorotoxin story. J. Clin. Neurosci. 33: 52–58. 2016.
Kuzmenkov A.I., Vassilevski A.A. Labelled animal toxins as selective molecular markers of ion channels: Applications in neurobiology and beyond. Neurosci. Lett. 679: 15–23. 2018
King G.F. (ed.) Venoms to Drugs. 2015.
Housley D.M., Housley G.D., Liddell M.J., Jennings E.A. Scorpion toxin peptide action at the ion channel subunit level. Neuropharmacology. 127: 46–78. 2017.
Rodríguez de la Vega R.C., Possani L.D. Overview of scorpion toxins specific for Na+ channels and related peptides: Biodiversity, structure-function relationships and evolution. Toxicon. 46: 831–844. 2005.
Kuzmenkov A.I., Grishin E.V., Vassilevski A.A. Diversity of potassium channel ligands: Focus on scorpion toxins. Biochemistry (Mosc.). 80: 1764–1799. 2015.
Mouhat S., Jouirou B., Mosbah A., De Waard M., Sabatier J.-M. Diversity of folds in animal toxins acting on ion channels. Biochem. J. 378: 717–26. 2004.
Quintero-Hernández V., Jiménez-Vargas J.M., Gurrola G.B., Valdivia H.H., Possani L.D. Scorpion venom components that affect ion-channels function. Toxicon. 76: 328–342. 2013.
Kuzmenkov A.I., Krylov N.A., Chugunov A.O., Grishin E.V., Vassilevski A.A. Kalium: a database of potassium channel toxins from scorpion venom. Database (Oxford). 2016. pii: baw056.
Tabakmakher V.M., Krylov N.A., Kuzmenkov A.I., Efremov R.G., Vassilevski A.A. Kalium 2.0, a comprehensive database of polypeptide ligands of potassium channels. Sci. Data. 6: 73. 2019.
Kuzmenkov A.I., Vassilevski A.A., Kudryashova K.S., Nekrasova O.V., Peigneur S., Tytgat J., Feofanov A.V., Kirpichnikov M.P., Grishin E.V. Variability of potassium channel blockers in Mesobuthus eupeus scorpion venom with focus on Kv1.1: An integrated transcriptomic and proteomic study. J. Biol. Chem. 290: 12195–12209. 2015.
Jan L.Y., Jan Y.N. Voltage-gated potassium channels and the diversity of electrical signalling, J. Physiol. 590: 2591–2599. 2012.
Vassilevski A.A., Kozlov S.A., Egorov T.A., Grishin E.V. Purification and characterization of biologically active peptides from spider venoms. Methods Mol. Biol. 615: 87–100. 2010.
Kuzmenkov A.I., Sachkova M.Y., Kovalchuk S.I., Grishin E.V., Vassilevski A.A. Lachesana tarabaevi, an expert in membrane-active toxin. Biochem. J. 473: 2495–2506. 2016.
Peigneur S., Billen B., Derua R., Waelkens E., Debaveye S., Béress L., Tytgat J. A bifunctional sea anemone peptide with Kunitz type protease and potassium channel inhibiting properties. Biochem. Pharmacol. 82: 81–90. 2011.
Sali A., Blundell T.L. Comparative protein modelling by satisfaction of spatial restraints. J. Mol. Biol. 234: 779–815. 1993.
Pettersen E.F., Goddard T.D., Huang C.C., Couch G.S., Greenblatt D.M., Meng E.C., Ferrin T.E. UCSF Chimera–a visualization system for exploratory research and analysis. J. Comput. Chem. 25: 1605–1612. 2004.
Jaravine V.A., Nolde D.E., Reibarkh M.J., Korolkova Y.V., Kozlov S.A., Pluzhnikov K.A., Grishin E.V., Arseniev A.S. Three-dimensional structure of toxin OSK1 from Orthochirus scrobiculosus scorpion venom. Biochemistry. 36: 1223–1232. 1997.
Kuzmenkov A.I., Peigneur S., Chugunov A.O., Tabakmakher V.M., Efremov R.G., Tytgat J., Grishin E.V., Vassilevski A.A. C-Terminal residues in small potassium channel blockers OdK1 and OSK3 from scorpion venom fine-tune the selectivity. Biochim. Biophys. Acta - Proteins Proteomics. 1865: 465–472. 2017.
Tytgat J., Chandy K.G., Garcia M.L., Gutman G.A., Martin-Eauclaire M.F., van der Walt J.J., Possani L.D. A unified nomenclature for short-chain peptides isolated from scorpion venoms: alpha-KTx molecular subfamilies. Trends Pharmacol. Sci. 20: 444–447. 1999.
The UniProt Consortium. UniProt: A worldwide hub of protein knowledge. Nucleic Acids Res. 47: D506–D515. 2019
Romi-Lebrun R., Martin-Eauclaire M.F., Escoubas P., Wu F.Q., Lebrun B., Hisada M., Nakajima T. Characterization of four toxins from Buthus martensi scorpion venom, which act on apamin-sensitive Ca2+-activated K+ channels. Eur. J. Biochem. 245: 457–464. 1997.
Crest M., Jacquet G., Gola M., Zerrouk H., Benslimane A., Rochat H., Mansuelle P., Martin-Eauclaire M.F. Kaliotoxin, a novel peptidyl inhibitor of neuronal BK-type Ca(2+)-activated K+ channels characterized from Androctonus mauretanicus mauretanicus venom. J. Biol. Chem. 267: 1640–1647. 1992
Garcia M.L., Garcia-Calvo M., Hidalgo P., Lee A., MacKinnon R. Purification and characterization of three inhibitors of voltage-dependent K+ channels from Leiurus quinquestriatus var. hebraeus venom. Biochemistry. 33: 6834–6839. 1994.
Grishin E.V., Korolkova Y.V., Kozlov S.A., Lipkin A.V., Nosyreva E.D., Pluzhnikov K.A., Sukhanov S.V., Volkova T.M. Structure and function of the potassium channel inhibitor from black scorpion venom. Pure Appl. Chem. 68: 2105–2109. 1996.
Renisio J.G., Romi-Lebrun R., Blanc E., Bornet O., Nakajima T., Darbon H. Solution structure of BmKTX, a K+ blocker toxin from the Chinese scorpion Buthus Martensi. Proteins. 38: 70–78. 2000.
Gao B., Peigneur S., Tytgat J., Zhu S. A potent potassium channel blocker from Mesobuthus eupeus scorpion venom. Biochimie. 92: 1847–1853. 2010.
Koschak A., Bugianesi R.M., Mitterdorfer J., Kaczorowski G.J., Garcia M.L., Knaus H.G. Subunit composition of brain voltage-gated potassium channels determined by hongotoxin-1, a novel peptide derived from Centruroides limbatus venom. J. Biol. Chem. 273: 2639–2644. 1998.
Cotton J., Crest M., Bouet F., Alessandri N., Gola M., Forest E., Karlsson E., Castañeda O., Harvey A.L., Vita C., Ménez A. A potassium-channel toxin from the sea anemone Bunodosoma granulifera, an inhibitor for Kv1 channels. Revision of the amino acid sequence, disulfide-bridge assignment, chemical synthesis, and biological activity. Eur. J. Biochem. 244: 192–202. 1997.
Kuzmenkov A.I., Nekrasova O.V., Peigneur S., Tabakmakher V.M., Gigolaev A.M., Fradkov A.F., Kudryashova K.S., Chugunov A.O., Efremov R.G., Tytgat J., Feofanov A.V., Vassilevski A.A. KV1.2 channel-specific blocker from Mesobuthus eupeus scorpion venom: Structural basis of selectivity. Neuropharmacology. 143: 228–238. 2018.
Banerjee A., Lee A., Campbell E., Mackinnon R. Structure of a pore-blocking toxin in complex with a eukaryotic voltage-dependent K(+) channel. Elife. 2: e00594. 2013.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова