Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 12, стр. 1561-1570
Механизмы поддержания экспрессии медленного миозина в волокнах постуральной мышцы при стимуляции опорных афферентов на фоне гравитационной разгрузки
К. А. Шарло 1, *, И. Д. Львова 1, С. А. Тыганов 1, Б. С. Шенкман 1
1 Институт медико-биологических проблем РАН
Москва, Россия
* E-mail: lubimowa.cristina@yandex.ru
Поступила в редакцию 05.08.2019
После доработки 16.09.2019
Принята к публикации 17.09.2019
Аннотация
Цель работы состояла в исследовании роли опорной афферентации в поддержании функционирования сигнальных механизмов, обеспечивающих экспрессию генов, характерных для “медленного” окислительного типа волокон при функциональной разгрузке постуральной камбаловидной мышцы. Для анализа эффектов опоры применялась механическая опорная стимуляция. Самцы крыс Вистар были разделены на шесть групп по 8 животных в каждой: две группы виварного контроля (C), группы, подвергнутые разгрузке задних конечностей на протяжении 1 сут (1HS) и 3 сут (3HS), и группы разгрузки, сопровождавшейся опорной стимуляцией 1HS + МСО; 3HS + МСО. Животные из групп опорной стимуляции в течение 4-х ч в сутки на протяжении эксперимента получали опорную стимуляцию стоп по схеме, имитирующей нормальную ходьбу животного. В группе с опорной стимуляцией в сравнении с группой чистого вывешивания уже на первые сутки было предотвращено снижение экспрессии мРНК “медленной” изоформы ТЦМ I, а также мРНК гена myh7b, являющегося блокатором транскрипционных репрессоров генов “медленного” фенотипа скелетной мышцы. После третьих суток эксперимента экспрессия медленной изоформы ТЦМ и мРНК гена myh7b в группе с опорной стимуляцией достоверно превышала значения экспрессии в группе 3HS, экспрессия транскрипционного репрессора SOX6, достоверно повышенная в группе чистого вывешивания, в группе 3HS + МСО не отличалась от контроля. Таким образом, механическая стимуляция опорных зон стопы предотвращает инактивацию сигнального пути ТЦМ I/myh7b/SOX6 при гравитационной разгрузке, способствуя предотвращению трансформации миозинового фенотипа в “быструю” сторону.
Скелетная мышца состоит из волокон различных типов, расположенных мозаичным образом. Мышечные волокна медленного типа обладают высокой устойчивостью к утомлению при сравнительно небольшой максимальной силе и скорости сокращений. “Быстрые” мышечные волокна обладают высокой силой и скоростью сокращений наряду с быстрой утомляемостью. На протяжении последних лет было показано, что данные свойства мышечных волокон обусловлены преобладанием в волокне той или иной изоформы тяжелых цепей миозина (ТЦМ). В скелетной мышце млекопитающих существует четыре основных изоформы ТЦМ: “медленная” изоформа ТЦМ I(β) и три “быстрых” изоформы: IIa-, IId/x-, и IIb- [1]. Относительные уровни экспрессии различных ТЦМ в волокне определяются паттерном иннервации данного волокна. Постуральные мышцы, такие как камбаловидная мышца (m. soleus), содержат наибольшее число волокон медленного типа (типа I). Мотонейроны контролируют тип волокна путем генерирования нервных импульсов определенной частоты, определяющих характерный для данного типа волокон паттерн мышечной активности и уровень экспрессии миозиновых изоформ [1].
Экспрессия мРНК медленной изоформы ТЦМ также является одним из регуляторных сигналов, запускающим сигнальные пути, в том числе, регулирующие ее же экспрессию по механизму положительной обратной связи. Важнейшую роль в данном процессе играют микро-РНК. Микро-РНК представляют собой семейство некодирующих РНК длиной около 23 пар нуклеотидов, способных регулировать экспрессию генов на посттрансляционном уровне за счет связывания с 3'-нетранслируемой областью генов и ингибирования их транскрипции [2], дестабилизации мРНК целевого гена [3], или же за счет ингибирования трансляции мРНК [4]. В процессе экспрессии мРНК гена myh7, кодирующего медленную изоформу ТЦМ, также происходит экспрессия микро-РНК 208b, закодированной в одном из интронов этого гена. Микро-РНК 208b способна индуцировать экспрессию гена myh7b, который представляет собой древний ген одной из миозиновых изоформ, у человека и у крысы практически не присутствующий в мышечном волокне постуральных мышц на уровне белка и играющий в мышечных волокнах камбаловидной мышцы исключительно регуляторную роль. мРНК гена myh7b кодирует регуляторную микро-РНК 499 [5]. Микро-РНК 499 и микро-РНК 208b связываются с 3'-нетранслируемой областью генов транскрипционных репрессоров SOX6, PuRA и PuRβ, блокирующих транскрипционную активность гена myh7, и блокируют их экспрессию [6–8]. Это приводит к активации транскрипции генов, с которыми связываются данные репрессоры. Оверэкспрессия микро-РНК 499 в миотубах С2С12 приводит к усилению экспрессии медленной изоформы тропонина tnni1, миоглобина и PGC1α, таким образом, данная микро-РНК играет важную роль в реализации окислительного фенотипа мышечного волокна [8]. Особый интерес представляет способность микро-РНК 499 активировать экспрессию PGC1α, так как данный транскрипционный коактиватор представляет собой один из основных регуляторов митохондриального биогенеза в скелетной мышце, и уровень его экспрессии отражается на окислительных способностях мышцы [9].
Известно, что гравитационная разгрузка в условиях космического полета и моделирование микрогравитации в земных условиях приводят к трансформации мышечных волокон медленного типа в “быстрые” волокна и к соответствующему изменению относительных уровней экспрессии различных ТЦМ [10]. Микро-РНК –зависимые механизмы регуляции миозинового фенотипа также подвергаются изменениям в процессе вывешивания. Показано, что после 28 сут вывешивания крыс в камбаловидной мышце наблюдается снижение экспрессии микроРНК miR499 и miR208b, а также возрастает экспрессия промоторных репрессоров SOX6 и PuRβ [6]. Исследования экспрессии пре-микроРНК-499 myh7b и микро-РНК-зависимых сигнальных механизмов на более ранних сроках вывешивания не проводились; более того, до сих пор остается неизвестным, возможно ли восстановить функционирование микро-РНК-зависимых сигнальных путей при вывешивании, восстановив нормальный уровень экспрессии ТЦМ I.
При моделировании гравитационной разгрузки в земных условиях (модели “сухой” иммерсии и вывешивания) было обнаружено практически полное отсутствие нервно-мышечной активности на основании проведенных электромиографических измерений в камбаловидных мышцах [11]. Поддержание нормального уровня нервно-мышечной активности мышц задних конечностей зависит от активации подошвенных рецепторов сенсорных зон стопы и передачи ими сигнала в центральную нервную систему, которая, в свою очередь, регулирует нервно-мышечную активность мышц задних конечностей. В условиях гравитационной разгрузки данное взаимодействие нарушается, что приводит к потере опорной афферентации и сниженной нервно-мышечной активности медленных двигательных единиц [12–15]. Было показано, что восстановление опорной афферентации путем механической стимуляции опорных зон стопы (МСО) на протяжении космического полета у человека и при моделировании гравитационной разгрузки в земных условиях у человека ведет к увеличению нервно-мышечной активности мышц нижних конечностей и к предотвращению трансформации мышечных волокон постуральных мышц [12].
На основе вышесказанного мы предположили, что механическая опорная стимуляция может привести к восстановлению экспрессии медленной изоформы ТЦМ I, что, в свою очередь, может привести к восстановлению myh7b-зависимых сигнальных механизмов стабилизации “медленного” фенотипа камбаловидной мышцы. Таким образом, целью нашей работы стало исследование роли устранения опорной афферентации в инактивации сигнального пути ТЦМ I/myh7b/SOX6 при функциональной разгрузке постуральной камбаловидной мышцы.
МЕТОДЫ ИССЛЕДОВАНИЯ
Проведение эксперимента с животными. Самцы крыс Вистар были разделены на шесть групп по 8 животных в каждой: две группы виварного контроля (С), группы, подвергнутые разгрузке задних конечностей на протяжении 1 сут (1HS) и 3 сут (3HS), и группы разгрузки, сопровождавшейся опорной стимуляцией (1HS + МСО; 3HS + МСО). В исследовании использовалась общепринятая модель антиортостатического вывешивания, позволяющая имитировать эффекты гипогравитации [16]. Животные из групп опорной стимуляции в течение 4-х ч в день на протяжении эксперимента получали опорную стимуляцию стоп по схеме, симулирующей нормальную ходьбу животного (давление на стопу величиной 104 мм рт. ст. с частотой 2 Гц и продолжительностью 250 мс в течение 10 мин с последующим 20-минутным периодом отдыха). После проведения эксперимента у каждого животного под бромэтанольным наркозом из обеих ног были выделены камбаловидные мышцы, взвешены на аналитических весах и немедленно заморожены в жидком азоте. Животные содержались в виварных условиях, получая стандартный корм и воду ad libitum. Все процедуры с животными были одобрены Комиссией по биомедицинской этике ГНЦ РФ – ИМБП РАН (протокол № 421, от 14. 04. 2016 г.). Эксперименты проводились в строгом соответствии с руководством ARRIVE [17].
Анализ экспрессии генов. Для анализа экспрессии мРНК генов тяжелых цепей миозина ТЦМ I(β), ТЦМ IIa, ТЦМ IId/x и ТЦМ IIb, а также мРНК гена myh7b, SOX6 и PuRB из мышечной ткани с помощью набора RNeasy micro kit (Qiagen, США) была выделена тотальная фракция РНК и использована в качестве матрицы для проведения обратной транскрипции с последующей ПЦР-реакцией. Для проведения обратной транскрипции были использованы компоненты фирмы “Синтол” (Россия): 30 мкМ случайных гексануклеотидов, 17.4 мкМ олиго-d(T)15, 1.3 мМ дНТФ, 0.02 ед./мкл ингибитора РНКазы, 6 ед./мкл M-MLV-ревертазы, 5х-буфер для M-MLV-ревертазы. Обратную транскрипцию проводили в амплификаторе (CFX96 Touch Real-Time PCR Detection System, Bio-Rad Laboratories, США). Для проведения ПЦР в реальном времени использовали праймеры, последовательности которых представлены в табл. 1.
Таблица 1.
Список использованных в работе праймеров
| Ген | Последовательность праймеров |
|---|---|
| Sumo1 | 5'- AGCTCCCTTAACATTGCCCT -3' 5'- AACTGCAGGGCCATTGAAAG -3' |
| Myh7 (ТЦМ I(β)) | 5'-ACAGAGGAAGACAGGAAGAACCTAC-3' 5'-GGGCTTCACAGGCATCCTTAG-3' |
| Myh2 (ТЦМ IIa) | 5'-TATCCTCAGGCTTCAAGATTTG-3' 5'-TAAATAGAATCACATGGGGACA-3' |
| Myh4 (ТЦМ IIb) | 5'-CTGAGGAACAATCCAACGTC-3' 5'-TTGTGTGATTTCTTCTGTCACCT-3' |
| Myh1 (ТЦМ IId/x) | 5'-CGCGAGGTTCACACCAAA-3' 5'-TCCCAAAGTCGTAAGTACAAAATGG-3' |
| Myh7b | 5'-CAAGCTCAAACTCCACACGC-3' 5'-TCGGTTCCTAGGTGATCCGT-3' |
| SOX6 | 5'-TCAAAGGCGATTTACCAGTGAC-3' 5'-TTGTTGTGCATTATGGGGTGC-3' |
| PuRβ | 5'-TGAGTGGATTGGTTGCTGCT-3' 5'-GCTCTTACCGTGGAGCCATT-3' |
Для проведения ПЦР в реальном времени использовали полученную в результате обратной транскрипции кДНК, праймеры с концентрацией 10 мкМ мастер-микс (0.3 мМ дНТФ, 3 мМ MgCl2, 2.5 мкл 10-кратного ПЦР-буфера Б (pH 8.8), 0.06 ед./мкл Taq ДНК-полимеразы, фирма “Синтол”). Для оценки содержания кДНК различных генов в каждой пробе были использованы значения Сt(тест) и Сt(реф), где Сt(реф) – точка пересечения базовой линии и графика амплификации референсного гена в пробе, а Сt(тест) – точка пересечения базовой линии и графика амплификации изучаемого гена в той же пробе. В качестве референсного гена с помощью базы EST Database был выбран ген Sumo1. Так как нельзя утверждать, что выборка является нормально распределенной, то для сравнения экспериментальных групп с соответствующей им контрольной группой (С) был использован непараметрический критерий Краскелла–Уоллеса. Данные представлены в виде максимума, минимума и интерквартильной широты (0.25–0.75).
Анализ содержания белков в тотальной фракции камбаловидной мышцы. Для выделения тотальной белковой фракции и последующей оценки содержания в ней PGC1α был использован набор реагентов RIPA Lysis Buffer System (Santa Cruz, США). При этом дополнительно использовались ингибиторы протеаз Complete Protease Inhibitor Coctail (Santa Cruz, США), 10 мкг/мл апротинина (SIGMA, США), 10 мкг/мл леупептина (SIGMA, США), 10 мкг/мл пепстатина (SIGMA, США), 20 мкл “complete Mini Protease Inhibitor Cocktail” (Roche, Швейцария), 40 мкл фосфоингибиторного коктейля (Santa Cruz, США).
Для проведения электрофореза в полиакриламидном геле (ПААГ) образцы разводились в двукратном буфере для образцов (5.4 мМ Tris-HCl (pH 6.8), 4%-ный Ds-Na, 20%-ный глицерин, 10%-ный β-меркаптоэтанол, 0.02%-ный бромфеноловый синий). Электрофорез был проведен в 10%-ном разделяющем ПААГ. Образцы каждой группы загружались на один гель с контрольными образцами. Электрофорез проводили при силе тока 17 мА на гель в мини-системе (Bio-Rad Laboratories) при комнатной температуре. Электроперенос белков проводили на нитроцеллюлозную мембрану при 100 V при температуре 4°C в течение 120 мин в системе mini Trans-Blot (Bio-Rad Laboratories). После электропереноса НЦ-мембраны инкубировали в растворе 5%-ного сухого молока (Bio-Rad Laboratories) в PBST (PBS + 0.1% Tween 20) в течение 1 ч при комнатной температуре. Для выявления белковых полос использовали первичные поликлональные антитела против PGC1α (Abcam, США, 1 : 2000), GAPDH (Cell Signalling, США, 1 : 10 000). В качестве вторичных антител использовали антитела goat anti-rabbit, конъюгированные с пероксидазой хрена (Santa Cruz, США) в разведении 1 : 5000.
Инкубация блотов с первичными антителами проводилась в течение ночи при 4°С, со вторичными антителами 1 ч при комнатной температуре. Выявление белковых полос осуществляли с помощью набора ImmunStar Substrate Kit (BioRad Laboratories, США). Анализ белковых полос проводили с использованием C-DiGit Blot Scanner (LI-COR Biotechnology, США). Оптическая плотность белковых полос была нормализована к тотальному количеству белка в пробе, окрашенному красителем ПОНСО. Все измерения плотности изображений проводились в линейном диапазоне проявляющего реагента и сканера. Данные представлены в виде максимума, минимума и интерквартильного размаха (0.25–0.75). Медиану ОП полос контрольной группы принимали за 100%. Так как нельзя утверждать, что выборка является нормально распределенной, то для сравнения экспериментальных групп с соответствующей им контрольной группой (С) был использован непараметрический критерий Краскелла–Уоллеса
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Мы обнаружили значительное снижение содержания мРНК ТЦМ I(β) в камбаловидной мышце экспериментальных животных в группе 1HS (рис. 1A). При этом в группе HS + МСО снижение содержания мРНК ТЦМ I(β) относительно контрольной группы не было достоверным. После трех суток вывешивания в группе 3HS содержание мРНК ТЦМ I(β) также было снижено в сравнении с контролем, при этом содержание мРНК ТЦМ I(β) в группе 3HS + МСО достоверно отличалось от значения в группе чистого вывешивания и было на 90% выше, чем в контроле (рис. 2A).
Рис. 1.
ПЦР-анализ содержания медленной ТЦМ I (А) и быстрых ТЦМ IId/x (Б), ТЦМ IIa (В), ТЦМ IIb (Г) в группах C, 1HS и 1HS + МСО. * – достоверные (p < 0.05) отличия от контрольной группы.
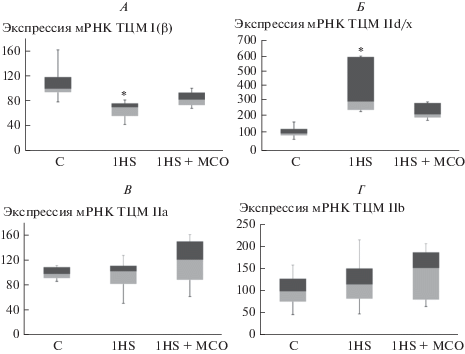
Рис. 2.
ПЦР-анализ содержания медленной ТЦМ I (А) и быстрых ТЦМII d/x (Б), ТЦМ IIa (В), ТЦМ IIb (Г) в группах C, 3HS и 3HS + МСО. * – достоверные (p < 0.05) отличия от контрольной группы, & – достоверные отличия от группы чистого вывешивания.
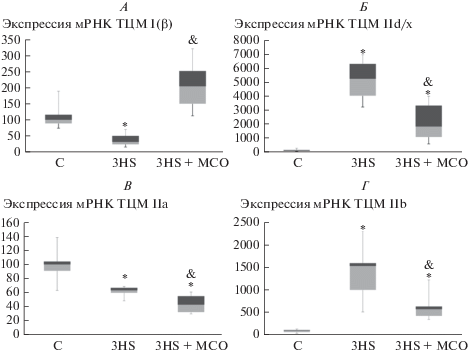
После первых суток вывешивания мы не обнаружили изменений в уровне экспрессии мРНК ТЦМ IIa и ТЦМ IIB (рис. 1В, Г). Экспрессия ТЦМ IId/x была повышена в обеих вывешенных группах, однако в группе HS + МСО увеличение экспрессии мРНК ТЦМ IId/x не было достоверным (рис. 1Б). После трех суток моделируемой гравитационной разгрузки экспрессия мРНК ТЦМ IIa снизилась в обеих вывешенных группах (рис. 2В). Экспрессия мРНК ТЦМ IIB в группе 3HS возросла в 15 раз в сравнении с контролем, однако в группе 3HS + МСО экспрессия мРНК ТЦМ IIB возросла лишь в 6 раз и не имела достоверных отличий от контроля (рис. 2Г). Экспрессия мРНК ТЦМ IId/x также увеличилась в обеих вывешенных группах, однако в группе 3HS + МСО данное увеличение экспрессии было менее выраженным (рис. 2Б).
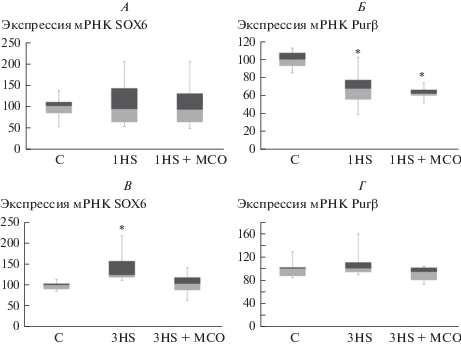
После первых суток вывешивания содержание мРНК гена myh7b снизилось на 60% по сравнению с контролем как в группе чистого вывешивания, так и в группе вывешивания с опорной стимуляцией (рис. 3A). После трех суток вывешивания содержание пре-микроРНК-499, мРНК гена myh7b, составляло 27% от контроля. Содержание мРНК гена myh7b в группе 3HS + МСО достоверно отличалось от группы 3HS и составляло 55% от контроля (рис. 3Б). После первых суток вывешивания содержание мРНК SOX6 не различалась между экспериментальными группами, в то время как содержание PuRβ было достоверно снижено в обеих вывешенных группах (рис. 4A, Б); тем не менее, после третьих суток вывешивания содержание мРНК SOX6 в группе 3HS достоверно повысилось до 126% от контроля, тогда как в группе 3HS + МСО содержание мРНК SOX6 не отличалось от контроля (рис. 4В). Содержание мРНК PuRβ после трех суток вывешивания не отличалось от контроля (рис. 4Г).
Рис. 3.
ПЦР-анализ содержания мРНК гена myh7b в группах C, 1HS и 1HS + МСО (А) и в группах C, 3HS и 3HS + МСО (Б). * – достоверные (p < 0.05) отличия от контрольной группы, & – достоверные отличия от группы чистого вывешивания.

Рис. 4.
ПЦР-анализ содержания мРНК SOX6 и PuRβ в группах C, 1HS и 1HS + МСО (А, Б) и в группах C, 3HS и 3HS + МСО (В, Г). * – достоверные (p < 0.05) отличия от контрольной группы.
Также после трех суток гравитационной разгрузки было достоверно снижено содержание PGC1α в тотальной белковой фракции камбаловидных мышц, при этом в группе вывешивания с опорной стимуляцией содержание PGC1α сохранялось на уровне контроля (рис. 5).
Рис. 5.
Содержание PGC1α в тотальной белковой фракции в группах C, 3HS и 3HS + МСО. * – достоверные (p < 0.05) отличия от контрольной группы.

Наблюдаемое снижение экспрессии мРНК ТЦМ I(β) после первых суток гравитационной разгрузки соответствует данным, полученным J.M. Giger с соавт. [18], а также данным, полученным в нашей лаборатории [19, 20]. Данные, свидетельствующие о снижении уровня мРНК ТЦМ I(β) после трех суток вывешивания, являются более противоречивыми. Ранее в нашей лаборатории были получены результаты, показывающие лишь тенденцию к снижению ТЦМ I(β) на этом сроке, несмотря на то, что некоторые исследователи наблюдали снижение экспрессии ТЦМ I(β) после вторых и после четвертых суток вывешивания [18, 21]. Наблюдавшееся поддержание и даже некоторое усиление экспрессии ТЦМ I(β), вызванное опорной стимуляцией, соответствует данным, полученным на человеке [22], свидетельствующим что опорная стимуляция предотвращает сдвиг миозинового фенотипа в быструю сторону при 7-суточной “сухой” иммерсии. Данные по экспрессии “быстрых” изоформ ТЦМ после 1 и 3 сут вывешивания соответствуют ранее полученным в нашей лаборатории результатам [20].
Наблюдавшееся снижение уровня мРНК myh7b и повышение экспрессии мРНК SOX6 согласуется с данными J.J. McCarthy и соавт., [6], однако противоречит данным S. Yokoyama и соавт., не обнаруживших снижения мРНК myh7b после двух недель вывешивания [23]. Как бы то ни было, различия в результатах могут быть связаны с несоответствием сроков вывешивания в данной работе и в работах других авторов. При этом данные об экспрессии PuRβ не совпадают с результатами J.J. McCarthy с соавт. [6]. Возможно, что экспрессия SOX6 наиболее чувствительна к блокированию со стороны микро-РНК-499, в то время как экспрессия PuRβ может регулироваться за счет других механизмов.
Данные о снижении содержания PGC1α после трех суток вывешивания также согласуются с ранее полученными данными [24]. Таким образом, опорная стимуляция на фоне вывешивания может оказывать воздействовать на один из ключевых регуляторов митохондриального биогенеза скелетной мышцы.
На основании вышеизложенных данных можно заключить, что нервно-мышечная активность, связанная с опорной афферентацией, обеспечивает экспрессию ТЦМ I(β) в камбаловидной мышце, что сопровождается активацией сигнального пути myh7b/SOX6 и поддержанием нормального уровня экспрессии ряда генов, обеспечивающих реализацию “медленного” окислительного фенотипа волокон постуральной мышцы.
Список литературы
Schiaffino S., Reggiani C. Fiber types in mammalian skeletal muscles. Physiol. Rev. 91(4): 1447–1531. 2011.
Friedman R.C., Farh K.K., Burge C.B., Bartel D.P. Most mammalian mRNAs are conserved targets of microRNAs. Genome Res. 19(1): 92–105. 2009.
Fabian M.R., Sonenberg N., Filipowicz W. Regulation of mRNA translation and stability by microRNAs. Annu. Rev. Biochem. 79: 351–379. 2010.
Iwakawa H.O., Tomari Y. The Functions of MicroRNAs: mRNA Decay and Translational Repression. Trends Cell Biol. 25(11): 651–665. 2015.
Van Rooij E., Quiat D., Johnson B.A., Sutherland L.B., Qi X., Richardson J.A., Kelm R.J., Jr., Olson E.N. A family of microRNAs encoded by myosin genes governs myosin expression and muscle performance. Dev. Cell. 17(5): 662–673. 2009.
McCarthy J.J., Esser K.A., Peterson C.A., Dupont-Versteegden E.E. Evidence of MyomiR network regulation of beta-myosin heavy chain gene expression during skeletal muscle atrophy. Physiol. Genomics. 39(3): 219–226. 2009.
Ji J., Tsika G.L., Rindt H., Schreiber K.L., McCarthy J.J., Kelm R.J., Jr., Tsika R. Puralpha and Purbeta collaborate with Sp3 to negatively regulate beta-myosin heavy chain gene expression during skeletal muscle inactivity. Mol. Cell. Biol. 27(4): 1531–1543. 2007.
Xu M., Chen X., Chen D., Yu B., Li M., He J., Huang Z. MicroRNA-499-5p regulates skeletal myofiber specification via NFATc1/MEF2C pathway and Thrap1/MEF2C axis. Life Sci. 215: 236–245. 2018.
Hatazawa Y., Minami K., Yoshimura R., Onishi T., Manio M. C., Inoue K., Sawada N., Suzuki O., M-iura S., Kamei Y. Deletion of the transcriptional coactivator PGC1alpha in skeletal muscles is associated with reduced expression of genes related to oxidative muscle function. Biochem. Biophys. Res. Commun. 481(3–4): 251–258. 2016.
Templeton G.H., Sweeney H.L., Timson B.F., Padalino M., Dudenhoeffer G.A. Changes in fiber composition of soleus muscle during rat hindlimb suspension. J. Appl. Physiol. (1985). 65(3): 1191–1195. 1988.
De-Doncker L., Picquet F., Falempin M. Effects of cutaneous receptor stimulation on muscular atrophy developed in hindlimb unloading condition. J. Appl. Physiol. (1985). 89(6): 2344–2351. 2000.
Kozlovskaya B.S. Cellular Responses of Human Postural Muscle to Dry Immersion. Front Physiol. 2019.
Kozlovskaya I.D., Grigorieva L., Kirenskaya A., Kreydich Yr. Gravitational mechanisms in the motor system. Studies in real and simulated weightlessness. Stance and motion Eds. Gurfinkel V.S., Ioffe M.Ye. N.Y. J. Massion Plenum. 37–48. 1988.
Litvinova K.S., Vikhlyantsev I.M., Kozlovskaya I.B., Podlubnaya Z.A., Shenkman B.S. Effects of artificial support stimulation on fiber and molecular characteristics of soleus muscle in men exposed to 7-day dry immersion. J. Gravit. Physiol. 11(2): 131–132. 2004.
Shigueva T.A., Zakirova A.Z., Tomilovskaya E.S., Kozlovskaya I.B. [Effect of support deprivation on the sequence of motor units recruiting]. Aviakosm. Ekolog. Med. 47(3): 50–53. 2013.
Morey-Holton E.R., Globus R.K. Hindlimb unloading rodent model: technical aspects. J. Appl. Physiol. (1985). 92(4): 1367–1377. 2002.
Danos O., Davies K., Lehn P., Mulligan R. The ARRIVE guidelines, a welcome improvement to standards for reporting animal research. J. Gene Med. 12(7): 559–560. 2010.
Giger J.M., Bodell P.W., Zeng M., Baldwin K.M., Haddad F. Rapid muscle atrophy response to unloading: Pretranslational processes involving MHC and actin. J. Appl. Physiol. (1985). 107(4): 1204–1212. 2009.
Vilchinskaya N.A., Mochalova E.P., Nemirovskaya T.L., Mirzoev T.M., Turtikova O.V., Shenkman B.S. Rapid decline in MyHC I(beta) mRNA expression in rat soleus during hindlimb unloading is associated with AMPK dephosphorylation. J. Physiol. 595(23): 7123–7134. 2017.
Lomonosova Y.N., Turtikova O.V., Shenkman B.S. Reduced expression of MyHC slow isoform in rat soleus during unloading is accompanied by alterations of endogenous inhibitors of calcineurin/NFAT signaling pathway. J. Muscle Res. Cell Motil. 37(1–2): 7–16. 2016.
Stevens L., Gohlsch B., Mounier Y., Pette D. Changes in myosin heavy chain mRNA and protein isoforms in single fibers of unloaded rat soleus muscle. FEBS Lett. 463(1–2): 15–18. 1999.
Григорьев А.И., Шенкман Б.С. Роль опорной афферентации в организации тонической мышечной системы. Рос. физиол. журн. им. И.М. Сеченова. 90(5): 508-521. 2004. [Grigor’ev A.I., Shenkman B.S. The role of supporting afferentation in the organization of the tonic muscular system. Russ. J. Physiol. 90(5): 508–521. 2004. (In Russ.)].
Yokoyama S., Ohno Y., Egawa T., Yasuhara K., Nakai A., Sugiura T., Ohira Y., Yoshioka T., Okita M., Origuchi T., Goto K. Heat shock transcription factor 1-associated expression of slow myosin heavy chain in mouse soleus muscle in response to unloading with or without reloading. Acta Physiol. (Oxf). 217(4): 325–337. 2016.
Cannavino J., Brocca L., Sandri M., Bottinelli R., Pellegrino M. A. PGC1-alpha over-expression prevents metabolic alterations and soleus muscle atrophy in hindlimb unloaded mice. J. Physiol. 592(20): 4575–4589. 2014.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


