Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 12, стр. 1546-1560
Структуроспецифичные изменения содержания моноаминов в мозге при остром стрессе, вызванном однократным введением физиологического раствора
П. Л. Наплёкова 1, *, Н. В. Кудряшов 1, 3, К. А. Касабов 1, В. С. Кудрин 1, Э. А. Андяржанова 1, 2
1 НИИ фармакологии им. В.В. Закусова
Москва, Россия
2 University Hospital Bonn, Clinic of Psychiatry and Psychotherapy
Bonn, Germany
3 Первый МГМУ им. И.М. Сеченова (Сеченовский университет)
Москва, Россия
* E-mail: p.naplekova@gmail.com
Поступила в редакцию 08.08.2019
После доработки 13.09.2019
Принята к публикации 17.09.2019
Аннотация
Внутрибрюшинное (в.б.) введение является широко применяемым способом системной доставки фармакологически активных веществ в экспериментальной нейрофизиологии. Этот способ введения подразумевает кратковременную иммобилизацию животного, а также сопровождается болевыми ощущениями, следовательно, выступает в качестве стрессора. В настоящем исследовании была проведена оценка нейрохимических и гормональных изменений, вызванных однократным в.б. введением физиологического раствора грызунам. Было показано, что в.б. введение физиологического раствора приводит к увеличению секреции кортикостерона у мышей линии С57Bl/6N, что подтверждало стрессогенность процедуры. У мышей этой линии в.б. введение физиологического раствора сопровождалось увеличением оборота дофамина во фронтальной коре, гиппокампе и хвостатом ядре, а также снижением норадреналина в гиппокампе и гипоталамусе; у крыс Вистар – увеличением соотношения между общим содержанием метаболитов дофамина и общим тканевым содержанием дофамина. Наблюдаемое у грызунов усиление активности дофаминергической системы после в.б. введения может оказывать влияние на когнитивные функции и работу системы вознаграждения мозга. Обнаруженный нейрохимический феномен должен приниматься во внимание при планировании экспериментальных исследований, использующих в.б. способ введения препаратов и направленных на изучение процессов обучения, памяти, внимания и подкрепления.
Достоверность и воспроизводимость экспериментальных данных являются одними из важных требований к экспериментальным исследованиям. Для улучшения качества нейрофизиологических исследований существуют стандартизированные протоколы. Однако даже валидированные методики имеют недостатки. Большинство протоколов подразумевают активное взаимодействие с животными – от хэндлинга и ухода за животными до стереотаксических нейрохирургических операций. Эти и другие “фоновые” неизбегаемые манипуляции, включая системное и местное введение фармакологически активных веществ, могут стать источником психофизиологического стресса для животных, который, в свою очередь, может изменять их поведение [1–4].
Внутрибрюшинный (в.б.) способ введения веществ широко используется в нейрофизиологических исследованиях [5]. Системные инъекции грызунам требуют кратковременной иммобилизации животного и сопровождаются болью, связанной с проколом брюшной стенки и брюшины. В настоящее время применяются разнообразные щадящие способы фиксации животного, что позволяет уменьшить влияние иммобилизации [1, 2], однако, в комплексе, в.б. введение выступает как стрессор [6]. Во время в.б. введения происходит активация гипоталамо-гипофизарно-адреналовой (ГГА) системы, что выражается в повышении уровней адренокортикотропного гормона (АКТГ) и кортикостерона [7] в плазме крови. Сигнал, опосредуемый глюкокортикоидными рецепторами в мозге, является важным фактором эпигенетических механизмов регуляции нейропластичности, следовательно, влияет как на настоящую, так и будущую поведенческую активность животного [8–10]. Так как ответ на стресс характеризуется индивидуальной вариабельностью, последствия острого стресса, сопровождающего в.б. введение, могут оказывать разнонаправленное влияние на поведение животного, определяя как десенситизацию к стрессу, так и повышение лабильности к нему.
Стресс, сопровождающий в.б. введение, следует рассматривать как дополнительный экспериментальный фактор, влияющий на нейрохимические и молекулярные показатели активности структур мозга. Известно, что острый стресс, такой как неизбегаемое плавание, иммобилизация, подвешивание за хвост, электрическое раздражение конечностей, может вызывать значительные изменения в концентрации моноаминов серотонина, норадреналина, дофамина и их метаболитов в мозге мышей [11–14]. Несмотря на общепризнанный факт вовлечения моноаминов в реакцию организма на стресс, до настоящего времени нейрохимические изменения, сопровождающие стресс в.б. введения, не описаны в литературе, и сведения о влиянии однократного в.б. введения физиологического раствора на параметры моноаминергических систем у грызунов отсутствуют.
Целью настоящего исследования явилась проверка гипотезы о том, что однократное в.б. введение физиологического раствора может приводить к изменению уровня моноаминов и их метаболитов в структурах мозга, участвующих в регуляции ответа организма на стресс. По результатам исследования был охарактеризован профиль изменений в тканевом содержании моноаминов, а также величина секреции кортикостерона и изменение в двигательной активности грызунов, характерные для в.б. введения физиологического раствора.
МЕТОДЫ ИССЛЕДОВАНИЯ
Животные
В исследовании были использованы самцы мышей линии С57Bl/6N из питомника Charles River (Зульцфельд, Германия), самцы мышей линии С57Bl/6N и самцы крыс Вистар из питомника Филиал “Столбовая” ФГБУН НЦБМТ ФМБА России (Московская область, Россия) в возрасте 3–4 мес. Все животные содержались по группам в стандартных лабораторных условиях при световом режиме 12 ч/12 ч с температурой воздуха 23 ± 1°C, со свободным доступом к корму и воде. Количество животных в группе варьировало от 6 до 8. Эксперименты проводились в соответствии с Директивой Совета Европейского сообщества 2010/63/EEC или с Приказом Министерства здравоохранения РФ от 1 апреля 2016 г. № 199н “Об утверждении Правил надлежащей лабораторной практики”.
Введение веществ
Всем животным вводился стерильный изотонический 0.9%-ный раствор NaCl (“Fresenius Kabi”, Германия или ПАО “Биосинтез”, Россия) в объеме 10 мл/кг. Для осуществления внутрибрюшинного введения бодрствующее животное (мышь или крысу) осторожно фиксировали в супинальном положении головой вверх при наклоне 10–15 градусов по отношению к горизонтальной плоскости. Инъекции были выполнены опытным исследователем с помощью инсулинового шприца, оборудованного иглой диаметром 27G из нержавеющей стали. В случае перорального введения (п.о.) мышь фиксировали в вертикальном положении головой вверх, и, прижимая язык и отодвигая мягкое нёбо, осторожно вводили в пищевод тупоконечный зонд диаметром 2 мм, так что его конец в итоге попадал в полость желудка; после этого вводился физиологический раствор.
Оценка двигательной активности
Общую двигательную активность оценивали на мышах C57Bl/6N в тесте “Открытое поле” (ОП) по пройденной дистанции (общей и в центральной зоне), регистрируемой с помощью автоматической системы TruScan Photo Beam Activity system (Coulbourn Instruments, США), как описано ранее [15]. Освещенность установки составляла 15 люкс. Для оценки фактора новизны интактные мыши помещались на арену ОП на 50 мин (предварительное тестирование). Этого времени было достаточно, чтобы вызвать у мышей привыкание к тестовой установке (угашение или габитуация), то есть ослабление ориентировочной реакции на новую обстановку. В качестве контроля для оценки влияния в.б. введения физиологического раствора выступали те же животные, но протестированные неделю ранее без каких-либо предваряющих процедур или манипуляций (наивные). При оценке эффекта физиологического раствора в течение начальных 10 мин тестирования регистрировались базальные значения двигательной активности; затем проводили в.б. инъекцию, снова помещали на арену и регистрировали значения двигательной активности в течение 40 мин. Показатели общей и центральной пройденной дистанций оценивали каждые 5 мин.
Мозговой микродиализ
Мозговой микродиализ был выполнен по ранее описанной методике [16]. В правый гиппокамп имплантировали направляющие канюли (AP = –3.0 мм, ML = 3.00 мм и DV = –1.80 мм) в соответствии с атласом стереотаксических координат под редакцией G. Paxinos и K.B.J. Franklin [17]. Для анестезии использовали комбинированный наркоз (изофлуран 2 v/v% ингаляционно, Abbot, Индия и Метакам 0.5 мг/кг подкожно, Boehringer Ingelheim GmbH, Германия). В последующую неделю животные содержались в домашних клетках из плексигласа (16 × 16 × 32 см) с ежедневным контролем состояния. Метакам добавляли в питьевую воду (0.25 мг/100 мл) в течение 3-х дней после операции. За 1 день до эксперимента животных краткосрочно анестезировали изофлураном, вводили микродиализные зонды (наружный диаметр 0.24 мм, купрофановая мембрана, длина 3 мм, CMA11, CMA Microdialysis, Швеция) в канюлю и подключали их к перфузионной системе, состоящей из полипропиленовых трубочек и жидкостного вертлюга TCS2-23 (Eicom, Япония). Зонды непрерывно перфузировали стерильной искусственной спинномозговой жидкостью (концентрация, ммоль/л: NaCl 145.0; KCl 2.7; CaCl2 1.2; MgCl2 1.0; Na2HPO4 2.0; pH 7.4) при скорости потока 0.3 мкл/мин. В день эксперимента, после 1.5-часового периода стабилизации, микродиализные фракции (20 мин) собирали при скорости перфузии 1.5 мкл/мин в микропробирки объемом 300 мкл (Microbiotech/se AB, Швеция), содержащие 3 мкл HClO4 (0.4 моль/л). Мертвый объем исходящей трубки был компенсирован задержкой в сборе фракций (7 мин). Во время отбора образцов пробирки находились в охлажденном микросемплере Univentor 820 Microsampler (Univentor, Мальта). После отбора проб зонды извлекались из мозга животных, образцы хранились при температуре –80°C до момента анализа.
Определение кортикостерона
Микродиализная мембрана с размерами пор 6 кДа не позволяет фильтрацию конъюгированного с глобулином кортикостерона, таким образом, уровень измеряемого в микродиализатах гормона отражает концентрацию свободной формы гормона. Определение свободного кортикостерона проводили согласно методике C.Y. Kao и соавт. [16] с помощью радиоиммунологического метода с применением набора реагентов RIA kit, MPBiomedicals (США). Порог обнаружения составлял 7.7 нг/мл. Коэффициенты повторяемости и воспроизводимости анализа составляли 6.9 и 7.3%, соответственно. Микродиализаты разводили в 2.5 раза, содержание кортикостерона определяли, используя стандартную калибровочную кривую.
В качестве стресс-модели использовался тест “приподнятая платформа” [18, 19]. Для стрессирования мышь аккуратно помещали в центр платформы и оставляли на 20 мин.
Определение содержания моноаминов в ткани мозга
Через 40 мин после в.б. введения физиологического раствора крыс и мышей декапитировали и извлекали на холоду (4°C) следующие структуры мозга: фронтальную кору, гиппокамп, хвостатое ядро (дорсальный стриатум) и гипоталамус. У крыс дополнительно извлекали вентральный стриатум – прилежащее ядро. Образцы ткани мозга хранились в жидком азоте в течении 2–3 недель до момента анализа.
Структуры мозга гомогенизировали в 0.1 моль/л растворе HClO4 с добавлением в качестве внутреннего стандарта 0.5 нмоль/л дигидроксибензиламина (ДОБА), и центрифугировали при 10 000 g в течение 10 мин при температуре 4°C (центрифуга K70D, Германия).
Надосадочную жидкость отбирали и определяли в ней содержание моноаминов и их метаболитов методом высокоэффективной жидкостной хроматографии (ион-парная хроматография) с электрохимической детекцией (ВЭЖХ/ЭД). Норадреналин, дофамин и его метаболиты – 3,4-диоксифенилуксусную кислоту (ДОФУК) и гомованилиновую кислоту (ГВК), серотонин и его метаболит 5-оксииндолуксусную кислоту (5-ОИУК) разделяли на обращённо-фазной колонке (С18, 4 мкм, 150 мм × 4.6 мм, Phenomenex, Германия). Подвижная фаза содержала 0.1 моль/л цитратно-фосфатного буфера (рН 2.9), 1.85 ммоль/л 1-октансульфоновой кислоты, 0.27 ммоль/л этилендиаминтетраацетата натрия (ЭДТА-Na2) и 8% ацетонитрила [20]. Скорость элюции подвижной фазы составляла 1.0 мл/мин, при давлении 200 атм. Измерение проводили с помощью электрохимического детектора (BAS LC-4B, США) на стеклоугольном электроде (+0.85 V) против электрода сравнения Ag/AgCl.
Статистический анализ
Все данные представлены в виде средних значений и стандартной ошибки среднего. Результаты поведенческих тестов были проанализированы с помощью двухфакторного дисперсионного анализа. Относительные и абсолютные изменения концентрации кортикостерона в микродиализатах, а также содержания моноаминов и их метаболитов в тканевых образцах структур мозга были проанализированы с помощью непарного критерия Стьюдента. Уровни моноаминов представлены как десятичный логарифм от содержания, нмоль/г ткани. Величина оборота дофамина (ДА) и серотонина была представлена в виде комплексных показателей (ДОФУК + ГВК)/ДА, ГВК/ДА и 5-ОИУК/серотонин соответственно. Статистическую обработку проводили в программе GraphPad Prizm 8.0 (США).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Влияние введения физиологического раствора на двигательную активность мышей
Оценку эффекта однократного в.б. введения физиологического раствора на двигательную активность мышей проводили в два этапа. Сначала измеряли двигательную активность наивных мышей при их помещении в полностью новое окружение, то есть, на арену ОП. Через неделю тех же животных тестировали в ОП до и после в.б. введения физиологического раствора.
После помещения наивных животных на арену в течение 50 мин наблюдения локомоторная активность у животных снижалась (рис. 1А). Это является проявлением ослабления ориентировочной реакции на новую обстановку – угашения (габитуации) [21]. Манипуляции, определяемые в.б. введением физиологического раствора (изъятие животного с арены ОП, его временная иммобилизация, укол и введение раствора, возвращение животного обратно на арену) длились не более 1–1.5 мин и не вызывали краткосрочных изменений в уровнях измеряемых параметров локомоторной активности. После в.б. инъекции общая пройденная дистанция продолжала уменьшаться во времени до конца теста. Однако при сравнении показателя общей пройденной дистанции между двумя последовательными тестированиями было обнаружено, что введение физиологического раствора оказывало влияние на динамику локомоторной активности, но не на начальные и конечные значения двигательной активности (рис. 1А). Двухфакторый дисперсионный анализ показал, что различия были статистически значимы при оценке влияния фактора времени (F(9,126) = 42.92, р < 0.001), дня (F(1,14) = 9.39, р = 0.008), а также взаимодействия обоих факторов (F(9,126) = 5.318, р < 0.001).
Рис. 1.
Двигательная активность мышей в ОП после в.б. введения физиологического раствора. А – общая пройденная дистанция; Б – дистанция, пройденная в центральной зоне. Стрелкой показан момент введения физиологического раствора. ** – значимость отличий между условиями тестирования при p < 0.01 (по результатам дисперсионного двухфакторного анализа).
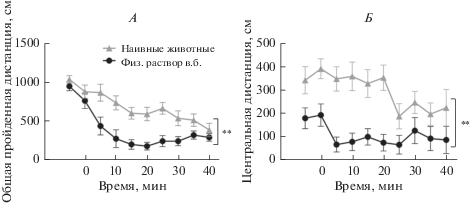
Двигательная активность в центральной зоне арены снижалась во времени при двух последовательных тестированиях. Однако различия между результатами первого и второго тестирования не были однозначно доказательны в отношении наличия специфического эффекта физиологического раствора (двухфакторный дисперсионный анализ: время (F(9,126) = 20.43, р < 0.001); день (F(1,14) = 22.64, р = 0.008); день × время (F(9,126) = 4.709, р = 0.023) (рис. 1Б).
Влияние введения физиологического раствора на концентрацию свободного кортикостерона в диализатах мозга
Эффект системного введения физиологического раствора на секрецию кортикостерона был изучен в отношении двух способов его введения, в.б. и п.о. Базальный уровень кортикостерона, измеренный в микродиализатах гиппокампа мышей линии С57Bl6/N и полученный по результатам двух экспериментов, составлял 59.33 ± 8.54 нг/мл. Индивидуальные данные были распределены нормально, и из общей выборки не было исключено ни одно значение (Z = 2.46, p = 0.05). При сравнении базальных уровней, полученных в двух независимых экспериментах, не было выявлено различий (тест Стьюдента: t < 0.001, df = 11, p > 0.05).
В первом эксперименте через 20 мин после в.б. введения физиологического раствора наблюдалось значимое повышение уровня свободного кортикостерона в гиппокампе – на 200% по сравнению с базальным значением (тест Стьюдента: t = 2.534, df = 10, p = 0.030) (рис. 2А). Во втором эксперименте после п.о. введения физиологического раствора увеличение кортикостерона достигало 240% от базального уровня (тест Стьюдента: t = 4.602, df = 12, p = 0.001). Сравнение между двумя группами не показало разницы между уровнями повышения свободного кортикостерона при в.б. и п.о. путях введения (тест Стьюдента: t = 0.833, df = 11, p = 0.423) (рис. 2Б).
Рис. 2.
Концентрация свободного кортикостерона в диализатах мозга мышей. А – после введения физиологического раствора в.б.; Б – после введения физиологического раствора п.о.; В – в тесте “приподнятая платформа”. Значимость отличий между двумя последовательными измерениями при * – p < 0.05, (t-критерий Стьюдента), ** – при р < 0.01, *** – при р < 0.001.

Для того, чтобы доказать, что определяемое при использованном подходе повышение уровней кортикостерона при введении физологического раствора не является артефактом, измерения в уровне этого гормона в микродиализатах было проведены при стрессе, смоделированном в тесте “приподнятая платформа”. Через 20 мин после начала теста измеряемое содержание кортикостерона увеличивалось до 400% по отношению к базальным значениям (тест Стьюдента: t = 4.24, df = 10, p < 0.001) (рис. 2В).
Изменения в содержании моноаминов в структурах мозга крыс Вистар и мышей линии C57Bl/6N при в.б. введении физиологического раствора
Тканевые концентрации моноаминов и их метаболитов в структурах мозга крыс и мышей определялись через 40 мин после в.б. введения физиологического раствора. Животные контрольной группы не подвергались каким-либо манипуляциям (интактные).
Во фронтальной коре крыс было выявлено повышение комплексного показателя оборота дофамина ГВК/ДА (тест Стьюдента: t = 2.545, df = 12, p = 0.026), чему соответствовало увеличение содержания ГВК (тест Стьюдента: t = 2.657, df = 12, p = 0.021). Также наблюдали значимое повышение оборота серотонина, определенного по отношению 5-ОИУК/серотонин (тест Стьюдента: t = 2.268, df = 12, p = 0.043), по сравнению с контрольной группой (рис. 3Б). В гиппокампе наблюдалась тенденция к уменьшению соотношения ДОФУК/ДА (тест Стьюдента: t = 1.897, df = 10, p = 0.087) (рис. 4Б). В прилежащем ядре было показано некоторое увеличение оборота дофамина (ДОФУК + ГВК)/ДА (тест Стьюдента: t = 4.248, df = 11, p = 0.001), соотносящееся с тенденцией к повышению уровня ДОФУК (тест Стьюдента: t = 1.83, df = 11, p = 0.094) и со значимым увеличением концентрации ГВК (тест Стьюдента: t = 3.45, df = 11, p = 0.005) по сравнению с интактными животными. Однако показатель метаболизма дофамина ГВК/ДА в этой структуре уменьшался (тест Стьюдента: t = 2.809, df = 11, p = 0.017) (рис. 6). В то же время в хвостатом ядре крыс было показано увеличение соотношения ГВК/ДА (тест Стьюдента: t = 2.792, df = 12, p = = 0.016) (рис. 5Б). Внутрибрюшинное введение физиологического раствора не оказывало статистически значимого влияния на уровень моноаминов и их метаболитов в гипоталамусе (рис. 7Б).
Рис. 3.
Содержание моноаминов во фронтальной коре грызунов после в.б. введения физиологического раствора. А – мыши, Б – крысы. * – значимость отличий между группами при p < 0.05 (t-критерий Стьюдента), ** – при р < 0.01, t – тенденция.
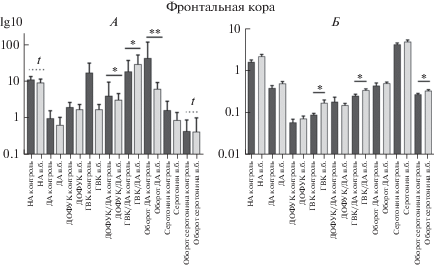
Рис. 4.
Содержание моноаминов в гиппокампе грызунов после в.б. введения физиологического раствора. А – мыши, Б – крысы. * – значимость отличий между группами при p < 0.05 (t-критерий Стьюдента), ** – при р < 0.01, t – тенденция.

Рис. 5.
Содержание моноаминов в хвостатом ядре грызунов после в.б. введения физиологического раствора. А – мыши, Б – крысы. * – значимость отличий между группами при p < 0.05 (t-критерий Стьюдента).

Рис. 6.
Содержание моноаминов в прилежащем ядре крыс после в.б. введения физиологического раствора. * – значимость отличий между группами при p < 0.05 (t-критерий Стьюдента), ** – при р < 0.01, t – тенденция.

Рис. 7.
Содержание моноаминов в гипоталамусе грызунов после в.б. введения физиологического раствора. А – мыши, Б – крысы. *** – значимость отличий между группами при р < 0.001,(t-критерий Стьюдента).

Через 40 мин после в.б. введения физиологического раствора мышам во фронтальной коре наблюдалось повышение соотношения ГВК/ДА (t = 2.137, df = 17, p = 0.047), а также увеличение соотношения ДОФУК/ДА (t = 2.607, df = 16, p = 0.019) и оборота дофамина (t = 3.876, df = 16, p = 0.001) (рис. 3А). Увеличение соотношения ДОФУК/ДА также было обнаружено в хвостатом ядре (t = 2.617, df = 17, p = 0.018) (рис. 5А). Снижение концентрации норадреналина было выявлено в гиппокампе (t = 2.286, df = 17, p = 0.035) (рис. 4А) и гипоталамусе (t = 4.039, df = 18, p = 0,001) (рис. 7А). В гиппокампе также наблюдалось повышение показателя метаболизма дофамина ГВК/ДА (t = 3.716, df = 17, p = 0.002) (рис. 4А). Во всех остальных случаях значимых различий не было выявлено.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В настоящем исследовании было установлено, что однократное системное в.б. введение физиологического раствора сопровождается (1) увеличением в уровне секреции кортикостерона (что было оценено по увеличению содержания свободного гормона в микродиализатах гиппокампа мышей линии C57Bl/6N) (рис. 2А) и (2) увеличением оборота дофамина во фронтальной коре, гиппокампе и хвостатом ядре, снижением норадреналина в гиппокампе и гипоталамусе у мышей C57Bl/6N (рис. 3А, 4А, 5А, 7А), а также увеличением оборота дофамина и серотонина во фронтальной коре и прилежащем ядре у крыс Вистар (рис. 3Б, 6) (что было оценено по изменению в тканевом содержании монаминов и их метаболитов).
Активация ГГА системы наблюдается у мышей во многих экспериментальных моделях стресса, например, в тесте неизбегаемого плавания [22] или акустической стартл-реакции [23]. Поэтому обнаруженное нами повышение уровня кортикостерона при в.б. и п.о. введениях физиологического раствора, позволяет охарактеризовать его как острый стресс для мышей линии C57Bl/6N с активным типом эмоционально-стрессовой реакции. Обнаруженное в этом исследовании относительное увеличение концентрации свободного кортикостерона в микродиализатах после в.б. инъекции или п.о. введения было ниже, чем то, которое наблюдалось при помещении мышей на приподнятую платформу (рис. 2В), а также чем то, которое мы наблюдали в наших предыдущих экспериментах с использованием электрического раздражения конечностей в качестве стрессора [16]. Можно заключить что в.б. и п.о. введения физиологического раствора являются стрессом субмаксимальной интенсивности для мышей.
Полученные результаты оценки изменений в уровнях моноаминов в мозге крыс Вистар и мышей линии C57Bl/6N прежде всего свидетельствуют о структурной специфичности нейрохимических изменений после в.б. введения физиологического раствора. Наблюдаемое увеличение уровня оборота дофамина, соотношения ГВК/ДА и содержания ГВК, а также содержания 5-ОИУК во фронтальной коре и прилежащем ядре крыс Вистар (рис. 3Б, 6), а также увеличение оборота дофамина во фронтальной коре, гиппокампе и хвостатом ядре мышей линии C57Bl/6N (рис. 3А, 4А, 5А) согласуется с данными литературы о паттерне активации моноаминергических систем вследствие острого стресса. Так, электрическое раздражение конечностей [14, 24], иммобилизационный стресс [11, 25, 26], стресс социального взаимодействия [27, 28], тоническая боль [29, 30], реакция на условные стимулы, предшествующие стрессу [31, 32], сопровождаются увеличением содержания дофамина и других моноаминов и их высвобождения в коре и прилежащем ядре. Таким образом, в.б. введение является нейрохимически значимым фактором стресса для грызунов.
Наши данные не выявили значимых изменений в норадреналиновой системе при в.б. введении физиологического раствора и указали только на небольшие изменения в обороте серотонина во фронтальной коре крыс. Обнаруженная нами меньшая “заинтересованность” норадренергической и серотонинергической систем может свидетельствовать о меньшей интенсивности стресса в.б. введения по сравнению со стрессом неизбегаемого плавания, иммобилизации, подвешивания за хвост и электрического раздражения конечностей [13, 33, 34]. Однако в проведенном исследовании мы не определяли содержание основного метаболита норадреналина 3-метокси-4-гидроксифенилгликоля и поэтому не оценивали показатель его оборота, который может быть повышен при введении физиологического раствора.
В противоположность крысам, у мышей были обнаружены значимые изменения в норадренергической системе, которые выражались в снижении содержания норадреналина в гиппокампе и гипоталамусе (рис. 4А, 7А). Эти результаты согласуются с данными, в которых описывается снижение общего содержания норадреналина и увеличение его оборота в мозге мышей в таких стрессовых ситуациях, как предъявление хищника, электрическое раздражение конечностей, неизбегаемое плавание [35–37]. Обнаруженные нами различия в реакции норадренергической системы у крыс Вистар и мышей C57Bl/6 указывает на видоспецифичность реакции на стрессовое воздействие в.б. ведения физиологического раствора у последних. Анализ результатов еще раз указывает на важность оценки оборота норадреналина для осуществления более полного описания ответа на стресс.
Сходство изменений в дофаминергической системе у мышей и крыс свидетельствует о том, что эта компонента нейрохимического ответа на стресс в.б. введения физиологического раствора у двух видов животных может быть характеристической. Специфические изменения в дофаминергической передаче вследствие в.б. введения физиологического раствора указывают на функциональную особенность активированных при этом процессов и, следовательно, на специфичность их поведенческого проявления. В наших экспериментах динамика изменений в общей и центральной дистанции после в.б. введения физиологического раствора не отличалась драматически от динамики этих параметров у интактных животных (рис. 1А, Б). Это позволяет предположить, что ни система базальныех ганглиев, регулирующих локомоторную активность, ни нервные пути, ответственные за тревожность [38, 39] не выступают в качестве субстрата, вовлеченного в наблюдаемые изменения в дофаминергической системе. Поэтому активация дофаминергической передачи во фронтальной коре и прилежащем ядре, наблюдаемая в нашем исследовании, скорее может быть рассмотрена в контексте роли дофамина в обучении и памяти.
Как известно, недостаток или, наоборот, избыток высвобождения дофамина [40, 41] оказывает влияние на рабочую память, принятие решений, планирование действий [42–49] и может изменять как настоящее, так и будущее адаптивное поведение животных [50]. Активация дофаминергической передачи во фронтальной коре при в.б. введении физиологического раствора может усиливать стимуляцию D1- и D-дофаминовых рецепторов и способствовать консолидации памяти о значимом событии в.б. инъекции путем потенцирования механизмов рабочей памяти [50, 51]. Более того, переходящие изменения в уровне дофаминергической нейропередачи во фронтальной коре могут приводить к дефициту внимания и поведенческой гибкости, а также к угнетению эмоционального ответа, и определять недостаточность специфичного контексту адаптивного ответа на будущий стрессор [52]. В свою очередь, дофаминергическая передача в прилежащем ядре имеет ключевое значение в кодировании сигнала ошибки предикции, а также в интеграции эмоциональной и контекстной информации во время стресса [53, 54]. Следовательно, стресс-ассоциированное повышение высвобождения дофамина после в.б. введения физиологического раствора может способствовать усилению механизмов обучения значимым стимулам и обусловливания ответа на наркотические вещества [55–57].
ЗАКЛЮЧЕНИЕ
Обнаруженные нами в экспериментах с системным введением физиологического раствора активация ГГА системы и изменения нейрохимического профиля, сходные с таковыми при воздействии стрессовых процедур, позволяют характеризовать в.б. введение физиологического раствора грызунам как острый стресс. Преимущественные изменения нейрохимических параметров дофаминергической системы у обоих видов животных во фронтальной коре говорят в пользу того, что такие изменения являются характерными при стрессе субмаксимальной интенсивности и указывают на возможные изменения в ассоциативных механизмах и памяти у грызунов после однократного в.б. введения физиологического раствора [58]. Поэтому планирование и интерпретация нейрофизиологических исследований, в дизайн которых входят в.б. инъекция (иньекции) и особенно, направленные на изучение памяти и обучения [59], должны проводиться с учетом влияния стресса в.б. инъекции, модулирующего дофаминергическую систему.
Список литературы
Ghosal S., Nunley A., Mahbod P., Lewis A.G., Smith E.P., Tong J., D’Alessio D.A., Herman J.P. Mouse handling limits the impact of stress on metabolic endpoints. Physiology & Behavior. 150: 31–37. 2015.
Gouveia K., Hurst J.L. Optimising reliability of mouse performance in behavioural testing: the major role of non-aversive handling. Scient. Rep. 7: 44999. 2017.
Stuart S.A., Robinson E.S. Reducing the stress of drug administration: Implications for the 3Rs. Scient. Rep. 5: 14288. 2015.
Wahlsten D. Mouse Behavioral Testing: How to Use Mice in Behavioral Neuroscienceю 1st Edition ed. Acad. Press. London. 2011.
Buccafusco J.J. Methods of Behavior Analysis in Neuroscience. 2nd ed, Boca Raton (FL). CRC Press.Taylor & Francis. 2009.
Steiner M.A., Marsicano G., Nestler E.J., Holsboer F., Lutz B., Wotjak C.T. Antidepressant-like behavioral effects of impaired cannabinoid receptor type 1 signaling coincide with exaggerated corticosterone secretion in mice. Psychoneuroendocrinology. 33(1): 54–67. 2008.
Baek J.M., Kwak S.C., Kim J.Y., Ahn S.J., Jun H.Y., Yoon K.H., Lee M.S., Oh J. Evaluation of a novel technique for intraperitoneal injections in mice. Lab. Animal. 44. 440–444. 2015.
Hunter R.G., Gagnidze K., McEwen B.S., Pfaff D.W. Stress and the dynamic genome: Steroids, epigenetics, and the transposome. Proc. Natl. Acad. Sci. U.S.A 112. 6828–6833. 2015.
McEwen B.S. Neurobiological and Systemic Effects of Chronic Stress. Chronic Stress 1. 2017.
Nasca C., Zelli D., Bigio B., Piccinin S., Scaccianoce S., Nistico R., McEwen B.S. Stress dynamically regulates behavior and glutamatergic gene expression in hippocampus by opening a window of epigenetic plasticity. Proc. Natl. Acad. Sci. U.S.A. 112. 14960–14965. 2015.
Abercrombie E.D., Keefe K.A., DiFrischia D.S., Zigmond M.J. Differential effect of stress on in vivo dopamine release in striatum, nucleus accumbens, and medial frontal cortex. J. Neurochem. 52. 1655–1658. 1989.
Cabib S., Kempf E., Schleef C., Mele A., Puglisi-Allegra S. Different effects of acute and chronic stress on two dopamine-mediated behaviors in the mouse. Physiology & Behavior. 43. 223–227. 1988.
Hajos-Korcsok E., Robinson D.D., Yu J.H., Fitch C.S., Walker E., Merchant K.M. Rapid habituation of hippocampal serotonin and norepinephrine release and anxiety-related behaviors, but not plasma corticosterone levels, to repeated footshock stress in rats. Pharmacol. Biochemi. Behav. 74. 609–616. 2003.
Kalivas P.W., Duffy P. Selective activation of dopamine transmission in the shell of the nucleus accumbens by stress. Brain Res. 675. 325–328. 1995.
Yen Y.C., Gassen N.C., Zellner A., Rein T., Landgraf R., Wotjak C.T., Anderzhanova E. Glycogen synthase kinase-3beta inhibition in the medial prefrontal cortex mediates paradoxical amphetamine action in a mouse model of ADHD. Front. Behav. Neurosci. 9. 67. 2015.
Kao C.Y., Stalla G., Stalla J., Wotjak C.T., Anderzhanova E. Norepinephrine and corticosterone in the medial prefrontal cortex and hippocampus predict PTSD-like symptoms in mice. Eur. J. Neurosci. 41. 1139–1148. 2015.
Paxinos G., Franklin K.B.J. The Mouse Brain in Stereotaxic Coordinates. 2nd Edition. Acad. Press. San Diego. 2001.
Андяржанова Э.А., Вотьяк С.Т. Влияние центральных β-адренергических рецепторов на высвобождение кортикостерона во время стресса у мышей. Рос. физиол. журн. им. И.М. Сеченова. 105(8): 1013–1020. 2019. [Anderzhanova E.A., Wotjak C.T. Central β-adrenergic receptor signaling is involved in the tuning of stress-evoked corticosterone secretion in mice. Russ. J. Physiol. 105 (8): 1013–1020. 2019. (In Russ.)].
Андяржанова Э.А., Кудрин В.С., Вотьяк С.Т. Влияние эндоканнабиноида анандамида на эффективность норадренергическое нейропередачи в миндалевидном теле при остром стрессе у мышей. Рос.физиол. журн. им. И.М. Сеченова 105(9): 1122–1132. 2019. [Anderzhanova E.A., Kudrin V.S., Wotjak C.T. Anandamide prevents activation of norepinephrine transmission in the amygdala during acute stress in mice. Russ. J. Physiol. 105(9). 1122–1132. 2019. (In Russ.)].
Anderzhanova E.A., Bachli H., Buneeva O.A., Narkevich V.B., Medvedev A.E., Thoeringer C.K., Wotjak C.T., Kudrin V.S. Strain differences in profiles of dopaminergic neurotransmission in the prefrontal cortex of the BALB/C vs. C57Bl/6 mice: Consequences of stress and afobazole. Eur. J. Pharmacol. 708. 95–104. 2013.
Bolivar V.J. Intrasession and intersession habituation in mice: from inbred strain variability to linkage analysis. Neurobiol. Learn. Memory 92. 206–214. 2009.
Yau J.L., Noble J., Kenyon C.J., Ludwig M., Seckl J.R. Diurnal and stress-induced intra-hippocampal corticosterone rise attenuated in 11beta-HSD1-deficient mice: A microdialysis study in young and aged mice. Eur. J. Neurosci. 41. 787–792. 2015.
Golub Y., Mauch C.P., Dahlhoff M., Wotjak C.T. Consequences of extinction training on associative and non-associative fear in a mouse model of Posttraumatic Stress Disorder (PTSD). Behav. Brain Res. 205. 544–549. 2009.
Robinson T.E., Becker J.B., Young E.A., Akil H., Castaneda E. The effects of footshock stress on regional brain dopamine metabolism and pituitary beta-endorphin release in rats previously sensitized to amphetamine. Neuropharmacology. 26. 679–691. 1987.
Ling T.J., Forster G.L., Watt M.J., Korzan W.J., Renner K.J., Summers C.H. Social status differentiates rapid neuroendocrine responses to restraint stress. Physiology & Behavior. 96. 218–232. 2009.
Puglisi-Allegra S., Imperato A., Angelucci L., Cabib S. Acute stress induces time-dependent responses in dopamine mesolimbic system. Brain Res. 554. 217–222. 1991.
Anstrom K.K., Miczek K.A., Budygin E.A. Increased phasic dopamine signaling in the mesolimbic pathway during social defeat in rats. Neuroscience. 161. 3–12. 2009.
Tidey J.W., Miczek K.A. Social defeat stress selectively alters mesocorticolimbic dopamine release: an in vivo microdialysis study. Brain Res. 721. 140–149. 1996.
Altier N., Stewart J. The role of dopamine in the nucleus accumbens in analgesia. Life Sci. 65. 2269–2287. 1999.
Navratilova E., Xie J.Y., Okun A., Qu C., Eyde N., Ci S., Ossipov M.H., King T., Fields H.L., Porreca F. Pain relief produces negative reinforcement through activation of mesolimbic reward-valuation circuitry. Proc. Natl. Acad. Sci. U.S.A. 109. 20709–20713. 2012.
Badrinarayan A., Wescott S.A., Vander Weele C.M., Saunders B.T., Couturier B.E., Maren S., Aragona B.J. Aversive stimuli differentially modulate real-time dopamine transmission dynamics within the nucleus accumbens core and shell. J. Neurosci. Official J. Society Neurosci. 32. 15779–15790. 2012.
Murphy C.A., Pezze M., Feldon J., Heidbreder C. Differential involvement of dopamine in the shell and core of the nucleus accumbens in the expression of latent inhibition to an aversively conditioned stimulus. Neuroscience. 97. 469–477. 2000.
Mahar I., Bambico F.R., Mechawar N., Nobrega J.N. Stress, serotonin, and hippocampal neurogenesis in relation to depression and antidepressant effects. Neurosci. Biobehav. Rev. 38. 173–192. 2014.
Renard C.E., Dailly E., David D.J., Hascoet M., Bourin M. Monoamine metabolism changes following the mouse forced swimming test but not the tail suspension test. Fundament. Clin. Pharmacol. 17. 449–455. 2003.
Hayley S., Borowski T., Merali Z., Anisman H. Central monoamine activity in genetically distinct strains of mice following a psychogenic stressor: Effects of predator exposure. Brain Res. 892(2): 293–300. 2001.
Shanks N., Zalcman S., Zacharko R.M., Anisman H. Alterations of central norepinephrine, dopamine and serotonin in several strains of mice following acute stressor exposure. Pharmacol. Biochem. Behav. 38 (1): 69–75. 1991.
Miura H., Naoi M., Nakahara D., Ohta T., Nagatsu T. Effects of moclobemide on forced-swimming stress and brain monoamine levels in mice. Pharmacol. Biochem. Behav. 53 (2): 469–475. 1996.
Carlsson A., Hansson L.O., Waters N., Carlsson M.L. Neurotransmitter aberrations in schizophrenia: new perspectives and therapeutic implications. Life Sci. 61. 75–94. 1997.
Labonte B., McLaughlin R.J., Dominguez-Lopez S., Bambico F.R., Lucchino I., Ochoa-Sanchez R., Leyton M., Gobbi G. Adolescent amphetamine exposure elicits dose-specific effects on monoaminergic neurotransmission and behaviour in adulthood. Internat. J. Neuropsychopharmacol. 15. 1319–1330. 2012.
Arnsten A.F. Catecholamine and second messenger influences on prefrontal cortical networks of “representational knowledge”: A rational bridge between genetics and the symptoms of mental illness. Cerebr. Cortex. 17. Suppl 1. 6–15. 2007.
Cools R., D’Esposito M. Inverted-U-shaped dopamine actions on human working memory and cognitive control. Biol. Psychiatry. 69. 113–125. 2011.
Arnsten A.F., Goldman-Rakic P.S. Noise stress impairs prefrontal cortical cognitive function in monkeys: Evidence for a hyperdopaminergic mechanism. Archiv. Gener. Psychiatry. 55. 362–368. 1998.
Broersen L.M. Attentional processes and learning and memory in rats: The prefrontal cortex and hippocampus compared. Progress Brain Res. 126. 79–94. 2000.
Gamo N.J., Lur G., Higley M.J., Wang M., Paspalas C.D., Vijayraghavan S., Yang Y., Ramos B.P., Peng K., Kata A., Boven L., Lin F., Roman L., Lee D., Arnsten A.F. Stress Impairs Prefrontal Cortical Function via D1 Dopamine Receptor Interactions With Hyperpolarization-Activated Cyclic Nucleotide-Gated Channels. Biol. Psychiatry. 78. 860–870. 2015.
Glickstein S.B., Hof P.R., Schmauss C. Mice lacking dopamine D2 and D3 receptors have spatial working memory deficits. J. Neurosci. Official J. Society Neurosci. 22. 5619–5629. 2002.
Mizoguchi K., Yuzurihara M., Ishige A., Sasaki H., Chui D.H., Tabira T. Chronic stress induces impairment of spatial working memory because of prefrontal dopaminergic dysfunction. J. Neurosci. Official J. Society Neurosci. 20. 1568–1574. 2000.
Puig M.V., Rose J., Schmidt R., Freund N. Dopamine modulation of learning and memory in the prefrontal cortex: Insights from studies in primates, rodents, and birds. Front. Neur. Circuits. 8. 93. 2014.
Tse M.T., Cantor A., Floresco S.B. Repeated amphetamine exposure disrupts dopaminergic modulation of amygdala-prefrontal circuitry and cognitive/emotional functioning. J. Neurosci. Official J. Society Neurosci. 31. 11282–11294. 2011.
Wass C., Pizzo A., Sauce B., Kawasumi Y., Sturzoiu T., Ree F., Otto T., Matzel L.D. Dopamine D1 sensitivity in the prefrontal cortex predicts general cognitive abilities and is modulated by working memory training. Learning & Memory. 20. 617–627. 2013.
McKlveen J.M., Myers B., Herman J.P. The medial prefrontal cortex: coordinator of autonomic, neuroendocrine and behavioural responses to stress. J. Neuroendocrinol. 27. 446–456. 2015.
Barsegyan A., Mackenzie S.M., Kurose B.D., McGaugh J.L., Roozendaal B. Glucocorticoids in the prefrontal cortex enhance memory consolidation and impair working memory by a common neural mechanism. Proc. Natl. Acad. Sci. U.S.A. 107. 16655–16660. 2010.
Myers B., McKlveen J.M., Herman J.P. Glucocorticoid actions on synapses, circuits, and behavior: implications for the energetics of stress. Front. Neuroendocrinol. 35. 180–196. 2014.
Gill K.M., Grace A.A. Differential effects of acute and repeated stress on hippocampus and amygdala inputs to the nucleus accumbens shell. Internat. J. Neuropsychopharmacol. 16. 2013–2025. 2013.
Goto Y., Grace A.A. Dopamine-dependent interactions between limbic and prefrontal cortical plasticity in the nucleus accumbens: Disruption by cocaine sensitization. Neuron. 47. 255–266. 2005.
Ikegami M., Uemura T., Kishioka A., Sakimura K., Mishina M. Striatal dopamine D1 receptor is essential for contextual fear conditioning. Scient. Reports. 4. 3976. 2014.
Schultz W. Predictive reward signal of dopamine neurons. J. Neurophysiol. 80. 1–27. 1998.
White N.M., Salinas J.A. Mnemonic functions of dorsal striatum and hippocampus in aversive conditioning. Behav. Brain Res. 142. 99–107. 2003.
Schultz W. Dopamine reward prediction-error signalling: A two-component response. Nat. Rev. Neurosci. 17. 183–195. 2016.
Pryce C.R., Azzinnari D., Sigrist H., Gschwind T., Lesch K.P., Seifritz E. Establishing a learned-helplessness effect paradigm in C57BL/6 mice: behavioural evidence for emotional, motivational and cognitive effects of aversive uncontrollability per se. Neuropharmacology. 62. 358–372. 2012.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


