Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 2, стр. 150-164
Особенности функционального состояния гипоталамо-гипофизарно-адренокортикальной системы у крыс линии Крушинского–Молодкиной
Е. Л. Горбачёва 1, *, А. А. Куликов 1, Е. В. Черниговская 1, М. В. Глазова 1, Л. С. Никитина 1
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
* E-mail: jengorbacheva@gmail.com
Поступила в редакцию 14.11.2018
После доработки 28.11.2018
Принята к публикации 09.12.2018
Аннотация
Целью настоящей работы являлась оценка межлинейных различий в функциональном состоянии гипоталамо-гипофизарно-адренокортикальной системы (ГГАКС) у интактных крыс линии Вистар и линии Крушинского–Молодкиной (КМ), являющихся генетической моделью рефлекторной аудиогенной эпилепсии, и анализ динамики изменений ГГАКС у крыс линии КМ в ходе и после судорожного припадка. Полученные результаты показали, что у крыс линии КМ понижена активность кортиколиберинергических нейронов, вследствие повышенного тормозного влияния ГАМКергических нейронов. В передней доле гипофиза было отмечено повышенное содержание проопиомеланокортина (ПОМК) и адренокортикотропного гормона (АКТГ). При этом, базальный уровень АКТГ и кортикостерона в крови у крыс линий КМ и Вистар не отличается. Таким образом, полученные данные свидетельствуют о существовании нарушений во взаимодействии гипоталамуса и гипофиза у крыс линии КМ, что по-видимому, может являться одним из возможных механизмов, обеспечивающих поддержание концентрации гормонов в крови на уровне, характерном для контрольных крыс материнской линии Вистар. Однократный судорожный припадок у крыс линии КМ приводит к усилению выведения кортиколиберина и вазопрессина в портальный кровоток, а также АКТГ в системный кровоток непосредственно на клонико-тонической стадии, которая развивается спустя 6–10 с с момента предъявления звукового сигнала. Также показано продолжительное повышение уровня кортикостерона в крови в течение 24 ч. Звуковая стимуляция с теми же параметрами у крыс линии Вистар не приводила к достоверным изменениям в концентрации АКТГ и кортикостерона в крови. Таким образом, полученные данные указывают на специфический характер активации ГГАКС у крыс линии КМ, что является следствием распространения эпилептиформной активности в мозге и свидетельствуют о волеченности ГГАКС в реализацию судорожной активности.
Эпилепсия является одним из распространенных неврологических заболеваний и включает в себя неоднородную группу синдромов, характерной чертой большинства из которых является развитие спонтанных повторяющихся судорожных приступов [1]. В связи с гетерогенностью данного заболевания изучение молекулярных механизмов патогенеза различных типов эпилепсии, в том числе рефлекторной, в настоящее время является одной из актуальных задач медико-биологических исследований. Для рефлекторной эпилепсии характерно развитие эпилептиформного припадка в результате воздействия сенсорного стимула (акустического, визуального и др.) [2]. Одной из экспериментальных моделей для исследования рефлекторной аудиогенной эпилепсии являются крысы линии Крушинского–Молодкиной (КМ). Данная линия крыс стала результатом селекции и близкородственного скрещивания крыс линии Вистар, демонстрирующих судорожные припадки при звуковой стимуляции [3]. В настоящее время в более 99% случаев крысы линии КМ в 3-х месячном возрасте в ответ на звуковое воздействие демонстрируют развернутый судорожный припадок, который характеризуется стадией дикого бега, клонико-тоническими судорогами и постиктальной депрессией. Использование крыс линии КМ является адекватным подходом для изучения факторов, способствующих развитию предрасположенности к заболеванию [4].
Известно, что наряду с нейромедиаторными системами, эндокринная система, в частности ГГАКС, может быть вовлечена в регуляцию эпилептиформной активности [5]. На различных моделях эпилепсии было продемонстрировано, что гормоны ГГАКС могут оказывать разнонаправленное действие на судорожный припадок [5]. Показано, что кортиколиберин и кортикостерон способны повышать нейрональную возбудимость и восприимчивость к судорогам [6]. Особенно уязвимыми являются структуры лимбической системы [7]. В то же время применение АКТГ является одним из вариантов рекомендуемых схем лечения инфантильных спазмов [8].
Известно, что судорожные припадки различной этиологии сопровождаются активацией ГГАКС [9, 10]. В настоящее время существует относительно немного работ, в которых был проведен анализ влияния аудиогенного припадка на активность периферического звена ГГАКС у крыс линии КМ [11]. При этом характер изменений активности центральных звеньев ГГАКС и механизмов их регуляции при судорожной активности в настоящее время не изучен.
В данном исследовании была проведена оценка зависимости активности ГГАКС от предрасположенности к аудиогенной эпилепсии. Активность ГГАКС оценивалась на основании содержания кортиколиберина и вазопрессина в гипоталамусе, ПОМК и АКТГ в передней доле гипофиза, а также уровня АКТГ и кортикостерона в крови. Для исследования механизмов регуляции состояния центральных звеньев ГГАКС нами были проанализированы межлинейные различия в ГАМК-ергической иннервации гипоталамуса у крыс линии Вистар и линии КМ, в связи с тем, что ГАМК является основным нейромедиатором, участвующим в регуляции активности нейронов мелкоклеточной части паравентрикулярного ядра (ПВЯ) гипоталамуса [12]. ГАМК-ергическая иннервация гипоталамуса оценивалась на основании содержания глутаматдекарбоксилазы (GAD67) в волокнах, иннервирующих нейроны ПВЯ гипоталамуса и наружную зону срединного возвышения, в связи с тем, что уровень фермента отражает уровень синтеза нейромедиатора в нейронах и таким образом используется в качестве маркера содержания ГАМК [13]. Анализ содержания белка cFos в нейронах ПВЯ гипоталамуса и активной формы транскрипционного фактора CREB в передней доле гипофиза позволили оценить интенсивность экспрессии кортиколиберина и ПОМК соответственно [14, 15]. Анализ содержания белка, участвующего в экзоцитозе секреторных гранул, SNAP25 в передней доле гипофиза позволил оценить уровень секреции АКТГ в системный кровоток [16].
Также была проанализирована динамика изменения активности обоих центральных и периферического звеньев ГГАКС в ходе судорожного припадка. Известно, что для грызунов интенсивный звук является одним из стрессорных факторов, способствующих активации ГГАКС [17]. Поэтому, для того чтобы определить является ли активация ГГАКС у крыс линии КМ следствием распространения эпилептиформной активности в мозге или следствием реакции на акустический стресс, был проведен эксперимент, в ходе которого мы проанализировали влияние звуковой стимуляции с теми же параметрами на содержание гормонов ГГАКС в крови у крыс линии Вистар.
МЕТОДЫ ИССЛЕДОВАНИЯ
В работе были использованы половозрелые самцы крыс линии Вистар (n = 30) и крыс линии КМ (n = 26) в возрасте 4.5–6 мес., массой 300–400 г. Животные содержались в стандартных условиях вивария со свободным доступом к воде и еде. Все процедуры с использованием животных проводились согласно этическим принципам, изложенным в Европейской конвенции по защите позвоночных животных, используемых для экспериментальных и других научных целей, и были одобрены этической комиссией ИЭФБ РАН.
1. Для оценки межлинейных различий в функциональном состоянии ГГАКС были использованы интактные половозрелые самцы крыс линии Вистар (n = 10) и линии КМ (n = 9).
2. Для оценки влияния однократного аудиогенного судорожного припадка на функциональное состояние ГГАКС крыс линии КМ подвергали звуковой стимуляции интенсивностью 50 Дб и частотой 10 кГц. В эксперименте были проанализированы следующие группы крыс линии КМ: контрольная группа (n = 5), на стадии клонико-тонических судорог (n = 4), через 1 ч после окончания судорожного припадка (n = 4), через 24 ч после окончания судорожного припадка (n = 4).
3. Для того чтобы исключить влияние аудиогенного стресса на функциональное состояние ГГАКС у крыс линии КМ, крыс линии Вистар также подвергали звуковой стимуляции с теми же параметрами в течение 1 мин. В эксперименте были проанализированы следующие группы крыс линии Вистар: контрольная группа (n = 5), сразу после окончания звуковой стимуляции (n = 5), через 1 ч после звуковой стимуляции (n = 5), через 24 ч после звуковой стимуляции (n = 5).
Во всех экспериментах после декапитации у каждого животного были взяты образцы крови. Для получения сыворотки пробирки с кровью центрифугировали 25 мин при 1800 g при температуре 4°С и отбирали супернатант.
В первом и втором экспериментах головной мозг фиксировали в 4%-ном параформальдегиде на фосфатно-солевом буфере (PBS: (мМ) 137 NaCl; 2.7 KCl; 10 Na2HPO4; 1.76 KH2PO4; рН 7.4) в течение 7 дней. После этого следовали 3 промывки головного мозга в PBS. Затем головной мозг погружали в 20%-ный раствор сахарозы на PBS. Головной мозг был заморожен. Серии чередующихся срезов гипоталамо-гипофизарной системы были приготовлены во фронтальной плоскости толщиной 8 мкм на криостате.
В первом эксперименте из головного мозга иссекали гипоталамус и гипофиз для приготовления проб для вестерн-блот анализа. Образцы гомогенизировали в лизирующем буфере, содержащем ингибиторы протеаз и фосфатаз. Лизаты центрифугировали 15 мин при 12 000 g при комнатной температуре, затем отбирали супернатант, после чего к одной части отобранного супернатанта добавляли 2 части 3х SDS буфера, содержащего 0.2 М Трис-HCl, pH 6.7; 6% додецилсульфат натрия; 15% глицерина; 0.003% бромфенолового синего и 10% β-меркаптоэтанол, и инкубировали 10 мин при температуре +96°С.
Иммуноферментный анализ. Концентрация АКТГ и кортикостерона в сыворотке крови была оценена с помощью коммерческого набора для иммуноферментного определения АКТГ (Phoenix Pharmaceuticals, № EKE-001-21) и кортикостерона (Arbor Assays № K014-C1; Хема, № K210R) согласно инструкции производителя.
Иммуногистохимический анализ. Иммуногистохимический анализ был проведен стрептавидин-биотиновым методом по стандартному протоколу. Срезы инкубировали в растворе первичных антител против кортиколиберина (1 : 1000; Peninsula Lab. № T-4037), нейрофизина II (1 : 1000; PS 41, любезно предоставленных Dr. Harold Gainer, NIH, Bethesda, США) [18], GAD67 (1 : 1000; Millipore № MAB5406), фосфо-CREB (Ser133; 1 : 600; Upstate № 05-807), cFos (1 : 1000; Calbiochem № PC38) в течение 18 ч при температуре 24°C (кортиколиберин, фосфо-CREB, GAD67) или в течение 48 ч при температуре 4°C (нейрофизин II, cFos). После этого следовала инкубация с биотинилированными вторичными антителами против иммуноглобулинов G кролика или мыши (BA-1000 или BA-9200, Vector Laboratories, Inc.), разведенными 1 : 500 и со стрептавидин-пероксидазным комплексом (S2438, Sigma-Aldrich) в разведении 1 : 700 в течение часа каждая. Для визуализации реакции срезы инкубировали в растворе 3,3'-диаминобензидина (0.05%) и перекиси водорода (0.01%) в течение 7 мин. Все препараты серии были обработаны параллельно. Для оценки специфичности иммунного окрашивания в каждом случае делали отрицательный контроль (выполнение иммуногистохимической реакции без первичных антител), результатом чего было отсутствие иммунного окрашивания. Анализ производили с помощью светового микроскопа Zeiss Axio Imager A1.
Вестерн-блот анализ. Разделение белков в пробах по их молекулярной массе происходило с помощью электрофореза в 10%-ном полиакриламидном геле по Лэммли (SDS-PAGE). Затем белковые фракции переносились на нитроцеллюлозную мембрану (GVS, США), после чего следовала инкубация мембран в растворе первичных антител против кортиколиберина (1 : 3000; Peninsula Lab. № T-4037), АКТГ (1 : 2000; Millipore № AB902), SNAP25 (1 : 1000; Chemicon № MAB331), актина (1 : 2000; Abcam № 3280) и тубулина (1 : 1000; Cell Signaling Technology № 2148). После промывок мембраны инкубировали с вторичными антителами, конъюгированными с пероксидазой хрена: против иммуноглобулина G кролика (1 : 10 000; А0545, Sigma-Aldrich) или против иммуноглобулина G мыши (1 : 40 000; А9044, Sigma-Aldrich). Реакцию визуализировали с помощью набора ECL plus (Thermo Fisher Scientific № 34075) по протоколу производителя. Денситометрический анализ проводили с использованием программы ImageJ. Нормирование уровня экспрессии белков интереса проводили по уровню экспрессии референсных белков актина и/или тубулина.
Морфометрический анализ препаратов. Оценка содержания кортиколиберина, нейрофизина II, cFos в нейронах мелкоклеточной части ПВЯ гипоталамуса, GAD67 в волокнах, иннервирующих эти нейроны, а также фосфо-CREB в аденогипофизе производилась на основании измерения оптической плотности иммунореактивного вещества и подсчета количества иммуномеченных ядер с помощью программного обеспечения PhotoM и ImageJ. Данные были выражены в условных единицах оптической плотности или числом иммуномеченных ядер.
Статистический анализ данных. Данные представлены в виде среднего ± стандартное отклонение. Сравнение независимых выборок проводили с помощью непараметрического критерия Манна–Уитни (Mann–Whitney U-test) или непараметрического теста Краскела–Уоллиса (Kruskal–Wallis test) с использованием программного обеспечения GraphPad Prism7. Различия считали достоверными при уровне значимости p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
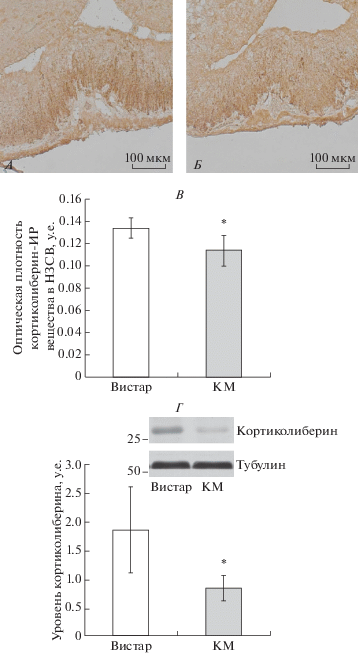
Межлинейные различия в функциональном состоянии ГГАКС у интактных крыс линий КМ и Вистар. Было показано, что у крыс линии КМ по сравнению с крысами линии Вистар содержание GAD67 было повышено в волокнах, иннервирующих нейроны мелкоклеточной части ПВЯ гипоталамуса (Вистар 0.232 ± 0.01 и КМ 0.273 ± 0.025, р < 0.05), а также в волокнах, иннервирующих наружную зону срединного возвышения (Вистар 0.059 ± 0.005 и КМ 0.069 ± 0.005, р < 0.05). При этом мы показали, что у крыс линии КМ оптическая плотность кортиколиберин-иммунореактивного вещества была ниже в нейронах ПВЯ гипоталамуса (Вистар 0.124 ± 0.004 и КМ 0.118 ± 0.004, р < 0.05) и в наружной зоне срединного возвышения, чем у крыс линии Вистар (рис. 1А–В). Пониженное содержание кортиколиберина в гипоталамусе у крыс линии КМ по сравнению с крысами линии Вистар также было продемонстрировано и с помощью вестерн-блот анализа (рис. 1Г).
Рис. 1.
Оценка содержания кортиколиберина в гипоталамусе интактных крыс линий Вистар и КМ. Иммуногистохимическое выявление кортиколиберина в волокнах наружной зоны срединного возвышения крыс линии Вистар (А) и линии КМ (Б). В – Содержание кортиколиберина в наружной зоне срединного возвышения (НЗСВ). Белые столбики – интактные крысы линии Вистар. Темные столбики – интактные крысы линии КМ. Средняя оптическая плотность выражена в условных единицах ± стандартное отклонение. * – p < 0.05 статистически достоверные различия между линиями крыс. Г – Вестерн-блот анализ содержания кортиколиберина в гипоталамусе крыс линий Вистар и КМ. Значения нормировали по тубулину. Белые столбики – интактные крысы линии Вистар. Темные столбики – интактные крысы линии КМ Средняя оптическая плотность выражена в условных единицах ± стандартное отклонение. * – p < 0.05 статистически достоверные различия между линиями крыс.
Для оценки содержания и распределения вазопрессина в нейронах мелкоклеточной части ПВЯ гипоталамуса иммуногистохимически был выявлен нейрофизин II, который совместно с вазопрессином синтезируется из общего препрогормона, транспортируется и секретируется в эквимолярных количествах [19]. Различий в оптической плотности вазопрессин-нейрофизин II-иммунореактивного вещества в нейронах мелкоклеточной части ПВЯ (Вистар 0.185 ± 0.012 и КМ 0.182 ± 0.029) и в наружной зоне срединного возвышения (Вистар 0.059 ± 0.004 и КМ 0.057 ± 0.006) у крыс линии КМ и линии Вистар выявлено не было.
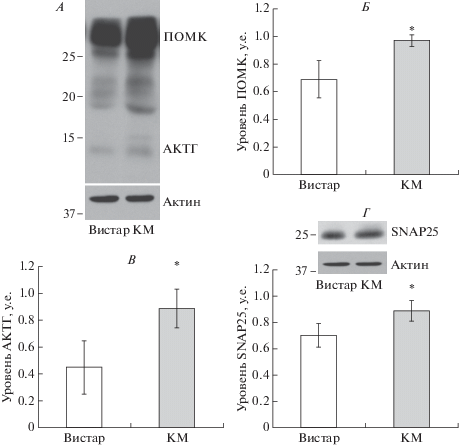
В передней доле гипофиза у крыс линии КМ по сравнению с крысами линии Вистар было отмечено повышенное количество фосфо-CREB-иммунопозитивных ядер (Вистар 411 ± 17 и КМ 435 ± 9, р < 0.05), а также повышенное содержание ПОМК и АКТГ (рис. 2А–В). Содержание SNAP25 в аденогипофизе у крыс линии КМ также было достоверно выше, чем у крыс линии Вистар (рис. 2Г). При этом концентрация АКТГ (Вистар 1.118 ± 0.257 и КМ 1.137 ± 0.254) и кортикостерона (Вистар 216.46 ± 84.34 и КМ 156.19 ± 70.85) в сыворотке крови у крыс линии Вистар и линии КМ не различалась.
Рис. 2.
Оценка уровня ПОМК, АКТГ и SNAP25 в передней доле гипофиза интактных крыс линий Вистар и КМ. А – Вестерн-блот анализ содержания ПОМК и АКТГ в передней доле гипофиза крыс линий Вистар и КМ. Значения нормировали по актину. Содержание ПОМК (Б) и АКТГ (В) в передней доле гипофиза крыс линий Вистар и КМ. Белые столбики – интактные крысы линии Вистар. Темные столбики – интактные крысы линии КМ. Средняя оптическая плотность выражена в условных единицах ± стандартное отклонение. * – p < 0.05 статистически достоверные различия между линиями крыс. Г – Вестерн-блот анализ содержания SNAP25 в передней доле гипофиза крыс линий Вистар и КМ. Значения нормировали по актину. Белые столбики – интактные крысы линии Вистар. Темные столбики – интактные крысы линии КМ. Средняя оптическая плотность выражена в условных единицах ± стандартное отклонение. * – p < 0.05 статистически достоверные различия между линиями крыс.
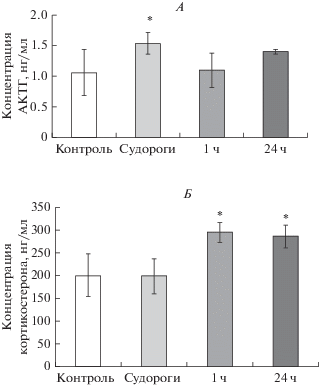
Влияние однократного судорожного припадка на функциональное состояние ГГАКС крыс линии КМ. Мы показали, что количество cFos-иммунопозитивных ядер в нейронах мелкоклеточной части ПВЯ гипоталамуса крыс линии КМ на клонико-тонической стадии судорожного припадка не отличалось от такового в контроле (рис. 3В). Однако через 1 ч после завершения судорожного припадка количество cFos-иммунопозитивных ядер в нейронах мелкоклеточной части ПВЯ гипоталамуса крыс линии КМ значительно превышало значения в контроле и на клонико-тонической стадии припадка (рис. 3А–В). При этом мы не выявили изменений в оптической плотности кортиколиберин-иммунореактивного вещества ни в нейронах ПВЯ гипоталамуса (контроль 0.091 ± 0.011; клонико-тонические судороги 0.094 ± 0.014; 1 ч 0.097 ± 0.007; 24 ч 0.084 ± 0.007), ни в волокнах наружной зоны срединного возвышения (контроль 0.148 ± 0.015; клонико-тонические судороги 0.143 ± 0.008; 1 ч 0.149 ± 0.007; 24 ч 0.15 ± 0.004) у крыс линии КМ ни на клонико-тонической стадии судорожного припадка, ни через 1 и 24 ч после его завершения. Однако на клонико-тонической стадии припадка была отмечена транслокация кортиколиберин-иммунопозитивного вещества в периваскулярную область наружной зоны срединного возвышения, а также увеличение размера сосудов (рис. 4А, Б). Кроме того, на клонико-тонической стадии судорожного припадка у крыс линии КМ было показано снижение оптической плотности вазопрессин-нейрофизин II-иммунореактивного вещества в нейронах мелкоклеточной части ПВЯ гипоталамуса и повышение в волокнах наружной зоны срединного возвышения (рис. 5А, Б). Через 1 ч после завершения судорожного припадка содержание вазопрессин-нейрофизина II у крыс линии КМ в нейронах ПВЯ гипоталамуса оставалось пониженным по сравнению с контролем, в то время как в наружной зоне срединного возвышения содержание вазопрессин-нейрофизина II вернулось к контрольным значениям (рис. 5А, Б). Через 24 ч у крыс линии КМ уровень вазопрессин-нейрофизина II в нейронах мелкоклеточной части ПВЯ гипоталамуса не отличался от контрольных значений, при этом в наружной зоне срединного возвышения содержание вазопрессин-нейрофизина II было повышено по сравнению с контролем (рис. 5А, Б). Содержание GAD67 в волокнах, иннервирующих наружную зону срединного возвышения у крыс линии КМ повышалось в ходе и после завершения припадка (контроль 0.084 ± 0.015; клонико-тонические судороги 0.11 ± 0.003; 1 ч 0.104 ± 0.009; 24 ч 0.106 ± 0.008, р < 0.05). Концентрация АКТГ в сыворотке крови у крыс линии КМ повышалась непосредственно на клонико-тонической стадии судорожного припадка по сравнению с контролем (рис. 6А). Через 1 и 24 ч после судорожного припадка уровень АКТГ у крыс линии КМ не отличался от такового в контроле (рис. 6А). Уровень кортикостерона в сыворотке крови у крыс линии КМ повышался через 1 ч после судорожного припадка и оставался на повышенном уровне в течение 24 ч (рис. 6Б).
Рис. 3.
Оценка содержания cFos в нейронах мелкоклеточной части паравентрикулярного ядра гипоталамуса крыс линии КМ, подвергнутых звуковой стимуляции. Иммуногистохимическое выявление cFos в нейронах мелкоклеточной части паравентрикулярного ядра гипоталамуса контрольных крыс линии КМ (А) и крыс линии КМ через 1 ч после судорожного припадка (Б). В – Число cFos-иммунопозитивных ядер в мелкоклеточной части паравентрикулярного ядра гипоталамуса (ПВЯ) у контрольных крыс (контроль, белые столбики), на клонико-тонической стадии судорожного припадка, которая развивалась спустя 6–10 с после предъявления звукового сигнала (судороги, светло-серые столбики), через 1 ч (1 ч, серые столбики) и через 24 ч (24 ч, темно-серые столбики) после окончания судорожного припадка. Данные представлены как среднее число иммуномеченных ядер на ПВЯ ± стандартное отклонение. * – p < 0.05 статистически достоверные различия по сравнению с контролем.
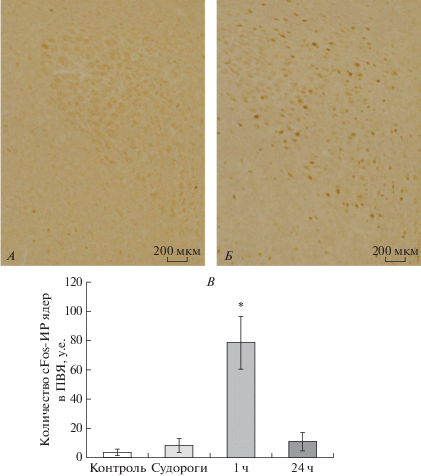
Рис. 4.
Анализ наружной зоны срединного возвышения крыс линии КМ, подвергнутых звуковой стимуляции. Иммуногистохимическое выявление кортиколиберина в волокнах наружной зоны срединного возвышения контрольных крыс линии КМ (А) и крыс этой линии на клонико-тонической стадии судорожного припадка, которая развивалась спустя 6–10 с после предъявления звукового сигнала (Б).

Рис. 5.
Оценка содержания нейрофизина II в нейронах мелкоклеточной части паравентрикулярного ядра гипоталамуса и в волокнах наружной зоны срединного возвышения крыс линии КМ, подвергнутых звуковой стимуляции. Содержание нейрофизина II-иммунореактивного вещества в мелкоклеточной части паравентрикулярного ядра гипоталамуса (мчПВЯ) (А) и в наружной зоне срединного возвышения (НЗСВ) (Б) у контрольных крыс (контроль, белые столбики), на клонико-тонической стадии судорожного припадка, которая развивалась спустя 6–10 с после предъявления звукового сигнала (судороги, светло-серые столбики), через 1 ч (1ч, серые столбики) и через 24 ч (24 ч, темно-серые столбики) после окончания судорожного припадка. Средняя оптическая плотность выражена в условных единицах ± стандартное отклонение. * – p < 0.05 статистически достоверные различия по сравнению с контролем.
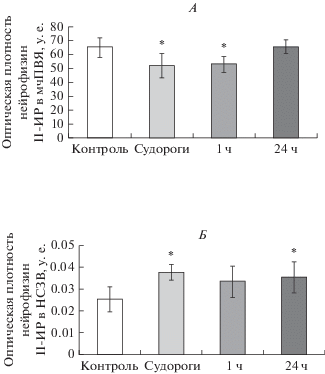
Рис. 6.
Оценка содержания гормонов передней доли гипофиза и надпочечников в крови крыс линии КМ, подвергнутых звуковой стимуляции. Концентрация АКТГ (А) и кортикостерона (Б) в сыворотке крови у контрольных крыс (контроль, белые столбики), на клонико-тонической стадии судорожного припадка, которая развивалась спустя 6–10 с после предъявления звукового сигнала (судороги, светло-серые столбики), через 1 ч (1 ч, серые столбики) и через 24 ч (24 ч, темно-серые столбики) после окончания судорожного припадка. Данные представлены как среднее значение ± стандартное отклонение. * – достоверность различий по сравнению с контролем при p < 0.05.
Влияние однократной звуковой стимуляции на функциональное состояние ГГАКС крыс линии Вистар. У крыс линии Вистар однократная звуковая стимуляция с теми же параметрами в течение 1 мин не приводила к достоверным изменениям в концентрации АКТГ (контроль 1.081 ± 0.188; 1 мин 0.964 ± 0.275; 1 ч 1.233 ± 0.238; 24 ч 1.206 ± 0.256) и кортикостерона (контроль 175.28 ± 33.29; 1 мин 155.89 ± 79.1; 1 ч 139.93 ± 67.83; 24 ч 129.56 ± 24.47) в крови ни через 1 мин, ни через 1 и 24 ч.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
На первом этапе исследования для того, чтобы охарактеризовать взаимосвязь ГГАКС и предрасположенности к аудиогенным судорожным припадкам, была проведена оценка межлинейных различий в функциональном состоянии ГГАКС у крыс линий КМ и Вистар. В настоящее время существует относительно немного работ о вовлеченности ГГАКС в формирование повышенной судорожной готовности ЦНС. Так, показано, что у крыс линии WAR (Wistar Audiogenic Rat), предрасположенных к аудиогенным судорогам, увеличена площадь пучковой зоны коркового вещества надпочечников, повышена стресс-реактивность периферического звена ГГАКС, а также нарушен циркадианный ритм секреции АКТГ в кровь по сравнению с крысами линии Вистар [20]. Для крыс линии КМ характерен пониженный уровень кортикостерона в крови в течение первого месяца жизни и при этом более раннее развитие ответной реакции ГГАКС на стрессорные воздействия в постнатальном онтогенезе [21]. Однако мы не обнаружили в литературе данных о межлинейных различиях у крыс линий КМ и Вистар в функциональном состоянии и механизмах регуляции центральных звеньев ГГАКС.
Мы показали, что у крыс линии КМ повышено содержание GAD67 в волокнах, иннервирующих мелкоклеточную часть ПВЯ гипоталамуса, что сопровождалось пониженным содержанием кортиколиберина у крыс линии КМ в телах нейронов ПВЯ, по сравнению с крысами линии Вистар. Полученные данные свидетельствуют о пониженной активности кортиколиберинергических нейронов гипоталамуса у крыс с генетической предрасположенностью к судорожным припадкам на фоне повышенной тормозной ГАМК-ергической иннервации. У крыс линии КМ повышенное содержание GAD67 было отмечено не только в волокнах, иннервирующих тела нейронов ПВЯ гипоталамуса, но также и в волокнах, иннервирующих их отростки, образующие наружную зону срединного возвышения, что было сопряжено с пониженным содержанием кортиколиберина в них. Показано, что в отличие от тормозного влияния ГАМК на тела кортиколиберинергических нейронов, на их отростки ГАМК способен оказывать деполяризующее действие вследствие изменения хлорного градиента за счет повышения экспрессии NKCC1 и понижения экспрессии KCC2 в этих отростках, таким образом способствуя усилению секреции кортиколиберина [22, 23]. В целом, пониженное содержание кортиколиберина в отростках нейронов ПВЯ гипоталамуса, сопровождающееся повышенной возбуждающей ГАМК-ергической иннервацией наружной зоны срединного возвышения, может указывать на повышенный уровень секреции кортиколиберина из терминалей в портальную систему кровотока.
Известно, что основной функцией кортиколиберина является регуляция синтеза и секреции АКТГ в передней доле гипофиза [24]. Поэтому на следующем этапе мы проанализировали содержание активной формы транскрипционного фактора CREB, участвующего в регуляции транскрипции гена ПОМК [15]. Мы показали повышенное содержание фосфо-CREB в аденогипофизе у крыс линии КМ по сравнению с крысами линии Вистар, что сопровождалось повышенным содержанием ПОМК и АКТГ. Повышенный уровень гормонов в аденогипофизе у крыс линии КМ по сравнению с крысами линии Вистар на фоне повышенного содержания активной формы транскрипционного фактора CREB указывает на существование нарушений у данной линии крыс на этапе транскрипции. Однако различий в базальной концентрации АКТГ и кортикостерона в крови у крыс линий КМ и Вистар выявлено не было. Полученные нами данные об отсутствии межлинейных различий в концентрации гормонов ГГАКС в периферической крови у крыс линий КМ и Вистар в норме хорошо согласуются с данными, полученными ранее В.Г. Шаляпиной с соавт [21]. В связи с тем что, несмотря на повышение содержания АКТГ в гипофизе, не происходит увеличения его уровня в крови, мы предположили существование нарушений также и в секреции АКТГ кортикотропоцитами аденогипофиза у крыс линии КМ на уровне экзоцитоза секреторных гранул. Мы показали повышенное содержание белка SNARE комплекса SNAP25 в передней доле гипофиза у крыс линии КМ по сравнению с крысами линии Вистар. Из данных литературы известно, что повышенное содержание SNAP25 в секреторных клетках коррелирует со снижением секреторной активности этих клеток [25]. Таким образом, совокупность полученных данных о повышенном синтезе ПОМК и повышенном содержании АКТГ на фоне повышенного уровня SNAP25 в аденогипофизе при не отличающемся уровне АКТГ в крови свидетельствует о том, что для крыс линии КМ характерны нарушения на уровне регуляции экзоцитоза секреторных гранул.
В целом, на основании полученных данных можно заключить, что для крыс линии КМ, генетически предрасположенных к судорожным припадкам, характерны нарушения во взаимодействии центральных звеньев ГГАКС, при том что базальный уровень гормонов аденогипофиза и надпочечников в крови у крыс обеих линий не отличается. По-видимому, показанные нарушения во взаимодействии гипоталамуса и гипофиза являются одним из возможных механизмов, обеспечивающих поддержание концентрации гормонов в крови у крыс линии КМ на уровне характерном для контрольной крыс материнской линии Вистар.
Показано, что эпилептиформные припадки различной этиологии сопровождаются секрецией гормонов ГГАКС [9]. Однако механизмы, лежащие в основе повышения гормонов ГГАКС в ходе и после припадков до конца не ясны. Исследования о влиянии судорожных припадков на функциональное состоянии ГГАКС в основном выполнены на фармакологических моделях эпилепсии. Однако следует отметить, что природа судорог, вызванных применением хемиконвульсантов является иной по сравнению с судорогами, вызванными звуковыми раздражителями [26]. Так, локальное или системное введение пилокарпина или каината у грызунов вызывает возникновение очага возбуждения в гиппокампе и как следствие паттерны лимбических судорог [26, 27], в то время как аудиогенный судорожный припадок сопровождается возникновением эпилептиформной активности в стволовых структурах мозга [28]. При этом в гиппокампе и неокортексе эпилептиформной активности выявлено не было [28]. Исследований функционального состояния центральных звеньев ГГАКС и механизмов их регуляции в ходе и после аудиогенного эпилептиформного припадка не проводилось.
Было показано, что возбуждающее влияние ГАМК на отростки нейронов ПВЯ гипоталамуса может являться одной из причин усиления секреции кортиколиберина в портальную систему кровотока [22]. Мы показали повышение содержания GAD67 в волокнах, иннервирующих наружную зону срединного возвышения, на клонико-тонической стадии судорожного припадка, через 1 и 24 ч после его окончания, что может свидетельствовать о повышении возбуждающей ГАМК-ергической иннервации отростков кортиколиберинергических нейронов. Это сопровождалось повышением секреции кортиколиберина на клонико-тонической стадии судорожного припадка, о чем свидетельствует транслокация кортиколиберин-иммунореактивного вещества в периваскулярную область наружной зоны срединного возвышения и увеличение размера сосудов у крыс линии КМ. Кроме того, нами также было показано перераспределение вазопрессина из тел нейронов в их отростки у крыс линии КМ непосредственно на стадии клонико-тонических судорог. Известно, что уровень вазопрессина в наружной зоне срединного возвышения коррелирует с его уровнем в портальной системе кровотока [29]. Таким образом, полученные данные о содержании и распределении нейрогормонов указывают на усиление секреторной активности кортиколиберинергических и вазопрессинергических нейронов на ранних стадиях припадка. И действительно, было показано повышение концентрации АКТГ в сыворотке крови уже на клонико-тонической стадии судорожного припадка у крыс линии КМ. Таким образом, совокупность полученных данных свидетельствует о том, что активация центральных звеньев ГГАКС – гипоталамуса и гипофиза – происходит уже на клонико-тонической стадии, которая развивается спустя 6–10 с с момента предъявления звукового сигнала.
Об активации этих нейронов вследствие аудиогенного припадка также свидетельствует повышение количества cFos-иммунопозитивных ядер в нейронах мелкоклеточной части ПВЯ гипоталамуса крыс линии КМ через 1 ч после завершения судорожного припадка по сравнению с контрольной группой и на клонико-тонической стадии припадка. Через 1 ч после окончания судорожного припадка у крыс линии КМ содержание вазопрессина в нейронах мелкоклеточной части ПВЯ оставалось пониженным. Однако в наружной зоне срединного возвышения уровень вазопрессина возвращался к контрольным значениям, как и уровень АКТГ в сыворотке крови. При этом концентрация кортикостерона через 1 ч после судорожного припадка была значительно выше, чем в контроле и на стадии клонико-тонических судорог. Полученные нами данные об активации периферического звена ГГАКС вследствие однократного судорожного припадка хорошо согласуются с полученными ранее данными, где было показано повышение уровня кортикостерона в крови через 5 мин после судорожного припадка в крови у крыс линии КМ, при этом повышенный уровень кортикостерона сохранялся в течение 1 ч [11, 21, 30].
Кроме того, нами была впервые проанализирована активность ГГАКС у крыс линии КМ на более отставленной временной точке. Через 24 ч после завершения судорожного припадка содержание вазопрессина в нейронах мелколеточной части ПВЯ гипоталамуса у крыс линии КМ не отличалось от такового в контрольной группе. Однако в наружной зоне срединного возвышения содержание вазопрессина было повышено по сравнению с контролем. При этом был показан повышеный уровень кортикостерона в сыворотке крови. Полученные данные свидетельствуют о продолжительной активации центрального и периферического звеньев ГГАКС у крыс линии КМ вследствие аудиогенного припадка.
Однако остается неясным, что же является фактором, способствующим активации ГГАКС на ранней стадии припадка у крыс линии КМ – акустический стресс, вызванный звуковым воздействием, или развивающаяся в ответ на звуковой стимул эпилептиформная активность?
Ранее было показано, что воздействие звонка с интенсивностью 110–115 дБ в течение 90 с приводило к повышению уровня кортикостерона в крови через 5 мин у крыс линии КМ, но не у крыс линии Вистар [30]. В данном исследовании мы показали, что минутная звуковая стимуляция с теми же параметрами (частота 10 кГц; интенсивность 50 дБ), что и для крыс линии КМ, не приводила к достоверным изменениям в концентрации АКТГ и кортикостерона в крови у крыс линии Вистар ни через 1 мин, ни через 1 и 24 ч.
Таким образом, полученные данные указывают на то, что активация гипоталамо-гипофизарно-адренокортикальной системы у крыс линии КМ, вызванная аудиогенным судорожным припадком, носит специфический характер, является следствием распространения эпилептиформной активности в мозге и свидетельствуют о вовлеченности гипоталамо-гипофизарной системы в реализацию судорожной активности у крыс линии КМ.
Список литературы
Elger C.E. Epilepsy: disease and model to study human brain function. Brain pathol. 12(2): 193–198. 2002.
Ross K.C., Coleman J.R. Developmental and genetic audiogenic seizure models: behavior and biological substrates. Neurosci. Biobehav. Rev. 24(6): 639–653. 2000.
Полетаева И.И., Костына З.А., Сурина Н.М., Федотова И.Б., Зорина З.А. Генетическая линия крыс Крушинского–Молодкиной как уникальная экспериментальная модель судорожных состояний. Вавиловский журн. генетики и селекции. 21(4): 427–434. 2017. [Poletaeva I.I., Kostyna Z.A., Surina N.M., Fedotova I.B., Zorina Z.A. The Krushinsky-Molodkina genetic rat strain as a unique experimental model of seizure states. Vavilov J. Genet. Breed. 21(4): 427–434. 2017 (In Russ.)].
Семиохина А.Ф., Федотова И.Б., Полетаева И.И. Крысы линии Крушинского-Молодкиной: исследования аудиогенной эпилепсии, сосудистой патологии и поведения. Журн. высш. нерв. деятельности им. И.П. Павлова. 56(3): 298–316. 2006. [Semiokhina A.F., Fedotova I.B., Poletaeva I.I. Rats of Krushinsky–Molodkina Strain: Studies of Audiogenic Epilepsy, Vascular Pathology and Behavior. Zh. Vyssh. Nerv. Deiat. Im I.P.Pavlova. 56(3): 298–316. 2006. (In Russ.)].
Clynen E., Swijsen A., Raijmakers M., Hoogland G., Rigo J.M. Neuropeptides as targets for the development of anticonvulsant drugs. Mol. Neurobiol. 50(2): 626–646. 2014.
Wulsin A.C., Solomon M.B., Privitera M.D., Danzer S.C., Herman J.P. Hypothalamic-pituitary-adrenocortical axis dysfunction in epilepsy. Physiol. Behav. 166: 22–31. 2016.
Joëls M. Stress, the hippocampus, and epilepsy. Epilepsia. 50(4): 586–597. 2009.
Jaseja H., Jaseja B., Badaya S., Tonpay P. Superior therapeutic efficacy of adrenocorticotrophic hormone (ACTH) in infantile spasms: emerging evidence. Epilepsy Behav. 25(2): 250. 2012.
O’Toole K.K., Hooper A., Wakefield S., Maguire J. Seizure-induced disinhibition of the HPA axis increases seizure susceptibility. Epilepsy Res. 108(1): 29–43. 2014.
Gallagher B.B. Endocrine abnormalities in human temporal lobe epilepsy. Yale J. Biol. Med. 60(2): 93–97. 1987.
Ракицкая В.В., Гарина И.А., Лопатина Н.Г., Пивина С.Г., Шаляпина В.Г. Рецепторное связывание 3Н-кортикостерона и содержание дофамина в стриатуме крыс с предрасположенностью к аудиогенным судорогам. Физиол. журн. СССР им. И.М. Сеченова. 76(6): 802–807. 1990. [Rakitskaia V.V., Garina I.A., Lopatina N.G., Pivina S.G., Shaliapina V.G. The receptor binding of 3H-corticosterone and the dopamine content in the striatum of rats with a predisposition to audiogenic seizures. Fiziol. Zh. SSSR Im I.M. Sechenova. 76(6): 802–807. 1990. (In Russ.)].
Herman J.P., Cullinan W.E., Ziegler D.R., Tasker J.G. Role of the paraventricular nucleus microenvironment in stress integration. Eur. J. Neurosci. 16(3): 381–385. 2002.
Fong A.Y., Stornetta R.L., Foley C.M., Potts J.T. Immunohistochemical localization of GAD67-expressing neurons and processes in the rat brainstem: subregional distribution in the nucleus tractus solitarius. J. Comp. Neurol. 493(2): 274–290. 2005.
Hoffman G.E., Smith M.S., Verbalis J.G. c-Fos and related immediate early gene products as markers of activity in neuroendocrine systems. Front. Neuroendocrinol. 14(3): 173–213. 1993.
Jenks B.G. Regulation of proopiomelanocortin gene expression. Ann. N. Y. Acad. Sci. 1163(1): 17–30. 2009.
Aguado F., Gombau L., Majó G., Marsal J., Blanco J., Blasi J. Regulated secretion is impaired in AtT-20 endocrine cells stably transfected with botulinum neurotoxin type A light chain. J. Biol. Chem. 272(41): 26005–26008. 1997.
Burow A., Day H.E., Campeau S. A detailed characterization of loud noise stress: Intensity analysis of hypothalamo-pituitary-adrenocortical axis and brain activation. Brain Res. 1062(1–2): 63–73. 2005.
Ben-Barak Y., Russell J.T., Whitnall M.H., Ozato K., Gainer H. Neurophysin in the hypothalamo-neurohypophysial system. I. Production and characterization of monoclonal antibodies. J. Neurosci. 5(1). 81–97. 1985.
Burbach J.P.H., Luckman S.M., Murphy D., Gainer H. Gene regulation in the magnocellular hypothalamo-neurohypophysial system. Physiol. Rev. 81(3): 1197–1267. 2001.
Umeoka E.H., Garcia S.B., Antunes-Rodrigues J., Elias L.L., Garcia-Cairasco N. Functional characterization of the hypothalamic-pituitary-adrenal axis of the Wistar Audiogenic Rat (WAR) strain. Brain Res. 1381: 141–147. 2011.
Шаляпина В.Г., Гарина И.А., Ракицкая В.В., Лопатина Н.Г. О линейных различиях в реактивности гипофизарно-адренокортикальной системы у крыс. Физиол. журн. СССР им. И.М. Сеченова. 68(5): 616–620. 1982. [Shaliapina V.G., Garina I.A., Rakitskaia V.V., Lopatina N.G. Linear differences in the reactivity of the hypophyseal-adrenocortical system in rats. Fiziol. Zh. SSSR Im I.M. Sechenova. 68(5): 616–620. 1982. (In Russ.)].
Kakizawa K., Watanabe M., Mutoh H., Okawa Y., Yamashita M., Yanagawa Y., Itoi K., Suda T., Oki Y., Fukuda A. A novel GABA-mediated corticotropin-releasing hormone secretory mechanism in the median eminence. Sci. Adv. 2(8): 1–15. 2016.
Hewitt S.A., Wamsteeker J.I., Kurz E.U., Bains J.S. Altered chloride homeostasis removes synaptic inhibitory constraint of the stress axis. Nat. Neurosci. 12: 438–443. 2009.
Smith S.M., Vale W.W. The role of the hypothalamic-pituitary-adrenal axis in neuroendocrine responses to stress. Dialogues Clin. Neurosci. 8(4): 383–395. 2006.
Eisenhofer G., Huynh T.-T., Elkahloun A., Morris J.C., Bratslavsky G., Linehan W.M., Zhuang Z., Balgley B.M., Lee C.S., Mannelli M. Differential expression of the regulated catecholamine secretory pathway in different hereditary forms of pheochromocytoma. Am. J. Physiol. Endocrinol. Metab. 295(5): 1223–1233. 2008.
Kandratavicius L., Balista P.A., Lopes-Aguiar C., Ruggiero R.N., Umeoka E.H., Garcia-Cairasco N., Bueno-Junior L.S., Leite J.P. Animal models of epilepsy: use and limitations. Neuropsychiatr. Dis. Treat. 10: 1693–1705. 2014.
Scorza F.A., Arida R.M., Naffah-Mazzacoratti M.d.G., Scerni D.A., Calderazzo L., Cavalheiro E.A. The pilocarpine model of epilepsy: what have we learned? Ann. Acad. Bras. Cienc. 81(3): 345–365. 2009.
Poletaeva I.I., Fedotova I.B., Sourina N.M., Kostina Z. A. Audiogenic seizures-biological phenomenon and experimental model of human epilepsies. In: Clinical and genetic aspects of epilepsy. Zaid Afawi (ed.). 115–148. 2011.
Verbalis J.G., Baldwin E.F., Ronnekleiv O.K., Robinson A.G. In vitro release of vasopressin and oxytocin from rat median eminence tissue. Neuroendocrinology. 42(6): 481–488. 1986.
Никитина М.М., Романова Л.Г. Содержание кортикостерона в крови крыс линии Крушинского–Молодкиной и Вистар после кратковременного звукового воздействия. Бюл. эксперим. биологии и медицины. 92(11): 555–557. 1981. [Nikitina M.M., Romanova L.G. Corticosterone content of the blood in Krushinskiĭ–Molodkina and Wistar rats following short-term acoustic exposure. Biull. Eksp. Biol. Med. 92(11): 555–557. 1981 (In Russ.)].
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


