Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 2, стр. 225-237
Влияние сенситизации и десенситизации капсаицин-чувствительных нейронов на образование эрозий в слизистой оболочке желудка, индуцированных индометацином, у крыс: роль глюкокортикоидных гормонов
Т. Т. Подвигина 1, *, О. Ю. Морозова 1, С. Д. Солнушкин 1, В. Н. Чихман 1, Л. П. Филаретова 1
1 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: tpodvigina@yandex.ru
Поступила в редакцию 06.12.2018
После доработки 12.12.2018
Принята к публикации 12.12.2018
Аннотация
Задача настоящей работы заключалась в изучении влияния сенситизации и десенситизации капсаицин-чувствительных афферентных нейронов (КЧН) на чувствительность слизистой оболочки желудка крыс к ульцерогенному действию индометацина (35 мг/кг) и оценке участия глюкокортикоидных гормонов в этом влиянии. Сенситизацию КЧН вызывали однократным введением капсаицина в малых дозах: 0.1–10.0 мг/кг, десенситизацию – трехкратным введением капсаицина в суммарной дозе 100 мг/кг за 2 недели до введения индометацина. Капсаицин в малых дозах вводили за 1 ч до инъекции индометацина. Для оценки участия кортикостерона в эффектах капсаицина использовали ингибитор синтеза глюкокортикоидных гормонов метирапон (30 мг/кг). Десенситизация КЧН с использованием большой дозы капсаицина приводила к усугублению ульцерогенного действия индометацина. При введении капсаицина в малых дозах было выявлено дозозависимое уменьшение площади индометацин-индуцированных эрозий желудка, а также повышение уровня кортикостерона и глюкозы в крови. Введение метирапона предотвращало повышение уровня кортикостерона в ответ на введение капсаицина и устраняло гастропротективный эффект капсаицина (1 мг/кг). Полученные результаты свидетельствуют об участии глюкокортикоидных гормонов в опосредовании гастропротективного эффекта капсаицина.
Капсаицин-чувствительные афферентные нейроны (КЧН) играют важную роль в регуляции функции желудка [1–5]. Установлено, что десенситизация КЧН путем введения больших доз капсаицина приводит к усугублению повреждаемости слизистой оболочки желудка ульцерогенными факторами [6–9], сенситизация КЧН малыми дозами капсаицина, напротив, оказывает гастропротективный эффект [2, 8–11]. Изменения чувствительности слизистой оболочки желудка под действием капсаицина выявлены при действии различных ульцерогенных факторов: стресса (иммобилизационного, холодового), спиртовых растворов (от 25 до 100%), нестероидных противовоспалительных препаратов (аспирина, индометацина), ишемии-реперфузии [1–4, 6, 7, 11]. Капсаицин оказывает свое действие через активацию или ингибирование ваниллоидных рецепторов (transient receptor potential vanilloid 1-TRPV1) [12, 13].
В реализации гастропротективного эффекта КЧН важная роль отводится кальцитонин ген-связанному пептиду, который выделяется из нервных окончаний при активации КЧН [1, 3, 11, 14, 15]. Продемонстрировано участие простагландинов и оксида азота в опосредовании гастропротективного действия капсаицина [3, 10, 11, 16].
Вопрос о взаимодействии глюкокортикоидных гормонов и КЧН в гастропротекции практически не изучался, за исключением одной работы [17]. Отсутствие интереса к этому вопросу, вероятно, связано с тем, что глюкокортикоидные гормоны традиционно рассматривались и нередко рассматриваются до сих пор как ульцерогенные факторы [18, 19]. Результаты исследований нашей лаборатории убедительно доказали гастропротективную роль эндогенных глюкокортикоидных гормонов, в том числе, что особенно важно, и выделяющихся при стрессе [20–24]. Мы продемонстрировали также гастропротективный эффект экзогенных глюкокортикоидов, проявляющийся в определенных условиях [25, 26].
Выявленная нами гастропротективная роль глюкокортикоидных гормонов и наличие общих мишеней в гастропротективном действии глюкокортикоидов и КЧН [2, 27–30] привели к предположению о возможном их взаимодействии. В предыдущих исследованиях лаборатории это предположение было подтверждено. Обнаружено, что усугубляющий эффект десенситизации КЧН на образование эрозий слизистой оболочки желудка, индуцированных индометацином, еще более усиливается при дефиците глюкокортикоидных гормонов, вызванном адреналэктомией, а заместительная терапия кортикостероном предотвращает такое усиление [6, 7]. Эти данные свидетельствуют о важной компенсаторной роли эндогенных глюкокортикоидов в поддержании целостности слизистой оболочки желудка при десенситизации КЧН [7]. Вопрос об участии глюкокортикоидных гормонов в опосредовании известного гастропротективного действия КЧН ранее не исследовался.
Задача настоящей работы заключалась в изучении влияния активации и ингибирования функции КЧН на чувствительность слизистой оболочки желудка крыс к ульцерогенному действию индометацина и оценке участия глюкокортикоидных гормонов в этом влиянии.
МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперименты проводили на крысах-самцах линии Спрейг-Доули массой около 250–270 г. За неделю до начала экспериментов крыс акклиматизировали к стандартным условиям лабораторного вивария: температура 20–22°С, световой режим 12 ч : 12 ч (включение света в 8 ч, выключение в 20 ч), свободный доступ к воде и пище. Животных лишали пищи за 24 ч до начала эксперимента.
Эффекты сенситизации и десенситизации КЧН на слизистую оболочку желудка крыс изучали в условиях действия ульцерогенного стимула, в качестве которого был использован индометацин (Sigma-Aldrich, Германия). Индометацин вводили подкожно в дозе 35 мг/кг (в объеме 5 мл/кг) после 24-часового голодания животных. Через 4 ч после его введения в слизистой оболочке желудка образуются геморрагические эрозии.
Сенситизацию КЧН производили путем однократного введения капсаицина в разных дозах: 0.1, 0.5, 1, 2, 3, 5 и 10 мг/кг. Капсаицин (Sigma-Aldrich, Германия) вводили подкожно в объеме 5 мл/кг за 1 ч до введения индометацина. Контрольным крысам вводили растворитель капсаицина: спирт : твин 80 : физиологический раствор в объемном соотношении 5 : 5 : 90 соответственно.
Для десенситизации КЧН капсаицин вводили крысам в нейротоксической дозе 100 мг/кг под эфирным наркозом в течение 3-х последовательных дней (20, 30, 50 мг/кг) подкожно, в объеме 5 мл/кг. В этом случае использовали растворитель капсаицина с увеличенным объемом спирта и твина по отношению к физиологическому раствору (10 : 10 : 80 соответственно). Десенситизацию КЧН производили за 2 недели до введения индометацина. В отдельном эксперименте исследовали влияние десенситизации КЧН на изучаемые показатели без введения ульцерогенного стимула.
Для предотвращения повышения уровня кортикостерона в крови в ответ на введение малой дозы капсаицина использовали ингибитор синтеза кортикостерона метирапон (Sigma-Aldrich, Германия), который вводили внутрибрюшинно в дозе 30 мг/кг. Контрольным крысам вводили растворитель метирапона: 0.9%-ный раствор NaCl с 1 каплей твина 80. В опытах с сенситизацией КЧН метирапон вводили за 30 мин до введения капсаицина. Для сенситизации КЧН в этих опытах использовали капсаицин в дозе 1 мг/кг. Выбор этой дозы капсаицина был сделан на основании полученных в данной работе результатов о дозозависимом эффекте капсаицина на образование индометацин-индуцированных эрозий. В опытах с десенситизацией КЧН метирапон вводили за 30 мин до инъекции индометацина.
Через 4 ч после введения индометацина животных декапитировали, брали пробы крови для определения уровней кортикостерона и глюкозы, извлекали желудок, тимус, селезенку и надпочечники. Площадь эрозий оценивали на основании фотографий желудков с помощью модифицированной компьютерной программы Image J [31]. Оценивали относительную (по отношению к массе тела) массу тимуса, селезенки и надпочечников. Содержание глюкозы определяли в капле крови крыс с помощью тест-полосок системы “One Touch Ultra”, США. Уровень кортикостерона в плазме крови определяли иммуноферментным методом с использованием набора реагентов “Кортикостерон крыса/мышь-ИФА” (“ХЕМА”).
Все данные обрабатывали статистически. Непараметрический метод Манна–Уитни использовали для сравнения площадей эрозий слизистой оболочки желудка, для анализа других показателей использовали t-критерий Стьюдента.
Это исследование проводилось в соответствии с принципами Базельской декларации и рекомендациями Комиссии по содержанию и использованию животных Института физиологии им. И.П. Павлова РАН. Работа выполнена с использованием животных из Биоколлекции ИФ РАН.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В опытах с сенситизацией КЧН введение капсаицина в малых дозах привело к дозозависимому уменьшению чувствительности слизистой оболочки желудка крыс к индометацину (рис. 1). Капсаицин, введенный в дозе 0.1 мг/кг, не изменил площадь эрозий, вызванных индометацином, по сравнению с контрольными значениями. Введение капсаицина в дозе 0.5 мг/кг привело к достоверному снижению площади эрозий слизистой оболочки желудка. Гастропротективный эффект капсаицина значительно усилился после введения его в дозе 1 мг/кг. Введение капсаицина в последующих дозах (2, 3, 5 мг/кг) также оказало гастропротективный эффект, который достоверно не отличался от эффекта, полученного при введении капсаицина в дозе 1 мг/кг. При введении капсаицина в дозе 10 мг/кг площадь эрозий в желудке была значимо ниже, чем при введении его в других дозах, что свидетельствует о дальнейшем усилении гастропротективного эффекта капсаицина.
Рис. 1.
Влияние сенситизации КЧН (капсаицин, 0.1–10.0 мг/кг) на площадь эрозий слизистой оболочки желудка, уровень глюкозы и кортикостерона в крови у крыс через 4 ч после введения индометацина. “Раств”. – растворитель капсаицина. Достоверные различия при р < 0.05: * – от группы “Раств”., # – от предыдущей группы, + – от всех групп. Число животных в группе 7–10.
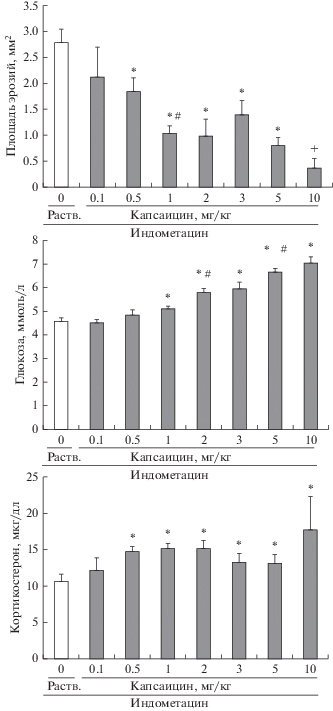
Как и во всех предыдущих наших исследованиях, введение индометацина на фоне голода привело к увеличению уровня кортикостерона в крови крыс, которым вводили растворитель капсаицина (контроль), по сравнению с базальным уровнем кортикостерона в крови (см. табл. 1). Введение капсаицина вызвало дальнейшее повышение уровня кортикостерона в крови. Увеличение уровня кортикостерона по сравнению с контрольным значением выявили после введения капсаицина в дозе 0.5 мг/кг. В изменении уровня кортикостерона после введения капсаицина четкой зависимости от дозы не наблюдалось: дозы 1, 2, 3, 5, 10 мг/кг оказали такой же эффект, как и при введении капсаицина в дозе 0.5 мг/кг (рис. 1).
Уровень глюкозы в крови контрольных крыс после голода и введения индометацина снижался по сравнению с базальным уровнем (см. табл. 1). Введение капсаицина в малых дозах достоверно повышало уровень глюкозы, начиная с дозы 1 мг/кг. Повышение уровня глюкозы было дозозависимым: после введения капсаицина в дозах 2 и 5 мг/кг уровень глюкозы был значимо выше такового после введения меньшей дозы (рис. 1).
Для выяснения вклада кортикостерона в гастропротективный эффект капсаицина использовали метирапон. Для данного этапа работы была выбрана доза капсаицина 1 мг/кг. Введение метирапона за 30 мин до капсаицина предотвращало повышение уровня кортикостерона, индуцированное введением капсаицина, и устраняло гастропротективное действие капсаицина. Действительно, у крыс с предварительным введением метирапона площадь эрозий была достоверно выше той, которая наблюдалась у крыс с введением растворителя метирапона (рис. 2).
Рис. 2.
Влияние метирапона (Мет) на площадь эрозий слизистой оболочки желудка, уровень глюкозы и кортикостерона в крови (через 4 ч после введения индометацина) у крыс с сенситизацией КЧН (капсаицин, 1 мг/кг) и у контрольных животных. Контроль – растворитель метирапона (физ. раствор). Достоверные различия при р < 0.05: * – от контроля в группе “Растворитель”, # – от контроля в группе “Капсаицин”. Число животных в группе 10–12.
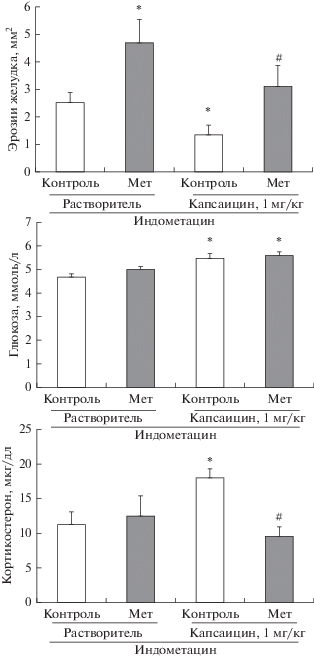
У контрольных крыс с введением растворителя капсаицина введение метирапона также приводило к увеличению площади эрозий желудка, несмотря на то, что в этой временной точке (5.5 ч после введения метирапона) уже не наблюдалось снижения уровня кортикостерона в крови (рис. 2).
Уровень глюкозы в крови был повышен у крыс с сенситизацией КЧН, вызванной введением капсаицина в дозе 1 мг/кг, и введение метирапона не повлияло на уровень глюкозы в крови как у крыс с сенситизацией КЧН, так и у контрольных животных (рис. 2).
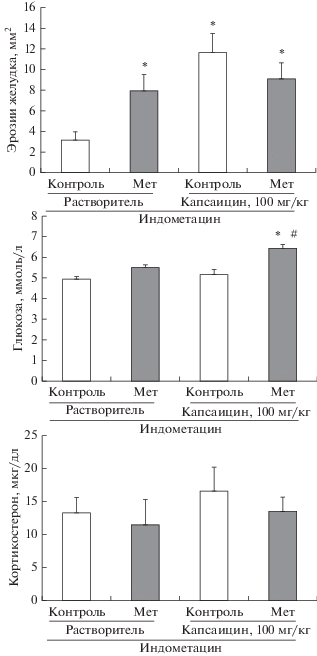
Десенситизация КЧН, как и в предыдущих наших работах, повысила чувствительность слизистой оболочки желудка крыс к индометацину, о чем свидетельствует значительное увеличение площади эрозий по сравнению с контрольными значениями. Этот эффект сопровождался небольшим, но достоверным снижением уровня глюкозы в крови. Уровень кортикостерона у крыс с десенситизацией КЧН в данных опытах не изменился по сравнению с контрольным значением (рис. 3). При введении метирапона крысам с десенситизацией КЧН не было выявлено достоверных изменений ни в уровне кортикостерона, ни в площади эрозий слизистой оболочки желудка по сравнению с аналогичными параметрами у крыс, которым вводили растворитель метирапона. Неожиданным результатом оказалось повышение уровня глюкозы после введения метирапона в крови крыс с десенситизацией КЧН. Введение метирапона контрольным крысам (с введением растворителя капсаицина) привело к увеличению площади эрозий по сравнению с крысами, которым вводили растворитель метирапона, при этом уровень кортикостерона в исследованный срок (4.5 ч после введения метирапона) не изменился (рис. 4).
Рис. 3.
Влияние десенситизации КЧН (капсаицин, 100 мг/кг, за 2 недели до эксперимента) на площадь эрозий в слизистой оболочке желудка, уровень глюкозы и кортикостерона в крови у крыс через 4 ч после введения индометацина. Контроль – интактные крысы, “Раств”. – растворитель капсаицина. Достоверные различия при р < 0.05: * – от группы “Раств”., + – от всех групп. Число животных в группе 7–9.
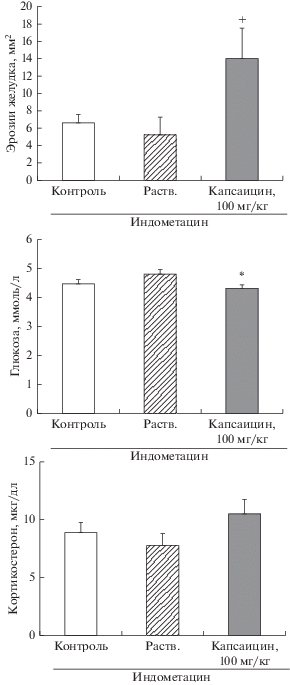
Рис. 4.
Влияние метирапона (Мет) на площадь эрозий слизистой оболочки желудка, уровень глюкозы и кортикостерона в крови (через 4 ч после введения индометацина) у крыс с десенситизацией КЧН (капсаицин, 100 мг/кг) и контрольных животных. Контроль – растворитель метирапона (физ. раствор). Достоверные различия при р < 0.05: * – от контроля в группе “Растворитель”, # – от контроля в группе “Капсаицин”. Число животных в группе 8–10.
Десенситизация КЧН сама по себе (без голода и введения индометацина) не вызвала повреждений в слизистой оболочке желудка. Базальный уровень кортикостерона и глюкозы в крови, относительные массы тимуса, селезенки и надпочечников не изменились по сравнению с показателями у крыс, которым вводили растворитель капсаицина. Наблюдалось лишь небольшое снижение прироста массы тела через 2 недели после введения капсаицина в большой дозе (см. табл. 1).
Таблица 1.
Влияние десенситизации капсаицин-чувствительных нейронов (КЧН) самой по себе (без голода и индометацина) на базальный уровень глюкозы и кортикостерона в крови, прирост массы тела крыс, а также на массу надпочечников, тимуса и селезенки
| Глюкоза, ммоль/л | Кортикостерон, мкг/дл | Прирост массы тела, г | ||||||
|---|---|---|---|---|---|---|---|---|
| Контроль | Раств. | Капсаицин | Контроль | Раств. | Капсаицин | Контроль | Раств. | Капсаицин |
| 7.5 + 0.2 | 7.1 ± 0.2 | 7.2 ± 0.2 | 2.1 ± 0.25 | 2.3 ± 0.3 | 2.9 ± 0. 5 | 99 ± 5 | 101 ± 5 | 86 ± 4* |
| Масса надпочечников, мг/100 г | Масса тимуса, мг/100 г | Масса селезенки, мг/100 г | ||||||
| Контроль | Раств. | Капсаицин | Контроль | Раств. | Капсаицин | Контроль | Раств. | Капсаицин |
| 20.1 ± 1.9 | 19.1 ± 1.7 | 19.7 ± 1.5 | 205 ± 21 | 191 ± 11 | 175 ± 12 | 301 ± 29 | 298 ± 25 | 286 ± 18 |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Полученные результаты свидетельствуют о том, что сенситизация КЧН, вызванная введением капсаицина в дозах от 0.5 до 10.0 мг/кг, дозозависимо снижает чувствительность слизистой оболочки желудка крыс к ульцерогенному действию индометацина, что сопровождается повышением уровня кортикостерона и глюкозы в крови. Введение метирапона, ингибитора синтеза кортикостерона, предотвращает повышение уровня кортикостерона в крови в ответ на введение капсаицина (1 мг/кг) и устраняет защитный эффект капсаицина на слизистую оболочку желудка. Полученные данные свидетельствуют об участии глюкокортикоидных гормонов в обеспечении гастропротективного эффекта, индуцированного сенситизацией КЧН.
Сравнить полученные нами результаты с данными литературы не получается, поскольку роль глюкокортикоидных гормонов в гастропротективном эффекте сенситизации КЧН не изучалась. Кроме того, трудно по немногочисленным данным литературы судить об активности гипоталамо-гипофизарно-адренокортикальной системы (ГГАКС) при сенситизации КЧН. Показано, что в отсутствие экзогенного АКТГ (при гипофизэктомии) введение кальцитонин ген-связанного пептида, одного из главных пептидов, опосредующих гастропротективное действие КЧН, активирует выброс кортизола в кровь у телят [14]. При длительном (10 дней) введении капсаицина в малой дозе (около 1 мг/кг) базальный уровень кортикостерона у крыс не менялся, однако стрессорный уровень гормона оставался повышенным на протяжении 10-дневного эксперимента [15].
В нашем исследовании при сенситизации КЧН малыми дозами капсаицина было обнаружено повышение уровня кортикостерона при использовании капсаицина в тех дозах, введение которых оказало защитный эффект на слизистую оболочку желудка при ульцерогенном действии индометацина. Следует отметить, что при этом происходило не просто увеличение базального уровня кортикостерона, а увеличение уже предварительно повышенного уровня гормона в результате голода в течение 24 ч и последующего 4-часового действия индометацина. Параллельно наблюдалось повышение уровня глюкозы в крови. Эти данные свидетельствуют о том, что сенситизация КЧН приводит к увеличению активности ГГАКС.
Введение метирапона привело к предотвращению повышения уровня кортикостерона в крови, вызванного сенситизацией КЧН. У контрольных крыс (введение растворителя капсаицина) не было обнаружено разницы в уровне кортикостерона после введения метирапона (через 5.5 ч) или его растворителя, что может быть связано с кратковременным действием метирапона и отсроченным временем регистрации его эффекта. При введении метирапона крысам с сенситизацией КЧН его ингибирующий эффект оставался видимым в конце эксперимента, вероятно, за счет более высокого уровня кортикостерона после введения капсаицина. В этом случае после введения метирапона наблюдалось достоверное снижение повышенного уровня кортикостерона, вызванного активацией КЧН, до уровня контрольных значений. Это находится в соответствии с данными литературы [23, 32] о том, что метирапон влияет, главным образом, на повышенный уровень глюкокортикоидных гормонов, снижая его до контрольного уровня.
Наблюдаемое снижение уровня кортикостерона после введения метирапона сопровождалось устранением защитного эффекта сенситизации КЧН на желудок, вызванным введением капсаицина в дозе 1 мг/кг. В литературе имеются данные о том, что дефицит кортикостерона у адреналэктомированных крыс устраняет защитный эффект простагландина F2beta, сульфгидрильных производных и других гастропротективных факторов в желудке крыс при повреждении его этанолом высокой концентрации или индометацином в ульцерогенной дозе [33, 34]. Приведенные данные литературы свидетельствуют о пермиссивном действии глюкокортикоидных гормонов. В настоящей работе мы наблюдали предотвращение защитного эффекта капсаицина при устранении повышения уровня кортикостерона в крови, вызванного введением капсаицина, что свидетельствует о компенсаторном гастропротективном действии гормона. Следует подчеркнуть, что наблюдаемые изменения происходили к тому же на фоне дефицита простагландинов, поскольку индометацин является неселективным ингибитором циклооксигеназы 1 и 2, фермента, ответственного за продукцию простагландинов, то есть на фоне ингибирования двух важных гастропротективных факторов.
Ранее в наших работах впервые был продемонстрирован компенсаторный гастропротективный эффект глюкокортикоидных гормонов при функциональном выключении КЧН и дефиците простагландинов. Показано, что дефицит глюкокортикоидных гормонов в крови крыс, вызванный 1-недельной адреналэктомией, усугубляет проульцерогенный эффект десенситизации КЧН в ульцерогенной индометациновой модели, а введение кортикостерона в физиологической дозе устраняет подобное усугубление [6, 7]. Эти данные подчеркивают гастропротективную роль эндогенных глюкокортикоидных гормонов, которая значительно возрастает в условиях выключения КЧН и дефицита простагландинов.
В представленной работе мы выясняли вопрос, может ли кратковременное снижение уровня кортикостерона в крови, вызванное введением метирапона, у крыс с десенситизацией КЧН привести к усугублению язвообразования в желудке подобно тому, как это наблюдалось у адреналэктомированных крыс. Десенситизация КЧН, как и следовало ожидать, значительно увеличила чувствительность слизистой оболочки желудка к ульцерогенному действию индометацина и в этих экспериментах. Однако введение метирапона, ингибитора синтеза кортикостерона, непосредственно перед индометацином, не привело к дальнейшему усугублению проульцерогенного эффекта десенситизации КЧН. Разница в эффектах адреналэктомии и метирапона, прежде всего, объясняется различиями в степени и продолжительности снижения продукции кортикостерона у крыс: при адреналэктомии – дефицит кортикостерона в течение 1 недели, при введении метирапона – небольшое и кратковременное понижение уровня кортикостерона в крови. У крыс с десенситизацией КЧН нами обнаружено достоверное повышение уровня глюкозы в крови после введения метирапона. Подобный эффект наблюдали и другие авторы [35, 36], механизм этого эффекта пока остается неясным. Было высказано предположение, что метирапон может влиять на уровень глюкозы независимо от уровня кортикостерона и ГГАКС через другие структуры мозга [35].
Вопрос о влиянии десенситизации КЧН на активность ГГАКС и ее гормонов изучен недостаточно. Имеющиеся данные довольно противоречивы и далеко не новы. Показано, что у крыс с десенситизацией КЧН при холодовом стрессе не происходит повышение уровня АКТГ и кортикостерона в крови. Однако при иммобилизационном стрессе повышение уровня АКТГ и кортикостерона в крови не устраняется десенситизацией КЧН [37]. При введении интерлейкина 1 или простагландинов повышение уровня АКТГ значимо выше у контрольных крыс, чем у крыс с десенситизацией КЧН, в то же время, при стрессе, вызванном перемещением животного из одной клетки в другую (cage switch), отличий между этими группами не наблюдается [38]. При неонатальной десенситизации КЧН обнаружено снижение базальных уровней кортикостерона, глюкагона и катехоламинов в крови взрослых крыс [39]. В некоторых работах обнаружен повышенный уровень кортикостерона в крови крыс с десенситизацией КЧН в ответ на ульцерогенный стимул или на стрессор [6, 38]. Таким образом, судя по представленным работам, при десенситизации КЧН может наблюдаться снижение активности ГГАКС, отсутствие изменений, либо повышение активности. Вероятно, характер изменений активности ГГАКС при стрессе в условиях нейротоксического действия капсаицина зависит от модальности и силы предъявляемого стрессора.
Неясно, как изменяется чувствительность нижних звеньев ГГАКС к соответствующим стимулам у крыс с десенситизацией КЧН. При внутривенном введении АКТГ уровень кортикостерона был одинаково повышен у крыс с десенситизацией КЧН и у контрольных животных, не различался у этих двух групп крыс и ответ на внутривенное введение КРФ по уровню АКТГ [37]. Однако в другой работе показано, что у крыс с десенситизацией КЧН повышение уровня АКТГ в крови после введения КРФ было достоверно более значимым по сравнению с таковым уровнем контрольных животных [38].
Результаты, полученные в представленной работе, совпадают с теми данными литературы, в которых показано отсутствие влияния десенситизации КЧН на активность ГГАКС. Об этом свидетельствуют следующие выявленные нами факты: отсутствие изменений базального и “стрессорного” (после голода и введения индометацина) уровня кортикостерона, незначительное отставание в приросте массы тела, отсутствие изменений относительной массы надпочечников, тимуса и селезенки.
Таким образом, сенситизация КЧН малыми дозами капсаицина приводит к увеличению уровня кортикостерона в крови и оказывает дозозависимый гастропротективный эффект при ульцерогенном действии индометацина на желудок. Кратковременное предотвращение повышения уровня кортикостерона метирапоном приводит к устранению гастропротективного эффекта КЧН, вызванного введением капсаицина в дозе 1 мг/кг. Полученные результаты свидетельствуют об участии глюкокортикоидных гормонов в опосредовании гастропротективного эффекта сенситизации КЧН.
Список литературы
Brzozowski T.1., Konturek P.C., Sliwowski Z., Drozdowicz D., Kwiecien S., Pawlik M., Pajdo R., Konturek S.J., Pawlik W.W., Hahn E.G. Neural aspects of ghrelin-induced gastroprotection against mucosal injury induced by noxious agents. J. Physiol. Pharmacol. 57(Suppl. 6): 63–76. 2006.
Holzer P. Efferent-like roles of afferent neurons in the gut: blood flow regulation and tissue protection. Auton. Neurosci. 125(1–2): 70–75. 2006.
Takeuchi K., Kato S., Takeeda M., Ogawa Y., Nakashima M., Matsumoto M. Facilitation by endogenous prostaglandins of capsaicin-induced protection in rodent through EP2 and IP receptors. J. Pharmacol. Exp. Ther. 304(3): 1055–1062. 2003.
Mózsik G. Capsaicin as new orally applicable gastroprotective and therapeutic drug alone or in combination with nonsteroidal anti-inflammatory drugs in healthy human subjects and in patients. Prog. Drug. Res. 68: 209–258. 2014.
Kwiecien S., Magierowska K., Magierowski M., Surmiak M., Hubalewska-Mazgaj M., Pajdo R., Sliwowski Z., Chmura A., Wojcik D., Brzozowski T. Role of sensory afferent nerves, lipid peroxidation and antioxidative enzymes in the carbon monoxide-induced gastroprotection against stress ulcerogenesis. J. Physiol. Pharmacol. 67(5): 717–729. 2016.
Бобрышев П.Ю., Подвигина Т.Т., Багаева Т.Р., Филаретова Л.П. Компенсаторное гастропротективное действие глюкокортикоидных гормонов в условиях выключения функции капсаицин-чувствительных нейронов у крыс. Рос. физиол. журн. им. И. М. Сеченова. 92(8): 1006–1015. 2006. [Bobryshev P.Y., Podvigina T.T., Bagaeva T.R., Filaretova L.P. Compensatory gastroprotective action of glucocorticoid hormones in the rats with ablation of capsaicin-sensitive neurons. Russ. J. Physiol. 92(8): 1006–1015. 2006. (in Russ.)].
Filaretova L., Bobryshev P., Bagaeva T., Podvigina T., Takeuchi K. Compensatory gastroprotective role of glucocorticoid hormones during inhibition of prostaglandin and nitric oxide production and desensitization of capsaicin-sensitive neurons. Inflammopharmacology. 15(4): 146–153. 2007.
Abdel-Salam O.M., Debreceni A., Mózsik G., Szolcsányi J. Capsaicin-sensitive afferent sensory nerves in modulating gastric mucosal defense against noxious agents. J. Physiol. (Paris). 93(5): 443–454. 1999.
Mózsik G., Vincze A., Szolcsányi J. Four response stages of capsaicin-sensitive primary afferent neurons to capsaicin and its analog: gastric acid secretion, gastric mucosal damage and protection. J. Gastroenterol. Hepatol. 16(10): 1093–1097. 2001.
Brzozowski T.1., Konturek S.J., Sliwowski Z., Pytko-Polończyk J., Szlachcic A., Drozdowicz D. Role of capsaicin-sensitive sensory nerves in gastroprotection against acid-independent and acid-dependent ulcerogens. Digestion. 57(6): 424–432. 1996.
Harada N., Okajima K. Inhibition of neutrophil activation by lafutidine, an H2-receptor antagonist, through enhancement of sensory neuron activation contributes to the reduction of stress-induced gastric mucosal injury in rats. Dig. Dis. Sci. 52(2): 469–477. 2007.
Holzer P. Transient receptor potential (TRP) channels as drug targets for diseases of the digestive system. Pharmacol. Ther. 131(1): 142–170. 2011.
Sun F., Xiong S., Zhu Z. Dietary capsaicin protects cardiometabolic organs from dysfunction. Nutrients. 8 (5). doi 2016.10.3390/nu8050174
Bloom S.R., Edwards A.V., Jones C.T. Adrenal responses to calcitonin gene-related peptide in conscious hypophysectomized calves. J. Physiol. 409: 29–41. 1989.
Choi Y.J., Kim J.Y., Yoo S.B., Lee J.H., Jahng J.W. Repeated oral administration of capsaicin increases anxiety-like behaviors with prolonged stress-response in rats. J. Biosci. 38(3): 561–571. 2013.
Brzozowski T., Drozdowicz D., Szlachcic A., Pytko-Polonczyk J., Majka J., Konturek S.J. Role of nitric oxide and prostaglandins in gastroprotection induced by capsaicin and papaverine. Digestion. 54(1): 24–31. 1993.
Evangelista S., Maggi C.A., Giuliani S., Meli A. Further studies on the role of the adrenals in the capsaicin-sensitive “gastric defence mechanism”. Int. J. Tissue React. 10 (4): 253–255. 1988.
Garabadu D., Shah A., Ahmad A., Joshi V.B., Saxena B., Palit G., Krishnamurthy S. Eugenol as an anti-stress agent: modulation of hypothalamic-pituitary-adrenal axis and brain monoaminergic systems in a rat model of stress. Stress. 14(2): 145–155. 2011.
Martínek J., Hlavova K., Zavada F., Seifert B., Rejchrt S., Urban O., Zavoral M. “A surviving myth” – corticosteroids are still considered ulcerogenic by a majority of physicians. Scand. J. Gastroenterol. 45(10): 1156–1161. 2010.
Филаретова Л.П. Стресс и язвообразование в желудке: гастропротективная роль глюкокортикоидных гормонов. Рос. физиол. журн. им. И.М. Сеченова. 95(10): 1160–1170. 2009. [Filaretova L.P. Stress and gastric ulcer formation: the gastroprotective role of glucocorticoid hormones. Russ. J. Physiol. 95(10): 1160–1170. 2009. (in Russ.)].
Филаретова Л.П. Вклад глюкокортикоидных гормонов в гастропротекцию. Успехи физиол. наук. 45(1): 43–55. 2014. [Filaretova L.P. Contribution of glucocorticoid hormones to gastroprotection. Usp. Fisiol. Nauk. 45(1): 43–55. 2014. (in Russ.)] .
Filaretova L. Gastroprotective role of glucocorticoids during NSAID-induced gastropathy. Curr. Pharm. Des. 19(1): 29–33. 2013.
Filaretova L., Bagaeva T. The realization of the brain-gut interactions with corticotropin releasing factor and glucocorticoids. Curr. Neuropharmacol. 14(8): 876–881. 2016.
Filaretova L., Bagaeva T., Morozova O. Stress and stomach: corticotropin-releasing factor may protect the gastric mucosa through involvement of glucocorticoids. Cell Mol. Neurobiol. 32(5): 829–836. 2012.
Filaretova L., Podvigina T., Bagaeva T., Morozova O. From gastroprotective to ulcerogenic effects of glucocorticoids: role of long-term glucocorticoid action. Curr. Pharm. Des. 20(7): 1045–1050. 2014.
Подвигина Т.Т., Филаретова Л.П. Двойственные эффекты глюкокортикоидных гормонов на слизистую оболочку желудка. Успехи физиол. наук. 45(4): 19–33. 2014. [Podvigina T.T., Filaretova L.P. Dual effects of glucocorticoids on the gastric mucosa. Usp. Fisiol. Nauk. 45(4): 19–33. 2014. (in Russ.)].
Filaretova L., Tanaka A., Miyazawa T., Kato S., Takeuchi K. Mechanisms by which endogenous glucocorticoids protects against indomethacin-induced gastric injury in rats. Am. J. Physiol. 83(5): G1082–G1089. 2002.
Abdel-Salam O.M., Czimmer J., Debreceni A., Szolcsányi J., Mózsik G. Gastric mucosal integrity: gastric mucosal blood flow and microcirculation. J. Physiol. (Paris). 95(1–6): 105–127. 2001.
Morgan A.E., Lang C.H. Involvement of capsaicin-sensitive nerves in regulating the hormone and glucose metabolic response to endotoxin. Am. J. Physiol. 273(2, Pt 1): E328–E335. 1997.
Mourad F.H., Saadé N.E. Neural regulation of intestinal nutrient absorption. Prog. Neurobiol. 95(2): 149–162. 2011.
Солнушкин С.Д., Чихман В.Н. Компьютерная обработка биологических изображений. Биомед. радиоэлектроника. 2: 35–40. 2018. [Solnushkin S.D., Chikhman V.N. Experience of biological images processing. Biomed. radioengineering. 2: 35–40. 2018. (in Russ.)].
Mikics E., Kruk M.R., Haller J. Genomic and non-genomic effects of glucocorticoids on aggressive behavior in male rats. Psychoneuroendocrinology. 29(5): 618–635. 2004.
Suleyman H., Demircan B., Gocer N.F., Halycy Z., Hacymuftuo A. Role of adrenal gland hormones in the mechanism of antiulcer action of nimesulide and ranitidine. Pol. J. Pharmacol. 56: 799–804. 2004.
Szabo S., Gallagher G.T., Horner H.C., Frankel P.W., Underwood R.H., Konturek S.J., Brzozowski T., Trier J.S. Role of the adrenal cortex in gastric mucosal protection by prostaglandins, sulfhydryls and cimetidine in the rat. Gastroenterology. 85(6): 1384–1390. 1983.
Gehlert D.R., Shaw J. 5-Hydroxytryptamine 1A (5HT1A) receptors mediate increases in plasma glucose independent of corticosterone. Eur. J. Pharmacol. 745 : 91–97. 2014.
Thomson E.M., Pilon S., Guénette J., Williams A., Holloway A.C. Ozone modifies the metabolic and endocrine response to glucose: Reproduction of effects with the stress hormone corticosterone. Toxicol. Appl. Pharmacol. 342: 31–38. 2018.
Donnerer J., Lembeck F. Different control of the adrenocorticotropin-corticosterone response and of prolactin secretion during cold stress, anesthesia, surgery, and nicotine injection in the rat: involvement of capsaicin-sensitive sensory neurons. Endocrinology. 126(2): 921–926. 1990.
Watanabe T., Morimoto A., Tan N., Makisumi T., Shimada S.G., Nakamori T., Murakami N. ACTH response induced in capsaicin-desensitized rats by intravenous injection of interleukin-1 or prostaglandin. Eur. J. Physiol. 475(1): 139–145. 1994.
Koopmans S.J., Leighton B., DeFronzo R.A. Neonatal de-afferentation of capsaicin-sensitive sensory nerves increases in vivo insulin sensitivity in conscious adult rats. Diabetologia. 41(7): 813–820. 1998.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


