Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 2, стр. 216-224
Влияние элементов пуринергической сигнальной системы на функциональные свойства плазмалеммы гранулоцитов
Е. А. Шамрай 1, *, М. Ю. Скоркина 1, Е. А. Сладкова 1, Е. Н. Зинакова 1, О. В. Черкашина 2, М. Ю. Пальчиков 1
1 Белгородский государственный национальный исследовательский университет
Белгород, Россия
2 Белгородская областная клиническая больница им. Св. Иоасафа
Белгород, Россия
* E-mail: elenashamray@yandex.ru
Поступила в редакцию 20.11.2018
После доработки 12.12.2018
Принята к публикации 13.12.2018
Аннотация
Пуринергическая сигнальная система выполняет ключевую роль в регуляции межклеточных взаимодействий в микроциркуляторном русле. Практически все типы клеток осуществляют выброс молекулы АТФ, которая активирует клеточную поверхность гранулоцитов через семейство пуринергических рецепторов и обеспечивает эффективное функционирование клеток на различных этапах иммунного воспаления. В выполненном исследовании с целью активации элементов пуринергической сигнальной системы использована модель механического стресса in vitro. При моделировании условий механической деформации клеток уровень АТФ в крови увеличился в 2.3 раза по сравнению с контролем, заряд клеточной поверхности и жесткость снизились соответственно на 47 и 16.8% (р < 0.05), а сила адгезии между эритроцитом и гранулоцитом возросла на 18% (р < 0.05). Смоделировав осмотическую нагрузку на клетку после механического стресса нам удалось опосредованно доказать везикулярный выход АТФ из гранулоцитов с использованием части запасов мембранного резерва, в результате чего относительный мембранный резерв, задействованный гранулоцитами в регуляции своего объема, был снижен примерно в 1.5 раза по сравнению с контролем. Полученные данные указывают на ведущую регуляторную роль молекулы АТФ, которая выступает паракринным регулятором биофизических свойств плазмалеммы гранулоцитов в условиях стимуляции механической деформации клеток крови и аутокринным регулятором в механизмах регуляции клеточного объема. Полученные экспериментальные данные имеют значение в изучении механизмов межклеточных взаимодействий в микроциркуляторном русле и могут быть учтены при поиске и разработке фармакологических регуляторных мишеней с целью поддержания функциональной активности иммунных клеток.
Пуринергическая сигнальная система является эволюционно древним механизмом межклеточной коммуникации, который, посредством изменения свойств плазмалеммы клеток крови, запускает физиологические и патофизиологические ответы, такие как воспаление [1], миграция [2], дифференцировка [3] и пролиферация лейкоцитов [4], регуляция апоптоза [5].
Известно, что при прохождении эритроцитов через узкие просветы капилляров в условиях механической деформации они освобождают молекулы АТФ, активно взаимодействующие с рецепторами Р2Y-семейства на эритроцитарной поверхности, что приводит к еще более выраженному выбросу АТФ через канал паннексин-1 [6]. В межклеточном пространстве молекула АТФ деградирует в течение нескольких секунд, расщепляясь семейством эктонуклеотидаз [7] с образованием метаболитов, которые являются агонистами пуринергических рецепторов, широко представленных на различных клеточных типах, в том числе и на иммунных клетках. Согласно работе M.D. Ita [8] на плазмалемме всех полиморфноядерных лейкоцитов экспрессированы рецепторы пуринергической сигнальной системы подтипов Р2Y. Это семейство рецепторов связано с G-белками [9] и активируется АТФ, АДФ, УТФ, УДФ и УДФ-глюкозой [10].
Семейство пуринергических рецепторов на плазмалемме гранулоцитов активно участвует в механизмах сигнальной трансдукции, в частности, позволяет им реагировать на сигнальные молекулы, продуцируемые, например, эритроцитами [11], тромбоцитами [12] при реализации своих функций. Вместе с тем, при реализации гранулоцитами физиологических функций при миграции и формировании псевдоподий и фагосом [13], в процессах деформации при прохождении клеток крови через капилляры [14] клетки используют дополнительные мембранные структуры, заложенные в складчатости плазмалеммы. Эти структуры формируют мембранный резерв клетки, который задействован ею в процессах жизнедеятельности. В связи с этим актуальным является изучение вопросов, связанных с участием активации элементов пуринергической сигнальной системы и их влиянием на биофизические свойства плазмалеммы (упругость, заряд) и регуляторные возможности мембраны, задействованные в регуляции объема клетки. Цель исследования – изучить влияние элементов пуринергической сигнальной системы на биофизические свойства плазмалеммы и использование мембранного резерва гранулоцитами в механизмах регуляции объема на моделях механического и осмотически индуцированного стресса in vitro.
МЕТОДЫ ИССЛЕДОВАНИЯ
В эксперименте использовали кровь здоровых людей (n = 30) в возрасте от 25 до 45 лет, проходивших диспансеризацию на базе областной клинической больницы г. Белгорода. Забор крови проводили путем пункции вены с участием специализированного медперсонала. Кровь собирали в вакуумные пробирки Vacuette K3E, содержащие сухую ЭДТА К3 в концентрации 2.0 мг (0.006843 моль/л) на 1 мл крови. Исследования выполнены с соблюдением требований Хельсинской декларации, получено предварительное информированное согласие участников эксперимента в соответствии с рекомендациями (Декларация по этическим принципам медицинских исследований, в которых участвуют люди, принятая 52-ой Генеральной Ассамблеей Всемирной Медицинской Ассоциации, Эдинбург, Шотландия, октябрь, 2000 г.).
Каждую пробу крови делили на две части – контрольную и опытную. Опытные пробы крови подвергали механическому стрессу, контрольные – оставались интактными. Механический стресс in vitro моделировали согласно методу, описанному в работе [15]. В опытных пробах измеряли концентрацию АТФ колориметрическим методом [16]. В исследуемых пробах измеряли оптическую плотность, используя фотометр фотоэлектрический КФК-3 (Россия, 2008) при длине волны 670 нм против физиологического раствора. Уровень АТФ рассчитывали по разности оптических плотностей между пробиркой, в которой провели гидролиз фосфатных связей, и пробой без гидролиза фосфатных связей, используя калибровочный график. Для построения калибровочного графика использовали раствор фосфат-ионов (ГСО 7791-2000) в концентрациях от 50 до 500 мкг/мл с шагом в 50 мкг/мл. Измерение АТФ выполняли в трех повторностях для каждой пробы.
Функциональная активность клеточной поверхности гранулоцитов тесно связана с биофизическими свойствами плазмалеммы, которые изучали с использованием подходов атомно-силовой микроскопии. Количественно механические свойства плазмалеммы клеток крови оценивали по числовым данным модуля Юнга. В основе метода регистрации модуля Юнга лежит измерение степени деформации поверхности образца при взаимодействии его с вершиной зонда АСМ [17]. В работе использованы модифицированные АСМ-зонды, изготовленные коллективом авторов на основе полимерных микросфер с радиусом закругления 5 мкм. Измерение модуля Юнга осуществляли на атомно-силовом микроскопе (АСМ) ИНТЕГРА ВИТА (конфигурация на базе инвертированного оптического микроскопа Olympus IX-71; производитель NT MDT, Зеленоград, 2009). Измерения выполнены в режиме силовой спектроскопии согласно алгоритму, описанному в работе [18]. Из каждой пробы сканировали по 20 клеток, таким образом, общая выборка клеточной популяции в крови здоровых людей составила по 600 клеток в каждой опытной и контрольной группах.
Электрические свойства мембраны гранулоцитов оценивали, выполняя измерения поверхностного потенциала (ПП) в режиме зонда Кельвина на АСМ. Суспензию клеток для измерения ПП и процедуру измерения осуществляли согласно способу, изложенному в работе [19]. Использовали кантилеверы с токопроводящим титановым покрытием серии NSG03/TiN (Nanoworld, США). Из каждой пробы сканировали по 20 гранулоцитов, проводили обработку полученных сканов в программе Nova (NT-MDT, Россия).
Изучение механизмов межклеточной адгезии выполнено на АСМ в режиме силовой спектроскопии. Для измерения сил адгезии между эритроцитом и гранулоцитом конструировали биосенсорный чип, изготовленный на основе нативного эритроцита и типлесса CSG11 (США) согласно способу, изложенному в работе [20]. Выбор эритроцита в качестве биосенсора основан на идее о том, что в микроциркуляторном русле популяция эритроцитов играет ключевую роль в процессе маргинации гранулоцитов к сосудистой стенке [21] и их дальнейшей экстравазии через сосудистую стенку [22]. Силу межклеточной адгезии измеряли в системе «эритроцит–гранулоцит», регистрируя силовые кривые с поверхности 20 клеток, таким образом, в исследовании выполнено 600 измерений. Силы адгезии рассчитывали с помощью программного обеспечения Nova (NT-MDT, Зеленоград, 2009).
Учитывая тот факт, что в мембранах гранулоцитов обнаружены механо-осмотические датчики в виде каналов TRPV4 [23], которые трансформируют физические раздражители в Са2+-зависимое высвобождение АТФ [24], в выполненном исследовании была использована модель гипоосмотической нагрузки, приложенной к гранулоцитам после механического стресса. Использованная модель, с одной стороны, позволила оценить осморегуляторные реакции клетки по длительности периода регуляторного увеличения объема клетки и возможности клетки восстанавливать свой объем до исходных значений, а с другой стороны пронаблюдать аутокринные эффекты освобожденной молекулы АТФ в ходе набухания.
Лейкоциты из цельной крови в опытных и контрольных пробах выделяли путем центрифугирования при 1500 об./мин в течение 5 мин. Проводили нагрузочные гипоосмотические тесты in vitro. Суспензию лейкоцитов в опытных и контрольных пробах делили на 2 части: к первой добавляли равное количество аутологичной плазмы, ко второй – гипотонического раствора хлорида натрия (0.45%).
Формировали суспензионные препараты из каждой пробы, в которых через каждые 30 с регистрировали изображения нативной суспензии лейкоцитов с помощью лазерного сканирующего конфокального микроскопа Nikon (TokyoByoke, 2011), используя программное обеспечение Nis-Elements Documentation (ver. 2.32). Длительность гипоосмотической нагрузки составила 5 мин. На полученных изображениях измеряли диаметр 50 клеток из каждой пробы. На основе промеров диаметров рассчитывали объем клетки по формуле (1):
где V – объем клетки, мкм3; R – радиус клетки, мкм.Рассчитывали относительный мембранный резерв, заложенный в складчатости плазмалеммы и используемый клетками в регуляции объема при гипоосмотической нагрузке, согласно формуле (2):
(2)
${{M}_{{{\text{о т н }}{\text{.}}}}} = \frac{{{{S}_{{\text{г }}}} - {{S}_{{\text{п }}}}}}{{{{V}_{{\text{п }}}}}},$Интенсивность использования относительного мембранного резерва клеткой оценивали, вычисляя процент относительного мембранного резерва, используемого клеткой от потенциального мембранного резерва, принимаемого за 100%.
Результаты экспериментальных исследований обрабатывали методами вариационной статистики. Достоверность различий между контрольными и опытными пробами определяли с использованием t критерия Стьюдента при p < 0.05 в случае нормального распределения признака и U-критерия Манна–Уитни при p < 0.05 для непараметрических данных. В работе приведены средние величины (М) и величины статистической ошибки средней (m).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
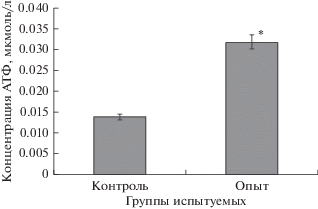
При активации элементов пуринергической сигнальной системы в условиях механической деформации клеток крови in vitro установлено увеличение концентрации АТФ в крови в 2.3 раза по сравнению с контролем (рис. 1).
Рис. 1.
Концентрация АТФ в крови. Опыт – под влиянием механического стресса in vitro, контроль – интактная кровь. * – статистически значимые различия между показателями в опытной и контрольной группах по критерию Стьюдента (p < 0.05).
В условиях механической стимуляции установлено изменение биофизических свойств плазмалеммы гранулоцитов. В опытных пробах крови, подвергнутых механическому стрессу in vitro, заряд гранулоцитов стал более отрицательный – снизился на 47% (р < 0.05) что повлекло за собой увеличение адгезивной активности клеточной поверхности (табл. 1).
Таблица 1.
Биофизические свойства клеточной поверхности гранулоцитов
| Показатели | Контроль | Опыт |
|---|---|---|
| Сила адгезии в системе “эритроцит–гранулоцит”, нН | 35.9 ± 0.2 | 43.9 ± 1.1* |
| Модуль Юнга гранулоцитов, мкПа | 4.16 ± 0.01 | 3.56 ± 0.02* |
| Потенциал поверхности гранулоцитов, мV | –31.76 ± 1.52 | –46.7 ± 4.32* |
Сила адгезии между эритроцитом и гранулоцитом возросла на 18% (р < 0.05) по сравнению с контрольной группой. Кроме того, в условиях механического стресса модуль Юнга, характеризующий жесткость поверхности, снизился на 16.8% (р < 0.05) по сравнению с контролем.
В тестах с осмотической нагрузкой установлено увеличение объема клеток на протяжении всего времени инкубации, по сравнению с клетками, помещенными в аутологичную плазму как в опытных, так и в контрольных пробах. Кроме того, отмечено регуляторное сокращение объема клеток в исследуемых пробах к концу по сравнению с начальными секундами инкубации (табл. 2).
Таблица 2.
Объем гранулоцитов в тестах с осмотической нагрузкой in vitro
| Время, с | Контроль | Модель механического стресса | ||
|---|---|---|---|---|
| V плазма, мкм3 | V гипо, мкм3 | V плазма, мкм3 | V гипо, мкм3 | |
| 0 | 443.7 ± 5.1 | 602.4 ± 7.1* | 476.8 ± 4.7 | 596.6 ± 5.7* |
| 30 | 452.0 ± 5.0 | 600.4 ± 6.6* | 481.3 ± 4.7 | 585.4 ± 5.4* |
| 60 | 451.7 ± 4.8 | 581.2 ± 6.4* | 484.4 ± 4.6 | 589.1 ± 5.3* |
| 90 | 447.1 ± 4.7 | 578.3 ± 6.1* | 486.3 ± 4.2 | 568.9 ± 5.2* |
| 120 | 446.4 ± 5.0 | 565.4 ± 6.0* | 479.5 ± 4.1 | 566.0 ± 5.2* |
| 150 | 452.5 ± 5.0 | 565.5 ± 6.0* | 485.8 ± 4.5 | 553.4 ± 4.9* |
| 180 | 450.1 ± 4.9 | 556.9 ± 5.8* | 478.3 ± 4.3 | 555.9 ± 4.9* |
| 210 | 446.4 ± 4.7 | 544.1 ± 6.0* | 484.4 ± 4.6 | 553.5 ± 4.9* |
| 240 | 454.6 ± 4.7 | 543.8 ± 5.5* | 492.6 ± 4.4 | 561.1 ± 4.8* |
| 270 | 451.2 ± 4.7 | 540.9 ± 5.6* | 484.6 ± 4.3 | 555.9 ± 4.9* |
| 300 | 451.4 ± 4.6 | 533.0 ± 5.5* | 482.5 ± 4.3 | 551.7 ± 4.8* |
При сравнении изменения объема в гипотонической среде между опытной и контрольной группами установлено, что фаза регуляторного увеличения объема гранулоцитов в первые 30 с инкубации менее выражена в условиях активации элементов пуринергических сигнальных путей. Выявленная особенность подтверждена данными по использованию относительного мембранного резерва гранулоцитами в гипотонической среде (рис. 2).
Рис. 2.
Интенсивность использования относительного мембранного резерва гранулоцитами в гипоосмотическом тесте (in vitro). Опыт – под влиянием механического стресса in vitro; контроль – интактная кровь; Mотн. – относительный мембранный резерв клетки, мкм–1. * – статистически значимые различия между показателями по критерию Стьюдента (p < 0.05).
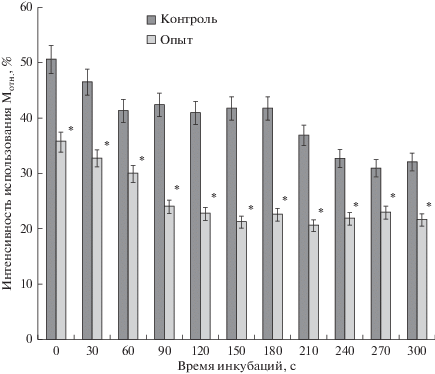
При анализе динамики изменения объема гранулоцитов и использования ими относительного мембранного резерва в реакциях осморегуляции видно, что в условиях стимуляции элементов пуринергической сигнальной системы вовлечение дополнительных мембранных структур в механизмы регуляции объема снижено по сравнению с контролем примерно в 1.5 раза, а в середине инкубации (через 150–180 с) – в 2 раза по сравнению с контролем.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В выполненном исследовании изучено влияние элементов пуринергической сигнальной системы на биофизические свойства плазмалеммы гранулоцитов и их способность поддерживать свой объем за счет мембранного резерва в условиях гипоосмотического стресса in vitro. Установлено, что в условиях механической деформации клеток крови концентрация АТФ в крови возросла в 2.3 раза по сравнению с пробами без нагрузки. Полученные данные свидетельствуют об экскреции в межклеточное пространство молекул АТФ при механической стимуляции, что согласуется с результатами, представленными рядом авторов [7, 25].
Смоделированный механо-индуцированный выброс АТФ клетками крови повлиял на биофизические свойства поверхности гранулоцитов. В частности, снизились жесткость и заряд клеточной поверхности, увеличилась сила адгезии между лейкоцитом и эритроцитом. Изменение биофизических свойств клеточной поверхности мы связываем с запуском и реализацией пуринергического сигнального каскада под влиянием механического стресса, что приводит к увеличению концентрации цитозольного Са2+, необходимого для ремоделирования элементов цитоскелета [7]. В настоящее время рядом работ описаны Р2Х рецепторы, которые представляют собой мембранные ионные каналы, открывающиеся в течение миллисекунд в ответ на связывание с АТФ [26]. Рецептор Р2Х4, экспрессированный на поверхности иммунных клеток, имеет высокую проницаемость для Са2+ [27]. На модели фибробластов установлено повышение концентрации внутриклеточного Са2+ в ответ на механическую стимуляцию, что приводит к снижению жесткости клеточной поверхности и тканевого напряжения, вызванного растяжением ткани [28, 29].
Смоделировав осмотическую нагрузку на клетку после механического стресса нам удалось опосредованно доказать везикулярный выход АТФ из гранулоцитов с использованием части запасов мембранного резерва. Согласно полученным нами результатам относительный мембранный резерв, задействованный гранулоцитами в регуляции своего объема, был снижен примерно в 1.5 раза по сравнению с контролем. Согласно данным литературы в лейкоцитах функционирует TRPV4-катионный канал в качестве датчика, трансформирующего осмотические стимулы в Са2+-зависимое высвобождение АТФ посредством везикулярного транспорта с участием паннексина-1 [10]. Полученные результаты указывают на то, что в условиях осмотического напряжения в гранулоцитах запускается отток цитозольных нуклеотидов в виде везикул с поверхности мембраны, что в итоге снижает доступный мембранный резерв, задействованный клетками в механизмах регуляции объема.
С точки зрения физиологии микроциркуляции выявленные изменения биофизических свойств плазмалеммы гранулоцитов в условиях запуска пуринергического сигнального каскада позволяют более “мягким” клеткам легче мигрировать и сильнее адгезировать за счет более отрицательного заряда клеточной поверхности к клеткам эндотелия, что обеспечивает их эффективное функционирование.
Таким образом, в условиях стимуляции механической деформации клеток крови (модель механического стресса in vitro) доказано увеличение концентрации АТФ в крови, изменение биофизических свойств плазмалеммы гранулоцитов и снижение относительного мембранного резерва, задействованного в регуляции клеточного объема. Под влиянием механического стресса снизилась жесткость клеточной поверхности, при этом она приобрела более выраженный отрицательный заряд, что в итоге способствовало увеличению сил адгезии в системе “эритроцит–гранулоцит”. Полученные данные указывают на ведущую регуляторную роль молекулы АТФ, которая выступает паракринным регулятором биофизических свойств плазмалеммы гранулоцитов в условиях стимуляции механической деформации клеток крови и аутокринным регулятором в механизмах регуляции клеточного объема. Полученные экспериментальные данные имеют значение в изучении механизмов межклеточных взаимодействий в микроциркуляторном русле и могут быть учтены при поиске и разработке фармакологических регуляторных мишеней с целью поддержания функциональной активности иммунных клеток.
Список литературы
Campwala H., Fountain S.J. Constitutive and agonist stimulated ATP secretion in leukocytes. Commun. Integr. Biol. 6(3): e23631. 2013.
Chen Y., Sumi Y.Y., Li A., To U.K., Elkhal A., Inoue Y., Woehrle T., Zhang Q., Hause C., Junger W.G. Purinergic signaling: a fundamental mechanism in neutrophil activation. Sci. Signal. 3(125): ra45. 2014.
Di V.F, Vuerich M. Purinergic signaling in the immune system. Auton Neurosci. 191: 117–123. 2015.
Kaebisch C., Schipper D., Tobiasch E. The role of purinergic receptors in stem cell differentiation. Computat. Struct. Biotechnol. J. 13: 75–84. 2015.
Qu Y., Misaghi S., Newton K., Gilmour L.L., Louie S., Cupp J.E., Dubyak G.R., Hackos D., Dixit V.M. Pannexin-1 is required for ATP release during apoptosis but not for inflammasome activation. J. Immunol. 186 : 6553–6561. 2011.
Baroja-Mazo A., Barbero-Gremades H., Pelegrini P. The participation of plasma membrane hemichannels to purinergic signaling. Biochem. Biophys. Acta. 828: 79–93. 2013.
Montalbetti N., Denis M.F.L., Pignataro O.P., Kobatake E., Lazarowski E.R., Schwarbaum P.J. Homeostasis of extracellular ATP in human erythrocytes. J. Biol. Chem. 286(44): 38397–38407. 2011.
Ita M.D., Vargas M.H., Carbajal V., Ortiz-Quentero B., Lopez-Lopez C. ATP releases ATP or other nucleotides from human peripheral blood leukocytes through purinergic P2 receptors. Life Sci. 145(5): 85–92. 2016.
Burnstock G., Boeynaems J.-M. Purinergic signalling and immune cells. Purinergic Signalling. 10: 529–564. 2014.
Lazarowski E.R. Vesicular and conductive mechanisms of nucleotide release. Purinergic Signalling. 8: 359–373. 2012.
Ellworth M., Ellis C., Goldman D. Erythrocytes: oxygen sensor and modulators of vascular tone. Physiology. 24: 107–116. 2009.
Clark S.R., Ma A.C., Tavener S.A., McDonald B., Goodarzi Z., Kelly M.M., Patel K.D., Chakrabarti S., McAvov E., Sinclair G.D., Keys E.M., Allen-Vercoe E., Devvinev R., Doig C.J., Green F.H., Kubes P. Platelet TLR4 activates neutrophil exytacellular traps to ensnare bacteria in septic blood. Nature Med. 13: 463–469. 2007.
Федорова М.З., Левин В.Н. Использование мембранного резерва лимфоцитами крови при деформации и в условиях гипотонии. Биол. мембраны. 18(14): 306–311. 2001. [Fedorova M.Z., Levin V.N. Use of membrane reserve by blood lymphocytes during deformation and under hypotonia. Biol. membranyi. 18(14): 306–311. 2001. (In Russ.)].
Федорова М.З., Надеждин С.В., Головко С.В., Зубарева Е.В. Сравнительная оценка “мембранного резерва” клеток крови земноводных и млекопитающих. Журн. эвол. биохим. и физиол. 43(5): 419–422. 2007. [Fedorova M.Z., Nadezhdin S.V., Golovko S.V., Zubareva E.V. Comparative evaluation of the “membrane reserve” of amphibian and mammalian blood cells. Zhurn. evol. biohim. i fiziol. 43(5): 419–422. 2007. (In Russ.)].
Oonishi T., Sakashita K., Uyesaka N. Regulation of red blood cell filterability by Ca2+ influx and cAMP-mediated signaling pathways. Am. J. Physiol. Soc. 273: C1828–C1834. 1997.
Алейникова Т.Л., Рубцова Г.В. Руководство к практическим занятиям по биохимии. М. Высшая школа. 1988. [Aleynikova T.L., Rubtsova G.V. Rucovodstvo k prakticheskim zanytiyam po biokhimii. [Guide to practical classes in biochemistry]. Moscow. Vyisshaya shkola. 1988].
Alonso J.L., Goldman W.H. Feeling the forces: atomic force microscopy in cell biology. Life Sci. 72: 2553–2560. 2003.
Скоркина М.Ю., Федорова М.З., Муравьев А.В., Сладкова Е.А. Использование наномеханического сенсора для изучения морфофункциональных свойств лимфоцитов здоровых доноров и больных хроническим лимфобластным лейкозом. Клет. техн. в биол. и мед. 3: 172–175. 2012. [Skorkina M.Yu., Fedorova M.Z., Muravev A.V., Sladkova E.A. Using a nanomechanical sensor to study the morphofunctional properties of lymphocytes from healthy donors and patients with chronic lymphoblastic leukemia. Klet. tehn. v biol. i med. 3: 172–175. 2012. (In Russ.)].
Сладкова Е.А., Скоркина М.Ю. Оценка поверхностного потенциала лимфоцитов больных лейкозом методом зонда Кельвина. Биофизика. 59(2): 310–313. 2014. [Sladkova E.A., Skorkina M.Yu. Evaluation of the surface potential of lymphocytes in patients with leukemia using the Kelvin probe method. Biofizika. 59(2): 310–313. 2014. (In Russ.)].
Скоркина М.Ю., Шамрай Е.А., Сладкова Е.А. Измерение сил адгезии в системе “клетка–клетка” на основе технологий атомно-силовой микроскопии. Клет. техн. в биол. и мед. 4: 213–215. 2017. [Skorkina M.Yu., Shamray E.A., Sladkova E.A. Measurement of adhesion forces in the “cell–cell” system based on atomic force microscopy technology. Klet. tehn. v biol. i med. 4: 213–215. 2017. (In Russ.)].
Hussain M.A., Merchant S.N., Mombasawala L.S., Puniyani R.R. A decrease in effective diameter of rat mesenteric venules due to leukocyte margination after a bolus injection of pentoxifylline–digital image analysis of an intravital microscopic observation. Microvasc. Res. 67(3): 237–244. 2004.
Verdier C., Couzon C., Duperray A., Singh P. Modeling cell interactions under flow. J. of Mathematical Biology. 58: 235–259. 2009.
Yin J., Michalik L., Tang C., Tabuchi A. Role of transient receptor potential vaniloid 4 in neutrophil activation and acute lung injury. Am. J. Respir. Cell Mol. Biol. 54(3): 370–383. 2016.
Sprung R., Sprague R., Spence D. Determination of ATP release from erythrocytes using microbore tubing as a model of resistance vessels in vivo. Anal. Chem. 74(10): 2274–2278. 2002.
Evans J., Gratzer W., Mohandas N., Parker K., Sleep J. Fluctuations of the red blood cell membrane: relation to mechanical properties and lack of ATP dependence. Biophys J. 94(10): 4134–4144. 2008.
North R.A. P2X receptors. Philos. Trans. R. Soc. Lond. B Biol Sci. 371 (1700): 20150427. 2016.
Egan T.M., Khakh B.S. Contribution of calcium ions to P2X channel responses. J Neurosci. 24(13): 3413–20. 2004.
Abbott R.D., Koptiuch C., Iatridis J.C., Howe A.K., Badger G.J. Stress and matrix-responsive cytoskeletal remodeling in fibroblasts. Cell. Physiol. 228(1): 50–57. 2013.
Helfand B.T., Chang L., Goldman R.D. Intermediate filaments are dynamic and motile elements of cellular architecture. J. Cell Sci. 15: 133–141. 2004.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


