Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 3, стр. 284-294
Акустические стволовые и когнитивные вызванные потенциалы при хроническом нарушении мозгового кровообращения
Д. О. Боричева 1, *, Л. М. Тибекина 1, А. А. Александров 2
1 Санкт-Петербургский государственный университет, Медицинский факультет
Санкт-Петербург, Россия
2 Санкт-Петербургский государственный университет, Биологический факультет
Санкт-Петербург, Россия
* E-mail: daria.boricheva@gmail.com
Поступила в редакцию 26.10.2018
После доработки 29.12.2018
Принята к публикации 12.01.2019
Аннотация
Целью исследования явилось изучение информативности метода слуховых вызванных потенциалов (ВП) – акустических стволовых (АСВП) и когнитивных (негативности рассогласования – НР) в оценке функционального состояния головного мозга и когнитивных функций у пациентов с хроническим нарушением мозгового кровообращения (ХНМК). Клинико-нейрофизиологическое обследование было выполнено 33 пациентам. 1-ю группу составили 12 пациентов с ХНМК преимущественно в каротидном бассейне (КБ), средний возраст 61.2 ± 6.3 года; во 2-ю группу вошли 11 пациентов с ХНМК в вертебрально-базилярном бассейне (ВББ), средний возраст 62.4 ± 8.0 года, а в 3-ю (контрольную) группу – 10 пациентов без цереброваскулярной патологии, средний возраст 54.6 ± 6.4 года. При регистрации АСВП предъявляли по две серии по 1000 стимулов типа “щелчок” на каждое ухо (длительность 0.1 мс, интенсивность 65 дБ над порогом слышимости пациента, частота 10 Гц). Для регистрации НР использовалась классическая пассивная одд-болл парадигма, (стандартный стимул – синусоидальный тон длительностью 50 мс с частотой 1000 Гц, девиантный – 900 Гц; межстимульный интервал – 500 мс). Тестирование по шкалам MMSE, FAB, таблицам Шульте и повторение 10 слов у пациентов с ХНМК, вне зависимости от преимущественно пораженного сосудистого бассейна, выявило снижение когнитивных функций по сравнению с контрольной группой. По данным АСВП статистически значимых изменений у пациентов с ХНМК не отмечалось, однако, при регистрации когнитивного ВП НР у них наблюдалось снижение амплитуды НР по сравнению с контрольной группой. Это свидетельствует о снижении активации механизмов непроизвольного внимания и сокращении длительности сохранения слуховых следов в памяти при ХНМК. НР информативна и может быть использована в оценке когнитивных нарушений у пациентов с ХНМК.
Cосудистые заболевания головного мозга относятся к группе социально значимых заболеваний, т.к. имеют высокий уровень инвалидизации и смертности. В России насчитывается не менее 1.5 млн человек, страдающих хроническим нарушением мозгового кровообращения (ХНМК) [1]. К тому же в настоящее время отмечается увеличение количества пациентов с выявляемыми факторами риска развития острых и хронических форм нарушения мозгового кровообращения [2].
Уже на начальных этапах развития ХНМК у 85–90% пациентов возникают когнитивные нарушения [2]. На ранних стадиях ХНМК отмечается преобладание когнитивных нарушений нейродинамического характера: дефицит внимания, ухудшение кратковременной памяти, замедленность психических процессов, повышенная утомляемость при умственной деятельности. Данные изменения обусловлены развивающимся при хронической ишемии диффузным разрежением белого вещества (лейкоареозом), а также лакунарными очагами в глубинных отделах белого вещества больших полушарий и базальных ганглиях. Вследствие этого происходит функциональное разобщение и вторичная дисфункция передних отделов коры головного мозга [3].
При ХНМК когнитивные расстройства более выражено коррелируют с объемом патологических изменений в тканях головного мозга, чем другие проявления, и вносят существенный вклад в определение тяжести заболевания [4]. В связи с этим разработка эффективных методов их диагностики, лечения и профилактики является одной из важных задач неврологии.
Регистрация АСВП и когнитивного ВП НР относится к методам исследования функционального состояния головного мозга. Метод может быть использован у больных с когнитивными нарушениями, не требуя их активного участия, не зависит от степени мотивации, наличия эмоционально-личностных нарушений в отличие от традиционного исследования при помощи шкал и тестов.
НР (mismatch negativity, MMN) – один из малоизученных у пациентов с сосудистыми заболеваниями головного мозга компонентов слухового ВП с латентностью пика 100–250 мс, возникающий в ответ на изменение характеристик стимула, например, частоты, интенсивности, а также при восприятии речевых компонентов [5]. Психофизиологическая функция НР – автоматическое распознавание изменений при слуховой стимуляции и контроль выхода информации в сознание. НР характеризует наличие возможности реализации когнитивных процессов за счет активации механизмов непроизвольного внимания [6].
Изменение параметров НР (удлинение латентности, снижение амплитуды) может свидетельствовать об уменьшении точности различения слуховых стимулов, длительности сохранения следов в памяти, нарушении переключения непроизвольного внимания, что наблюдается, например, при нейродегенеративных заболеваниях, шизофрении, рассеянном склерозе [6–8].
Для генерации НР на нейромедиаторном уровне большое значение имеет система NMDA-рецепторов [9]. Известно, что NMDA-рецепторы играют ведущую роль в обеспечении синаптической пластичности, и их дисфункция проявляется, в частности, нарушением формирования следов в памяти и прогностического кодирования, лежащих в основе генерации НР [7, 10, 11]. Таким образом, НР может характеризовать функциональное состояние NMDA-рецепторов и процессы пластичности в головном мозге.
Учитывая то, что АСВП отражают наличие дисфункции стволовых структур, а НР является неспецифическим электрофизиологическим коррелятом когнитивной дисфункции, целью исследования явилось изучение информативности метода слуховых ВП (АСВП и НР) в оценке функционального состояния головного мозга и когнитивных функций у пациентов с ХНМК.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследование проведено на базе СПб ГБУЗ “Городская больница № 15” г. Санкт-Петербурга у 33 пациентов. 1-ю группу составили 12 пациентов с ХНМК преимущественно в каротидном бассейне (КБ), средний возраст 61.2 ± 6.3 года (мужчин – 6, женщин – 6). Во 2-ю группу вошли 11 пациентов с ХНМК в вертебрально-базилярном бассейне (ВББ), средний возраст 62.4 ± 8.0 года (мужчин – 3, женщин – 8). 3-ю (контрольную) группу составили 10 пациентов без цереброваскулярной патологии, средний возраст 54.6 ± 6.4 года (мужчин – 6, женщин – 4). Пациенты контрольной группы проходили обследование и лечение по поводу дегенеративно-дистрофического заболевания позвоночника с преимущественным поражением поясничного отдела вне острой стадии болевого синдрома.
У всех пациентов было получено письменное добровольное информированное согласие на участие в исследовании. Когнитивные функции оценивали при помощи шкалы MMSE, батареи тестов лобной дисфункции FAB, таблиц Шульте, теста запоминания десяти слов; эмоциональную сферу – по шкале личностной тревожности Спилбергера–Ханина, госпитальной шкале тревоги и депрессии и гериартрической шкале депрессии [12]. Нейропсихологическое тестирование осуществлялось в спокойной обстановке в отдельном кабинете.
Пациентам проводилось клинико-неврологическое обследование, лабораторные, электрофизиологические (ЭКГ, АСВП), нейровизуализационные (КТ/МРТ головного мозга), ультразвуковые исследования (УЗДГ брахиоцефальных артерий), консультации терапевта, офтальмолога и других специалистов. Данные нейровизуализационного и ультразвукового исследования использовались для подтверждения диагноза, оценки выраженности атрофических изменений вещества головного мозга, изменения параметров гемодинамики и наличия атеросклеротического поражения сосудов каротидного и вертебрально-базилярного бассейнов.
Вследствие того, что в основе метода ВП лежит когерентное накопление и усреднение сигнала в ходе многократного предъявления стимулов и при построении ВП используется большое число накоплений у одного испытуемого, при данных размерах выборки получается достаточно высокий уровень достоверности результатов [9, 13].
Для регистрации АСВП использовалась система для электронейромиографии и регистрации ВП MEB-9400 (Nihon Kohden, Япония). Активные электроды (А1, А2) располагались на сосцевидных отростках височных костей, референтный электрод – в точке Cz по международной системе “10–20”, заземляющий электрод – Fz. Предъявляли по две серии по 1000 стимулов на каждое ухо (тип стимула “щелчок”, длительность 0.1 мс, интенсивность 65 дБ над порогом слышимости пациента, частота 10 Гц). Нижняя граница полосы пропускания равнялась 100 Гц, верхняя – 3 кГц [14].
НР регистрировали при помощи компьютерного энцефалографа Neurovisor 24 (Neurobotics Ltd., РФ) с системой электродов actiCAP (Brain Products GmbH, Германия). Регистрация и анализ ВП были проведены в соответствии с рекомендациями по применению метода ВП в клинических исследованиях Международной федерации клинической нейрофизиологии [6].
Использовалась классическая пассивная одд-болл парадигма, когда в последовательности стандартных (частых) стимулов предъявляются девиантные (редкие) стимулы. В качестве стандартного стимула применялся синусоидальный тон длительностью 50 мс с частотой 1000 Гц, девиантного – 900 Гц. Вероятность предъявления девиантного стимула составляла 0.20, их количество – 150; количество стандартных стимулов – 450; межстимульный интервал – 500 мс. ВП регистрировались в отведениях F3, Fz, F4, Cz, C3, C4, в которых отмечается максимальная выраженность НР [6], и на сосцевидных отростках. Референтный электрод располагался на кончике носа, заземляющий – на лбу. Для отслеживания глазодвигательных артефактов регистрировалась электроокулограмма в вертикальном и горизонтальном отведениях. Сопротивление электродов не превышало 5 кОм. Обработка ВП производилась при помощи пакета WinEEG (Мицар, РФ) c применением анализа независимых компонент. Сигнал оцифровывался с частотой дискретизации 500 Гц (полоса пропускания 0.1–30 Гц). Амплитуда НР считалась как среднее значение на отрезке в 50 мс вокруг индивидуального пика на разностной волне ВП на стандартный и девиантый стимулы [15].
Статистическая обработка проводилась с использованием программы Statistica 10. Результаты представлены в виде среднего значения и стандартного отклонения (М ± σ). Для подтверждения достоверности различий между группами использовался U-критерий Манна–Уитни, при исследовании корреляции – коэффициент корреляции Спирмена. Статистически значимыми различия считались при p < 0.05.
Для анализа когнитивного ВП НР в каждой группе пациентов использовали двухфакторный дисперсионный анализ повторных измерений (repeated measures ANOVA) с факторами: “тип стимула” (число уровней – 2: стандартный, девиантный) и “локализация электрода” (число уровней – 8: Fz, F3, F4, Cz, C3, C4, M1, M2). Также для сравнения средней амплитуды НР в разных группах использовали двухфакторную модель с факторами: “группа” (число уровней – 2: ХНМК/ХНМК в ВББ, контроль) и “локализация электрода” (число уровней – 8: Fz, F3, F4, Cz, C3, C4, M1, M2).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Анализ клинико-неврологического обследования пациентов 1-й группы выявил у них в 11 (92%) случаях пирамидную недостаточность, 4 (33%) – наличие симптомов орального автоматизма и псевдобульбарные нарушения, у 2-х (17%) пациентов – координаторные расстройства и у 1 (8%) - глазодвигательные нарушения. У пациентов 2-й группы (с ХНМК в ВББ) пирамидная недостаточность наблюдалась в 2 (18%) случаях, наличие симптомов орального автоматизма выявлено у 3 (27%) человек, глазодвигательные нарушения – у 4 (36%), а координаторные нарушения – в 100%. Наличие атеросклеротического поражения сосудов каротидного и вертебрально-базилярного бассейна по данным УЗДГ БЦС было выявлено у 15 (65%) больных, что подтверждает вовлечение в патологический процесс двух сосудистых бассейнов с преобладанием клинической картины одного из них.
Результаты исследования когнитивных функций и эмоциональной сферы у пациентов с ХНМК преимущественно в КБ, ХНМК с поражением ВББ и контрольной группы приведены в табл. 1.
Таблица 1.
Результаты исследования когнитивных функций и эмоциональной сферы
| Показатель | 1-я группа (ХНМК в КБ) |
2-я группа (ХНМК в ВББ) |
3-я группа (контрольная) |
|---|---|---|---|
| Показатели исследования когнитивных функций | |||
| MMSE (баллы) | 27.1 ± 2.8* | 27.8 ± 2.1* | 29.4 ± 0.9 |
| FAB (баллы) | 15.7 ± 2.4* | 15.9 ± 1.9* | 17.5 ± 0.5 |
| Тест 10 слов (кол-во слов) | |||
| третье повторение | 7.5 ± 1.2* | 7.7 ± 1.0 | 8.0 ± 1.6 |
| пятое повторение | 8.4 ± 1.4* | 8.8 ± 1.3 | 9.4 ± 0.9 |
| отсроченное | 6.8 ± 2.0* | 8.3 ± 1.6 | 8.5 ± 1.1 |
| Таблицы Шульте (среднее время работы, с) | 59.9 ± 22.7* | 46.5 ± 10.0 | 42.4 ± 6.5 |
| Показатели исследования эмоциональной сферы | |||
| Гериартрическая шкала депрессии (баллы) | 5.8 ± 4.4 | 4.2 ± 2.4 | 4.5 ± 3.8 |
| Госпитальная шкала тревоги и депрессии (баллы) | |||
| шкала тревоги | 7.6 ± 4.7 | 8.3 ± 4.4 | 6.6 ± 5.0 |
| шкала депрессии | 7.0 ± 3.9 | 4.9 ± 2.6 | 4.8 ± 2.8 |
| Шкала личностной тревожности Спилбергера–Ханина (баллы) | |||
| реактивная тревожность | 30.1 ± 9.3 | 29.7 ± 8.0 | 29.2 ± 7.2 |
| личностная тревожность | 47.7 ± 15.0 | 46.0 ± 7.6 | 45.8 ± 12.6 |
При сравнении с контрольной группой у пациентов с ХНМК в КБ (1-я группа), как видно из табл.1, отмечались более низкие показатели по шкалам MMSE и FAB, воспроизведение меньшего количества слов при проведении теста 10 слов (при третьем, пятом и отсроченном повторениях) и увеличение времени работы с таблицами Шульте (во всех случаях p < 0.05).
У лиц с ХНМК в ВББ статистически достоверные различия с контрольной группой были получены лишь по шкалам MMSE и FAB (p < 0.05).
При сравнении результатов исследования в группах пациентов с ХНМК преимущественно в КБ и пациентов с ХНМК в ВББ не было получено статистически значимых различий. Однако четко прослеживалась тенденция к более низким результатам при отсроченном повторении в тесте 10 слов и более длительному времени работы с таблицами Шульте у больных 1-й группы.
По данным нейровизуализации в 1-й группе больных в 50% случаев имелась наружно-внутренняя заместительная гидроцефалия и невыраженная атрофия преимущественно лобных отделов коры. Во 2-й группе корковые атрофические явления были в единичных случаях (18% больных).
При исследовании эмоциональной сферы отмечалась тенденция к повышению показателей в 1-й и 2-й группах относительно контрольной группы (табл. 1).
Результаты исследования АСВП и когнитивного ВП НР приведены в табл. 2.
Таблица 2.
Результаты исследования АСВП и НР
| Показатель | 1 группа (ХНМК) | 2 группа (ХНМК в ВББ) | 3 группа (контроль) |
|---|---|---|---|
| АСВП, латентность (мс) | |||
| Пик I слева | 1.82 ± 0.14 | 1.80 ± 0.18 | 1.93 ± 0.16 |
| Пик III слева | 4.05 ± 0.54 | 4.07 ± 0.33 | 3.96 ± 0.17 |
| Пик V слева | 6.04 ± 0.47 | 6.03 ± 0.40 | 5.91 ± 0.28 |
| Пик I справа | 1.86 ± 0.19 | 1.80 ± 0.18 | 1.84 ± 0.15 |
| Пик III справа | 4.11 ± 0.42 | 4.07 ± 0.33 | 3.92 ± 0.20 |
| Пик V справа | 6.37 ± 0.36 | 6.03 ± 0.40 | 5.83 ± 0.27 |
| АСВП, межпиковый интервал (мс) | |||
| I–III слева | 2.28 ± 0.50 | 2.35 ± 0.33 | 2.01 ± 0.15 |
| I–V слева | 4.14 ± 0.40 | 4.19 ± 0.47 | 3.99 ± 0.30 |
| III–V слева | 1.86 ± 0.30 | 1.84 ± 0.31 | 1.95 ± 0.28 |
| I–III справа | 2.27 ± 0.44 | 2.32 ± 0.36 | 2.08 ± 0.17 |
| I–V справа | 4.27 ± 0.32 | 4.34 ± 0.46 | 4.10 ± 0.23 |
| III–V справа | 2.00 ± 0.47 | 2.00 ± 0.41 | 1.91 ± 0.24 |
| АСВП, амплитуда (мкВ) | |||
| Пик V слева | 0.32 ± 0.17 | 0.39 ± 0.24 | 0.39 ± 0.17 |
| Пик V справа | 0.37 ± 0.20 | 0.45 ± 0.22 | 0.39 ± 0.17 |
| НР, амплитуда (мкВ) | |||
| Fz | –0.69 ± 0.36** | –0.65 ± 0.50** | –1.20 ± 0.49 |
| Cz | –0.63 ± 0.39** | –0.72 ± 0.49** | –1.10 ± 0.47 |
| F3 | –0.50 ± 0.39** | –0.80 ± 0.51** | –1.15 ± 0.35 |
| F4 | –0.67 ± 0.52** | –0.79 ± 0.52** | –1.14 ± 0.47 |
| С3 | –0.73 ± 0.51** | –0.73 ± 0.43** | –1.18 ± 0.27 |
| С4 | –0.70 ± 0.36* | –0.77 ± 0.56* | –0.97 ± 0.40 |
| Латентность пика НР, мс | |||
| 165 ± 24 | 178 ± 16 | 162 ± 18 | |
Статистически значимых различий параметров АСВП по сравнению с контрольной группой у пациентов с ХНМК получено не было.
Однако при анализе когнитивного ВП НР с помощью двухфакторного дисперсионного анализа повторных измерений с факторами: “тип стимула” (стандартный, девиантный) и “локализация электрода” (Fz, F3, F4, Cz, C3, C4, M1, M2) во всех группах пациентов были получены статистически значимые различия по фактору “тип стимула” (ХНМК в КБ: df = 1, F = 8.99, p = 0.02; ХНМК в ВББ: df = 1, F = 6.34, p = 0.04; контрольная группа: df = 1, F = 65.07, p < 0.01).
Также в контрольной группе были получены достоверные различия по взаимодействию факторов “тип стимула” * “локализация электрода” (df = 7, F = 4.64, p = 0.001; post hoc во всех отведениях p < 0.001). Это свидетельствует о нормальном пространственном распределении выраженности НР – т.е. большей ее амплитуды во фронтальных отведениях.
При сравнении средней амплитуды НР в группе пациентов с ХНМК и контрольной группе статистически значимые различия были получены по факторам “группа” (df = 1, F = 10,12, p = 0.01) и “локализация электрода” (df = 7, F = 19.23, p < 0.001; post hoc анализ p < 0.05 во всех отведениях). Сравнение средней амплитуды НР в группе пациентов с ХНМК в ВББ и контрольной группы выявило статистически значимые различия по фактору “группа” (df = 1, F = 12,83, p < 0.01). Таким образом, были получены результаты, указывающие на значительное снижение средней амплитуды НР у пациентов с ХНМК в КБ и ВББ при отсутствии достоверных различий по латентности пика НР между группами.
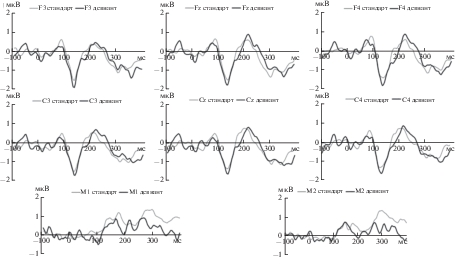
ВП на стандартный и девиантный стимулы у пациентов контрольной группы приведены на рис. 1, пациентов с ХНМК в КБ – на рис. 2, пациентов с ХНМК в ВББ – на рис. 3. Сравнение волны НР у пациентов контрольной группы и пациентов с ХНМК представлено на рис. 4.
Рис. 1.
ВП на стандартный и девиантный стимулы у пациентов контрольной группы. Во фронтальных и центральных отведениях видно четкое различие ответов на стандартный и девиантный стимулы в интервале 100–250 мс, а на мастоидах – инверсия полярности сигнала, характерная для НР.

Рис. 2.
ВП на стандартный и девиантный стимулы у пациентов с ХНМК (1-я группа). Во фронтальных и центральных отведениях отмечается лишь незначительное различие ответов на стандартный и девиантный стимулы в интервале 100–250 мс. На мастоидах наблюдается инверсия полярности сигнала.

ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
По данным нейропсихологического тестирования все обследованные пациенты с ХНМК имели снижение когнитивных функций (по шкалам MMSE и FAB), а у пациентов с преимущественным поражением КБ отмечалась тенденция к более низким результатам при отсроченном повторении слов в тесте 10 слов и более длительному времени работы с таблицами Шульте по сравнению с пациентами с ХНМК в ВББ. Это может быть связано с тем, что при нарушении кровоснабжения в КБ более выражены диффузные изменения мозгового вещества лобной и височной долей, а также у пациентов 1-й группы чаще отмечались атрофические изменения корковых отделов головного мозга (50% по сравнению с 18% у пациентов 2-й группы).
В обеих группах пациентов с ХНМК регистрировалось статистически достоверное по сравнению с контрольной группой снижение амплитуды НР (в отведении Fz до –0.69 ± 0.36 мкВ при ХНМК в КБ и до –0.65 ± 0.50 мкВ при ХНМК с преимущественным поражением ВББ). Это свидетельствует об ухудшении активации механизмов непроизвольного внимания и сокращении длительности сохранения слуховых следов в памяти при ХНМК.
Более значительное снижение амплитуды НР описано у пациентов на ранних стадиях болезни Альцгеймера и при сосудистой деменции (до –0.47 ± 1.38 мкВ и ‒0.44 ± 1.45 мкВ соответственно) [16]. Таким образом, чем сильнее выражены нарушения когнитивных функций у пациентов, тем в большей степени снижается амплитуда НР [8, 10, 16].
Изменение параметров НР при ХНМК указывает на нарушение автоматического процесса распознавания различий между двумя стимулами. Это происходит вследствие ишемии областей мозга, ответственных за генерацию НР – слуховой коры, обеспечивающей функционирование сенсорных следов памяти и улавливание изменений, или префронтальной зоны, ответственной за процедуру сравнения (прогностическое кодирование) и автоматическое переключение внимания, происходящее при изменении в слуховой стимуляции [7, 10].
При исследовании АСВП статистически значимых различий у пациентов с ХНМК не отмечалось, что может быть обусловлено отсутствием грубых морфологических изменений при данной патологии в отличие от острого ишемического инсульта, кровоизлияния, опухоли, выраженного стеноза позвоночной артерии, которые приводят к существенным изменениям АСВП [17, 18].
Поскольку патогенетические механизмы развития хронических ишемических нарушений мозга обычно одинаковы при вовлечении как каротидного, так и вертебрально-базилярного бассейнов [2], и чаще всего связаны с атеросклеротическим поражением сосудов обоих магистральных бассейнов, то обнаружить различия в параметрах АСВП и НР в зависимости от преимущественно пораженного бассейна не удается.
Выявленное у пациентов с ХНМК статистически значимое снижение амплитуды НР (по сравнению с контрольной группой) указывает на информативность когнитивного ВП НР в оценке высших психических функций человека.
ЗАКЛЮЧЕНИЕ
1. У пациентов с ХНМК как в каротидном, так и вертебрально-базилярном бассейне отмечается снижение когнитивных функций по сравнению с контрольной группой по результатам тестирования по шкале MMSE, FAB, таблицам Шульте и повторении 10 слов.
2. Независимо от преимущественно пораженного сосудистого бассейна у всех пациентов с ХНМК наблюдается снижение амплитуды когнитивного ВП НР по сравнению с контрольной группой, свидетельствующее об ухудшении активации механизмов непроизвольного внимания и сокращении длительности сохранения слуховых следов в памяти.
3. Исследование НР при ХНМК информативно и может быть использовано в оценке когнитивных нарушений. Однако данная тема требует дальнейшего изучения и оптимизации парадигмы исследования.
Список литературы
Суслина З.А., Варакин Ю.Я. Клиническое руководство по ранней диагностике, лечению и профилактике сосудистых заболеваний головного мозга. М. МЕДпресс-информ. 2017. [Suslina Z.A., Varakin Y.Y. Klinicheskoe rukovodstvo po rannej diagnostike, lecheniju i profilaktike sosudistyh zabolevanij golovnogo mozga [Clinical guide to early diagnostics, treatment and prophylaxis of vascular diseases of the brain]. Moscow. MEDpress-inform. 2017].
Чуканова Е.И., Чуканова А.С. Хроническая ишемия мозга. (Факторы риска, патогенез, клиника, лечение). М. АСТ. 2016. [Сhukanova E.I., Сhukanova A.S. Hronicheskaja ishemija mozga. (Faktory riska, patogenez, klinika, lechenie) [Chronical brain ischaemia (Risk factors, pathogenesis, clinical pattern, treatment].Moscow. ACТ. 2016].
Парфенов В.А., Захаров В.В., Преображенская И.С. Когнитивные расстройства. М. Ремедиум. 2014. [Parfenov V.A., Zakharov V.V., Preobrazhenskaja I.S. Kognitivnye rasstrojstva. [Cognitive impairment]. Moscow. Remedium. 2014].
Левин О.С. Патология белого вещества при дисциркуляторной энцефалопатии: диагностические и терапевтические аспекты. Трудный пациент. 9(12): 16–23. 2011. [Levin O.S. White matter pathology in discirculatory encephalopathy: diagnostic and therapeutic aspects. Difficult patient. 9(12): 16–23. 2011. (In Russ.)].
Näätänen R., Paavilainen P., Rinne T., Alho K. The mismatch negativity (MMN) in basic research of central auditory processing: A review. Clin. Neurophysiol. 118(12): 2544–2590. 2007.
Duncan C.C., Barry R.J., Connolly J.F., Fischer C., Michie P.T., Näätänen R., Polich J., Reinvang I., Van Petten C. Event-related potentials in clinical research: Guidelines for eliciting, recording, and quantifying mismatch negativity, P300, and N400. Clin. Neurophysiol. 120(11): 1883–1908. 2009.
Garrido M.I., Kilner J.M., Stephan K.E., Friston K.J. The mismatch negativity: A review of underlying mechanisms. Clin. Neurophysiol. 120: 453–463. 2009.
Näätänen R., Sussman E.S., Salisbury D., Shafer V.L. Mismatch negativity (MMN) as an index of cognitive dysfunction. Brain Topogr. 27: 451–466. 2014.
Robson H., Cloutman L., Keidel J.L., Sage K., Drakesmith M., Welbourne S. Mismatch negativity (MMN) reveals inefficient auditory ventral stream function in chronic auditory comprehension impairments. Cortex. 59: 113–125. 2014.
Näätänen R., Kujala T., Kreegipuu K., Carlson S., Escera C., Baldeweg T., Ponton C. The mismatch negativity: An index of cognitive decline in neuropsychiatric and neurological diseases and in ageing. Brain. 134: 3435–3453. 2011.
Michie P.T., Malmierca M.S., Harms L., Todd J. The neurobiology of MMN and implications for schizophrenia. Biol. Psychol. 116: 90–97. 2016.
Захаров В.В., Вознесенская Т.Г. Нервно-психические нарушения: диагностические тесты. М. МЕДпресс-информ. 2016. [Zakharov V.V., Voznesenskaja T.G. Nervno-psihicheskie narushenija: diagnosticheskie testy [Neuropsychic disorders: diagnostic tests]. Moscow. MEDpress-inform. 2016].
Cheng C.H., Hsu W.Y., Lin Y.Y. Effects of physiological aging on mismatch negativity: A meta-analysis. Int. J. Psychophysiol. 90: 165–171. 2013.
Гнездицкий В.В., Корепина О.С. Атлас по вызванным потенциалам мозга. Иваново. Изд.-полигр. комплекс “ПресСто”. 2011. [Gnezditskiy V.V., Korepina O.S. Atlas po vyzvannym potencialam mozga. [Atlas of event-related potentials]. Ivanovo. Publication and printing complex “PresSto”. 2011].
Luck S.J. An Introduction to the Event-Related Potential Technique. New York. A Bradford Book. 2014.
Jiang S., Yan C., Qiao Z., Yao H., Jiang S., Qiu X., Yang X., Fang D., Yang Y., Zhang L., Wang L., Zhang L. Mismatch negativity as a potential neurobiological marker of early-stage Alzheimer disease and vascular dementia. Neurosci. Lett. 647: 26–31. 2017.
Hall J.W. New handbook of auditory evoked responses. Boston. Pearson. 2007.
Шубина Н.Ю., Фридман Е.Л., Комарова Т.Г., Соганов М.И., Гнездицкий В.В., Корепина О.С., Гарбарук Е.С., Гауфман В. Е. Современные методы функциональной диагностики слуха. Иваново. Изд.-полигр. комплекс “ПресСто”. 2013. [Shubina N.Y., Fridman E.L., Komarova T.G., Soganov M.I., Gnezditskiy V.V., Korepina O.S., Garbaruk E.S., Gaufman V.E. Sovrememennye metody functional’noj diagnostics [Current methods of auditory functional diagnostics]. Ivanovo. Publication and printing complex “PresSto”. 2013].
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова