Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 3, стр. 303-310
Взаимодействие δ2-опиоидных рецепторов и КАТФ-каналов в регуляции толерантности сердца к действию реперфузии
А. В. Мухомедзянов 1, Л. Н. Маслов 1, *, А. А. Скрябина 1, Ю. В. Бушов 2, В. С. Клим 1
1 Научно-исследовательский институт кардиологии,
Томский национальный исследовательский медицинский центр РАН
Томск, Россия
2 Томский государственный университет
Томск, Россия
* E-mail: maslov@cardio-tomsk.ru
Поступила в редакцию 10.12.2018
После доработки 27.12.2018
Принята к публикации 28.12.2018
Аннотация
Исследовали роль δ2-опиоидных рецепторов (ОР) и АТФ-чувствительных К+-каналов (КАТФ-каналов) в регуляции толерантности сердца к действию реперфузии. У крыс моделировали коронароокклюзию (45 мин) и реперфузию (2 ч). Для изучения роли δ2-ОР использовался пептидный агонист ОР дельторфин II. Блокада всех типов ОР налтрексоном, а также ингибирование периферических ОР налоксона метиодидом полностью устраняло инфаркт-лимитирующий эффект дельторфина II. Использование селективных антагонистов μ- и κ-ОР СТАР и нор-биналтофимина не влияло на проявление кардиопротекторного эффекта дельторфина II. Неселективный блокатор δ-ОР TIPP[ψ] устранял эффект опиоида. Введение селективного ингибитора δ1-ОР BNTX не влияло на кардиопротекторный эффект препарата, в свою очередь антагонист δ2-ОР налтрибен отменял эффект пептида. Таким образом, найдено, что дельторфин II способен оказывать инфаркт-лимитирующий эффект за счет активации δ2-ОР. Установлено, что КАТФ-каналы участвуют в кардиопротекторном эффекте дельторфин II. Обнаружено, что Са2+-зависимый К+-канал большой проводимости (ВКСа-канал) не участвует в механизме дельторфин-индуцированного повышения устойчивости сердца к действию реперфузии.
Острый инфаркт миокарда (ОИМ) является социально значимым заболеванием для России и развитых стран. Внутригоспитальная смертность у пациентов с ОИМ и подъемом сегмента ST в кардиологических стационарах России достигает 8–11% [1], в США – 4.7% [2]. Более низкий процент летальности при ОИМ в США связан с тем, что в США и европейских странах для восстановление коронарной перфузии чаще используется высокоэффективный метод коронарной ангиопластики, а у нас чаще используется тромболизис [2, 3]. В США быстрее, чем в России проводят реперфузионную терапию. Однако американские кардиологи отмечают, что, несмотря на все их достижения, смертность при ОИМ за последние годы не снижается и составляет 4.6–4.8% [2, 4, 5]. Такое положение дел связано с тем, что в клинической практике отсутствуют препараты, способные с высокой эффективностью предупредить возникновение реперфузионных повреждений, которые возникают после восстановления коронарной перфузии [6]. Между тем, по мнению некоторых исследователей, реперфузионное повреждение обеспечивает до 50% конечного размера инфаркта [7].
Установлено, что агонисты опиоидных рецепторов (ОР) способны предупреждать реперфузионные повреждения сердца [8]. Однако рецепторная природа инфаркт-лимитирующего эффекта опиоидов во время реперфузии сердца остается малоизученной. Ранее нами было показано, что селективный агонист δ2-ОР дельторфин II способен предупреждать ишемические/реперфузионные повреждения сердца за счет активации δ2-ОР и при участии АТФ-чувствительных К+-каналов (КАТФ-каналов) [9].
Цель исследования: оценить роль δ2-опиоидных рецепторов и КАТФ-каналов в регуляции толерантности сердца к действию реперфузии
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследование было выполнено на крысах-самцах линии Вистар массой 250–300 г. Животные содержались в стандартных условиях вивария. Все болезненные процедуры осуществляли, соблюдая рекомендации о гуманном отношении к лабораторным животным, изложенные в “Правилах проведения работ с использованием экспериментальных животных” (Приказ МЗ СССР № 742 от 13.11.84 г. “Об утверждении правил поведения работ с использованием экспериментальных животных” и № 48 от 23.01.85 г. “О контроле за проведением работ с использованием экспериментальных животных”).
Животных наркотизировали внутрибрюшинным введением α-хлоралозы (60 мг/кг, внутрибрюшинно, Sigma) и подключали к аппарату искусственной вентиляции легких “SAR-830 Series” (CWE Inc., США). Коронароокклюзию и реперфузию осуществляли по методу J.E. Schultz и соавт. [10]. Регистрация АД осуществлялась с помощью датчика давления SS13L (BiopacSystemInc., Goleta, Калифорния, США), сопряженного с аппаратом для электрофизиологических исследований MP35 (BiopacSystemInc., Goleta, США). Измерение артериального давления проводили путем каннюлирования правой сонной артерии с помощью датчика давления SS13L (BiopacSystemInc., Goleta, Калифорния, США), сопряженного с аппаратом для электрофизиологических исследований MP35 (BiopacSystemInc., Goleta, США) и персональным компьютером компании Intel. Данный прибор также использовался для регистрации ЭКГ. После 45 мин ишемии лигатуру снимали и восстановление кровотока подтверждали появлением эпикардиальной гиперемии. Продолжительность реперфузии составляла 2 ч.
Регистрацию ЭКГ осуществляли на протяжении всего эксперимента. При оценке нарушений ритма сердца принимали во внимание только желудочковые формы аритмий: единичные желудочковые экстрасистолы (6–16 за 10 мин); множественные желудочковые экстрасистолы (более 16 за 10 мин или 3–4 следующих друг за другом преждевременных сокращений); желудочковая тахикардия (более 4 последовательных экстрасистол); желудочковая фибрилляция.
Выявление зоны некроза и области риска проводили по методу J. Neckar и соавт. [11]. После реперфузии сердце удаляли из грудной клетки и промывали ретроградно через аорту физиологическим раствором. Для определения зоны риска (ЗР) лигатуру вновь затягивали и миокард окрашивали струйно через аорту 5%-ным раствором перманганата калия. Зоной риска принято называть миокард, подвергнутый воздействию ишемии-реперфузии. После промывки физиологическим раствором делали срезы сердца толщиной в 1 мм перпендикулярно к продольной оси с помощью слайсера HSRA001-1 (ZivicInstruments, Pittsburgh, США). Визуализацию зоны некроза от зоны риска осуществляли путем окрашивания 1%-ным раствором 2,3,5-трифенил тетразолия хлорида в течение 30 мин при 37°C. В основе метода лежит способность 2,3,5-трифенил тетразолия хлорида приобретать стойкую окраску при переходе из окисленного состояния в восстановленное под действием дегидрогеназ. Поскольку в погибших кардиомиоцитах отсутствовали дегидрогеназы, некротизированный миокард не окрашивался. После окончания окраски срезы помещали в 10%-ный раствор формальдегида на 1 сутки. Срезы сканировали с обеих сторон сканером HP Scanjet G4050. Размер ЗР и зоны инфаркта (ЗИ) определяли компьютеризированным планиметрическим методом. Размер зоны инфаркта выражали в процентах от размера зоны гипоперфузии (зоны риска), как соотношение ЗИ/ЗР.
В эксперименте использовали агонист δ2-ОР дельторфин II (H-Tyr-DAla-Phe-Glu-Val-Val-Gly-NH2) в дозе 0.12 мг/кг [9], блокатор всего пула ОР налтрексон в дозе 5 мг/кг [9], неселективный антагонист переферических ОР налоксона метиодид в дозе 5 мг/кг [9], блокатор µ-ОР CTAP (NH2-D-Phe-c[Cys-Tyr-D-Trp-Arg-Thr-L-Pen]-Thr-NH2) в дозе 0.1 мг/кг [9], антагонист κ-ОР нор-биналторфимин в дозе 2 мг/кг [12], блокатор δ-ОР TIPP(ψ) в дозе 0.5 мг/кг [13], антагонист δ1-ОР BNTX (7-Benzylidenenaltrexone) в дозе 0.7 мг/кг [9], блокатор δ2-ОР налтрибен в дозе 0.3 мг/кг [9], неселективный ингибитор КАТФ-каналов глибенкламид в дозе 1 мг/кг [9], селективный блокатор митохондриальных КАТФ-каналов 5-гидроксидеканоат в дозе 5 мг/кг [9], селективный ингибитор сарколеммальных КАТФ-каналов – HMR 1098 в дозе 6 мг/кг [14] и блокатор кальций-чувствительных К-каналов большой проводимости (BКСа-каналов) паксиллин в дозе 1.5 мг/кг [15].
Налтрибен, BNTX, глибенкламид и паксиллин растворяли в 0.1 мл DMSO, а затем в 0.9 мл 20%-ного гидроксипропил-β-циклодекстрине. Остальные препараты растворяли в 0.9%-ном растворе NaCl. Все ингибиторы вводили внутривенно за 10 мин до реперфузии, дельторфин II использовали за 5 мин до реперфузии. Каждая экспериментальная группа включала в себя по 12 особей. В группу контроля были включены животные, которым вводили физиологический раствор или 20%-ный гидроксипропил-β-циклодекстрин.
Статистическую обработку данных проводили с помощью пакетов программы “Statistica 6.0”. Для оценки достоверности полученных результатов использовали критерий Манна–Уитни. Статистически значимыми считались различия при p < 0.05. Результаты всех экспериментов представлены в виде среднего арифметического (М) ± стандартной ошибки среднего (SEM).
РЕЗУЛЬТАТЫ ИСЛЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
В контрольной группе во время ишемии у 10 из 12 животных были выявлены аритмии различного характера. Так, у 10 особей были обнаружены и множественные желудочковые экстрасистолы, и желудочковая тахикардия. У 7 крыс зафиксирована желудочковая фибрилляция. В связи с тем, что исследуемые препараты вводились за 5 мин до реперфузии, то в опытной группе в период ишемии количество аритмии достоверно не отличалось от контроля. Во время реперфузии и в группе контроля, и в опытных группах единичные желудочковые экстрасистолы возникали лишь у отдельных особей, у остальных животных не было выявлено реперфузионных аритмий, поэтому обнаружить антиаритмический эффект препаратов не удалось.
Как показано на рис. 1, в контрольной группе отношение зоны инфаркта к зоне риска (ЗИ/ЗР) составило 48%. После внутривенного введения дельторфина II перед реперфузией мы обнаружили достоверное уменьшение индекса ЗИ/ЗР в 2 раза по сравнению с контрольной группой (рис. 1). Указанный результат согласуется с данными, полученными нашей лабораторией ранее [9]. Однако в тех исследованиях дельторфин II вводили за 15 мин до коронароокклюзии, тем самым изучалась роль δ-ОР в повышении устойчивости сердца к действию ишемии. Введение неселективного антагониста ОР налтрексона полностью устраняло инфаркт-лимитирующий эффект дельторфина II (рис. 1). Это свидетельствует о том, что кардиопротекторный эффект изучаемого пептида связан с активацией ОР. Для оценки роли периферических ОР мы использовали непроникающий через гематоэнцефалический барьер блокатор ОР налоксона метиодид. При введении налоксона метиодида было также зафиксировано устранение инфаркт-лимитирующего эффекта дельторфина II (рис. 1).
Рис. 1.
Размер инфаркта/область риска при 45-минутной коронароокклюзии и 120-минутной реперфузии у крыс. Введение антагонистов за 10 мин, а агонистов – за 5 мин до реперфузии. (M ± SEM). * p < 0.05 по сравнению с контролем.

Дальнейшие исследования были направлены на выявление конкретного типа ОР, за счет активации которого проявляется кардиопротекторный эффект дельторфина II. Внутривенное введение антагониста µ-ОР СТАР не влияло на инфаркт-лимитирующий эффект дельторфина II. Использовании антагониста κ-ОР нор-биналторфимина также не устраняло эффект дельторфина II (рис. 2). В свою очередь, введение блокатора δ-ОР TIPP[ψ] устраняло кардиопротекторный эффект дельторфина II (рис. 2). Как известно δ-ОР имеют 2 субтипа рецепторов: δ1- и δ2-ОР, поэтому мы решили выяснить, связан ли эффект изучаемого пептида с каким-то одним субтипом рецепторов или же участвуют оба субтипа. С этой целью мы использовали селективные ингибиторы δ1- и δ2-ОР. Инъекция блокатора δ1-ОР BNTX не влияла на инфаркт-лимитирующий эффект дельторфина II, однако использование блокатора δ2-ОР налтрибена полностью устраняло инфаркт-лимитирующий эффект дельторфина II (рис. 2). Таким образом, было установлено, что кардиопротекторный эффект дельторфина II связан с активацией δ2-ОР.
Рис. 2.
Размер инфаркта/область риска при 45-минутной коронароокклюзии и 120-минутной реперфузии у крыс. 1) Контроль; 2) Дельторфин II; 3) Дельторфин II + СТАР; 4) Дельторфин II + нор-биналторфимин; 5) Дельторфин II + TIPP(ψ); 6) Дельторфин II + BNTX; 7) Дельторфин II + налтрибен. Введение антагонистов за 10 мин, а агонистов за 5 мин до реперфузии. (M ± SEM). *p < 0.05 по сравнению с контролем.

В последующих экспериментах было решено выяснить, участвуют ли КАТФ-каналы в механизме инфаркт-лимитирующего эффекта дельторфина II. Введение неселективного ингибитора КАТФ-каналов глибенкламида полностью устраняло инфаркт-лимитирующий эффект дельторфина II (рис. 3). Полученный результат свидетельствует о том, что кардиопротекторный эффект дельторфина II связан с КАТФ-каналами, однако было неясно, с каким типом этих каналов связан данный эффект, поэтому дальнейшие эксперименты были направлены на изучение роли сарколеммального и митохондриального КАТФ-канала в инфаркт-лимитирующем эффекте дельторфина II. Так, введение ингибитора митохондриального КАТФ-канала 5-гидроксидеканоата не устраняло инфаркт-лимитирующий эффект дельторфина II (рис. 3). В свою очередь, блокада сарколеммального КАТФ-канала с помощью HMR 1098 полностью устраняла эффект пептида (рис. 3). Следовательно, в механизме повышения устойчивости сердца к реперфузионным повреждениям участвует сарколеммальный КАТФ-канал.
Рис. 3.
Размер инфаркта/область риска при 45-минутной коронароокклюзии и 120-минутной реперфузии у крыс. 1) Контроль; 2) Дельторфин II; 3) Дельторфин II + глибенкламид; 4) Дельторфин II + 5-гидроксидеканоат; 5) Дельторфин II + HMR 1098; 6) Дельторфин II + паксиллин. Введение антагонистов за 10 мин, а агонистов за 5 мин до реперфузии. (M ± SEM). * p < 0.05 по сравнению с контролем.
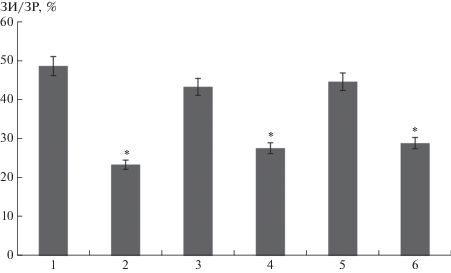
На сегодняшний день роль ВКСа-канала в механизме инфаркт-лимитирующего эффекта агонистов ОР не изучена. Исследования, связанные с изучением роли этого канала в ишемическом и реперфузионном повреждении миокарда, проводились на изолированном сердце [16], данные по экспериментам in vivo по указанной проблеме отсутствуют. Мы решили выяснить, участвует ли КСа-канал в реализации кардиопротекторного эффекта дельторфина II. При внутривенном введении блокатора ВКСа-канала паксиллина эффект дельторфина II сохранялся (рис. 3). Следовательно, можно сделать вывод о том, что инфаркт-лимитирующий эффект дельторфина II не связан с ВКСа-каналом.
За время, прошедшее с момента коронароокклюзии и до окончания реперфузии, достоверных изменений ЧСС и АД (см.таблицу 1) в контрольной группе животных выявлено не было. После введение дельторфина II также не было выявлено изменений со стороны показателей ЧСС и АД (данные не отображены в таблице).
Таблица 1.
Показатели ЧСС (уд/мин) и АД (мм рт. ст.) в группе контроля во время ишемии и реперфузии. Коронароокклюзия 45 мин, реперфузия 120 мин (M ± SEM)
| Группа | Контроль, ЧСС n = 12 | Контроль, АД n = 12 |
|---|---|---|
| Перед коронароокклюзией | 367 ± 7 | 132 ± 4 |
| За 1 мин до реперфузии | 362 ± 4 | 128 ± 3 |
| Через 30 мин после реперфузии | 357 ± 5 | 126 ± 4 |
| Через 2 ч после реперфузии | 348 ± 9 | 122 ± 6 |
ЗАКЛЮЧЕНИЕ
Полученные результаты указывают на то, что инфаркт-лимитирующий эффект дельторфина II связан с активацией δ2-ОР. Также было установлено, что в механизме кардиопротекторного эффекта исследуемого агониста ОР участвует сарколеммальный КАТФ-канал, а митохондриальный КАТФ-канал и ВКСа-канал не участвуют в реализации данного эффекта.
Список литературы
Сыркина А.Г., Белокопытова Н.В., Марков В.А., Эрлих А.Д. Как выполняются Национальные клинические рекомендации по лечению острого коронарного синдрома с подъемом сегмента ST в среднеурбанизированном городе Сибири по данным регистра РЕКОРД-2. Сиб. мед. жур. (Томск). 28(3): 19–23. 2013. [Syrkina A.G., Belokopytova N.V., Markov V.A., Erlich A.D. How are the National clinical recommendations for the treatment of acute coronary syndrome with ST elevation in the urbanized city of Siberia implemented according to the register RECORD-2. Sib. Med. J. (Tomsk). 28(3): 19–23. 2013. (In Russ)].
Menees D.S., Peterson E.D., Wang Y., Curtis J.P., Messenger J.C., Rumsfeld J.S., Gurm H.S. Door-to-balloon time and mortality among patients undergoing primary PCI. N. Engl. J. Med. 369(10): 901–909. 2013.
Simes R.J., O’Connell R.L., Aylward P.E. Varshavsky S., Diaz R., Wilcox R.G., Armstrong P.W., Granger C.B., French J.K., Van de Werf F., Marschner I.C., Califf R., White H.D. HERO-2 Investigators. Unexplained international differences in clinical outcomes after acute myocardial infarction and fibrinolytic therapy: Lessons from the Hirulog and Early Reperfusion or Occlusion (HERO)-2 trial. Am. Heart J. 159(6): 988–997. 2010.
Vaidya S.R., Devarapally S.R., Arora S. Infarct related artery only versus complete revascularization in ST-segment elevation myocardial infarction and multi vessel disease: A meta-analysis. Cardiovasc. Diagn. Ther. 7(1): 16–26. 2017.
Zhou Y., Chen S., Zhu X., Gui J., Abusaada K. Prior beta blockers use is independently associated with increased in patient mortality in patients presenting with acute myocardial infarction. Int. J. Cardiol. 243: 81–85. 2017.
Маслов Л.Н., Барбараш О.Л. Фармакологические подходы к ограничению размера инфаркта миокарда у пациентов с острым инфарктом миокарда. Эксперим. и клинич. фармакол. 81(3): 75–82. 2018. [Maslov L.N., Barbarsh O.L. Pharmacological approaches to limiting the infarct zone size in patients with acute myocardial infarction. Exper. Clin. Pharmacol. 81(3): 75–82. 2018. (In Russ)].
Ong S.B., Hall A.R., Dongworth R.K., Kalkhoran S., Pyakurel A., Scorrano L., Hausenloy D.J. Akt protects the heart against ischaemia-reperfusion injury by modulating mitochondrial morphology. Thromb. Haemost. 113(3): 513–521. 2015.
Maslov L.N., Khaliulin I., Oeltgen P.R., Naryzhnaya N.V., Pei J.-M., Brown S.A., Lishmanov Y.B., Downey J.M. Prospects of creation of cardioprotective and antiarrhythmic drugs based on opioid receptor agonists. Med. Res. Rev. 36(5): 871–923. 2016.
Maslov L.N., Lishmanov Yu.B., Oeltgen P.R., Barzakh E.I., Krylatov A.V., Govindaswami M., Brown S.A. Activation of peripheral δ2 opioid receptors increases cardiac tolerance to ischemia/reperfusion injury: Involvement of protein kinase C, NO-synthase, KATP channels and the autonomic nervous system. Life Sci. 84(19–20): 657–663. 2009.
Schultz J.E.J., Hsu A.K., Gross G.J.J. Ischemic preconditioning and morphine-induced cardioprotection involve the delta (δ)-opioid receptor in the intact rat heart. Mol. Cell. Cardiol. 29(8): 2187–2195. 1997.
Neckar J., Szarszoi O., Herget J., Ostadal B., Kolar F. Cardioprotective effect of chronic hypoxia is blunted by concomitant hypercapnia. Physiol. Res. 52(2): 171–175. 2003.
Guo H.T., Zhang R.H., Zhang Y., Zhang L.J., Li J., Shi Q.X., Wang Y.M., Fan R., Bi H., Yin W., Pei J.M. Endogenous κ-opioid peptide mediates the cardioprotection induced by ischemic postconditioning. J. Cardiovasc. Pharmacol. 58(2): 207–215. 2011.
Maslov L.N., Naryzhnaya N.V., Tsibulnikov S.Yu., Kolar F., Zhang Y., Wang H., Gusakova A.M., Lishmanov Yu.B. Role of endogenous opioid peptides in the infarct size-limiting effect of adaptation to chronic continuous hypoxia. Life Sci. 93(9–11): 373–379. 2013.
Gross G.J., Hsu A., Gross E.R., Falck J.R., Nithipatikom K. Factors mediating remote preconditioning of trauma in the rat heart: Central role of the cytochrome P450 epoxygenase pathway in mediating infarct size reduction. J. Cardiovasc. Pharmacol. Ther. 18(1): 38–45. 2013.
Smith B.L., McLeay L.M., Embling P.P. Effect of the mycotoxins penitrem, paxilline and lolitrem B on the electromyographic activity of skeletal and gastrointestinal smooth muscle of sheep. Res. Vet. Sci. 62(2): 111–116. 1997.
Behmenburg F., Pickert E., Mathes A., Heinen A., Hollmann M.W., Huhn, Berger M.M. The cardioprotective effect of dexmedetomidine in rats is dose-dependent and mediated by BKCa channels. J. Cardiovasc. Pharmacol. 69(4): 228–235. 2017.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


