Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 4, стр. 520-530
Способ моделирования эмоционального стресса “дефицита времени”
Е. А. Гусакова 1, *, И. В. Городецкая 1
Витебский государственный ордена Дружбы народов медицинский университет
Витебск, Беларусь
* E-mail: elena-gusakova83@mail.ru
Поступила в редакцию 25.10.2018
После доработки 30.01.2019
Принята к публикации 31.01.2019
Аннотация
В эксперименте на 40 половозрелых белых беспородных крысах-самцах массой 220–240 г предложен способ моделирования эмоционального стресса “дефицита времени” (СДВ) и сопоставлен его стрессирующий эффект с таковым стресса “свободного плавания в клетке”. Для воспроизведения СДВ крыс (по одной особи) помещали в спиралевидно-расположенный шланг, который быстро заполнялся водой, что вынуждало животное быстро перемещаться вверх. Наблюдали появление классических признаков стресса – повышение относительной массы надпочечников (на 31%), снижение массы тимуса и селезенки (на 26 и 14%), повреждение слизистой оболочки желудка (у 80% животных: с тяжестью 1 балл у 20% крыс, 2 или 3 балла у оставшихся 60% в соотношении 1 : 1; множественностью кровоизлияний: 2 кровоизлияния на животное у 30%, 3 у 40% и 4 у 10% крыс, индексом поражения 4.7), изменение сывороточного содержания кортикостероидов (увеличение на 43%) и инсулина (снижение на 19%), отмечали активацию функции щитовидной железы (возрастание концентрации общих и свободных трийодтиронина и тироксина в крови на 18–32%). Горизонтальная двигательная активность и физическая выносливость животных после стресса “дефицита времени” увеличивалась, тогда как их вертикальная локомоторная активность снижалась на фоне развития тревожного состояния. По сравнению с существующими предложенный способ моделирования эмоционального стресса обеспечивает индивидуальное тестирование животных, полное удаление продуктов их жизнедеятельности и отсутствие травматизации крыс, что позволяет более объективно изучать механизмы развития стрессорного повреждения.
Согласно современным представлениям, одним из механизмов развития стресса являются негативные эмоции, которые формируются за счет невозможности достижения полезного приспособительного результата [1].
Для моделирования эмоционального стресса используется стресс “свободного плавания в клетке” (СПК) [2]. С нашей точки зрения, недостатком данной модели является то, что на протяжении длительного времени животные находятся вместе в воде, загрязненной продуктами их жизнедеятельности. Совместное пребывание крыс снижает объективность оценки их поведенческих и физиологических реакций, поскольку доказано, что запах, звуки и сигналы особей одного и того же вида изменяют поведение (вызывают агрессию, подавляют исследование новой территории и др.) и функции практически всех систем организма [3].
В настоящее время наиболее актуальным стрессором из-за постоянно нарастающего темпа жизни является дефицит времени. Известны работы М.М. Хананашвили [4], где этот фактор использовался для воспроизведения информационных неврозов. Однако проведение исследований с использованием условнорефлекторных методик является трудозатратным.
Цель исследования: разработать методику воспроизведения эмоционального стресса у животных путем создания дефицита времени и сопоставить интенсивность стресс-реакции с таковой после СПК.
МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперимент выполнен на 40 белых беспородных половозрелых крысах-самцах массой 220–240 г. Животных исследовали утром в одно и то же время. При проведении экспериментов соблюдены требования гуманного обращения с экспериментальными животными, содержащиеся в методических указаниях “Положение о порядке использования лабораторных животных в научно-исследовательских работах и педагогическом процессе УО “Витебский государственный медицинский университет” и мерах по реализации требований биомедицинской этики”-2010 (протокол № 10 от 22.03.2017).
Постановка исследования с использованием лабораторных животных соответствует рекомендациям Конвенции Совета Европы по охране позвоночных животных (European Convention for the Protection of Vertebrate Animals for Experimental and Other Scientific Purposes: Strasbourg, Council of Europe, 51 pp; 18.03.1986), Директиве Совета ЕЭС от 24.11.1986 (Council Directive on the Approximation of Laws, Regulations and Administrative Provisions of the Member States Regarding the Protection of Animal Used for Experimental and Other Scientific Purposes) и рекомендациям FELASA Working Group Report (1994–1996), ТКП 125-2008.
Для моделирования стресса “дефицита времени” (СДВ) использовали разработанную нами экспериментальную установку (рис. 1), которая состоит из пластиковой емкости объемом 65 л, (высота 55 см, диаметр 40 см), широкого прозрачного гофрированного полиуретанового шланга диаметром 10 см, который располагают по спирали и крепят вокруг емкости. Нижнее отверстие шланга плотно закрывают пробкой. Внутри широкого шланга на всем его протяжении находится узкая полиуретановая трубка диаметром 1 см для подачи воды [5].
Рис. 1.
Устройство для моделирования стресса “дефицита времени” у экспериментального животного. 1 – пластиковая емкость; 2 – широкий прозрачный гофрированный полиуретановый шланг; 3 – пробка; 4 – узкая полиуретановая трубка для подачи воды.

Крыс по одной особи помещают в нижнюю часть широкого гофрированного шланга, после чего его отверстие закрывают. Узкую трубку, которая находится внутри, подсоединяют к крану с холодной (T 4°C) водопроводной водой. После включения она быстро заполняет устройство снизу. Постоянство скорости подачи воды контролируют положением вентиля крана. Экспериментальное животное, стараясь избежать контакта с водой, вынуждено перемещаться вверх по ходу спирали. Состояние стресса формируется за счет того, что крыса должна быстро двигаться вверх и никак не может повлиять своими действиями на ситуацию, в которой оказалась. После того, как животное достигает верхнего отверстия шланга, его помещают в индивидуальную клетку. Затем деревянную пробку внизу широкого шланга открывают и выпускают всю воду. Вследствие этого по окончании тестирования каждого животного установка промывалась большим количеством воды. Это обеспечивало полное удаление продуктов жизнедеятельности крыс. Индивидуальное исследование животных исключало влияние на их физиологические реакции присутствия другой особи.
Для сравнения интенсивности стресс-реакции при использовании разработанной нами модели СДВ с таковой, обусловленной СПК, оценивали выраженность вызванных ими классических признаков стресса.
Для моделирования СПК животных по 5 особей помещали в стандартную пластиковую клетку (50 × 30 × 20 см), заполненную водой (22°С) на высоту 15 см и закрытую сверху сеткой. Расстояние от сетки до поверхности воды составляет 5 см. Крысы могут стоять, ухватившись за сетку, висеть на ней, а также плавать, не мешая друг другу [2]. Время воздействия – 60 мин. Через час после стресса (СДВ или СПК) животных декапитировали под уретановым наркозом (1 г/кг внутрибрюшинно).
Ректальную температуру измеряли медицинским электротермометром “ТПЭМ-1”, вводя датчик на глубину 25 мм.
Интенсивность стресс-реакции оценивали по классической “триаде” стресса [6]: изменениям относительной массы надпочечников (1), тимуса и селезенки (2), поражению слизистой оболочки желудка (СОЖ) (3), а также по сдвигу концентрации кортикостероидов и инсулина в крови.
Органы-маркеры стресса извлекали сразу после декапитации крыс, освобождали от окружающих тканей. Их массу измеряли взвешиванием влажной ткани на торсионных весах ВТ-500. Относительную массу рассчитывали как отношение абсолютной массы органа к массе тела и выражали в мг/г.
Для исследования состояния СОЖ за сутки до эксперимента крыс лишали пищи, сохраняя свободный доступ к воде. Желудок удаляли, вскрывали вдоль большой кривизны и промывали физиологическим раствором. Состояние СОЖ изучали визуально в отраженном свете под малым увеличением.
Повреждение СОЖ оценивали по частоте (определяли у 30 особей), тяжести, множественности, индексу поражения (эти показатели исследовали у 10 крыс). Частоту повреждения СОЖ изучали по отношению числа животных, имевших дефекты слизистой, к общему количеству крыс в группе. Тяжесть поражения исследовали по числу повреждений на одну крысу и выражали в баллах. Для СПК использовали следующую шкалу: 1 балл – эрозии, 2 балла – единичные язвы, 3 балла – множественные язвы, 4 балла – пенетрирующие или прободные язвы. Для СДВ: 1 балл – площадь кровоизлияний 0–1.9 мм2, 2 балла – 2–3.9 мм2, 3 балла – 4–5.9 мм2, 4 балла – 6–8 мм2. Множественность поражения определяли по отношению числа повреждений СОЖ у всех крыс к числу животных в группе [7]. Индекс поражения, являющийся интегральным показателем поражения СОЖ, рассчитывали по сумме частоты, тяжести и множественности повреждения [8].
Для определения уровня йодсодержащих тиреоидных гормонов (ЙТГ), тиреотропного гормона (ТТГ), кортикостероидов и инсулина в сыворотке крови использовали иммуноферментный метод. Применяли набoры реактивов “ДС-ИФА-Тироид-Т3общий”, “ДС-ИФА-Тироид-Т4общий”, “ДС-ИФА-Тироид-Т3свободный”, “ДС-ИФА-Тироид-Т4свободный”, “ДС-ИФА-ТИРОИД-ТТГ”, “ДС-ИФА-Стероид-Кортизол” (НПО Диагностические системы, Россия), “Insulin Тest System” (Monobind Inc. Accu-Bind, California, USA). Измерения проводили на фотометре универсальном Ф 300 ТП (Беларусь).
Рассчитывали соотношение уровней кортикостероидов и инсулина – K/И коэффициент, отражающий напряженность компенсаторных механизмов [9]. Его величину в контроле принимали за 1.0.
Поведение крыс после СДВ исследовали в тесте “открытое поле” в течение 3 мин в затененной комнате с использованием видеосистемы SMART и программного обеспечения SMART 3.0. Горизонтальную двигательную активность животных оценивали по общей дистанции перемещения (м), таковой в периферической и центральной зонах (%), максимальной скорости движения (см/с); вертикальную, характеризующую также исследовательскую активность, по количеству стоек, сделанных крысами за время теста. Исследовательскую активность и уровень тревожности животных определяли по соотношению продолжительности их пребывания и замирания в центре и на периферии “открытого поля” (%), общей длительности замирания (%), числу входов в центр, латентному периоду входа в него (с), параллельному индексу, отражающему тенденцию к повороту. Последний показатель напрямую не зависит от расстояния и характеризует тонкие изменения в характере локомоторной активности, характерной для исследования незнакомой среды. Для его вычисления учитывали угол пути между текущим и предыдущим направлениями движения животного. Чем ближе данный показатель к 1, тем больше перемещений по прямой; чем ближе к –1, тем больше изменений в направлении смещений, т.е. интенсивнее исследовательские реакции [10]. Изучали время (с) нахождения животных на валике ротарода LE 8300, вращающемся со скоростью 30–35 об./мин, отражающее как физическую выносливость крыс, так и возможные изменения в вестибулярных рефлексах в связи с тренировкой движений в стресс-тестах.
После СПК поведение животных исследовали с использованием теста “открытое поле”, которое представляло собой квадратный короб со стороной 105 см и высотой стенок 35 см. Дно было расчерчено на 49 равных квадратов [11]. Животное помещали у стенки поля и на протяжении 3 минут оценивали его поведение по горизонтальной (число пересеченных квадратов в центре, на периферии поля и суммарное количество) и вертикальной (число стоек с опорой на борт поля, без опоры и суммарное количество) двигательной активности. Физическую выносливость крыс после СПК определяли плаванием с отягощением по методике Порсолта в модификации В.Н. Каркищенко с соавт. [12]. Для этого к основанию их хвоста прикрепляли груз, масса которого составляла 5% от массы тела. Крысы плавали в воде комнатной температуры (24 ± 1oС). Эксперимент продолжали до момента, когда животное не могло удержаться на поверхности воды.
Исследование физической выносливости и поведения животных проводили через 1 ч после стрессов (СДВ и СПК).
Статистическую обработку результатов проводили с помощью программы “Statistica 10.0” (StatSoft inc., STA999K347156-W). Использовали непараметрический метод, поскольку после первоначального определения характера распределения (Shapiro–Wilk,s test) было установлено, что оно отличалось от нормального. Для анализа различий по количественным параметрам при межгрупповом сравнении использовали U-критерий Манна–Уитни для попарного сравнения групп. Данные по частоте поражения СОЖ, являющиеся качественными бинарными признаками, обрабатывали с использованием модулей Непараметрические статистики, Таблицы 2 × 2 (использовали точный критерий Фишера). Для обработки данных по тяжести поражения СОЖ использовали модули: “Подробные двухвходовые таблицы” (модификации критерия χ2 – метод Пирсона и метод максимального правдоподобия). Количественные параметры представляли в виде Ме (LQ; UQ), где Me – медиана, (LQ; UQ) – интерквартильный интервал: верхняя граница нижнего квартиля (LQ) и нижняя граница верхнего квартиля (UQ). Критическим уровнем значимости при проверке статистических гипотез был принят р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
У животных, подвергнутых СДВ, относительная масса надпочечников увеличивалась на 31% (р < 0.01), тимуса и селезенки снижалась – на 26% (р < 0.01) и 14% (р < 0.01). В полном соответствии с повышением относительной массы надпочечников было обнаружено возрастание уровня кортикостероидов в крови – на 43% (р < 0.01). Сывороточная концентрация инсулина, напротив, падала на 19% (р < 0.01). Вследствие указанных изменений уровня кортикостероидов и инсулина в крови К/И коэффициент значительно возрастал – в 1.82 раза (табл. 1).
Таблица 1.
Изменение показателей, характеризующих интенсивность стресс-реакции, после стресса “дефицита времени” и “свободного плавания в клетке”
| Показатели | Контроль для СДВ | СДВ | Контроль для СПК | СПК |
|---|---|---|---|---|
| Температура тела, °С | 37.7 (37.6; 38.1) |
37.9 (37.5; 38.0) |
37.9 (37.4; 38.5) |
37.8 (37.3; 38.4) |
| Относительная масса надпочечников, мг/г | 0.18 (0.17; 0.20) |
0.23* (0.22; 0.25) |
0.17 (0.17; 0.25) |
0.25* (0.21; 0.29) |
| Относительная масса селезенки, мг/г | 4.03 (3.92; 4.24) |
3.49* (3.32; 3.74) |
4.26 (3.97; 4.31) |
3.27* (3.12; 3.46) |
| Относительная масса тимуса, мг/г | 2.17 (2.01; 2.28) |
1.60* (1.34; 1.81) |
2.10 (1.99; 2.15) |
1.63* (1.54; 1.85) |
| Уровень кортикостероидов в крови, нмоль/л | 21.37 (19.18; 24.26) |
30.49* (27.15; 31.30) |
23.95 (22.90; 24.39) |
33.51* (32.49; 34.02) |
| Концентрация инсулина в крови, мкМЕ/мл | 1.30 (1.19; 1.44) |
1.06* (1.02; 1.06) |
1.37 (1.16; 1.55) |
1.39 (1.38; 1.48) |
| К/И коэффициент | 1.00 | 1.82* | 1.00 | 1.70 |
Таблица 2.
Влияние стресса “дефицита времени” и “свободного плавания в клетке” на состояние слизистой оболочки желудка крыс
| Показатели | Контроль для СДВ | СДВ | Контроль для СПК | СПК |
|---|---|---|---|---|
| Частота поражения, % | 10 | 80* | – | 70* |
| Тяжесть поражения, баллы | 1 у 10% | 1 у 20% | – | 1 у 40% |
| 2 у 30% | 2 у 20% | |||
| 3 у 30%* | 3 у 10%* | |||
| Множественность поражения, число повреждений | 1 у 10% | 1 у 30% | – | 1 у 40% |
| 2 у 40% | 2 у 30%* | |||
| 3 у 10%* | ||||
| Индекс поражения | 0.3 | 4.7* | – | 2.8* |
У крыс, перенесших СПК, указанные изменения были сопоставимыми и составили: рост относительной массы надпочечников – 47% (р < 0.05), падение относительной массы селезенки и тимуса – 23% (р < 0.01) и 22% (р < 0.01), увеличение сывороточной концентрации кортикостероидов – 40% (р < 0.01) (табл. 1 ).
Поражение СОЖ после СДВ наблюдалось у 80% животных с тяжестью 1 балл у 20% крыс, 2 или 3 балла у оставшихся 60% в соотношении 1 : 1, множественностью 2 кровоизлияния на животное у 30% крыс, 3 у 40% и 4 у 10%. Индекс поражения составил 4.7 (табл. 2).
После СПК повреждение СОЖ было практически таким же – отмечалось у 70% животных с тяжестью поражения 1 балл у 40% крыс, 2 балла у 20%, 3 балла у 10% (р < 0.01); множественностью 1 поражение у 40% животных, 2 у 30% (р < 0.01); индексом поражения 2.80 (табл. 2).
После СДВ концентрация ЙТГ в крови крыс, особенно их свободных фракций, повышалась: Т3 на 18% (р < 0.01) (до 1.88 (1.84; 2.23) нмоль/л), Т4 на 22% (р < 0.01) (до 60.06 (59.14; 67.69) нмоль/л), Т3 св на 30% (р < 0.01) (до 4.21 (4.12; 4.31) пмоль/л), Т4 св на 32% (р < 0.01) (до 16.40 (15.79; 18.94) пмоль/л). В ответ на это сывороточный уровень ТТГ снижался на 36% (р < 0.05) (до 0.11 (0.09; 0.12) мкМЕ/мл), что свидетельствует о сохранении нормальных регуляторных отношений в системе гипофиз–щитовидная железа (рис. 2).
Рис. 2.
Влияние стресса “дефицита времени” (СДВ) и “свободного плавания в клетке” (СПК) на концентрацию йодсодержащих тиреоидных и тиреотропного гормонов в крови. Данные представлены в % к контрольной группе; за 100% приняты значения медиан в группах; * – статистически значимо отличается от контроля (р < 0,05).
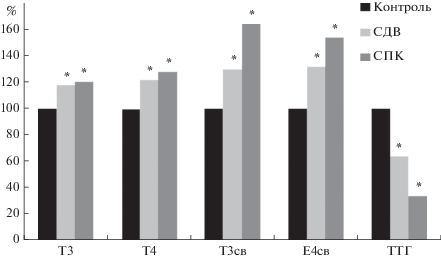
Концентрация ЙТГ в крови после СПК также увеличивалась и примерно в той же степени: Т3 на 26% (р < 0.01) (до 2.03 (1.99; 2.13) нмоль/л), Т4 на 28% (р < 0.01) (до 90.04 (87.37; 90.71) нмоль/л), Т3 св на 64% (р < 0.01) (до 6.64 (6.10; 7.06) пмоль/л), Т4 св на 54% (р < 0.01) (до 21.38 (18.82; 22.77) пмоль/л). Уровень ТТГ снижался более значительно – на 66% (р < 0.01) (до 0.07 (0.06; 0.07) мкМЕ/мл).
И СДВ, и СПК оказали влияние на поведение и физическую выносливость животных.
У животных, перенесших СДВ, время удержания на барабане ротарода повышалось на 35% (р < 0.01) (табл. 3).
Таблица 3.
Влияние стресса “дефицита времени” на продолжительность удержания на валике ротарода, двигательную и исследовательскую активность животных
| Показатели | Контроль | СДВ |
|---|---|---|
| Время (с) удержания на вращающемся валике ротарода | 8.5 (5.0; 9.0) | 11.5* (10.0; 14.0) |
| Общая дистанция (м) | 14.18 (12.66; 16.12) | 18.27* (17.57; 19.53) |
| Дистанция в периферической зоне (%) | 81.30 (73.19; 86.07) | 82.11 (72.66; 83.52) |
| Дистанция в центральной зоне (%) | 18.71 (13.93; 26.81) | 17.90 (16.48; 27.34) |
| Mаксимальная скорость перемещения (см/с) | 57.62 (45.44; 90.27) | 95.22 (85.71; 111.10) |
| Количество вертикальных стоек | 11.5 (9.0; 14.0) | 6.5* (5.0; 8.0) |
| Время пребывания на периферии (%) | 85.89 (78.97; 93.25) | 88.43 (79.79; 92.21) |
| Время пребывания в центре (%) | 14.11 (6.75; 21.03) | 11.57 (7.79; 20.21) |
| Общая длительность замирания (%) | 43.63 (35.70; 49.29) | 64.93* (61.75;70.84) |
| Длительность замирания (%) на периферии | 38.60 (34.67; 49.19) | 63.81 (61.09; 67.49) |
| Длительность замирания (%) в центре | 1.86 (1.03; 8.28) | 1.22 (1.00; 3.35) |
| Число входов в центральную зону | 12.5 (9.0; 18.0) | 7.5 (5.0; 12.0) |
| Латентный период входа (с) в центр | 9.81 (4.85; 11.48) | 14.55* (11.55; 19.35) |
| Параллельный индекс | –0.16 (–0.34; –0.11) | 0.03* (–0.03; 0.06) |
Горизонтальная двигательная активность крыс в тесте “открытое поле” также возрастала: общая дистанция перемещения увеличивалась на 29% (р < 0.01). Однако вертикальная двигательная активность животных была ниже: количество стоек снижалось на 43% (р < 0.05). При этом соотношение как дистанции перемещения крыс на периферии и в центре, так и продолжительности их пребывания в этих зонах были примерно равными (р > 0.05). Максимальная скорость перемещения животных и число входов в центр также не изменялись (р > 0.05). Латентный период входа в центральную зону был выше – на 48% (р < 0.05). Общая длительность замирания животных также была больше – на 49% (р < 0.05) за счет увеличения времени неподвижности в периферической зоне, которое повышалось на 65% (р < 0.01). Параллельный индекс становился положительным и составил 0.03, вследствие чего превышал контроль на 0.19 (р < 0.05), что наряду с изменением других показателей, по которым оценивали исследовательскую активность, характеризует ее уменьшение.
Следовательно, обнаруженные сдвиги свидетельствуют, с одной стороны, об увеличении физической выносливости, горизонтальных локомоторных реакций крыс, с другой, о снижении их вертикальной двигательной активности и исследовательского поведения, развитии тревожного состояния.
Физическая выносливость крыс после СПК также возрастала: время плавания повышалось на 14% (р < 0.01) (табл. 4). Суммарная горизонтальная двигательная активность животных не отличалась от таковой у контрольных крыс. Однако ее структура изменялась – исчезал центральный компонент (р < 0.001). Суммарная вертикальная двигательная активность животных в отличие от горизонтальной падала на 52% (р < 0.05). Нарушалась и ее структура: наблюдались только стойки с опорой на стенку “открытого поля”, число которых было меньше, чем в контроле, на 43% (р < 0.05).
Таблица 4.
Влияние стресса “свободного плавания в клетке” на физическую выносливость, интенсивность двигательных и исследовательских реакций крыс
| Показатели | Контроль | СПК |
|---|---|---|
| Физическая выносливость (время плавания, мин) | 13.72 (13.38; 14.18) | 15.62* (14.78; 16.47) |
| Суммарная горизонтальная двигательная активность (число квадратов) | 71.5 (65; 73) | 62.5 (57; 69) |
| Количество квадратов в центре поля | 5.5 (5; 6) | 0* (0; 1) |
| Количество квадратов на периферии поля | 65.5 (59; 69) | 62.5 (56; 68) |
| Суммарная вертикальная двигательная активность (число стоек) | 12.5 (9; 15) | 6* (5; 8) |
| Количество стоек без опоры на борт поля | 3 (2; 4) | 0* (0; 1) |
| Количество стоек с опорой на борт поля | 10.5 (6; 12) | 6* (5; 8) |
Следовательно, СПК, как и СДВ, повышал физическую выносливость и уровень тревожности крыс, снижал их вертикальную двигательную активность и изменял структуру поведения.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Ситуация, когда животное стремится избежать контакта с водой, быстро заполняющей устройство, и никак не может повлиять своими действиями на обстановку, в которой оказалось, вызывает появление классической “триады” стресса – увеличение относительной массы надпочечников, тимико-лимфатическую инволюцию и повреждение СОЖ, а также сдвиги уровня кортикостероидов и инсулина в крови, что свидетельствует о развитии стресс-реакции и позволяет отнести примененное нами воздействие к стрессирующему фактору. Горизонтальная двигательная активность и физическая выносливость животных в этих условиях повышаются, развивается состояние тревожности, вертикальная локомоторная активность, свидетельствующая об уровне исследовательской реакции, напротив, снижается. Выбранная нами модель стресса приводит к активации тиреоидной функции и (за счет срабатывания короткой петли обратной связи в гипоталамо-гипофизарно-тиреоидной системе) падению содержания ТТГ в крови.
Стимуляция тиреоидной функции при кратковременных стрессах обнаруживалась и другими авторами. Так, при болевом воздействии (нанесение на бедренно-поясничную область крыс однократного ноцицептивного воздействия, неповреждающего кожных покровов и нижележащих тканей) содержание Т4 и Т3 в крови повышалось в 2.5 и 2 раза, что было связано со стимуляцией секреции ТТГ [13]. Нами же обнаружено снижение концентрации ТТГ в сыворотке крови. Данный сдвиг может отражать “срабатывание” короткой петли обратной связи в гипофизарно-тиреоидной системе, а также может быть связан с повышением секреции АКТГ в условиях стресса [14], приводящим к реципрокному угнетению синтеза ТТГ передней долей гипофиза [15].
Обнаруженные сдвиги относительной массы стресс-сенситивных органов в наших исследованиях могут быть обусловлены: 1) гипертрофией надпочечников – с повышенной секрецией адренокортикотропного гормона (АКТГ), вызывающей увеличение запасов холестерина, аскорбиновой и пантотеновой кислот в коре надпочечников, стимуляцию синтеза кортикостероидов [16]; 2) снижением относительной массы надпочечников и селезенки – со стресс-индуцированной тимико-лимфатической атрофией (гибелью незрелых клеток за счет апоптоза или их миграцией и выходом в циркуляцию, при этом часть таких клеток, возможно, обретает новые функции, например, стволовых клеток) [17].
Снижение сывороточной концентрации инсулина, вероятно, обусловлено ингибированием его секреции β-клетками островков Лангерганса поджелудочной железы под влиянием катехоламинов [18], вырабатывающихся в повышенных количествах при стрессе [19].
Повреждение СОЖ при стрессе может быть связано с: 1) увеличением синтеза кортикостероидов при стрессе, которые повышают желудочную секрецию, преобразуют состав слизи, увеличивают образование соляной кислоты, нарушают процессы восстановления тканей и микроциркуляцию [20]; 2) активацией протеолиза [21]; 3) стимуляцией перекисного окисления липидов [22] в этих условиях.
Увеличение физической выносливости и двигательной активности крыс после СДВ и СПК, вероятно, определяется стимуляцией выброса катехоламинов и глюкокортикоидов в кровь, повышающих энергетическое обеспечение сократительного акта в результате активации распада гликогена в печени с образованием глюкозы [23], усиления аэробного и анаэробного окисления гликогена мышц, обеспечивающего выработку большого количества АТФ [24], роста скорости тканевого дыхания в митохондриях [25], мобилизации жира из жировых депо [26], β-окисления жирных кислот и образования кетоновых тел [27], включения аминокислот в глюконеогенез [28].
Снижение вертикальной двигательной активности, вероятно, отражает ингибирование дофаминергических систем головного мозга, с уровнем активности которых она прямо соотносится [29].
Использование предложенной нами модели эмоционального стресса, обеспечивающей индивидуальное тестирование животных, эффективное очищение от продуктов их жизнедеятельности, исключающей травмирование животных, позволит более объективно исследовать механизмы патогенеза стрессорного повреждения для разработки новых способов ограничения развития негативных последствий стресса.
ЗАКЛЮЧЕНИЕ
Разработана модель стресса “дефицита времени” – ситуация, когда животное стремится избежать контакта с водой, быстро заполняющей установку, и никак не может повлиять своими действиями на обстановку, в которой оказалось. Использование предложенной модели СДВ вызывает появление классических признаков стресс-реакции.
При сопоставлении изменений, вызванных стрессом “дефицита времени” и стрессом “свободного плавания в клетке”, установлена их практически одинаковая выраженность. Однако модель стресса “дефицита времени” обладает важными преимуществами по сравнению с другими моделями эмоционального стресса: животные подвергаются процедуре стрессирования по одной особи, после окончания воздействия экспериментальная установка эффективно очищается от продуктов их жизнедеятельности, не происходит травмирования крыс. Это существенно повышает объективность исследования показателей стресс-реакции.
Список литературы
Судаков К.В. Новые акценты классической концепции стресса. Бюл. эксперим. биологии и медицины. 123(2): 124–130. 1997. [Sudakov K.V. New accents of the classic concept of stress. Bul. experiment biology and medicine. 123(2): 124–130. 1997. (In Russ.)].
Бондаренко С.Н., Бондаренко Н.А., Манухина Е.Б. Влияние различных методик стрессирования и адаптации на поведенческие и соматические показатели у крыс. Бюл. эксперим. биологии и медицины. 128(8): 157–160. 1999. [Bondarenko S.N., Bondarenko N.A., Manukhina E.B. The effect of various stress and adaptation techniques on behavioral and somatic indicators in rats. Bul. Еxperiment. biology and medicine. 128(8): 157–160. 1999. (In Russ.)].
Khan A.G., Sarangi M., Bhalla U.S. Rats track odour trails accurately using a multi-layered strategy with near-optimal sampling. Nat. Commun. 3: 703. 2012.
Хананашвили М.М. Информационные неврозы. Ленинград. Медицина. 1978. [Hananashvili M.M. Informacionnye nevrozy [Informational neuroses]. Leningrad. Medicine. 1978].
Городецкая И.В., Гусакова Е.А. Устройство для моделирования эмоционального стресса у экспериментального животного. Афіцыйны бюл. Нац. цэнтр інтэлектуал. уласнасці. 6: 118–119. 2017. 4. [Gorodetskaya I.V., Gusakova E.A. A device for modeling emotional stress in an experimental animal. Official Bul. Nat. Center intellectual. property. 6: 118–119. 2017. (In Russ.)].
Селье Г. Очерки об адаптационном синдроме. М. Медгиз. 1960. [Selye G. Ocherki ob adaptatsionnom sindrome [Essays on the adaptation syndrome]. Moscow. Medgiz. 1960].
Виноградов В.А., Полонский В.М. Влияние нейропептидов на экспериментальную дуоденальную язву у крыс. Патол. физиология и эксперим. терапия. 1: 3–7. 1983. [Vinogradov V.A., Polonsky V.M. The effect of neuropeptides on experimental duodenal ulcer in rats. Patol. physiology and experim. therapy. 1: 3–7. 1983. (In Russ.)].
Воложин А.И., Тарасенко Л.М., Непорада К.С., Скрупник И.Н. Экспериментальная модель пептической язвы желудка. Патол. физиология и эксперим. терапия. 4: 27–28. 2001. [Volozhin A.I., Tarasenko L.M., Neporada K.S., Skrupnik I.N. Experimental model of peptic ulcer of the stomach. Patol. physiology and experim. therapy. 4: 27–28. 2001. (In Russ.)].
Панин Л.Е. Биохимические механизмы стресса. Новосибирск. Наука. 1983. [Panin L. Biohimicheskie mehanizmyi stressa [Biochemical mechanisms of stress]. Novosibirsk. Science. 1983].
Negishi T. Diphenylarsinic acid increased the synthesis and release of neuroactive and vasoactive peptides in rat cerebellar astrocytes. J. Neuropathol. & Exp. Neurol. 71(6): 468–479. 2012.
Huck U.W., Price E.O. Differential effects of environmental enrichment on the open-field behavior of wild and domestic Norway rats. J. Comp. Physiol. Psychol. 89(8): 892–898. 1975.
Каркищенко В.Н., Капанадзе Г.П., Деньгина С.Е., Станкова Н.В. Разработка методики оценки физической выносливости мелких лабораторных животных для изучения адаптогенной активности некоторых лекарственных препаратов. Биомедицина. 1: 72–74. 2011. [Karkishchenko V.N., Kapanadze G.P., Den’gina S.E., Stankova N.V. Development of methods for assessing the physical endurance of small laboratory animals to study the adaptogenic activity of certain drugs. Biomedicine. 1: 72–74. 2011. (In Russ.)].
Белякова Е.И. Реакция гипоталамо-гипофизарно-тиреоидной системы на острое и пролонгированное стресс-воздействие. Успехи соврем. естествознания. 8: 33–34. 2004. [Belyakova E.I. Reaction of the hypothalamic-pituitary-thyroid system to an acute and prolonged stress effect. Successes sovrem. natural science. 8: 33–34. 2004. (In Russ.)].
Franco A.J., Chen C., Scullen T., Zsombok A., Salahudeen A.A., Di S., Herman J.P., Tasker J.G. Sensitization of the hypothalamic-pituitary-adrenal axis in a male rat chronic stress model. Endocrinology. 157(6): 2346–2355. 2016.
Shigemitsu Y. Isolated adrenocorticotropic hormone (ACTH) deficiency and thyroid-stimulating hormone (TSH)-thyroid hormone derangement: report of three cases. J. Saitama Med. School. 3: 115–120. 2004.
Wang L., Liu F., Luo Y., Zhu L., Li G. Effect of acute heat stress on adrenocorticotropic hormone, cortisol, interleukin-2, interleukin-12 and apoptosis gene expression in rats. Biomed. Rep. 3(3): 425–429. 2015.
Старская И.С., Полевщиков А.В. Морфологические аспекты атрофии тимуса при стрессе. Иммунология. 5: 271–277. 2013. [Starskaya I.S., Polevshchikov A.V. Morphological aspects of thymus atrophy under stress. Immunology. 5: 271–277. 2013. (In Russ.)].
Barth E., Albuszies G., Baumgart K., Matejovic M., Wachter U., Vogt J., Radermacher P., Calzia E. Glucose metabolism and catecholamines. Crit. Care Med. 35(9): 508–518. 2007.
Луцкий И.С., Лютикова Л.В., Луцкий E.И., Луцкая Е.И. Особенности формирования артериальной гипертензии в условиях действия хронического стресса. Университетская клиника. 13(1): 47–51. 2017. [Lutsky I.S., Lyutikova L.V., Lutsky E.I., Lutskaya E.I. Features of the formation of arterial hypertension under conditions of chronic stress. University cliniс. 13(1): 47–51. 2017. (In Russ.)].
Никольский В.И., Сергацкий К.И. Этиология и патогенез острых гастродуоденальных изъязвлений, осложненных кровотечением. Вестник хирургической гастроэнтерологии. 4: 53–63. 2009. [Nikolsky V.I., Sergatsky K.I. Etiology and pathogenesis of acute gastroduodenal ulcerations complicated by bleeding. Bulletin of surgical gastroenterology. 4: 53–63. 2009. (In Russ.)].
Чегодарь Д.В., Кубышкин А.В. Влияние раствора наносеребра на процессы неспецифического протеолиза в слизистой желудка при моделировании язвенного повреждения. Вестник СПб университета. Серия 11. Медицина. 3: 138–148. 2015. [Chegodar D.V., Kubyshkin A.V. Effect of nano-silver solution on the processes of nonspecific proteolysis in the gastric mucosa when simulating ulcerative damage. St. Petersburg Un. Bul. Series 11. Medicine. 3: 138–148. 2015. (In Russ.)].
Михайлова И.В. Содержание продуктов перекисного окисления липидов в биоптатах слизистой оболочки желудка. Междунар. журн. прикл. и фунд. исследований. 8(2): 248–250. 2015. [Mikhailova I.V. Content of lipid peroxidation products in biopsy specimens of the gastric mucosa. Internat. J. Pract. Fund. Res. 8(2): 248–250. 2015. (In Russ.)].
Kuo T., McQueen A., Chen T.C., Wang J.C. Regulation of glucose homeostasis by glucocorticoids. Adv. Exp. Med. Biol. 872: 99–126. 2015.
Kuo T., Harris C.A., Wang J.C. Metabolic functions of glucocorticoid receptor in skeletal muscle. Mol. Cell Endocrinol. 380(5) 1–2: 79–88. 2013.
Duclos M., Gouarne C., Martin C., Rocher C., Mormède P., Letellier T. Effects of corticosterone on muscle mitochondria identifying different sensitivity to glucocorticoids in Lewis and Fischer rats. AJP Endocrinol. Metabolism. 286(2): 159–167. 2004.
Xu C., He J., Jiang H., Zu L., Zhai W., Pu S., Xu G. Direct effect of glucocorticoids on lipolysis in adipocytes. Mol. Endocrinol. 23(8): 1161–1170. 2009.
Grabacka M., Pierzchalska M., Dean M., Reiss K. Regulation of ketone body metabolism and the role of PPARα. Int. J. Mol. Sci. 17(12): 2093. 2016.
Михайлов С.С. Биохимия двигательной деятельности. М. Спорт. 2018. [Mikhailov S.S. Biohimiya dvigatelnoy deyatelnosti [Biochemistry of motor activity]. Moscow. Sport. 2018].
Medvedev I.O., Ramsey A.J., Masoud S.T., Bermejo M.K., Urs N., Sotnikova T.D., Beaulieu J.M., Gainetdinov R.R., Salahpour A. D1 dopamine receptor coupling to PLCβ regulates forward locomotion in mice. J. Neurosci. 46 (33): 18125–18133. 2013.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


