Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 4, стр. 456-464
Роль белка Cbx7 в процессах регенерации поврежденного эпидермиса
А. Н. Мардарьев 1, Н. В. Мардарьева 2, *, Г. А. Ларионов 2, В. С. Гордова 3
1 Брэдфордкий университет
Брэдфорд, Великобритания
2 Чувашская государственная сельскохозяйственная академия
Чебоксары, Россия
3 Балтийский федеральный университет им. Иммануила Канта
Калининград, Россия
* E-mail: volga480@yandex.ru
Поступила в редакцию 10.08.2018
После доработки 05.02.2019
Принята к публикации 05.02.2019
Аннотация
В настоящее время одним из приоритетных направлений биомедицинских исследований является изучение эпигенетических механизмов регуляции экспрессии генов при возникновении патологических процессов в коже. Целью данной работы было выявление экспрессии поликомбного белка Cbx7 в эпителии поврежденной кожи, а также его роль в миграции кератиноцитов в ходе заживления ран. Уровень экспрессии Cbx7 в эпидермисе был определен на 1-й, 3-й и 5-й день после ранения кожи мышей, с использованием методов полимеразной цепной реакции реального времени и иммунофлюоресцетного окрашивания. Сравнительный анализ экспрессии выявил значительное снижение уровня мРНК-транскрипта и белка Cbx7 в кератиноцитах раневого эпителия и эпидермиса, непосредственно прилегающего к ране, по сравнению с неповрежденной или более отдаленной от раны коже. При оценке влияния белка Cbx7 на клеточную миграцию в культуре кератиноцитов HaCaT выяснилось, что воздействие специфического ингибитора MS37452 приводит к повышению скорости миграции клеток в область раны-царапины. Полученные данные свидетельствуют, что снижение уровня экспрессии Cbx7 необходимо для миграции клеток кожи и реэпителизации раневого дефекта. Полученные результаты могут быть использованы для разработки новых препаратов для ускорения заживления кожи.
Кожа – один из важных источников стволовых клеток (СК), и поэтому она представляет интерес для системного изучения механизмов, контролирующих регенерацию тканей. Эпителий кожи способен к быстрой регенерации и самообновлению за счет наличия в нем нескольких пулов СК, расположенных в базальном слое эпидермиса и в волосяном фолликуле [1–3]. В неповрежденной коже СК волосяного фолликула участвуют в регенерации только этого фолликула, тогда как в поврежденной коже из них образуются эпидермальные клетки-предшественники, которые мигрируют в эпидермис, где принимают непосредственное участие в восстановлении повреждения [4, 5].
Активность СК, необходимую для поддержания клеточной идентичности и дифференцировки в специализированные типы клеток, контролируют поликомбные белки PcG, которые выполняют функцию транскрипционных репрессоров [6–9]. Эти белки взаимодействуют друг с другом, образуя хроматин-ассоциированные поликомбные репрессивные комплексы двух видов, PRC1 и PRC2 [3, 10]. Комплекс PRC2 способствует метилированию лизина 27 на гистоне Н3 (H3K27me3) [21]. Модифицированный гистон распознается белковым комплексом PRC1, состоящим из нескольких PcG-белков, таких как Cbx7 и E3-лигазы Ring1/2. Гистон Н2А убиквитинилируется по лизиновому основанию в позиции 119 (H2AK119ub1) с участием белков Ring1/2, что приводит к уплотнению хроматина и ингибированию активности генов [3, 10].
Последние данные показывают, что белки PcG играют важную роль в процессе развития кожи и регуляции активности в ней эпителиальных СК. Например, белки Bmi1, Ezh1/2 и Jarid2 стимулируют их пролиферацию, подавляя действие ингибиторов клеточного цикла, а также тормозят преждевременную активацию генов дифференцировки, а Ezh1/2 также участвует в репрессии неэпидермальных генов [1, 2, 11, 12]. Показано, что белок Cbx4, компонент PRC1-комплекса, контролирует пролиферацию и дифференцировку в культуре человеческих эпидермальных клеток-предшественников, замедляя этим самым их старение [13]. Необходимость Cbx4 для развития эпидермиса у мышей обусловливается тем, что, помимо поддержания пролиферации эпидермальных клеток-предшественников, он предотвращает их преждевременную дифференцировку [14, 15]. Эти данные свидетельствуют о том, что Cbx4 является критическим детерминантом, регулирующим активность СК в процессах нормального функционирования и регенерации кожи.
Для того, чтобы кожа была способна к восстановлению после повреждения, требуются немедленные изменения в экспрессии генов, контролирующих пролиферацию, миграцию и дифференцировку клеток. В кожных ранах мышей экспрессия компонентов PRC2-комплекса Ezh2, Eed и Suz12 уменьшается, в то же время содержание в них H3K27-деметилирующих ферментов Jmjd3 и Utx увеличивается [3]. Эти изменения приводят к снижению уровня гистона H3K27me3 и уменьшению связывания белка Eed с промоторами Myc и Egfr генов с последующей их активацией, что является необходимым условием для заживления кожи. Следовательно, снижение активности PRC2-комплекса необходимо для индукции генов, участвующих в ранней регенерации поврежденной кожи [16]. В то же время в базальных эпидермальных клетках, расположенных вблизи ран, многие гены, связанные с дифференцировкой и старением клеток, не активируются. Это позволяет заключить, что существуют некоторые другие репрессивные механизмы, подавляющие активность генов и участвующие в регенерации кожи. Можно предположить, что PRC1-комплекс является одним из важных регуляторов, контролирующих экспрессию генов в ходе заживления ран. Однако остается неизвестным, какие процессы (пролиферация или миграция) находятся под контролем Cbx-белков PRC1-комплексa при заживлении ран кожи.
Целью данного исследования явилось изучение экспрессии белка Cbx7 в коже мышей до и после повреждения, а также выявление его роли в регуляции миграции клеток.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследования проводились на половозрелых (8 нед. после рождения) мышах-самках линии C57BL/6 (Charles River, Великобритания) по протоколам (PPL 40/3565), утвержденным Министерством внутренних дел (Великобритания). Мыши, четыре группы по три особи в каждой, содержались в индивидуальных вентилируемых клетках в условиях 12-часового дневного цикла, при температуре воздуха 21 ± 1°С и влажности 40–60% со свободным доступом к воде и пище. Первая группа мышей (интактная) не подвергалась воздействию, мышам второй, третьей, четвертой группы после внутрибрюшинной анестезии инъекцией смеси кетамин/ксилазин в дозе 100 мг/10 мг на кг массы тела пункционной биопсийной иглой на всю толщину кожи спины каждой мыши были нанесены четыре раны (5 мм в диаметре). Образцы ран кожи были собраны на 1-й, 3-й и 5-й день после ранения и заморожены в жидком азоте с последующим хранением в морозильнике при температуре –80°С, в качестве контроля использовали кожу интактных мышей из группы 1, взятую непосредственно перед нанесением ран мышам групп 2, 3, 4.
Культура клеток и анализ клеточной миграции методом “царапин”. Человеческие кератиноциты линии HaCaT (ATCC, Великобритания) культивировали в среде DMEM (Thermo Fisher, Великобритания), содержащим 10%-ную эмбриональную бычью сыворотку, 2 мМ L-глутамина, 100 ед/мл пенициллина, 100 мкг/мл стрептомицина (Thermo Fisher, Великобритания) до достижения субконфлюентного состояния (90% слияния) при температуре 37°С и содержании в воздухе 5% СО2.
Клетки культивировались в 12-луночных культуральных планшетах (Starstedt, Германия) до достижения 90% конфлюентности, после чего в середине монослоя наконечником микропипетки P100 наносили царапину для имитации раневого пространства с последующим анализом миграции в него клеток.
Для подавления функции белка Cbx7 в две группы клеток (по 3 лунки для каждой) добавляли ингибитор Cbx7 (MS37452) (Tocris, Великобритания), растворенный в 0.1%-ном растворе диметилсульфоксида (ДМСО) (Sigma-Aldrih, Великобритания), в концентрации 50 и 100 мкМ соответственно. В качестве контроля служила группа клеток (три лунки) с добавлением ДМСО (0.1% финальная концентрация). Степень миграции клеток оценивали двумя способами с использованием программы ImageJ [17]: 1) измерение скорости миграции путем определения расстояний между краями царапин (30 измерений с каждой лунки) на сроках 0 и 24 ч по формуле Rm = (Wi – Wt)/t, где Rm = скорость миграции (мкм/ч), Wi = изначальная ширина раны (мкм), Wt = конечная ширина раны (мкм), t = время миграции; средние значения полученных данных были проанализированы с применением ANOVA теста; и 2) определение площади раневого дефекта-царапины на сроках 0, 6, 12 и 24 ч с помощью ImageJ-макроса WH-NJ с последующим подсчетом % закрытия раны по формуле WC% = (At0– At)/At0, где WC% = % закрытия раны, At0 = изначальная площадь раны (мкм2), At = площадь раны в момент времени t [17, 18]. При помощи GraphPad Prism6 программного обеспечения с использованием Kruskal–Wallis H теста проводили оценку статистической значимости различий средних величин, которые были признаны значимыми при р < 0.05.
Полимеразная цепная реакция в реальном времени. С помощью использования Тризол реагента (Invitrogen, Великобритания) из замороженных образцов была изолирована клеточная РНК [19] с последующей конвертацией в комплементарную ДНК с помощью обратной транскрипционной системы (Promega, Великобритания). Последовательности праймеров Cbx7 (табл. 1) для полимеразной цепной реакции (ПЦР) были получены из базы данных праймеров PrimerBank [20]. Синтез праймеров был осуществлен компанией Sigma-Aldrich (Великобритания). ПЦР проводили на оборудовании StepOne Plus (Applied Biosystems, Великобритания) с использованием реагента 2xSYBR Master Mix (Applied Biosystems, Великобритания). Анализ данных был произведен с помощью программы Genex (Bio-Rad), для нормализации использовали экспрессию гена Gapdh. Статистический анализ объединенных данных с трех репликатов проводился при помощи GraphPad Prism6 программного обеспечения с использованием Kruskal–Wallis H теста. Различия средних величин считали статистически значимыми при значении р < 0.05.
Таблица 1.
Список праймеров
| Ген | Последовательность | Температура |
|---|---|---|
| Cbx7 | TGCGGAAGGGCAAAGTTGAAT' ACAAGGCGAGGGTCCAAGA |
60°С |
| Gapdh | AGGTCGGTGTGAACGGATTTG TGTAGACCATGTAGTTGAGGTCA |
60°С |
Иммунофлуоресцентный анализ. Экспрессию белков выявляли в криостатных срезах толщиной 8–10 мкм, которые были получены из средней части замороженных образцов ран кожи. Срезы фиксировали в 4%-ном параформальдегиде в течение 10 мин при комнатной температуре с последующим промыванием в PBS буфере, 3 раза по 5 мин. Срезы инкубировали с первичными антителами против Cbx7 (Abcam, Великобритания, 1 : 100 разведение) в течение 16–18 ч при температуре 4°С с последующей обработкой вторичными антителами, меченными флуоресцентной меткой Alexa-Cy-555 (Life Technologies, Великобритания; 1: 200) в течение 60 мин при температуре 37°С. Срезы были заключены в флуоресцентную среду с 6-диамидин-2-фенилиндоном (DAPI) (Abcam, Великобритания).
Микрофотографии были сделаны с помощью флуоресцентного микроскопа Nikon Eclipse 501 и цифровой камеры QImaging. Для анализа изображений использовали программу Image Pro Express (Media Cybernetics, США).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Динамика Cbx7 экспрессии в эпидермисе после ранения кожи. Иммунофлуоресцентный анализ кожи до и после ранения выявил следующие изменения экспрессии белка Cbx7 в эпителиальных структурах. В неповрежденной коже (день 0) белок Cbx7 выявлен в кератиноцитах эпидермиса и волосяного фолликула (рис. 1А, стрелки). Однако на следующий день после ранения (день 1) было выявлено значительное снижение уровня Cbx7 в формирующемся раневом эпителии (рис. 1Б, наконечник) по сравнению с прилегающим неповрежденным эпидермисом (рис. 1Б, стрелки). По мере заживления раны (день 3 и 5) было выявлено увеличение количества клеток, экспрессирующих белок Cbx7 в раневом эпителии, но уровень экспрессии белка в нем по-прежнему был ниже по сравнению с прилегающим неповрежденным эпидермисом (рис. 1В–Д, наконечник и стрелки).
Рис. 1.
Иммунофлуоресцентный анализ экспрессии Cbx7 в эпидермисе на разных сроках заживления раны. A–Г – Снижение экспрессии белка Cbx7 в раневом эпителии на день 0 (А), день 1 (Б), день 3 (В) и день 5 (Г) после ранения кожи. Шкала – 50 мкм. Пунктирная линия и “наконечник” указывают на пределы раневого эпителия; стрелки указывает на неповрежденный эпидермис вблизи раны, где экспрессия белка Cbx7 сохранена.

Похожая динамика в изменении уровня экспрессии мРНК Cbx7 была обнаружена с помощью ПЦР. Уровень Cbx7-транскрипта резко уменьшился сразу после ранения с последующим увеличением его синтеза к 5-му дню (рис. 2). Однако уровень мРНК Cbx7 все еще оставался ниже, чем в неповрежденной коже (рис. 2). Снижение уровня Cbx7 сразу после ранения кожи позволяет предположить, что активность PRC1-комплекса также снижена, что может способствовать активации генов, участвующих в заживлении раны. Чтобы подтвердить это предположение, в дальнейших работах необходимо определить уровень гистона H2AK119ub1, катализируемого PRC1-комплексом.
Рис. 2.
Выявление экспрессии Cbx7 транскрипта до и в разные сроки после ранения кожи с помощью ПЦР реального времени. Экспрессия гена Cbx7 нормализована к гену Gapdh. Данные с трех репликатов были объединены и выражены как среднее ± стандартная ошибка среднего. Статистический анализ проведен с использованием Kruskal–Wallis H тест; * – p < 0.05; нз – нет значимости различий.
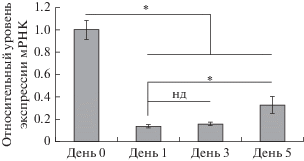
Также важно будет выяснить, на каком сроке после ранения кожи происходит восстановление уровня белка Cbx7. Для ответа на этот вопрос следует повторить проведенное исследование с анализом состояния кожи в более поздние сроки, например, на седьмой день, когда раневой эпителий покроет всю поверхность раны, и на 14-й день, когда произойдет полная регенерация эпидермиса.
Ингибирование Cbx7 повышает миграцию эпидермальных кератиноцитов in vitro. В ответ на повреждение кожи эпидермальные кератиноциты начинают продуцировать регуляторные факторы, такие как Zeb1/2, Snail1/2, Twist1, которые способствуют частичной эпителиально-мезенхимальной транзиции и приобретению повышенной миграционной активности эпителиальными клетками в раневом эпителии [21]. Миграция кератиноцитов в рану является ключевым звеном в процессе заживления раны и востановления целостности кожного покрова.
Результаты влияния ингибирования белка Cbx7 на миграцию кератиноцитов в монослое клеток с имитацией раневого пространства представлены на рис. 3. Вне зависимости от воздействия через 24 часа ширина пространства заметно уменьшается, причем максимальное заполнение пространства клетками наблюдается в случае ингибирования белка Cbx7, визуально использование различной концентрации ингибитора MS37452 (50 и 100 мкМ) на ширине пространства не отражается (рис. 3А). Первые изменения в заполнении царапины клетками можно заметить только через 12 ч, до этого срока кератиноциты заполняют пространство одинаково. Визуальные наблюдения подтверждаются измерением скорости миграции кератиноцитов, которая статистически значимо усиливается в группах с добавлением в культуральную среду MS37452 по сравнению с контрольной группой (рис. 3Б).
Рис. 3.
Миграция кератиноцитов после ингибирования белка Cbx7. A – Миграция кератиноцитов в первые 24 ч после нанесения царапин под влиянием Cbx7 ингибитора MS37452 и ДМСО. Б – скорость миграции кератиноцитов после воздействий MS37452 (50 и 100 мкМ) и ДМСО; данные выражены как среднее ± стандартное отклонение, ANOVA тест, * – p < 0.05. В – % заживления раны по отношению к первоначальной площади дефекта (0 ч) на сроках 6, 12 и 24 ч после воздействия MS37452 и ДМСО; данные выражены как среднее ± стандартное отклонение, Kruskal–Wallis H тест, * – p < 0.05.

Кроме того, подсчет площади раневого дефекта и определение процента заживления раны на указанных сроках наблюдения также свидетельствуют о повышении способности кератиноцитов мигрировать под влиянием ингибитора белка Cbx7 (рис. 3В). Обе исследованные концентрации MS37452 одинаково эффективно воздействовали на миграцию клеток в раневое пространство. Таким образом, ингибирование Cbx7 в культуре клеток стимулирует миграционную активность кератиноцитов. Данный результат позволяет предположить, что снижение Cbx7 сразу после ранения кожи необходимо для приобретения эпидермальными кератиноцитами способности к миграции в раневой дефект.
ЗАКЛЮЧЕНИЕ
Полученные данные свидетельствуют, что реэпителизация раневого дефекта происходит в условиях снижения уровня экспрессии в эпидермисе белка Cbx7, а ингибирование этого белка способствует увеличению скорости миграции клеток в поврежденную область.
Важными вопросами, которые остаются открытыми, являются следующие: какие гены регулируют белок Cbx7 и что контролирует уровень Cbx7 и его снижение в эпидермальных клетках сразу после ранения кожи. Ответы на эти вопросы позволят не только лучше понять функциональную значимость Cbx7 и PRC-комплекса в нормальном функционировании кожи, но и способствовать созданию новых терапевтических методов ускорения заживления ран, в том числе при лечении хронических язв кожи.
Список литературы
Bardot E., Valdes V.J., Zhang J., Perdigoto C.N., Nicolis S., Hearn S.A., Silva J.M., Ezhkova E. Polycomb subunits Ezh1 and Ezh2 regulate the Merkel cell differentiation program in skin stem cells. EMBO J. 32: 1990–2000. 2013.
Ezhkova E., Pasolli H.A., Parker J.S., Stokes N., Su I.H., Hannon G., Tarakhovsky A., Fuchs, E. Ezh2 orchestrates gene expression for the stepwise differentiation of tissue-specific stem cells. Cell. 136: 1122–1135. 2009.
Simon J., Kingston R. E. Mechanisms of polycomb gene silencing: Knowns and unknowns. Nat. Rev. Mol. Cell Biol. (10): 697–708. 2009.
Fuchs E.J. Cell Biol. Skin stem cells: Rising to the surface. 180: 273–284. 2008.
Ito M., Liu Y., Yang Z., Nguyen J., Liang F., Morris R.J., Cotsarelis G. Stem cells in the hair follicle bulge contribute to wound repair but not to homeostasis of the epidermis. Nat. Med. 11: 1351–1354. 2005.
Мардарьев А.Н., Мардарьева Н.В., Ларионов Г.А. Роль Cbx7 в регуляции миграции кератиноцитов при заживлении кожных ран у мышей. Вестник Чувашской гос. сельскохоз. академии. 3(3): 56–62. 2017. [Mardaryev A.N., Mardaryeva N.V., Larionov G.А. The role of Cbx7 in the regulation of keratinocytes migration during wound healing in mice. Vestnik Chuvash State Agricult. Acad. 3(3): 56–62. 2017. (In Russ.)].
Мардарьев А.Н., Мардарьева Н.В. Контроль поликомбного белка Cbx7 в пролиферации кератиноцитов в мышиной коже. Биологизация земледелия – основа воспроизводства плодородия почвы. Сборник материалов международной научно-практической конференции, посвященной 60-летию со дня рождения доктора сельскохозяйственных наук, профессора, академика РАЕ Л.Г. Шашкарова. Чувашская гос. сельскохоз. академия. 171–178. 2018. [Mardaryev A.N., Mardaryeva N.V. Cbx7 controls keratinocytes proliferation in mouse skin. In the collection: Proc. Internat. scientific-practical conference (dedicated to the 60th anniversary of Prof. L.G. Shashkarov. Chuvash state agricultural Academy. 171–178. 2018. (In Russ.)].
Boyer L., Plath K., Zeitlinger J., Brambrink T., Medeiros L.A., Lee T.I., Levine S.S., Wernig M., Tajonar A., Ray M.K., Bell G.W., Otte A.P., Vidal M., Gifford D.K., Young R.A., Jaenisch, R. Polycomb complexes repress developmental regulators in murine embryonic stem cells. Nature. 441: 349–353. 2006.
Margueron R., Reinberg D. The Polycomb complex PRC2 and its mark in life. Nature. 469: 343–349. 2011.
Di Croce L., Helin K. Transcriptional regulation by Polycomb group proteins. Nat. Struct. Mol. Biol. 20: 1147–1155. 2013.
Ezhkova E., Lien W.H., Stokes N., Pasolli H.A., Silva J.M., Fuchs E. EZH1 and EZH2 cogovern histone H3K27 trimethylation and are essential for hair follicle homeostasis and wound repair. Genes Dev. 25: 485–498. 2011.
Mejetta S., Morey L., Pascual G., Kuebler B., Mysliwiec M.R., Lee Y., Shiekhattar R., Di Croce L., Benitah S.A. Jarid2 regulates mouse epidermal stem cell activation and differentiation. EMBO J. 30: 3635–3646. 2011.
Liu B., Liu Y.F., Du Y.R., Mardaryev A.N., Yang W., Chen H., Xu Z.M., Xu C.Q., Zhang X.R., Botchkarev V.A., Zhang Y., Xu G.L. Cbx4 regulates the proliferation of thymic epithelial cells and thymus function. Development. 140(4): 780–800. 2013.
Мардарьев А.Н., Мардарьева Н.В. Роль Cbx4 в заживлении кожных ран у мышей. Научно-образовательная среда как основа развития агропромышленного комплекса и социальной инфраструктуры села. Материалы Международной научно-практической конференции, посвященной 85-летию ФГБОУ ВО Чувашская ГСХА. 305–310. 2016. [Mardaryev A.N., Mardaryeva N.V. The role of cbx4 in regulation of wound healing in mice. In the collection: Scientific-educational environment as a basis for the development of agroindustrial complex social infrastructure of the village proceedings of the international scientific-practical conference (dedicated to the 85th anniversary of the Chuvash state agricultural Academy). Chuvash state agricultural Academy. 305–310. 2016. (In Russ.)].
Mardaryev A.N., Liu B., Rapisarda V., Poterlowicz K., Malashchuk I., Rudolf J., Sharov A.A., Jahoda C.A., Fessing M.Y., Benitah S.A., Xu G.L., Botchkarev V. A. Cbx4 maintains the epithelial lineage identity and cell proliferation in the developing stratified epithelium. J. Cell Biol. 212(1): 77–89. 2016.
Shaw T., Martin P. Epigenetic reprogramming during wound healing: Loss of polycomb-mediated silencing may enable upregulation of repair genes. EMBO Reports. 10: 881–886. 2009.
Grada A., Otero-Vinas M., Prieto-Castrillo F., Obagi Z., Falanga V. Research techniques made simple: Analysis of collective cell migration using the wound healing assay. J. Invest. Dermatol. 137(2): 11–16. 2017.
Nunes J.P.S., Dias A.A. M. ImageJ macros for the user-friendly analysis of soft-agar and wound-healing assays. Biotechniques. 62(4): 175–179. 2017.
Luis N., Morey L., Mejetta S., Pascual G., Janich P., Kuebler B., Cozutto L., Roma G., Nascimento E., Frye M., Di Croce L., Benitah S.A. Regulation of human epidermal stem cell proliferation and senescence requires polycomb- dependent and -independent functions of Cbx4. Cell Stem Cell. 9: 233–246. 2011.
https: //pga.mgh.harvard.edu/primerbank.
Yan C., Grimm W.A., Garner W.L., Qin L., Travis T., Tan N., Han Y.P. Epithelial to mesenchymal transition in human skin wound healing is induced by tumor necrosis factor-alpha through bone morphogenic protein-2. Am. J. Pathol. 176: 2247–2258. 2010.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


