Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 5, стр. 565-577
Восстановление двигательных функций у спинализированных крыс при электрической стимуляции спинного мозга и локомоторной тренировкe
Н. В. Павлова 1, 2, И. Н. Богачева 1, *, Е. Ю. Баженова 1, О. В. Горский 1, Т. Р. Мошонкина 1, Ю. П. Герасименко 1
1 ФГБУН Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
2 СПбГУ Институт трансляционной биомедицины
Санкт-Петербург, Россия
* E-mail: boiss@mail.ru
Поступила в редакцию 7.03.2019
После доработки 24.03.2019
Принята к публикации 25.03.2019
Аннотация
Изучалось восстановление двигательных функций у хронических спинализированных крыс при локомоторных тренировках на тредбане в сочетании с электрической стимуляцией спинного мозга. Тренировка бипедальной ходьбы на движущейся ленте тредбана с поддержкой веса тела и применением либо подкожной, либо эпидуральной электрической стимуляции (40 Гц) проводилась 5 дней в неделю по 20–30 мин. Динамика изменения локомоторных способностей при использовании подкожной и эпидуральной электрической стимуляции и их действие на нейронные структуры спинного мозга были схожи. Спустя 3 нед. двигательной реабилитации одиночная стимуляция с частотой 1 Гц вызывала рефлекторные моносинаптические потенциалы в мышцах задних конечностей, а одновременная ритмическая стимуляции двух локусов спинного мозга с частотой 40 Гц инициировала локомоторно-подобную активность на движущейся ленте тредбана. После 9 нед. тренировок наблюдалась более выраженная ритмика, что совпадало с появлением полисинаптических спинальных рефлексов. Введение агониста серотониновых рецепторов – квипазина приводило к усилению полисинаптической активности в рефлекторных ответах и улучшению локомоции. Показано, что применение неинвазивной подкожной стимуляции в сочетании с локомоторными тренировками может быть эффективным методом активации нейронных локомоторных сетей, сопоставимым с инвазивной эпидуральной стимуляцией.
Электрическая стимуляция спинного мозга человека и животных в последние годы активно используется в физиологических исследованиях и в клинической практике. В физиологических исследованиях электрическая эпидуральная стимуляция спинного мозга (ЭССМ) применяется для изучения висцеральных [1] и соматических центров, локализованных в спинном мозге, в том числе спинальных локомоторных сетей [2–4]. В электрофизиологических и гистологических экспериментах показано, что ЭССМ воздействует на дорсальные корешки, активируя моно- и полисинаптически нейронные сети, которые продуцируют шагательный паттерн, адресованный к мотонейронам [5, 6]. Недавно было показано, что, стимулируя спинной мозг чрескожно в области поясничного утолщения, удалось вызвать локомоторный ответ у здоровых добровольцев [7]. С одной стороны, применение неинвазивной стимуляции позволяет проводить электрическую стимуляцию спинного мозга у здоровых людей и использовать этот метод в физиологических исследованиях спинного мозга в норме, с другой – найден неинвазивный способ стимуляции спинного мозга, который уже начинает применяться в клинике [8, 9]. Проблема состоит в том, что при чрескожной стимуляции спинного мозга между стимулирующим электродом и спинным мозгом располагается несколько видов биологических тканей, обладающих разной электрической проводимостью, поэтому предсказать, какие структуры спинного мозга активируются при такой стимуляции, довольно сложно. Задачей настоящего исследования было сравнить в одном эксперименте рефлекторную активность спинного мозга крыс при ЭССМ и при чрескожной стимуляции спинного мозга, а также оценить реабилитационный потенциал этих двух методов. В связи с тем, что исследования проведены в хроническом эксперименте на животных, чрескожная стимуляция заменена на подкожную стимуляцию спинного мозга (ПССМ). ПССМ близка по характеру воздействия с чрескожной, поскольку электрический ток, как и при чрескожной стимуляции, по пути к спинному мозгу должен пройти через подкожную клетчатку, фасции, позвонки и спинномозговую жидкость. Ставилась цель изучить восстановление локомоторных способностей за счет сочетанного воздействия длительной стимуляции и тренировки в динамике у крыс в хроническом эксперименте.
МЕТОДЫ ИССЛЕДОВАНИЯ
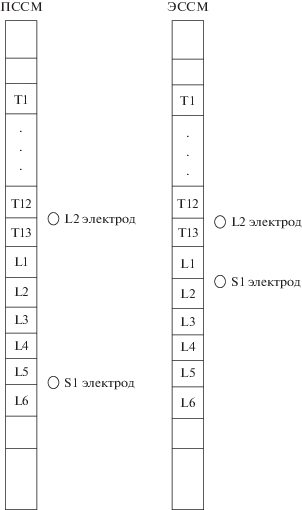
Работа проведена на животных из Центра коллективного пользования Биоколлекции Института физиологии РАН, поддержанной Программой Министерства образования и науки РФ по сохранению и развитию биоресурсных коллекций. В настоящей работе все эксперименты на хронических спинализированных крысах проведены в асептических условиях, согласно “Правилам проведения работ с использованием экспериментальных животных”, утвержденным приказом МЗ СССР № 775 от 12.08.1977, и в соответствии с законом “О защите животных от жестокого обращения” гл. IV, ст. 10, 4679/11 ГК от 01.12.1999 и соблюдением биоэтических норм в соответствии принципам Базельской декларации и рекомендациями комиссии по контролю за содержанием и использованием лабораторных животных при Институте физиологии им. И.П. Павлова РАН. Использовались крысы линии Sprague-Dawley, самки, n = 6. Животные были приручены и адаптировны к беговой дорожке за 1 месяц до хирургической операции. Накануне операции крысы были анестезированы комбинацией золетила и ксилазина – внутримышечно, 10 и 0.3 мг/кг соответственно. Животные были разделены на 2 равные группы: в 1-ой группе применялась ПССМ, во 2-ой – ЭССМ. У животных 1 группы проволочные электроды (катоды) из нержавеющей стали (AS632; Cooner Wire, Chatsworth, Калифорния, США), покрытые изолирующей оболочкой, подшивались этилоном-4 подкожно на позвоночник в области нижнегрудного (между Т12–13 позвонками) и крестцового (между L5–L6 позвонками) отделов. Размер активной зоны электрода, которая прорезалась в изолирующей оболочке провода, составлял 2–3 мм. У животных 2-ой группы электроды подшивались этилоном-8 к твердой мозговой оболочке на задней поверхности спинного мозга по средней линии на уровне L2 и S1 сегментов (между Т12–13 и L1–L2 позвонками соответственно) [10, 11]. Размер активной зоны электрода составлял 500 мкм. Стимуляция двух областей спинного мозга необходима для получения цикла шага близкого по кинематическим характеристикам к нормальному шагу [12]. Такая двойная стимуляция запускает локомоцию и позволяет обеспечивать фазу опоры в шагательном цикле. Различие в 1‑ой и 2-ой группах в позиции нижнего электрода (S1) обуславливалось получением достаточного разгибательного паттерна у животных 1 группы только при постановке электрода на более нижние позвонки – L5–L6 (рис. 1). Индифферентные электроды (аноды) с 1-сантиметровой удаленной изоляцией на дистальном конце имплантировались подкожно в области плеча и паха. Провода были проведены под кожей от разреза на голове до позвоночника, коннектор (розетка) закреплен на черепе животного с помощью шурупов и протакрила. Провода для электромиографических электродов также проводились под кожей от розетки до исследуемых мышц, где биполярно имплантировались в мышцы tibiasis anterior (ТА) и gastrocnemius medialis (GN) на обеих конечностях, как описано ранее [10]. Активная зона электродов для мышц составляла 500 мкм.
Рис. 1.
Схема расположения электродов. T1–L6 – позвонки. Для ЭССМ – обозначения электродов соответствуют названию сегментов спинного мозга. Для ПССМ – название нижнего электрода S1 – условно (объяснения в тексте).
Через неделю после имплантации электродов всем крысам проводили полную перерезку спинного мозга на уровне Т7–8, как описано в [13]. Кроме регулярного (2 раза в день) ухода за парализованными животными (опорожнение мочевого пузыря и кишечника, массаж нижних конечностей) проводилась локомоторная тренировка на беговой дорожке при ПССМ (1-я группа) или ЭССМ (2-я группа) в течение 9 нед. Для тренировки животное закреплялось в специальную жилетку, охватывающую грудную клетку, и фиксировалось в подвешивающем устройстве, находясь под углом 45° по отношению к тредбану, при этом задние лапы крысы касались поверхности дорожки. Тренировка состояла в поочередной постановке опорной поверхности стоп задних конечностей на движущуюся дорожку, что имитировало шагание. На более поздних сроках крысы выполняли шагательные движения самостоятельно. Тренировки проводилась ежедневно 5 дней в неделю в течение 20–30 мин. Скорость беговой дорожки оставалась стабильной – 15 см/с во время тренировок и при тестировании.
В обеих группах двигательное поведение животных на движущейся дорожке тредбана записывали через 3 и 9 нед. после спинализации посредством регистрации электромиографической (ЭМГ) активности мышц задних конечностей во время стимуляции. Через 9 нед. тренировок двигательные ответы записывали до и после однократного внутрибрюшинного введения квипазина – агониста серотониновых рецепторов в дозе 0.3 мг/кг. Известно, что серотонинергическая нисходящая система участвует в активации спинальных локомоторных центров, а квипазин, действуя на 5HT2A рецепторы, улучшает экстензорную активность мышц, прямо активируя мотонейроны. Кроме того, через 5НР7 и 5НР1А рецепторы квипазин воздействует на интернейроны спинального генератора, ответственные за чередование движений правой и левой ноги, без прямой активации выходных компонентов локомоторной сети [14, 15]. В этот же период времени регистрировали спонтанную ходьбу на движущейся дорожке тредбана без применения электрической стимуляции до и после введения квипазина.
Для электрической стимуляции спинного мозга использовался стимулятор A-M System, Model 2100. Для исследования двигательных рефлексов использовали монополярные импульсы прямоугольной формы длительностью 1 мс, амплитудой 800–1500 мкА для ПССМ и 150–200 мкА для ЭССМ, с частотой 1 Гц, для вызова шагательных движений применяли ритмические импульсы той же амплитуды с частотой 40 Гц. Рассчитывали среднее и стандартное отклонение для продолжительности пачек и межпачечных интервалов в ЭМГ-активности, а также амплитуды ответов в пачке по 15-ти шагательным циклам. Статистическую обработку данных производили с применением стандартных компьютерных программ Excel-2010. Для определения статистически значимых различий использовался t-критерий Стьюдента при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
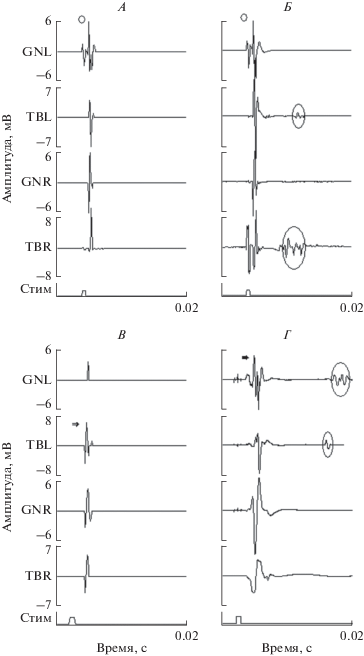
Анализировали динамику изменения одиночных рефлекторных ответов в мышцах голени у каждой группы крыс при раздельной стимуляции (1 Гц) двух локусов спинного мозга L2 (верхний электрод) и S1 (нижний электрод). Спустя 3 нед. в обоих случаях у крыс 1-ой группы в ответ на ПССМ в мышцах задних конечностей регистрировали одиночные ответы с латентностью 2–4 мс. У одной из крыс 2-ой группы на уровне S1 также появлялись такие ответы, в то время при стимуляции верхнего уровня L2 регистрировались ранние ответы с латентностью 5–6 мс. Ответы с латентностью 2–4 мс (М-ответы) являются, вероятно, прямыми мышечными ответами [16], а ответы с латентностью 5–6 мс – ранними ответами, которые принято считать моносинаптическими рефлексами [2, 4]. Спустя 9 нед. при стимуляции обоих локусов спинного мозга при ПССМ и ЭССМ появлялись поздние ответы с латентностью 10–30 мс (рис. 2Б, Г).
Рис. 2.
Динамика изменения одиночных рефлекторных ЭМГ-ответов при ПССМ (А – 3 нед. тренировок, Б – 9 нед.), при ЭССМ (В – 3 нед., Г – 9 нед.) в мышцах TBL–tibialis anterior, левая нога, TBR – tibialis anterior, правая нога, GNL – gastrocnemius medialis, левая нога, GNR – gastrocnemius medialis, правая нога. Стимуляция на уровне L2. Пример М-ответа показан кружком, раннего ответа – стрелкой, поздние ответы – обведены. Здесь и далее по оси абсцисс – время (c), по оси ординат – амплитуда.
Для тренировки локомоторных движений использовали одновременную стимуляцию двух локусов спинного мозга с частотой 40 Гц, при этом задние конечности крысы находились на движущемся тредбане. Через 3 нед. тренировок у крыс обеих групп регистрировалась шагоподобная ЭМГ-активность (рис. 3А, В). Слабо выраженная ритмика формировалась за счет модуляции прямых мышечных ответов при ПССМ и ранних ответов при ЭССМ, которые следовали с частотой стимуляции (рис. 3А и 3В – фрагменты). Наблюдалась слабая реципрокность в мышцах антагонистах (tibialis ant. и gastrocnemius med.) и одноименных мышцах обеих конечностей.
Рис. 3.
Динамика изменения локомоторных ЭМГ-паттернов при ПССМ: A – 3 нед. тренировок, Б – 9 нед.; при ЭССМ: В – 3 нед., Г – 9 нед. (слева – паттерн ЭМГ-активности, справа – его фрагмент); Д – движения крысы в одном шагательном цикле при ходьбе по движущемуся тредбану через 9 нед. тренировок при ПССМ, Е – при ЭССМ (реконструкция по видео).
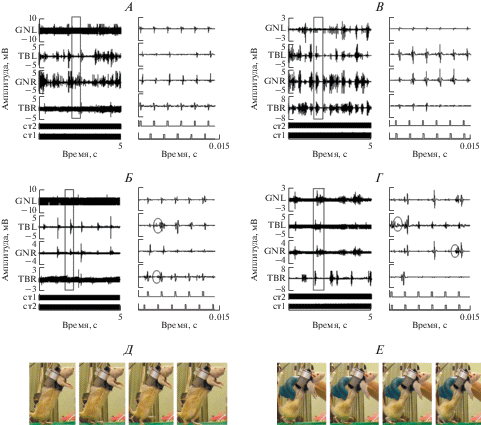
Следует отметить, что ходьба в обеих группах крыс не была при этом длительной и стабильной (не более 5 с). Спустя 9 нед. все крысы при стимуляции спинного мозга могли ходить по тредбану 10–25 с, при этом регистрировалась выраженная пачечная ЭМГ-активность, характеризующаяся чередованием периодов сгибания и разгибания в каждой мышце (рис. 3Б, Г). Детальный анализ пачки показал, что наряду с ранними и прямыми ответами в ней появляются поздние ответы, так же, как это наблюдалось в одиночных рефлекторных ответах. Таким образом, тренировка на тредбане в течение 9 нед. с применением как ПССМ, так и ЭССМ приводила к появлению поздних ответов как при низкочастотной, так и высокочастотной стимуляции. Вместе с тем, частота 1 Гц вызывала только одиночные рефлекторные ответы, для инициации локомоции у спинальных крыс требовалась стимуляция со значительно большей частотой.
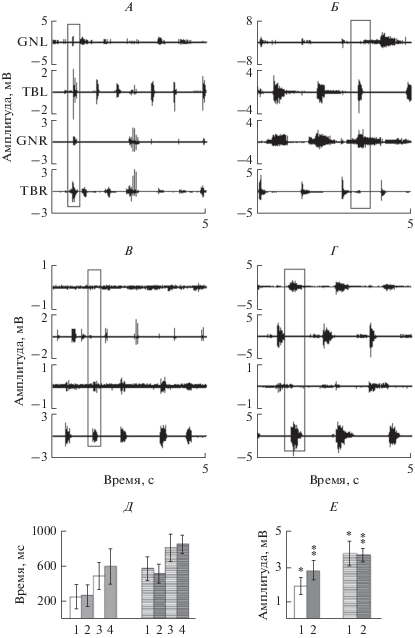
После 9 нед. тренировок крысам вводили квипазин и тестировали локомоторные ответы при стимуляции с частотой 40 Гц. На фоне действия квипазина ходьба становилась более координированной, что подтверждается более выраженной реципрокностью ответов (выделенные прямоугольниками участки на рис. 4А, Б). Увеличилась амплитуда ответов, главным образом поздних компонентов, они утрачивали связь со стимулом, их роль в формировании пачки значительно возрастала (фрагменты на рис. 4А, Б). Введение квипазина приводило к некоторому увеличению длительности пачек. Статистические характеристики этих параметров представлены на рис. 4В, Г.
Рис. 4.
Локомоторные ЭМГ-паттерны после введения квипазина – слева, их фрагменты – справа, А – при ПССМ (крыса 1-ой группы), Б – при ЭССМ (крыса 2-ой группы). В: 1 – среднее значение продолжительности пачки в 1-ой группе, 2 – то же во 2-ой, 3-среднее значение межпачечного интервала в 1-ой группе, 4 – то же во второй. Г – 1-амплитуда ответа в пачке в 1-ой группе, 2 – то же во 2-ой. Без штриховки – до введения квипазина, со штриховкой – после введения квипазина: n = 50.
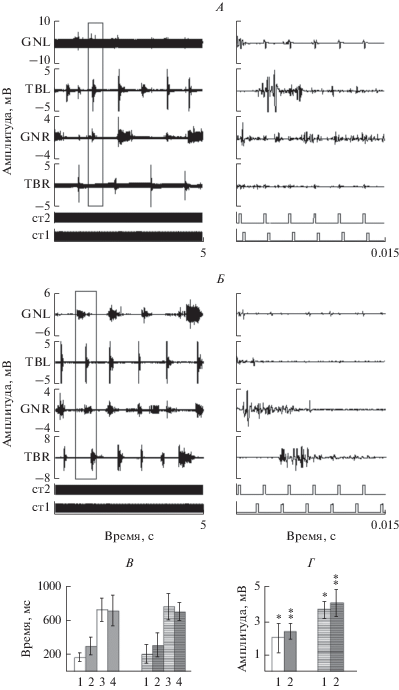
Рис. 5.
Локомоторные ЭМГ-паттерны при ходьбе по тредбану без стимуляции. А – крыса 1-ой группы до введения квипазина, Б – после введения квипазина; В – крыса 2-ой группы до введения квипазина, Г – после введении квипазина. Д – обозначения те же, что и на рис. 4В, Е – обозначения те же, что на рис. 4Г. n = 50.
Положительная динамика локомоторных способностей у спинализированных крыс проявлялась также в том, что при поддержке веса тела спустя 9 нед. тренировок крысы обеих групп могли совершать локомоторные движения задних конечностей по движущейся ленте тредбана в отсутствие стимуляции. Другими словами, у животных восстановилась произвольная регуляция локомоторной активности (рис. 5А, В). При введении квипазина наблюдалось увеличение амплитуды ответов, а также некоторое увеличение как длительности пачек, так и межпачечных интервалов у всех крыс (рис. 5Б, Г, Д, Е), таким образом, длительность шагательного цикла возросла с 0.9–1 с до 1.2–1.3с.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Результаты наших экспериментов позволяют сделать заключение, что ПССМ и ЭССМ оказывают сходное действие при восстановлении локомоторных способностей у спинализированных крыс. При регулярных тренировках ходьбы по движущейся ленте тредбана и воздействии ПССМ или ЭССМ уже спустя 3 нед. после спинализации крысы обеих групп при поддержке веса тела были способны совершать локомоторноподобные движения задних конечностей в течение 3–5 с. В ЭМГ-паттернах пачечная активность была выражена слабо. Пачки формировались за счет амплитудной модуляции преимущественно M-ответов при ПССМ и ранних ответов при ЭССМ. Такие же ответы присутствовали и при одиночной низкочастотной стимуляции ростральных и каудальных сегментов люмбального отдела спинного мозга. При ЭССМ мы наблюдали М-ответ лишь у одной из крыс при одиночной низкочастотной стимуляции нижнего уровня спинного мозга, наряду с ранним ответом. Аналогичные результаты были получены ранее при ЭССМ нижних уровней поясничного утолщения спинного мозга [16], в то время как при стимуляции верхнего уровня М-ответы отсутствовали [17]. Происхождение М-ответа обусловлено прямой активацией эфферентных волокон, а ранний ответ с латентностью 5–12 мс считается моносинаптическим рефлексом, он связан с активацией низкопороговых афферентов дорсальных корешков [2, 17]. Иногда было сложно разделить М-ответ и ранний ответ, который следует сразу же за ним. Такое явление можно было видеть и при магнитной стимуляции спинного мозга у децеребрированных кошек [18]. Нейрофизиологические и компьютерные [19] исследования последних лет показывают, что чрескожная стимуляция также хорошо, как и эпидуральная стимулирует дорсальные корешки, а присутствие ранних моносинаптических ответов при той и другой стимуляции свидетельствует о том, что активируются одни и те же нейронные структуры. Авторы отмечают рефлекторную природу таких ответов, что подтверждается постактивационнoй депрессией ответов при парной стимуляции [4]. Схожесть механизмов воздействия на нейронные структуры доказывает и появление поздних ответов на более поздних сроках, когда в активность вовлекаются кожные афференты, афференты группы II и афференты флексорного рефлекса. Вовлечение этих нейронных систем приводит к активации интернейронной локомоторной сети спинного мозга – спинального шагательного генератора [20, 21]. В наших экспериментах эффект тренировок проявлялся в появлении единичных поздних ответов при низкочастотной стимуляции обоих уровней спинного мозга у крыс 1-ой и 2‑ой групп, которые отсутствовали ранее. При высокочастотной стимуляции двух уровней спинного мозга локомоторный паттерн после 9 недель тренировок становился более ритмическим, с попеременным возбуждением и торможением в каждой мышце. При анализе ответов внутри пачки оказалось, что при ПССМ и ЭССМ, наряду с ранними и М-ответами, в пачке появляются поздние ответы с латентностью 10–20 мс. Это совпадает с полученными ранее данными о корреляции между восстановлением локомоторной способности и появлением в структуре рефлекторных ответов поздних полисинаптических компонентов [16]. Важно отметить, что динамика изменения структуры рефлекторных и пачечных ответов при ПССМ и ЭССМ схожа, что может свидетельствовать об активации одних и тех же нейронных структур. Улучшение локомоторных способностей под действием тренировки отмечали и другие авторы [21, 22]. В более ранних наших работах на децеребрированных кошках было показано, что поздние ответы, вызванные ЭССМ, по мере развития локомоторного паттерна могут терять связь со стимулом и следовать в собственном ритме, что свидетельствует об активации спинального шагательного генератора [2]. После 9 нед. тренировок спинальные крысы могли совершать шагоподобные движения по движущей ленте тредбана без стимуляции в течение некоторого времени, в этом случае главным фактором, запускающим процесс формирования локомоторного паттерна, были афферентные сигналы от стоп задних конечностей. Как было показано ранее, афферентное воздействие на опорную поверность способно инициировать шагательные движения у хронических спинальных кошек [23] и непроизвольные движения у здоровых испытуемых [24]. Полученные результаты могут служить доказательством эффективности систематического применения ПССМ или ЭССМ совместно с тренировками шагания для восстановления локомоторных способностей при нарушенном супраспинальном контроле.
Как известно, серотонинергическая система играет важную роль в контроле локомоции, что подтверждено многими исследованиями [25–27]. После спинализации, когда связь с головным мозгом, где находятся серотонинергические нейроны, утрачена, рецепторы, находящиеся на постсинаптической мембране, можно активировать с помощью фармакологического воздействия – введения их неселективного агониста–квипазина. Показано, что у спинальных животных агонисты серотониновой системы могут модулировать локомоторную активность [28, 29]. В проведенных нами ранее исследованиях показано, что его действие способствует сохранению морфологических характеристик большинства нейронов спинного мозга ниже места перерезки [30]. В настоящей работе показано, что введение квипазина приводит к увеличению амплитуды и длительности ЭМГ пачек при осуществлении локомоторной активности. Анализ ответов в ЭМГ пачке при спинальной стимуляции показывает, что после введения квипазина полисинаптические ответы становятся более выраженными. Это подтверждает сделанные ранее заключения, что серотонин регулирует не только активность спинальных локомоторных центров, но и афферентного звена в организации спинальной локомоции, а значит, модулирует активность афферентов, в том числе, кожных афферентов и рецепторов опоры, чем объясняется увеличение вклада поздних ответов в организации локомоторного паттерна.
ЗАКЛЮЧЕНИЕ
Показано, что регулярное применение неинвазивной ПССМ в сочетании с локомоторными тренировками на тредбане, может быть таким же эффективным методом активации нейронных локомоторных сетей, как и ЭССМ. Динамика восстановления локомоторных способностей и механизмы действия ПССМ и ЭССМ на нейронные структуры спинного мозга схожи.
Действие неселективного агониста серотониновых рецепторов-квипазина облегчает инициацию локомоторной активности при спинальной стимуляции и приводит к увеличению амплитуды и продолжительности пачек в ритмическом ЭМГ-паттерне, а также к возрастанию доли полисинаптических ответов в организации пачки, что доказывает влияние серотининергической системы на афферентное звено в организации локомоторного ответа.
Список литературы
De Groat W.C., Kruse M.N., Vizzard M.A., Cheng C.L., Araki I., Yoshimura N. Modification of urinary bladder function after spinal cord injury. Adv. Neurol. 72: 347–364.1997.
Геpаcименко Ю.П., Лавpов И.А., Богачева И.Н., Щербакова Н.А., Кучер В.И., Мусиенко П.Е. Особенности формирования локомоторных паттернов у децеребрированной кошки при эпидуральной стимуляции спинного мозга. Pоc. физиол. жуpн. им. И.М. Cеченова. 89(8): 1046–1057. 2003. [Gerasimenko Yu.P., Lavrov I.A., Bogacheva I.N., Scherbakova N.A., Kucher V.I., Musienko P.E. Features of stepping pattern formation under epidural spinal cord stimulation in decerebrated cat. Russ. J. Physiol. 89(8): 1046–1057. 2003. (In Russ.)].
Harkema S., Gerasimenko Y., Hodes J., Burdick J., Angeli C., Chen Y., Ferreira C., Willhite A., Rejc E., Grossman R.G., Edgerton V.R. Effect of epidural stimulation of the lumbosacral spinal cord on voluntary movement, standing, and assisted stepping after motor complete paraplegia: A case study. Lancet. 377: 1938–1947. 2011.
Hofstoetter U.S., Freundl B., Binder H., Minassian K. Common neural structures activated by epidural and transcutaneous lumbar spinal cord stimulation: Elicitation of posterior rootmusle reflexes.https://doi.org/10.1371/journal.pone.0192013
Minassian K., Hofstoetter U.S. Spinal Cord Stimulation and Augmentative Control Strategies for Leg Movement after Spinal Paralysis in Humans. CNS Neurosci. Ther. 22: 262–270. 2016.
Estes S.P., Iddings J.A., Field-Fote E.C. Priming Neural Circuits to Modulate Spinal Reflex Excitability. Front Neurol. 8: 17. https://doi.org/10.3389/fneur
Gerasimenko Y., Gorodnichev R., Puhov A., Moshonkina T., Savochin A., Selionov V., Roy R., Lu D.C., Edgerton V.R. Initiation and modulation of locomotor circuitry output with multisite transcutaneous electrical stimulation of the spinal cord in noninjured humans. J. Neurophysiol. 113(3): 834–842. 2014.
Minassian K., Hofstoetter U.S., Danner S.M., Mayr W., Bruce J.A., McKay W.B., Tansey K.E. Spinal Rhythm Generation by Step-Induced Feedback and Transcunfytous Poster Root Stimulation in Complete Spinal Cord-Injured Individuals. Neurorehabil. Neural. Repair. 30: 233–243. 2016.
Gerasimenko Y.P., Lu D.C., Modaber M., Zdunowski S., Parag G., Saenko D., Morikawa E., Haakana P., Ferguson A., Roy R., Edgerton R. Noninvasive Reactivation of Motor Descending Control after Paralysis. J. Neurotrauma. 32(15): 1968–1980. 2015.
Roy R.R., Hutchison D.L., Pierotti D.J., Hodgson J.A., Edgerton V.R. EMF patterns of rat ankle extensors and flexors during theadmill locomotion and swimming. J. Appl. Physiol. 70: 2522–2529. 1991.
Ichiyama R.M., Gerasimenko Y.P., Zhong H., Roy R.R., Edgerton V.R. Hindlimb stepping movements in complete spinal rats induced by epidural spinal cord stimulation. Neurosci. Lett. 383(3): 339–344. 2005.
Sayenko D.G., Atkinson D.A., Floyd T.C., Gorodnichev R.M., Moshonkina T.R., Harkema S.J., Edgerton V.R., Gerasimenko Y.P. Effects of paired transcutaneous electrical stimulation delivered at single and dual sites over lumbosacral spinal cord. Neurosci. Lett. 609: 229–234. 2015.
Talmadge R.J., Roy R.R., Caiozzo V.J., Edgerton V.R. Mechanical properties of rat soleus after long-term spinal cord transaction. J. Appl. Physiol. 93. 2002. https://doi.org/10.1152 /japplphysiol.00053.2002
Баев К.В. Механизмы локомоции. В кн.: Частная физиология нервной системы. Л. Наука. 1983. [Bayev K.V. Mekhanizmy lokomotsii. V kn.: Chastnaya fiziologiya nervnoy sistemy. [Baev K.V. Mechanisms of locomotion. In book: Particular physiology of nervous system]. Leningrad. Nauka. 1983].
Sławińska U., Miazga K., Jordan L.M. 5-HT2 and 5-HT7 receptor agonists facilitate plantar stepping in chronic spinal rats through actions on different populations of spinal neurons. Front. Neural Circuits: 8: 95. 2014.
Lavrov I., Gerasimenko Y., Ichiyama M., Courtine G., Zhong H., Roy R.R., Edgerton V.R. Plasticity of Spinal Cord Reflexes After a Complete Transection in Adult Rats: Relationship to Stepping Ability. J.Neurophysiol. 96: 1699–1710. 2006.
Мусиенко П.Е., Богачева И.Н., Савохин А.А., Килимник В.А., Горский О.В., Никитин О.А., Герасименко Ю.П. Инициация локомоторной активности у децеребрированных и спинальных кошек при неинвазивной чрескожной электрической стимуляции спинного мозга. Рос. физиол. журнал им. И.М. Сеченова. 99(8): 917–927. 2013. [Musienko P.E., Bogacheva I.N., Savokhin A.A., Kilimnik V.A., Gorskii O.V., Nikitin O.A., Gerasimenko Yu.P. Initiation of locomotor activity in decerebrate and spinal cats using noninvasive transcutaneous electrical stimulation of the spinal cord. Russ. J. Physiol. 99(8): 917–927. 2013. (In Russ.)].
Богачева И.Н., Мусиенко П.Е., Щербакова Н.А., Мошонкина Т.Р., Савохин А.А., Герасименко Ю.П. Анализ локомоторной активности у децеребрированных кошек при электромагнитной и эпидуральной электрической стимуляции спинного мозга. Рос. физиол. журнал им. И.М.Сеченова. 98(9): 1079–1093. 2012. [Bogacheva I.N., Musienko P.E., Shcherbakova, N.A., Moshonkina T.R., Savokhin A.A., Gerasimenko, Y.P. Analysis of Locomotor Activity in Decerebrate Cats Using Electromagnetic and Epidural Electrical Stimulation of the Spinal Cord. Neuroscience and Behavioral Physiology. Russ. J. Physiol. 98(9): 1079–1093. 2012. (In Russ.)].
Danner S.M., Hofstoetter U.S., Ladenbauer J., Rattay F., Minassian K. Can the human lumbar posterior columnsbe stimulated by transcutaneous spinal cord stimulation? A modeling study. Artif. Organs. 35(3): 257–262. 2011.
Lundberg A. Multisensory control of spinal reflex pathways. Prog. Brain Res. 50: 11–28. 1979.
Cabaj A.M., Majczyński H., Couto E., Gardiner P.F., Stecina K., Sławińska U., Jordan L.M. Serotonin controls initiation of locomotion and afferent modulation of coordination via 5HT7 receptors in adult rats. J. Physiol. 595(1): 301–320. 2017.
Fouad K., Metz G.A., Merkler D., Dietz V., Schwab M.E. Treadmill training in incomplete spinal cord injured rats. Behav. Brain Res. 115: 107–113. 2000.
Wirz M., Colombo G., Dietz V. Long term effects of locomotor training in spinal humans. J. Neurol. Neurosurg. Psychiatry. 71(1): 93–96. 2001.
Никитин О.А., Богачева И.Н., Мусиенко П.Е., Савохин А.А., Герасименко Ю.П. Афферентная активация генератора шагательных движений у спинализированной кошки в ранний период после спинализации. Вестник ТвГУ. Серия: Биология и экология. 6: 22–30. 2007. [Nikitin O.A., Bogacheva I.N., Musienko P.E., Savohin A.A., Gerasimenko Y.P. Afferent activation of step movements of spinalised cat in the early period after spinalisation. Vestnik Tv.GU. Series “Biology and Ecology” 6: 22–30. 2007. (In Russ.)].
Томиловская Е.С., Мошонкина Т.Р., Городничев Р.М., Шигуева Т.А., Закирова А.З., Пивоварова Е.А., Савохин А.А., Селионов В.А., Семенов Ю.С., Бревнов В.В., Китов В.В., Герасименко Ю.П., Козловская И.Б. Механическая стимуляция опорных зон стоп: неинвазивный способ активации генераторов шагательных движений у человека. Физиология человека. 39(5): 34–41. 2013. [Tomilovskaya E.S., Moshonkina T.R., Gorodnichev R.M., Shigueva T.A., Zakirova T.A., Pivovarova E.A., Savohin A.A., Selionov V.A. Semenov Yu.S., Brevnov V.V., Kitov V.V., Gerasimenko Yu.P., Коzlovskay I.B. Mechanical Stimulation of Soles’ Support Zones: Non-Invasive Method of Activation of Generators of Stepping Movements in Man. Fiziologiya Cheloveka. 39(5): 34–41. 2013. (In Russ.)].
Giroux N., Rossignol S., Reader T.A. Autoradiographic study of alpha-1, alpha-noradrenergic and serotonin 1A receptors in the spinal cord of normal and chronically transected cats. J. Comp. Neurol. 406: 402–414.1999.
Schmidt B.J., Jordan L.M. The role of serotoninin reflex modulation and locomotor rhythmoproduction in the mammalian spinal cord. Brain Res. Bull. 53: 689–710. 2000.
Dietz V., Nakazawa K., Wirz M., Erni T. Level of spinal cord lesion determines locomotor activity in spinal man. Exp. Brain Res. 128: 405–409. 1999.
Fong A.J., Cai L.L., Otoshi C.K., Reinkensmeyer D.J., Burdick J.W., Roy R.R., Edgerton V.R. Spinal cord-transected mice learn to step in response to quipazine treatment and robotic training. J. Neurosci. 25(50): 11738–11747.
Feraboli-Lohnherr D., Barthe J.Y., Orsal D. Serotonin-induced activation of the network for locomotion in adult spinal rats. J. Neurosci. Res. 55: 87–98.1999.
Гилерович Е.Г., Мошонкина Т.Р., Павлова Н.В., Отеллин В.А., Герасименко Ю.П. Морфофункциональное исследование поврежденного спинного мозга крыс после активации рецепторов серотонина и двигательных нагрузок. Докл. АН. 428(1): 413–416. 2009. [Gilerovich E.G., Moshonkina T.R., Pavlova N.V., Otellin V.A., Gerasimenko Yu.P. Morphofunctional study of injured spinel cord of rats after activation of serotonergic receptors an motor load. Dokl. Biol. Sci. 428(1): 412–415. 2009. (In Russ.)].
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


