Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 5, стр. 578-590
Реорганизазия астроцитов неокортекса белых крыс после 20-минутной окклюзии общих сонных артерий
С. С. Степанов 1, В. А. Акулинин 1, Д. Б. Авдеев 1, *, А. С. Степанов 1, А. В. Горбунова 1
1 Кафедра гистологии, цитологии и эмбриологии ФГБОУ ВО Омский государственный медицинский университет Министерства здравоохранения Российской Федерации
Омск, Россия
* E-mail: avdeev86@inbox.ru
Поступила в редакцию 19.01.2019
После доработки 19.03.2019
Принята к публикации 19.03.2019
Аннотация
. Изучить пространственную организацию астроцитов неокортекса белых крыс в норме и после 20-минутной окклюзии общих сонных артерий (ООАС). Методы исследования. Астроциты сенсомоторной коры были изучены с помощью окраски гематоксилином и эозином, электронной микроскопии, иммуногистохимии (GFAP), классической морфометрии и фрактального анализа на серийных фронтальных срезах в контроле (n = 15) и через 1, 3, 7, 14 и 30 сут (n = 25) после ООСА. Анализ полученных изображений проводили с помощью программы ImageJ 1.52 и плагина FracLac 2.5. Статистические гипотезы проверяли непараметрическими критериями. Результаты и обсуждение. Исследование показало, что после ООАС отмечалась значительная гетерогенность и гетерохронность изменений пространственной организации астроцитов и их фрактальной размерности в различных участках неокортекса. Более лабильными и реактивными были периферические зоны астроцитарных доменов. На этом уровне через 1 сут после ООСА филаменты значительной части отростков разрушались, а через 3 и 7 сут восстанавливались с увеличением степени ветвления и заполнения фрактального пространства. Заключение. Таким образом, после острой ишемии, вызванной 20-минутной ООСА, получены новые данные о закономерностях качественных и количественных изменений пространственной организации астроцитов неокортекса. Эти, преимущественно адаптационно-репаративные, изменения мы относим к механизмам естественной защиты нервной ткани головного мозга в реперфузионном периоде.
ВВЕДЕНИЕ
Астроциты обладают нейропротекторными, ангиогенными, иммуномодулирующими, нейрогенными, антиоксидантными свойствами и модулируют синаптическую передачу [1]. Было установлено, что реактивный астроглиоз и пролиферация астроцитов являются естественными нейропротекторными механизмами, а реактивные астроциты выделяют факторы, способствующие выживанию нейронов при тяжелых травмах или дегенерации [2]. Большое внимание уделяется изучению глиоцитоархитектоники, взаимоотношениям нейронов, астроцитов и микроглиоцитов в нервной ткани головного мозга млекопитающих в норме и после ишемии [3–6]. Особое значение имеет изучение тонких отростков астроцитов, которые модулируют синаптическую передачу в возбуждающих глутаматергических синапсах и контролируют процесс реорганизации межнейронных отношений [7, 8].
Хорошо изучены морфологические изменения нейроглиальных клеток при ишемическом повреждении нервной ткани [5, 9–11]. Показано, что форма и функция нейроглиальных клеток в норме и при различных патологических состояниях неразрывно связаны. Астроциты и микроглиоциты изменяют свою морфологию по мере функционирования и реакции на патологическое воздействие. Меняется толщина, длина, разветвленность толстых и тонких отростков, их пространственное распределение. Измерить такую “изменчивость” количественно традиционными методами проблематично. Однако, это позволяет сделать фрактальный анализ [12, 13]. Для оценки морфологии астроцитов неокортекса после окклюзии общих сонных артерий подобный подход не применялся.
Целью настоящего исследования было изучение пространственной организации астроцитов неокортекса белых крыс в норме и после 20-минутной окклюзии общих сонных артерий.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Работа выполнена на базе ФГБОУ ВО “Омский государственный медицинский университет”, одобрено этическим комитетом университета (протокол № 83 от 14 октября 2016 года). В качестве экспериментальных животных использовали белых крыс линии Wistar массой 180–200 гр. Исследования проводили в соответствии с рекомендациями Международного комитета по работе с лабораторными животными, поддержанных ВОЗ, директивой Европейского Парламента № 2010/63/EU от 22.09.2010 “О защите животных, используемых для научных целей”.
Острую 20-минутную ишемию мозга моделировали путем окклюзии общих сонных артерий (ООСА, 2-сосудистая модель неполной глобальной ишемии без гипотонии) на фоне премедикации (сульфат атропина 0.1 мг/кг, подкожно) и общей анестезии (Zoletil 100, 10 мг/кг). Состояние животных в послеоперационном периоде оценивалось в баллах с учетом принципов исследования физиологии и патофизиологии головного мозга [14].
Материал забирали через 1 (n = 5), 3 (n = 5), 7 (n = 5), 14 (n = 5) и 30 (n = 5) сут после ООСА. Контролем (n = 5) служили ложнооперированные (без ООСА) животные того же возраста. Головной мозг фиксировали путем перфузии 4% раствора параформа на 0.1 М фосфатном буфере (рН 7.4) через восходящую часть дуги аорты. Блоки (n = 30) заключали в гомогенизированный парафин (HISTOMIX®) с помощью автомата для гистологической проводки карусельного типа “STP 120”. Серийные фронтальные срезы толщиной 4 мкм резали на одном уровне сенсомоторной коры [15]. Использовали санный микротом HM 450 (Thermo) с электронным контролем толщины среза, автоматической подачей образца и системой ретракции. Препараты готовили из каждого 10-го серийного среза (5 – на случай, 25 – на срок).
Для обзорного гистологического исследования срезы окрашивали гематоксилином и эозином. Астроциты выявляли с помощью иммуногистохимической реакции на глиальный фибриллярный белок (GFAP). Срезы помещали на полилизиновые стекла. В качестве первичных использовали моноклональные мышиные антитела (Bond Ready-to-Use Primary Antibody Glial Fibrillary Acidic Protein; клон GA5; Leica Biosystems Newcastle Ltd, Великобритания). В процессе приготовления препаратов применяли: набор реагентов для детекции (Bond Polymer Refine Detection, DS9800), отмывочный раствор (Bond Wash Solution 10X Concentrate, 1 L), растворы для высокотемпературной демаскировки (Bond Epitope Retrieval), раствор для разведения антител (Bond Primary Antibody Diluent), раствор для депарафинизации (Bond Dewax Solution) (производитель: Leica Biosystems Newcastle Ltd, Великобритания). Препараты готовили согласно рекомендациям фирмы производителя реагентов. Для визуализации GFAP использовали мультимерный набор NovolinkTM (DAB) Polymer Detection System (Leica Biosystems Newcastle Ltd, Великобритания). После реакции с первичными антителами срезы последовательно инкубировали с вторичными антителами, затем хромогеном DAB (3,3'-диаминобензидин), докрашивали гематоксилином, заключали в полистирол.
Препараты фотографировали на микроскопе Leica DM 1000 (камера GXCAM-DM800 Unique Wrap-Around 8MP AUTOFOCUS USB, pixel size 1.4 × 1.4 µm), изображение сохраняли в файлах с расширением tiff (2592 × 1944 пикселей), затем в Photoshop CC размерность увеличивали (до 3780 × 2835 пикселей/см, разрешение 600 пикселей/дюйм). Для достижения максимальной контрастности и четкости мелких отростков астроцитов проводили коррекцию изображения с помощью фильтра Camera Raw (контрастность, баланс белого, четкость). Последнее позволяло выявлять самые мелкие частицы GFAP-позитивного материала. Дальнейшее морфометрическое исследование астроцитов проводили на масках 8-битовых черно-белых изображений (объектив ×40) с использованием программы ImageJ 1.52. Перед морфометрическим анализом (апплет Analyze Particles) изображения проводили его визуальную настройку с помощью апплета Image (Adjust). Устанавливали стандартный для всех изображений порог отсечения (Threshold). Фрактальный анализ полученных изображений осуществляли с помощью плагина FracLac 2.5 (Box Counting Sampling Methods) [13].
Для ультраструктурного исследования выделяли сенсомоторную кору, рассекали, контрастировали 1–2 ч в 1% незабуференном растворе четырехокиси осмия, промывали, обезвоживали и заключали в смесь эпона и аралдита. Ультратонкие (70–100 нм) срезы готовили на ультрамикротоме LKB-8800 (Швеция), окрашивали уранилацетатом и цитратом свинца на сетках без подложки, просматривали и фотографировали на микроскопе Hitachi-600H (Япония). На каждый срок фотографировали по 5 астроцитов при увеличении 12000.
В слое III неокортекса определяли относительную площадь GFAP- позитивного материала в поле зрения (по 200 полей зрения на каждый срок), фрактальную размерность (FD – показатель заполнения пространства фрактальной структурой) и лакунарность (Λ – мера неоднородности заполнения пространства фрактальной структурой) для астроцитов (по 80 полей зрения на каждый срок). Фрактальная размерность вычислялась по формуле: $D = \mathop {\lim }\limits_{\varepsilon \to \infty } \frac{{\ln {{N}_{\varepsilon }}}}{{\ln \varepsilon }}$ где ε – размер ячейки сетки; Nε – количество ячеек размера ε, содержащих пиксели изображения астроцита. Лакунарность вычислялась по формуле: Λ = (σ/µ)2, где σ – стандартное отклонение массы (для бинарного изображения – количество пикселей) фрактальной структуры в ячейках сетки заданного размера ε; μ – среднее значение массы структуры в ячейках заданного размера ε. Мерой лакунарности (Λ) в использованной программе (FracLac 2.5) являлось изменение плотности изображения GFAP-позитивного материала астроцита при сканировании сеткой с ячейками различных размеров [16, 17, 13 ]. Чем выше лакунарность, тем больше в изучаемом распределении имеется областей без GFAP.
Характер распределения указанных величин проводили с помощью критерия Колмогорова–Смирнова, проверку статистических гипотез – с помощью критериев χ2, Манна–Уитни, Вилкоксона и дисперсионного анализа Фридмана (ANOVA). Материал представлен в процентах (95% доверительный интервал – 95% ДИ), как медиана (Me) нижний (Ql) и верхний (Qu) квартили (StatSoft Statistica 8.0; MedCalc 11.6.1.0) [18]. В ходе проведения статистического анализа нулевая гипотеза отвергалась при p ≤ 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
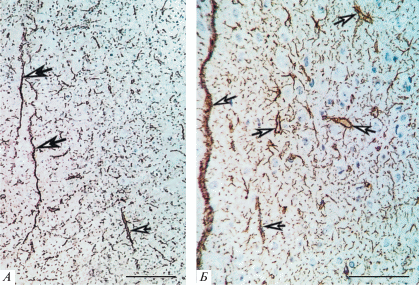
На фронтальных срезах СМК контрольных животных максимальная концентрация хромогена (DAB) отмечалась вокруг капилляров, где скопления конечных периваскулярных ножек астроцитов образуют периваскулярные глиальные мембраны (рис. 1А, Б), и под пиальной поверхностью мозга – молекулярном слое. Например, в последнем относительная площадь хромогена составляла 16.7% (95% ДИ: 11.5–22.2%). В нейропиле слоя III GFAP-позитивный материал распределялся равномерно в виде мелкоячеистой сети (рис. 1Б). Относительная площадь меченых отростков была на уровне 9.4% (95% ДИ: 5.7–14.3%) – статистически значимо меньше (критерий χ2; p = 0.044), чем в слое I.
Рис. 1.
Сенсомоторная кора головного мозга (контроль): равномерное распределение GFAP-позитивного материала отростков астроцитов (относительная площадь хромогена 10.2%) в нейропиле. Стрелки – кровеносные сосуды (радиальные артерии). Окраска: иммуногистохимия, глиальный кислый фибриллярный белок. Объектив: ×10 (А), ×40 (Б); шкала – 200 мкм (А) и 100 мкм (Б).
Слой III СМК контрольных животных представлен нормохромными пирамидными нейронами (диаметр тела 20–25 мкм) (рис. 2А). GFAP-позитивный материал локализовался в телах и отростках протоплазматических и фиброзных астроцитов, расположенных среди нейронов (рис. 2Б, В). В нейропиле выявлялись мелкие отростки астроцитов (рис. 2Б, Г).
Рис. 2.
Сенсомоторная кора (слой III) головного мозга в норме: А – нормохромные нейроны и окружающий нейропиль (*); Б – тела, крупные и мелкие отростки протоплазматических астроцитов; В – фиброзные астроциты с длинными тонкими отростками; Г – зона пространственного домена одного астроцита (красные стрелки). Белые стрелки – нейроны, черные стрелки – астроциты и их крупные отростки. Окраска: гематоксилином и эозином (А); иммуногистохимия, глиальный кислый фибриллярный белок (Б, В, Г). Объектив: ×100; шкала – 50 мкм.
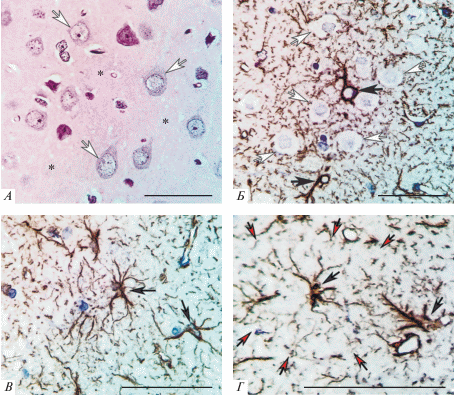
Для протоплазматических астроцитов было характерно относительно крупное тело (диаметр 16–24 мкм); неровные контуры толстых, коротких и сильно разветвленных (угол бифуркации 60 и более градусов) отростков; рыхлое заполнение хромогеном. От толстых (диаметр 3.2–4.0 мкм) отростков отходило большое количество тонких (0.30–0.42 мкм) ветвей, формирующих еще большее число очень тонких (0.15–0.20 мкм) периферических астроцитарных отростков в нейропиле (рис. 2Б, Г).
Фиброзные астроциты также имели древовидную организацию: небольшое тело (диаметр 8–12 мкм), длинные слаборазветвленные отростки (угол бифуркации 30 и менее градусов) с очень высокой плотностью хромогена (глиофибрилл). Эти отростки, в отличии от протоплазматических, гладкие без выступов, тесно связаны с пучками миелинизированных волокон, микрососудами (периваскулярные ножки), пиальной поверхностью мозга (молекулярный слой) (рис. 2В).
Астроциты представляли типичную древовидную фрактальную структуру, которая занимала определенный пространственный домен. На территории этого домена видны срезы одного тела астроцита, толстых, тонких и очень тонких отростков (рис. 2В, Г).
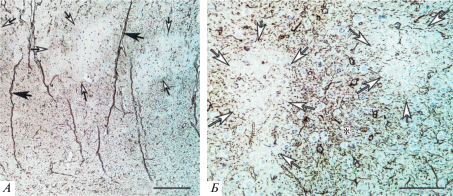
После ООСА в неокортексе преобладали диффузные мелкоочаговые обратимые ишемические изменения нейронов и нейроглии. Так, в верхнем этаже СМК через 1 и 3 сут были выявлены зоны неправильной формы с очень низкой плотностью хромогена, но сохранными ядрами клеток (рис. 3). Например, на рис. 3Б в двух таких зонах относительная площадь хромогена в нейропиле занимала соответственно 4.4 и 6.3%. Вокруг зон с низкой плотностью хромогена располагался нейропиль с контрольной или даже повышенной плотностью меченого GFAP (площадь 25.6%).
Рис. 3.
Сенсомоторная кора головного мозга в постишемическом периоде (1 сут): неравномерное распределение GFAP-позитивного материала. Черные стрелки – кровеносные сосуды (радиальные артерии), белые стрелки – зоны очень низкой плотности хромогена (доля – 4.4 и 6.3%), * – высокая плотность хромогена (доля – 25.6%). Окраска: иммуногистохимия, глиальный кислый фибриллярный белок. Объектив: ×10 (А), ×40 (Б); шкала – 200 мкм (А) и 100 мкм (Б).
По данным электронной микроскопии, в остром периоде (1 сут) после ООСА за счет отека-набухания цитоплазмы происходило разрушение большого количества глиофибрил в телах и отростках астроцитов. Вполне вероятно, что именно разрушение глиофибрил приводило к уменьшению GFAP-позитивного материала при иммуногистохимической реакции.
Уже через 1 сут после ООСА в СМК увеличивалось содержание реактивных гипертрофированных астроцитов с большим числом толстых отростков (рис. 4А). Через 3 сут появлялись очаговые скопления фиброзных астроцитов с очень высоким локальным содержанием маркера GFAP (рис. 4Б). Максимальное количество фиброзных астроцитов отмечалось в молекулярном слое (рис. 4В). При этом относительная площадь хромогена в этом слое через 7 сут составляла 19.2% (95% ДИ: 13.9–25.4%), не различалась в сравнении с контролем, но была больше (χ2 = 8.5; p = 0.004), чем в слое III на 10.6% (95% ДИ: 3.6–17.7%). Наиболее крупные клетки с толстыми разветвленными первичными отростками встречались через 14 сут после ишемии (рис. 4Г). Реорганизация нейронов и нейроглии через 1−14 сут сопровождалась увеличением нейроглиального индекса в 1.2−2.0 раза (критерий χ2 > 8.2; p < 0.01). В контроле на один нейрон приходилось 1.6 (1.3−1.7), через 1 сут − 1.5 (1.2−2.0), а через 14 сут − 3.2 (3.0−4.8) астроцитов. До контрольного уровня этого показатель в течение 30 сут не восстанавливался.
Рис. 4.
Сенсомоторная кора головного мозга в постишемическом периоде: А – протоплазматический астроцит с толстыми короткими отростками; Б – скопление протоплазматических астроцитов (белые стрелки; слой III; 3 сут); В – неравномерное распределение хромогена в слоях I (черные стрелки), II и III (7 сут); Г – фиброзные астроциты с толстыми первичными отростками (белые стрелки; 14 сут). Окраска: иммуногистохимия, глиальный кислый фибриллярный белок. Объективы: ×40 (А, Б, Г), ×10 (В); шкалы – 50 мкм (А, Б, Г), 100 мкм (В).

Через 30 сут после ООСА на уровне верхних этажей СМК выявлялись зоны (очаги) высокой плотности фиброзных астроцитов с длинными разветвленными отростками – проявление реактивного астроглиоза (рис. 5). На представленном рисунке численная плотность только фиброзных астроцитов составила 355 клеток на 1 мм2.
Рис. 5.
Сенсомоторная кора головного мозга в постишемическом периоде (30 сут): очаговое скопление (красные стрелки) фиброзных астроцитов. * – увеличенные фрагменты с одним астроцитом. Окраска: иммуногистохимия, глиальный кислый фибриллярный белок. Объектив: ×40; шкала – 100 мкм.

Развитие реактивного астроглиоза без рубцовых изменений рассматривается нами как реакция на мелкоочаговое ишемическое повреждение нервной ткани после 20-минутной ООСА и является, вероятно, естественным механизмом защиты нейронов.
По данным морфометрии, установлено, что несмотря на наличие в СМК отдельных очагов низкой плотности хромогена, его общая площадь статистически значимо не менялась в течение всего периода наблюдения (табл. 1). Вполне вероятно, что очаговая потеря GFAP-позитивного материала в остром периоде компенсировалась пролиферацией и гипертрофией реактивных астроцитов (с высокой экспрессией GFAP) в неповрежденных зонах СМК.
Таблица 1.
Относительная площадь (%) GFAP-позитивного материала в слое III неокортекса белых крыс в норме и после ООСА
| Группы | Результаты сравнения |
|---|---|
| Контроль | 9.3 (ДИ: 5.7–14.3) |
| Постишемический период, сут | |
| 1 | 11.6 (ДИ: 7.5–16.9), p = 0.55 |
| 3 | 9.4 (ДИ: 5.7–14.3), p = 0.89 |
| 7 | 13.4 (ДИ: 9.0–18.9), p = 0.26 |
| 14 | 10.2 (ДИ: 6.4–15.3), p = 0.89 |
| 30 | 12.5 (ДИ: 8.3–17.9); p = 0.39 |
В сравнении с контрольной группой различия статистически незначимы (p > 0.05, критерий χ2). ДИ – 95%.
Таким образом, с помощью иммуногистохимической реакции и морфометрии было изучено распределение и содержание GFAP астроцитов СМК белых крыс в норме и после 20-минутной ООСА. Фиброзные и протоплазматические астроциты обладали высокой гетероморфностью. Различия касались расположения, размеров, формы, количества, длины и разветвленности отростков. В постишемическом периоде выявлено одновременное очаговое уменьшение и увеличение относительной площади хромогена в соседних участках СМК. Вполне вероятно, что локальное снижение этого показателя связано с отеком–набуханием астроцитов и разрушением цитоскелета части отростков, а увеличение – с компенсаторной пролиферацией и гипертрофией активных клеток.
Для получения дополнительной информации о структурно-функциональных изменениях астроцитов слоя III СМК изучена их фрактальная размерность (FD) и лакунарность (Λ). На срезах астроцитов, включающих только тела клеток и их крупные отростки, FD варьировала в пределах 1.35–1.50. Фрактальный анализ нескольких полей зрения, включающих тела, крупные и мелкие отростки множества доменов, показал более высокие значения FD (за счет мелких периферических отростков) и позволил сравнить еще и лакунарность (Λ) астроцитарных сетей СМК в динамике постишемического периода (рис. 6А–6Г).
Рис. 6.
Протоплазматические (А, Б) и фиброзные (В, Г) астроциты неокортекса животных контрольной группы (А, Б) и основной группы (30 сут): А, В – оригинальные изображения, Б, Г – маски изображений. FD (Б) = 1.67; Λ (Б) = 0.62; FD (Г) = 1.73; Λ (Г) = 0.38. Объектив: ×100, шкала = 50 мкм.
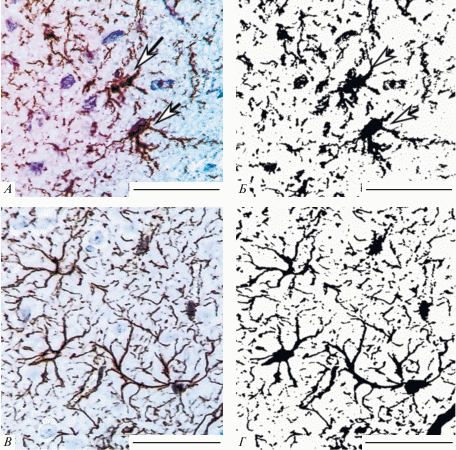
При одинаковых FD протоплазматических и фиброзных астроцитов лакунарность последних была ниже (рис. 6Б, Г). Это свидетельствовало о существовании количественных различий равномерности заполнения фрактального пространства сетей разных типов астроцитов.
В слое III удалось показать наличие статистически значимых различий FD и Λ в сравнении с контрольными значениями и между сроками после ООСА. В зонах низкой плотности хромогена фрактальная размерность (FD) была ниже (Min = 1.20), а лакунарность (Λ) существенно выше контроля (Max = 1.72). В зонах высокой плотности маркера наоборот: FD выше (Max = 1.87), а Λ ниже контроля (Min = 0.24). То есть, чем ниже лакунарность, тем меньше имелось областей без GFAP при высоком показателе заполнения пространства фрактальной структурой.
Во время максимальных проявлений отека–набухания нервной ткани неокортекса (1 сут) FD статистически значимо уменьшалась (на 17.0%), а Λ увеличивалась (на 23.2%). Через 3 сут после ООСА, в сравнении с предыдущим сроком, FD увеличивалась, а Λ уменьшалась. Через 7, 14 и 30 сут отмечалась высокая неоднородность (очаговость) заполнения пространства коры фрактальной структурой – большой интерквартильный разброс Λ. До уровня контроля суммарные показатели, характеризующие фрактальную структуру, не восстанавливались даже через 30 сут после ООСА. Однако, в очагах скопления фиброзных астроцитов FD достигала 1.80, а Λ – 0.27. Вполне вероятно, что одной из причин низкого суммарного значения FD в отдаленном периоде после ООСА было сохранение очагов с высокой лакунарностью (неоднородное распределение GFAP).
Изменения фрактальных характеристик крупных и мелких отростков астроцитов имели свои особенности. В контроле мелкие периферические отростки равномерно заполняли фрактальное пространство. Через 1 сут после ООСА в астроцитарных доменах статистически значимо уменьшалась FD и увеличивалась Λ. В большей степени это касалось тонких отростков, которые сильнее повреждались. Через 3 сут, по сравнению с предыдущим сроком, заполнение фрактального пространства СМК увеличивалось преимущественно за счет тонких периферических ветвей астроцитарных доменов (табл. 2).
Таблица 2.
Результаты фрактального анализа толстых и тонких отростков астроцитов СМК в норме и после ООСА, Me (Ql–Qu)
| Группы | Показатели | |||
|---|---|---|---|---|
| проксимальные зоны домена (толстые) |
дистальные зоны домена (тонкие) |
|||
| FD | Λ | FD | Λ | |
| Контроль | 1.59(1.52–1.63) | 0.85(0.80–0.87) | 1.64(1.62–1.67) р = 0.01* |
0.51(0.48–0.55) р = 0.001* |
| Постишемический период, сут | ||||
| 1 | 1.27(1.20–1.31) р < 0.001* |
1.33(0.92–1.40) р < 0.001* |
0.83(0.71–0.94) р < 0.001* |
0.88(0.75–0.91) р < 0.001* |
| 3 | 1.45(1.38–1.49) р = 0.001* р < 0.001^ |
1.12(0.81–1.20) р < 0.001* р = 0.001^ |
1.34(1.28–1.58) р < 0.001* р < 0.001^ |
0.66(0.45–0.79) р = 0.01* р < 0.001^ |
| 7 | 1.52(1.47–1.54) р = 0.01* р = 0.01^ |
0.74(0.71–0.82) р = 0.01* р = 0.001^ |
1.43(1.32–1.51) р < 0.001* |
0.54(0.51–0.58) р = 0.001^ |
| 14 | 1.38(1.35–1.49) р < 0.001* р < 0.001^ |
0.70(0.58–0.72) р < 0.001* р = 0.02^ |
1.32(1.12–1.35) р < 0.001* р = 0.001^ |
0.94(0.72–0.98) р < 0.001* р < 0.001^ |
| 30 | 1.5(1.48–1.62) р = 0.001^ |
0.77(0.74–0.93) р = 0.01^ |
1.49(1.10–1.68) р < 0.001^ |
0.65(0.63–0.72) р = 0.001* р < 0.001^ |
| ANOVA (df = 4) | χ2 = 22.5; p = 0.001# | χ2 = 14.4; p = 0.01# | χ2 = 15.2; p = 0.01# | χ2 = 19.8; p = 0.001# |
* Различия статистически значимы в сравнении с контролем (критерий Манна–Уитни), ^ – c предыдущим сроком (критерий Вилкоксона). # – между всеми сроками (дисперсионный анализ Фридмана). Примечание. FD – фрактальная размерность, Λ – лакунарность. Материал представлен как медиана и интерквартильный размах.
Через 7 сут после ООСА происходило дальнейшее увеличение заполнения фрактального пространства и его однородности, по сравнению с предыдущим сроком (табл. 2). Через 14 сут изменения были неоднородны: FD крупных и мелких отростков снижалась, лакунарность крупных отростков снижалась, а мелких увеличивалась. В этот период отмечалась максимальная лакунарность (неоднородность) слоя III, близкая к таковой в остром периоде (через 1 сут). Через 30 сут показатели фрактального анализа проксимальных зон домена были на уровне контроля, а для периферических зон сохранялась высокая неоднородность организации фрактального субстрата (табл. 2).
Таким образом, при проведении фрактального анализа получена дополнительная количественная характеристика распределения GFAP-позитивного материала. Показана значительная реорганизация астроцитов, количественная гетерогенность и гетерохронность изменений FD и Λ проксимальных и дистальных зон астроцитарных доменов. Согласно этим данным, после ООСА более лабильными и реактивными были мелкие периферические отростки астроцитов. Вполне вероятно, что именно пластичность этих отростков обеспечивает естественную нейропротекторную функцию реактивных астроцитов и способствует выживанию нейронов при ишемии.
ЗАКЛЮЧЕНИЕ
Иммуногистохимическое определение GFAP позволяет надежно идентифицировать тела и отростки астроцитов в нервной ткани [12, 10 ]. По данным настоящего исследования, в остром периоде (1 и 3 сут) после ООСА в верхнем этаже сенсомоторной коры выявлялись зоны с очень низкой плотностью GFAP, а в отдаленном периоде (14 и 30 сут) в этом месте – скопления фиброзных астроцитов. Вполне вероятно, что это свидетельствует о длительно сохраняющейся компенсаторно-восстановительной реакции нейроглии на ишемическое повреждение.
Классические методы морфометрии (определение, количества, площади, периметра клеток, диаметра и длины отростков) не дают необходимой информации о пространственной организации астроцитов. В этой связи в настоящей работе дополнительно использовался фрактальный анализ, который позволил количественно описать качественные характеристики сложной фрактальной структуры, каковыми являются нейроны и глиальные клетки [16, 17, 12 ].
Использование фрактального анализа позволило нам показать, что в норме отмечались высокий уровень заполнения пространства СМК фрактальной структурой и равномерность ее распределения. Через 1 сут после ООСА астроцитарная сеть становилась более разорванной и неравномерно окрашенной на GFAP. Через 3 и 7 сут после ООСА, на фоне повышения пролиферативной активности и гипертрофии астроцитов [20, 3 ], происходило частичное восстановление фрактальных характеристик. Однако контрольных значений показатели FD и Λ в течение всего наблюдения не достигали. Выявлена количественная гетерогенность и гетерохронность изменений пространственной организации проксимальных и дистальных ветвей астроцитарных отростков. Более лабильными и реактивными были мелкие отростки астроцитов, расположенные по периферии их доменов.
В отдаленном периоде (14 и 30 сут) после ООСА выявлялись скопления фиброзных астроцитов. Однако, в нашем исследовании мелкоочаговое увеличение количества реактивных фиброзных астроцитов не позволяло говорить о патологическом астроглиозе после необратимого разрушения нейронов, свойственному для ишемического и геморрагического инсульта [12]. Выявленные нами изменения скорее свидетельствовали об активации естественных защитных функций астроглии, направленных на восстановление и утилизацию поврежденных нейронов.
Таким образом, получены новые количественные данные об особенностях пространственной реорганизации глиальной сети неокортекса после 20-минутной ООСА. Эти данные могут быть использованы для понимания структурных основ естественной нейропротекции за счет реактивного астроглиоза.
ВЫВОДЫ
1. В сенсомоторной коре головного мозга белых крыс после перенесенной 20-минутной ООСА развивались очаговые деструктивные, адаптивные, репаративные и пролиферативные изменения астроглии.
2. Через 1 и 3 сут после ООСА часть отростков глиоцитов СМК разрушалась, а в других появлялись признаки адаптивных и компенсаторных реактивных изменений, которые сохранялись на протяжении 30 сут.
3. Через 7 сут увеличивалось количество фиброзных астроцитов в субпиальной зоне под наружной пограничной глиальной мембраной мозга. В отдаленном периоде (14 и 30 сут) очаговые скопления этих клеток выявлялись и на уровне верхних слоев коры.
4. В сочетании с классическими морфометрическими методами определение фрактальных характеристик астроцитов позволило получить дополнительную информацию о структурно-функциональном состоянии астроглии СМК.
5. После ООСА заполнение (FD) и мера неоднородности (Λ) заполнения пространства слоя III фрактальной структурой (астроцитами) статистически значимо изменялись. Через 1 сут после ишемии показатель FD уменьшался, а Λ увеличивался. Это свидетельствовало о фрагментации и деструкции фибрилл цитоскелета отростков астроцитов. Начиная с 3-х сут происходило восстановление характеристик астроцитарной фрактальной структуры неокортекса, но контрольного уровня они не достигали в течении всего периода наблюдения (30 сут).
6. Выявлена количественная гетерогенность и гетерохронность изменений FD и Λ различных астроцитарных отростков. Более лабильными и реактивными были тонкие отростки, расположенные на периферии доменов.
Список литературы
Becerra-Calixto A., Cardona-Gómez G.P. The role of astrocytes in neuroprotection after brain stroke: Potential in cell therapy. Front Mol Neurosci. 10(159): 88. 2017 Apr 3. https://doi.org/10.3389/fnmol.2017.00088
Mohn T.C., Koob A.O. Adult astrogenesis and the etiology of cortical neurodegeneration. J. Exp. Neurosci. 9: 25–34. 2015.
Степанов А.С., Акулинин В.А., Мыцик А.В., Степанов С.С., Авдеев Д.Б. Нейро-глио-сосудистые комплексы головного мозга после острой ишемии. Общая реаниматология. 12(4): 6–17. 2017.
Степанов А.С., Акулинин В.А., Степанов С.С., Авдеев Д.Б. Клеточные системы восстановления и утилизации поврежденных нейронов головного мозга белых крыс после 20-минутной окклюзии общих сонных артерий. Рос. физиол. жур. им. И.М. Сеченова. 103(10): 1135–1147. 2017.
Barreto G., White R. E., Ouyang Y. et al. Astrocytes: Targets for neuroprotection in stroke. Cent. Nerv. Syst. Agents. Med. Chem. 11(2): 164–173. 2011.
Harish G., Mahadevan A., Pruthi N. et al. Characterization of traumatic brain injury in human brains reveals distinct cellular and molecular changes in contusion and pericontusion. J Neurochem. 134(1): 156–172. 2015 Jul.
Luo Y., Xu N.G., Yi W. et al. Study on the correlation between synaptic reconstruction and astrocyte after ischemia and the influence of electroacupuncture on rats. Chin. J. Integr. Med. 17(10): 750–757. 2011.
Rose C.R., Felix L., Zeug A. et al. Astroglial glutamate signaling and uptake in the hippocampus. Front. Mol. Neurosci. 10(451): 1–20. 2018.
Naranjo D., Arkuszewski M., Rudzinski W. et al. Brain ischemia in patients with intracranial hemorrhage: pathophysiological reasoning for aggressive diagnostic management. Neuroradiol. J. 26(6): 610–628. 2013.
Ostergaard P.J., Jensen M.B. Histological quantification of astrocytosis after cerebral infarction: A systematic review. Int. J. Neurosci. 123(7): 439–443. 2013.
Zhao M., Zhu P., Fujino M. et al. Oxidative stress in hypoxic-ischemic encephalopathy: Molecular mechanisms and therapeutic strategies. Int. J. Mol. Sci. 17(12): 1–14. 2016.
Pirici D., Mogoantă L., Mărgăritescu O., Pirici I., Tudorică V., Coconu M. Fractal analysis of astrocytes in stroke and dementia. Rom. J. Morphol. Embryol. 50(3): 381–390. 2009.
Karperien A., Ahammer H., Jelinek H.F. Quantitating the subtleties of microglial morphology with fractal analysis. Front. Cell. Neurosci. 7(3): 1–18. 2013.
Буреш Я., Бурешова О., Хьюстон Д.П. Методики и основные эксперименты по изучению мозга и поведения. М. Высшая школа. 1991.
Paxinos G., Watson C. The Rat Brain in Stereotaxic Coordinates. 5th ed. Elsevier Academic Press, San Diego, CA. 2005.
Smith T.G.Jr., Lange G.D., Marks W.B. Fractal methods and results in cellular morphology. J. Neurosci. Methods. 69: 1123–126. 1996.
Fernandeza E., Boleaa J.A., Ortegab G., Louis E. Are neurons multifractals? J. Neurosci. Methods. 89: 151–157. 1999.
Боровиков В. Statistica. Искусство анализа данных на компьютере. Изд-во Питер. 2003.
Исаева В.В., Пущина Е.В., Каретин Ю.А. Изменения морфометрических показателей и фрактальной размерности нейронов спинного мозга в онтогенезе симы Oncorhynchus masou. Биология моря. 32(2): 125–133. 2006.
Степанов А.С., Акулинин В.А., Авдеев Д.Б., Горбунова А.В. Функциональная и пролиферативная активность клеток нейро-глио-сосудистых комплексов сенсомоторной коры, гиппокампа и миндалевидного тела головного мозга белых крыс после острой ишемии. Журнал анатомия и гистопатология. 7(2): 85–89. 2018.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


