Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 5, стр. 643-649
Изменение механических свойств и заряда поверхности форменных элементов крови в условиях активации пуринергической сигнальной системы
Е. А. Сладкова 1, *, Е. А. Шамрай 1, А. Ю. Тищенко 1, М. Ю. Скоркина 1
1 Белгородский государственный национальный исследовательский университет
Белгород, Россия
* E-mail: sladkova@bsu.edu.ru
Поступила в редакцию 02.03.2019
После доработки 11.03.2019
Принята к публикации 11.03.2019
Аннотация
В норме в микроциркуляторном сосудистом русле форменные элементы крови функционируют в условиях силового воздействия со стороны смещающихся слоев движущейся плазмы, так называемого механического “стресса”. В ответ на механический “стресс” эритроциты и клетки эндотелия экскретируют молекулы АТФ, выступающие ключевыми участниками межклеточных взаимодействий посредством активации пуриновых рецепторов на мембранах клеток крови. В представленной работе с использованием методов атомно-силовой микроскопии изучены механические и электрические свойства форменных элементов крови в условиях механического “стресса” in vitro. При активации пуринергической сигнальной системы уровень АТФ в крови увеличился в 2.3 раза по сравнению с контролем. Установлено изменение биофизических свойств плазмалеммы клеток крови. Жесткость эритроцитов и лимфоцитов увеличилась соответственно на 29 и 26% (р < 0.05), потенциал поверхности стал более отрицательным соответственно на 23.5 и 27% (р < 0.05) по сравнению с контролем. Вместе с тем, важным моментом в проведенном исследовании является установленное увеличение силы адгезии между эритроцитом и лимфоцитом на 49.7% (р < 0.05), что подтверждает важную физиологическую роль эритроцитов в усилении адгезивной функции лейкоцитов. Полученные данные позволяют заключить, что молекула АТФ, экскретируемая эритроцитами в условиях механического “стресса”, выступает ауто- и паракринным регулятором биофизических свойств плазмалеммы эритроцитов и лимфоцитов, что имеет важное значение в изучении механизмов межклеточных взаимодействий в микроциркуляторном русле и поиске фармакологических регуляторов сосудистого тонуса.
Изучение паракринных и внутриклеточных эффектов пуринсодержащих молекул, играющих существенную роль в изменении свойств и функций различных клеток организма, является одной из проблем современной биологии и медицины [1]. Известно, что пуриновые рецепторы локализованы практически во всех органах и тканях, они обнаружены на мембранах кардиомиоцитов, гладких мышечных клеток, форменных элементов крови и других клеток [2]. Сложность пуринергической сигнальной системы, определяется значительным разнообразием агонистов и пуринорецепторов (P1, P2X и P2Y), в том числе их подтипов, обладающих разнообразными функциями [3].
Известно, что в норме в микроциркуляторном русле форменные элементы крови функционируют в условиях механического “стресса”, в ответ на который эритроцитами и клетками эндотелия экскретируются молекулы АТФ [4], выступающие ключевыми лигандами, активирующими пуриновые рецепторы клеток крови. В сосудистом русле участниками межклеточных взаимодействий являются клетки крови трех популяций – эритроцитарной, лейкоцитарной и тромбоцитарной, а также клетки эндотелия сосудов. Физиологические эффекты таких взаимодействий в большинстве случаев зависят от свойств плазмалеммы и функционирования рецепторного аппарата клеток крови. Такие свойства плазмалеммы как жесткость, поверхностный потенциал, адгезивная активность являются ключевыми при выполнении клетками их функций.
Рядом работ показано, что эндогенный АТФ посредством P2X7-пуринового рецептора лейкоцитов вызывает приток Са2+ [5], что приводит к активации NFAT-ядерного фактора, который наравне с контролем пролиферации лимфоцитов, оказывает влияние на экспрессию генов, опосредующих нарушение генетических программ, включая эффекторы иммунных функций, клеточную пролиферацию и клеточную гибель [6, 7].
Один из эффектов функционирования рецепторов пуринергической сигнальной системы – нарушение кислородного гомеостаза организма и развитие тканевой гипоксии, которые наблюдаются при изменении содержания в кровеносном русле пуринергических соединений [8]. Активация пуринергических Р2Х-рецепторов эритроцита сопровождается деполяризацией мембраны за счет входа ионизированного кальция через ионную пору канала [2, 7]. При продолжительной активации рецепторов наблюдается экстернализация фосфатидилсерина на внешней поверхности плазматической мембраны эритроцита, образование активных форм кислорода и апоптоз [9].
В связи с этим, актуальным является изучение роли пуринергической сигнальной системы в функционировании и межклеточном взаимодействии клеток крови в микроциркуляторном русле. Цель исследования – изучить изменения механических свойств и заряда поверхности форменных элементов крови в условиях активации пуринергической сигнальной системы.
МЕТОДЫ ИССЛЕДОВАНИЯ
Экспериментальные исследования выполнены на крови здоровых людей-добровольцев зрелого возраста от 36 до 59 лет (n = 30), которые проходили клиническое обследование в Областной клинической больнице св. Иоасафа г. Белгорода. Забор крови был проведен из локтевой вены с участием специализированного медицинского персонала. Исследования выполнены с соблюдением требований Хельсинской декларации, получено предварительное информированное согласие участников эксперимента в соответствии с рекомендациями (Декларация по этическим принципам медицинских исследований, в которых участвуют люди, принятая 52-ой Генеральной Ассамблеей Всемирной Медицинской Ассоциации, Эдинбург, Шотландия, октябрь, 2000 г.).
Активацию пуринергических сигнальных путей форменных элементов крови осуществляли путем моделирования механической деформации мембран. Для этой цели была использована модель механического стресса in vitro согласно методике, описанной в работе [10]. Каждый образец крови был разделен на опытную и контрольную пробы. Опытные пробы крови подвергали механическому стрессу, контрольные оставляли без воздействия. Таким образом, общее количество исследованных образцов было равно 60.
Концентрацию АТФ в крови определяли колориметрическим методом [11]. В исследуемых пробах измеряли оптическую плотность, используя фотометр фотоэлектрический КФК-3 (Россия, 2008) при длине волны 670 нм против физиологического раствора. Уровень АТФ рассчитывали по разности оптических плотностей между пробиркой, в которой провели гидролиз фосфатных связей, и пробой без гидролиза фосфатных связей.
Цельную кровь разделяли на эритроцитарную и лейкоцитарную массы путем центрифугирования при 1500 об./мин в течение 5 мин. Затем из полученной суспензии лейкоцитов с помощью магнита для клеточной сепарации EasySep Magnet и набора для выделения лимфоцитов EasySep/EasySep Direct Human Total Lymphocyte Isolation Kit (StemCell) выделяли популяцию лимфоцитов.
Функциональная активность форменных элементов крови тесно связана с биофизическими свойствами плазмалеммы, которые были изучены с использованием методов атомно-силовой микроскопии. Жесткость поверхности эритроцитов и лимфоцитов оценивали по численным данным модуля Юнга. В работе были использованы модифицированные зонды АСМ, сделанные коллективом авторов на основе полимерных микросфер с радиусом закругления 5 мкм. Измерение модуля Юнга осуществляли на атомно-силовом микроскопе (АСМ) ИНТЕГРА ВИТА (конфигурация на базе инвертированного оптического микроскопа Olympus IX-71; производитель NT MDT, Зеленоград, 2009) в режиме силовой спектроскопии по алгоритму, описанному в работе [12]. Из каждого образца было отсканировано по 20 эритроцитов и лимфоцитов.
Электрические свойства плазмалеммы эритроцитов и лимфоцитов оценивали путем измерения поверхностного потенциала (ПП) в режиме зонда Кельвина на АСМ. Подготовка клеточной суспензии для измерения и процедура измерения ПП осуществлялись по методике, описанной в работе [13]. Использовали кантилеверы с токопроводящим титановым покрытием серии NSG03/TiN (Nanoworld, США). Из каждой пробы сканировали по 20 эритроцитов и лимфоцитов, проводили обработку полученных сканов в программе Nova (NT-MDT, Россия).
Исследование механизмов межклеточной адгезии проводилось на АСМ в режим силовой спектроскопии. Биосенсорный чип был сконструирован на основе нативного эритроцита и типлеса CSG11 (США) по методике, описанной в работе [14]. Межклеточную силу адгезии измеряли в системе “эритроцит–лимфоцит”, регистрируя силовые кривые с поверхности 20 клеток. Силы адгезии рассчитывали с помощью программного обеспечения Nova (NT-MDT,Зеленоград, 2009).
Достоверность различий между контрольными и опытными пробами определяли с использованием t-критерия Стьюдента при p < 0.05 с учетом нормального распределения данных. В работе приведены средние величины (М) и величины статистической ошибки средней (m).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В условиях механического стресса концентрация АТФ в крови составила 0.032 ± ± 0.001 мкмоль/л, что в 2.3 раза выше, чем в контрольной группе (0.014 ± 0.001 мкмоль/л).
При активации пуринергической сигнальной системы установлено изменение механических и электрических свойств эритроцитов. Так, модуль Юнга красных клеток крови был выше на 29% (р < 0.05), а потенциал поверхности стал более отрицательным на 23.5% по сравнению со значениями в контроле (табл. 1).
Модуль Юнга, характеризующий жесткость поверхности лимфоцитов, увеличился на 26% (р < 0.05) по сравнению с контролем (табл. 2).
Таблица 2.
Биофизические свойства клеточной поверхности лимфоцитов
| Показатели | Контроль | Опыт |
|---|---|---|
| Модуль Юнга лимфоцитов, мкПа | 9.16 ± 0.01 | 11.56 ± 0.02* |
| Потенциал поверхности лимфоцитов, мV | –19.72 ± 0.23 | –27.15 ± 0.32* |
В опытных пробах крови заряд лимфоцитов стал более отрицательным – снизился на 27% (р < 0.05).
Снижение заряда поверхности форменных элементов крови привело к изменению адгезивной активности в системе “эритроцит–лимфоцит” (рис. 1).
Рис. 1.
Силы межклеточной адгезии в системе “эритроцит–лимфоцит”: опыт – под влиянием механического стресса in vitro, контроль – интактная кровь.* – статистически значимые различия между показателями по t-критерию Стьюдента (p < 0.05).
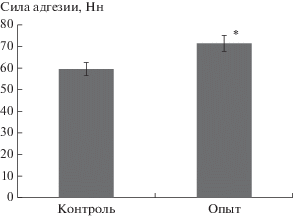
Сила адгезии между эритроцитом и лимфоцитом возросла на 49.7% (р < 0.05) по сравнению с контрольной группой.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В настоящем исследовании с использованием различных подходов атомно-силовой микроскопии изучены механические и электрические свойства мембран эритроцитов и лимфоцитов периферической крови людей зрелого возраста в условиях сдвиговых деформаций (модель механического стресса in vitro), которые были максимально приближены к физиологическим условиям, происходящим в сосудах микроциркуляторного русла.
В результате проведенных экспериментов было установлено увеличение концентрации АТФ в крови в 2.3 раза по сравнению с образцами без воздействия механического стресса. Полученные данные свидетельствуют о выделении молекул АТФ в межклеточное пространство при механической стимуляция, что согласуется с данными литературы [8, 15, 16].
В эксперименте были установлены изменения биофизических свойств эритроцитов. В условиях механической деформации клеток крови увеличилась жесткость и отрицательный заряд плазмалеммы эритроцитов по сравнению с контролем. В настоящее время доказано, что на мембране эритроцитов нет специфических Р-рецепторов непосредственно для молекулы АТФ [17], но были идентифицированы рецепторы для АДФ (ADP-P2Y13) [2] и аденозина (аденозин-A2B) [9]. Ввиду этого, мы предполагаем, что продукты распада молекул АТФ (в форме АДФ или аденозина) могли оказать влияние на изменение механических и электрических свойств красных клеток крови за счет входа ионизированного кальция через ионную пору [18].
Показано, что выброс молекул АТФ клетками крови приводит к увеличению жесткости лимфоцитов, при этом плазмалемма клеток приобретает более отрицательный заряд. В ряде работ описаны рецепторы P2X семейства, локализованные на поверхности лимфоцитов, которые представляют собой мембранные ионные каналы [19]. Возможно, что высвобождение молекул АТФ во время механического стресса запускает пуринергическую сигнальную систему за счет повышения концентрации цитозольного Ca2 + [20], который необходим для ремоделирования элементов цитоскелета [21]. Это согласуется с установленным в нашем исследовании увеличением жесткости клеточной поверхности, которая напрямую зависит от функциональной активности подмембранных структур цитоскелета.
Важным моментом в настоящем исследовании является установленное увеличение силы адгезии между эритроцитом и лимфоцитом, что подтверждает важную физиологическую роль эритроцитов в усилении адгезивной функции лейкоцитов. Согласно подходу Lattica–Bolcmana показано, что непосредственное взаимодействие между эритроцитами и лейкоцитами необходимо для увеличения тангенциальной силы и крутящего момента, что способствует роллингу лейкоцитов по поверхности эндотелиальной стенки в микроциркуляторном русле [22].
Таким образом, активация пуринергической сигнальной системы во время механической деформации форменных элементов крови запускает процессы, направленные на увеличение жесткости и отрицательного заряда клеточной поверхности эритроцитов и лимфоцитов. Кроме того, происходит увеличение адгезивной активности в системе “эритроцит–лимфоцит”. Вероятно, при механической деформации красных клеток в микрососудах они могут выполняют регуляторную функцию, запуская каскад сигнальных процессов, направленных на изменение биофизических свойств плазмалеммы лейкоцитов, что обеспечивает выполнение ими своих физиологических функций.
Список литературы
Di V.F., Vuerich M. Purinergic signaling in the immune system. Auton. Neurosci. 191: 117–123. 2015.
Wang L., Olivercrona G., Götberg M., Olsson M.L., Winzell M.S., Erlinge D. ADP acting on PY213 receptors is a negative feedback pathway for ATP release from human red blood cells. Circul. Res. 96: 189–196. 2005.
Baroja-Mazo A., Barbero-Gremades H., Pelegrini P. The participation of plasma membrane hemichannels to purinergic signaling. Biochem. Biophys. Acta. 828: 79–93. 2013.
Sprung R., Sprague R., Spence D. Determination of ATP release from erythrocytes using microbore tubing as a model of resistance vessels in vivo. Anal. Chem. 74(10): 2274–2278. 2002.
Ita M.D., Vargas M.H., Carbajal V., Ortiz-Quentero B., Lopez-Lopez C. ATP releases ATP or other nucleotides from human peripheral blood leukocytes through purinergic P2 receptors. Life sci. 145(5): 85–92. 2016.
Betz T., Lenz M., Joanny J.F. ATP-dependent mechanics of red blood cells. PNAS. 106 (36): 15320–15325. 2009.
Li J., Fountain S.J. Fluvastatin suppresses native and recombinant human P2X4 receptor function. Purinergic Signal. 8: 311–316. 2012.
Sprague R., Stephenson A., Ellworth M. Red not dead: Signaling in and from erythrocytes. Trends in Endocrin. Metabol. 18(9): 350–355. 2007.
Pafundo D.E., Alvarez C.I., Krumschnabel C., Schwarzbaum P.J. A volume regulatory response can be triggered by nucleosides in human erythrocytes, a perfect osmometer no longer. J. Biol. Chem. 285: 6134–6144. 2010.
Oonishi T., Sakashita K., Uyesaka N. Regulation of red blood cell filterability by Ca2+ influx and cAMP-mediated signaling pathways. Am. J. Physiol. Soc. 273: C1828–C1834. 1997.
Алейникова Т.Л., Рубцова Г.В. Руководство к практическим занятиям по биохимии. М. Высшая школа. 1988. [Aleynikova T.L., Rubtsova G.V. Rukovodstvo k prakticheskim zanyatiyam po biochimii. [Guide to practical classes in biochemistry]. Moscow. Vyisshaya shkola. 1988].
Скоркина М.Ю., Федорова М.З., Муравьев А.В., Сладкова Е.А. Использование наномеханического сенсора для изучения морфофункциональных свойств лимфоцитов здоровых доноров и больных хроническим лимфобластным лейкозом. Клет. техн. в биол. и мед. 3: 172–175. 2012. [Skorkina M.Yu., Fedorova M.Z., Muravev A.V., Sladkova E.A. Using a nanomechanical sensor to study the morphofunctional properties of lymphocytes from healthy donors and patients with chronic lymphoblastic leukemia. Klet. tehn. v biol. i med. 3: 172–175. 2012. (In Russ.)].
Сладкова Е.А., Скоркина М.Ю. Оценка поверхностного потенциала лимфоцитов больных лейкозом методом зонда Кельвина. Биофизика. 59(2): 310–313. 2014. [Sladkova E.A., Skorkina M.Yu. Evaluation of the surface potential of lymphocytes in patients with leukemia using the Kelvin probe method. Biofizika. 59(2): 310–313. 2014. (In Russ.)].
Skorkina M.Yu. Shamray E.A., Sladkova E.A. Measuring of adhesion force in the cell-cell system based on atomic force microscopy technology. Bull. Exp. Biol. Med. 4: 528–529. 2018.
Homolya L., Steinberg T.H., Boucher R.C. Cell to cell communication in response to mechanical stress via bilateral release of ATP and UTP in polarized epithelia. J. Cell Biol. 150: 1349–1360. 2000
Evans J., Gratzer W., Mohandas N., Parker K., Sleep J. Fluctuations of the red blood cell membrane: relation to mechanical properties and lack of ATP dependence. Biophys J. 94(10): 4134–4144. 2008.
Erlinge D., Burnstock G. P2 receptors in cardiovascular regulation and disease. Purinergic Signalling. 4(1): 1–20. 2008.
Egan T.M., Khakh B.S. Contribution of calcium ions to P2X channel responses. J Neurosci. 24(13): 3413–20. 2004.
North R.A. P2X receptors. Philos. Trans. R. Soc. Lond. B Biol Sci. 371(1700): 20150427. 2016.
Goldman N., Chandler-Militello D., Langevin H., Nedergaard M., Takano T. Purine receptor mediated actin cytoskeleton remodeling of human fibroblasts. Cell Calcium. 53(4): 297–301. 2013.
Chen Y., Sumi Y.Y., Li A., To U.K., Elkhal A., Inoue Y., Woehrle T., Zhang Q., Hause C., Junger W.G. Purinergic signaling: a fundamental mechanism in neutrophil activation. Sci. Signal. 3(125): 45. 2014.
Migliorini C., Qian Y., Chen H., Brown E.B., Lain R.K., Munn L.L. Red blood cells augment leukocyte rolling in a virtual blood vessel. Biophys. J. 83: 1834–1841. 2002.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


